Los pacientes con infección por virus de inmunodeficiencia humana (VIH) y recuentos de CD4+<200células/μl son más vulnerables a las infecciones oportunistas que pueden generar presentaciones difíciles con posibles errores de diagnóstico. Un enfoque sistemático podría prevenir los errores en casos complejos.
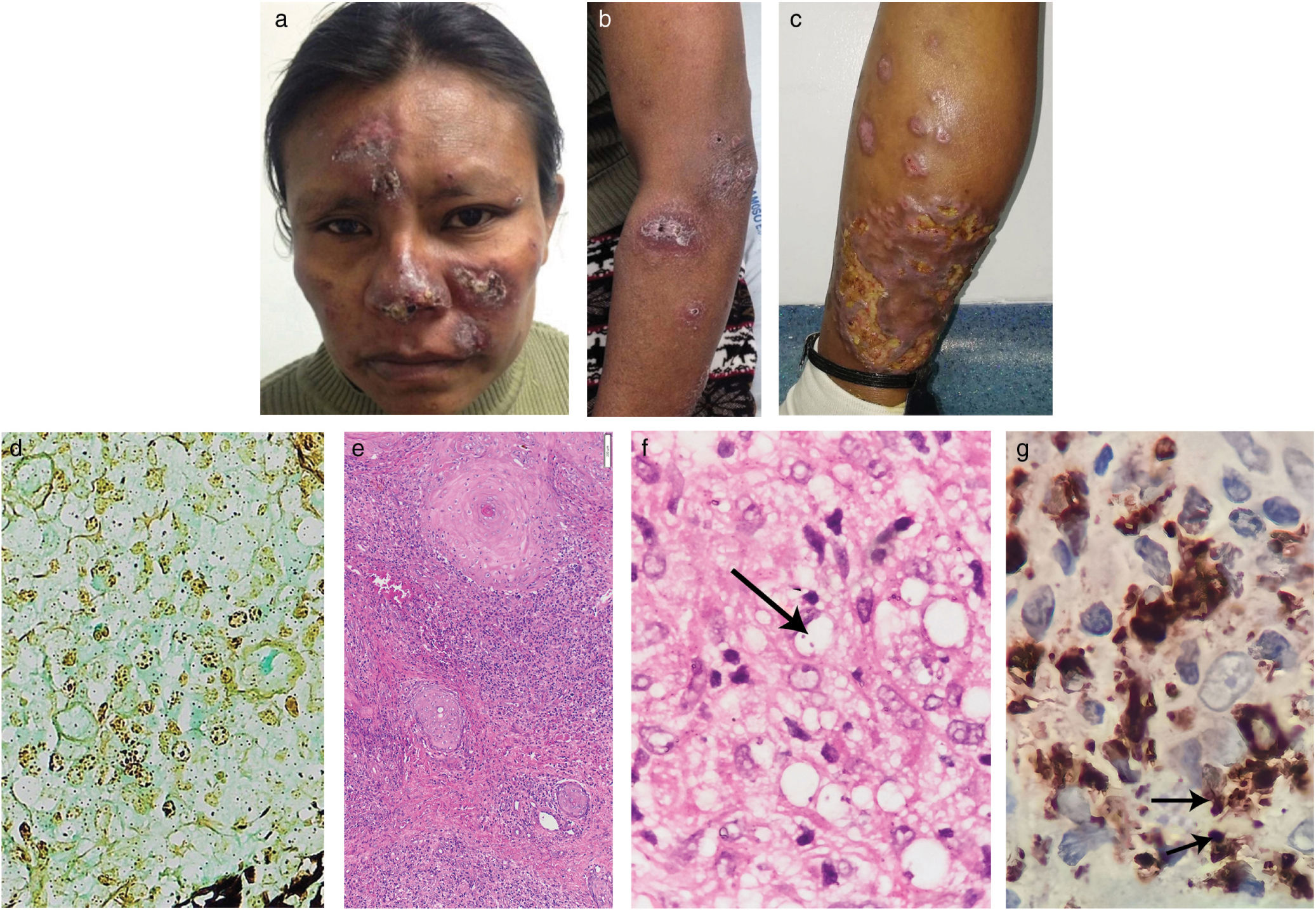
Una mujer de 40 años de edad, procedente de una región selvática tropical, hospitalizada por enfermedad diarreica aguda, fue remitida a nuestra unidad debido a historia de dos años de lesiones cutáneas múltiples que aparecieron en su pierna izquierda con ulceración subsiguiente, seguida de lesiones similares en el rostro y los miembros superiores. Había sido diagnosticada de VIH dos años antes, y tenía poca adherencia a la terapia antirretroviral altamente activa (HAART). La exploración física reveló nódulos y placas eritematosos pardos con costras hemáticas en el rostro, parte anterior de los antebrazos y piernas (fig. 1Fig. 1a–c). No se encontraron lesiones mucosas ni linfadenopatías. Las pruebas de laboratorio reflejaron una carga viral de VIH de 446.816copias/ml y un recuento de CD4+de 152células/μl. Las TAC torácica y abdominal fueron normales. La biopsia cutánea reveló dermatitis nodular granulomatosa dérmica sugestiva de infección por Histoplasma debido a la presencia de estructuras Gomori positivas en el interior de los histiocitos (fig. 1d). Se inició tratamiento con anfotericina B liposomal (dosis total de 1.080mg) durante 8 días, seguida de itraconazol 200mg/día durante 14 días, con mejora clínica.
Placas eritematosas parduzcas en el rostro (A). Placas violáceas en el antebrazo y brazo izquierdos (B). Nódulos y gran placa infiltrada eritematosa en la parte posteroinferior de la pierna izquierda, con zonas de ulceración(C). Estructuras Gomori positivas dentro de los histiocitos (tricrómico de Gomori, 40×). (D) Proceso inflamatorio nodular granulomatoso formado por linfocitos, histiocitos y algunas células plasmáticas en la dermis superior y profunda (tinción HyE, 10×). (E) Amastigote de Leishmania, flecha (tinción HyE, 600×). (F) Inmunohistoquímica anti-CD68 (clon KP1) que muestra positividad citoplasmática intensa en los macrófagos. Además, pueden observarse algunos amastigotes, flechas (IHQ, 600×) (G).
Transcurrido un mes, la paciente regresó con un aumento de infiltración de las lesiones y una prueba de antígeno urinario de Histoplasma negativo, lo que debilitó el diagnóstico inicial. Una segunda biopsia cutánea reflejó dermatitis nodular granulomatosa, organismos intracelulares consistentes con amastigotes, positividad citoplasmática anti-CD68 intensa (fig. 1e–g), y tinción negativa de Gomori. La PCR (reacción en cadena de la polimerasa) en tiempo real confirmó la presencia de Leishmania, subgénero Viannia. TAC torácica y abdominal adicionales fueron nuevamente normales. Los cultivos y pruebas histopatológicas cutáneos y las biopsias pulmonares resultaron negativos para hongos.
Se diagnosticó leishmaniasis cutánea difusa (LCD) reiniciándose la terapia de anfotericina B liposomal, ante la buena respuesta previa, hasta completar una dosis total de 2.200mg, logrando mejora cutánea.
Durante el seguimiento a los tres meses, las lesiones cutáneas desarrollaron un aspecto verrugoso, lo cual se consideró un signo de síndrome inflamatorio de reconstitución inmune (IRIS) a la vista de la adherencia adecuada a HAART, carga viral de VIH de 110copias/ml, recuento de CD4+de 500células/μl y biopsia cutánea negativa para amastigotes. En consecuencia, se prescribieron corticosteroides sistémicos. Posteriormente, tras su última alta hospitalaria, la paciente no retornó a los controles.
La LCD es una forma crónica rara de leishmaniasis en la que existe una respuesta reducida a los antígenos de Leishmania y, por tanto, se observa en aquellos casos con deficiencia de la inmunidad celular1. El cuadro clínico en los pacientes coinfectados de VIH puede ser grave, con más de 200 lesiones, o tener un curso progresivo2. En este contexto, pueden observarse dificultades diagnósticas clínicas en las que los diferenciales más importantes son la lepra lepromatosa y la histoplasmosis diseminada, entre otros3. De igual modo, los resultados histopatológicos pueden no ser concluyentes, dada la similitud a otras entidades en los que ciertos hallazgos podrían conducir a un diagnóstico equivocado (ej.: granulomas, macrófagos parasitados)4,5.
En nuestro caso, las lesiones cutáneas fueron similares a las de histoplasmosis, y las estructuras Gomori positivas dentro de los histiocitos observadas en la primera biopsia condujeron a este diagnóstico inicial. En la leishmaniasis, este último y raro hallazgo podría deberse a cierto tipo de artefacto procedente de la técnica histológica, donde los núcleos de amastigotes podrían captar nitrato de plata (AgNO3) del tricrómico de Gomori5. Más allá de un error técnico, otra explicación posible es la presencia de estructuras que asemejan cuerpos de Michaelis-Gutmann (MGB), observados en algunos casos de leishmaniasis cutánea6,7. Los MGB, que se encuentran habitualmente en malacoplaquia, son positivos para Gomori y Von Kossa. En la infección por leishmania, dichas estructuras son Gomori positivas pero pueden ser Von Kossa negativas y se ha planteado la hipótesis de que corresponden a contaminación bacteriana o fagosomas/fagolisosomas transformados por el parásito6,7. La microscopía electrónica es útil para confirmar la presencia de MGB, pero no se utilizó en nuestro caso.
Aunque la coinfección por Histoplasma era plausible en nuestra paciente, se descartó considerando la evidencia de (1) un enfoque multidisciplinar (Dermatología, Medicina Interna, Enfermedades infecciosas, Neumología, entre otros) en cada hospitalización con estudios complementarios relevantes que no encontraron ningún compromiso fúngico pulmonar ni cutáneo en las imágenes seriadas, ni en las muestras repetidas para citología, cultivos, biopsias y detección de antígenos, (2) el cuadro clínico esperado en nuestro contexto habría sido el de histoplasmosis diseminada (HD), caracterizada por esplenomegalia, hepatomegalia, adenopatías, pancitopenia y enfermedad pulmonar, además de lesiones cutáneas4,5. Ninguno de estos signos extracutáneos se observaron durante el seguimiento. Debemos mencionar que los signos cutáneos relacionados con la HD son casi siempre una característica de la enfermedad diseminada, en la que un foco pulmonar es el punto inicial de diseminación a la piel4.
Proponemos estas estrategias para abordar las dificultades diagnósticas anteriormente mencionadas: (1) considerar la epidemiología, dado que ciertas entidades se presentan en zonas específicas; (2) las claves clínicas e histológicas específicas de cada enfermedad permiten estrechar el rango diagnóstico (tablas 1 y 2)1–5; (3) en situaciones de características complejas o superpuestas, además de las biopsias repetidas obtenidas de diferentes lesiones, junto con el examen de múltiples secciones seriadas y tinciones específicas, es necesario realizar técnicas diagnósticas adicionales tales como PCR (tabla 2)2,3,8. También sugerimos utilizar una combinación de métodos, ya que algunos de ellos podrían tener sensibilidad limitada3,8; (4) hay que recordar que en los pacientes con HIV, las coinfecciones tienen el potencial de exhibir presentaciones atípicas, pueden coexistir más de dos organismos, y se han reportado tasas elevadas de recaída y una respuesta deficiente a la terapia convencional2,8.
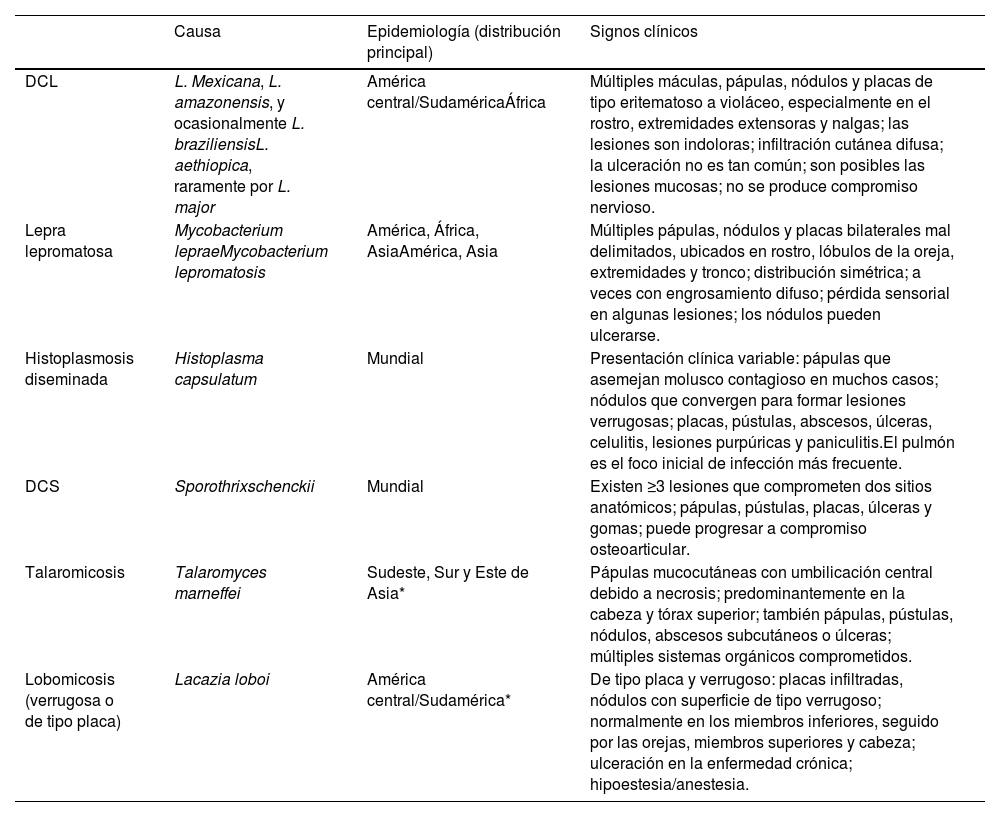
Hallazgos epidemiológicos y clínicos comparativos en la leishmaniasis cutánea difusa (LCD) y sus diagnósticos diferenciales
| Causa | Epidemiología (distribución principal) | Signos clínicos | |
|---|---|---|---|
| DCL | L. Mexicana, L. amazonensis, y ocasionalmente L. braziliensisL. aethiopica, raramente por L. major | América central/SudaméricaÁfrica | Múltiples máculas, pápulas, nódulos y placas de tipo eritematoso a violáceo, especialmente en el rostro, extremidades extensoras y nalgas; las lesiones son indoloras; infiltración cutánea difusa; la ulceración no es tan común; son posibles las lesiones mucosas; no se produce compromiso nervioso. |
| Lepra lepromatosa | Mycobacterium lepraeMycobacterium lepromatosis | América, África, AsiaAmérica, Asia | Múltiples pápulas, nódulos y placas bilaterales mal delimitados, ubicados en rostro, lóbulos de la oreja, extremidades y tronco; distribución simétrica; a veces con engrosamiento difuso; pérdida sensorial en algunas lesiones; los nódulos pueden ulcerarse. |
| Histoplasmosis diseminada | Histoplasma capsulatum | Mundial | Presentación clínica variable: pápulas que asemejan molusco contagioso en muchos casos; nódulos que convergen para formar lesiones verrugosas; placas, pústulas, abscesos, úlceras, celulitis, lesiones purpúricas y paniculitis.El pulmón es el foco inicial de infección más frecuente. |
| DCS | Sporothrixschenckii | Mundial | Existen ≥3 lesiones que comprometen dos sitios anatómicos; pápulas, pústulas, placas, úlceras y gomas; puede progresar a compromiso osteoarticular. |
| Talaromicosis | Talaromyces marneffei | Sudeste, Sur y Este de Asia* | Pápulas mucocutáneas con umbilicación central debido a necrosis; predominantemente en la cabeza y tórax superior; también pápulas, pústulas, nódulos, abscesos subcutáneos o úlceras; múltiples sistemas orgánicos comprometidos. |
| Lobomicosis (verrugosa o de tipo placa) | Lacazia loboi | América central/Sudamérica* | De tipo placa y verrugoso: placas infiltradas, nódulos con superficie de tipo verrugoso; normalmente en los miembros inferiores, seguido por las orejas, miembros superiores y cabeza; ulceración en la enfermedad crónica; hipoestesia/anestesia. |
LCD: leishmaniasis cutánea difusa; DCS: esporotricosis cutánea diseminada.
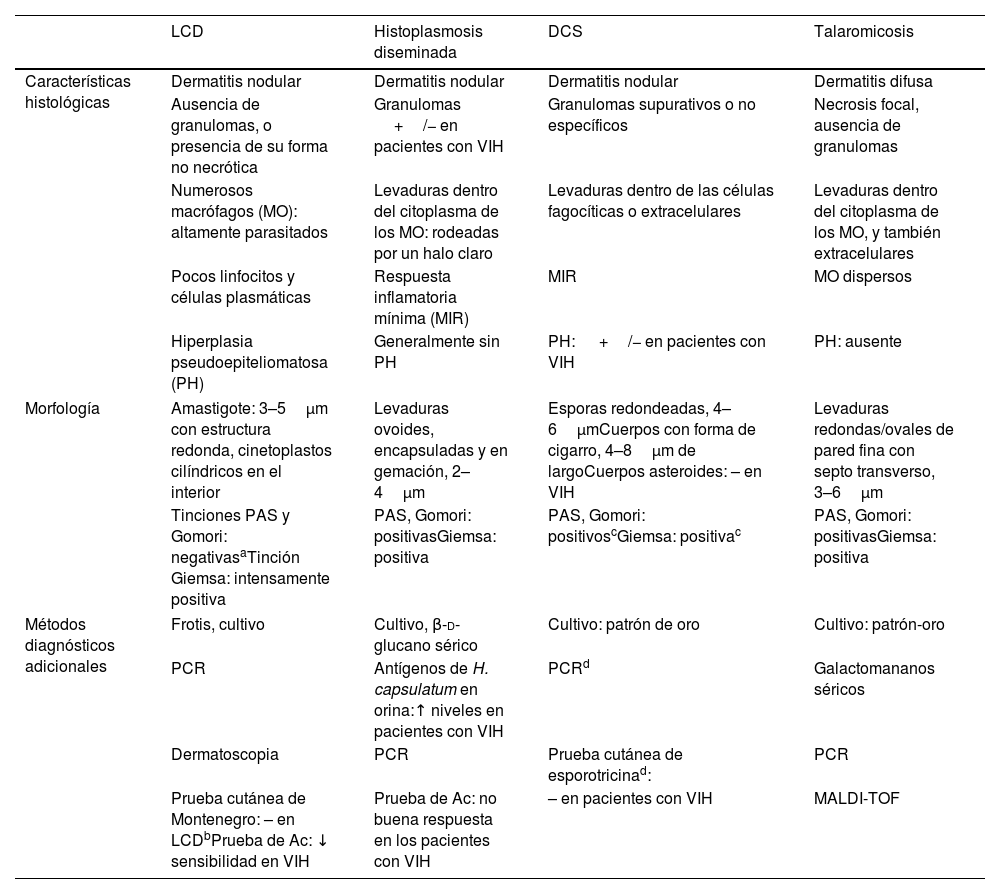
Hallazgos histológicos y morfológicos comparativos en la leishmaniasis cutánea difusa (LCD) y sus diagnósticos diferenciales en pacientes con VIH
| LCD | Histoplasmosis diseminada | DCS | Talaromicosis | |
|---|---|---|---|---|
| Características histológicas | Dermatitis nodular | Dermatitis nodular | Dermatitis nodular | Dermatitis difusa |
| Ausencia de granulomas, o presencia de su forma no necrótica | Granulomas +/− en pacientes con VIH | Granulomas supurativos o no específicos | Necrosis focal, ausencia de granulomas | |
| Numerosos macrófagos (MO): altamente parasitados | Levaduras dentro del citoplasma de los MO: rodeadas por un halo claro | Levaduras dentro de las células fagocíticas o extracelulares | Levaduras dentro del citoplasma de los MO, y también extracelulares | |
| Pocos linfocitos y células plasmáticas | Respuesta inflamatoria mínima (MIR) | MIR | MO dispersos | |
| Hiperplasia pseudoepiteliomatosa (PH) | Generalmente sin PH | PH: +/− en pacientes con VIH | PH: ausente | |
| Morfología | Amastigote: 3–5μm con estructura redonda, cinetoplastos cilíndricos en el interior | Levaduras ovoides, encapsuladas y en gemación, 2–4μm | Esporas redondeadas, 4–6μmCuerpos con forma de cigarro, 4–8μm de largoCuerpos asteroides: – en VIH | Levaduras redondas/ovales de pared fina con septo transverso, 3–6μm |
| Tinciones PAS y Gomori: negativasaTinción Giemsa: intensamente positiva | PAS, Gomori: positivasGiemsa: positiva | PAS, Gomori: positivoscGiemsa: positivac | PAS, Gomori: positivasGiemsa: positiva | |
| Métodos diagnósticos adicionales | Frotis, cultivo | Cultivo, β-d-glucano sérico | Cultivo: patrón de oro | Cultivo: patrón-oro |
| PCR | Antígenos de H. capsulatum en orina:↑ niveles en pacientes con VIH | PCRd | Galactomananos séricos | |
| Dermatoscopia | PCR | Prueba cutánea de esporotricinad: | PCR | |
| Prueba cutánea de Montenegro: – en LCDbPrueba de Ac: ↓ sensibilidad en VIH | Prueba de Ac: no buena respuesta en los pacientes con VIH | – en pacientes con VIH | MALDI-TOF | |
LCD: leishmaniasis cutánea difusa; DCS: esporotricosis cutánea diseminada; PCR: reacción en cadena de la polimerasa; Ac: anticuerpo; MALDI-TOF: espectrometría de masas (matrix-assisted laser desorption ionization time-of-flight method).
Sin embargo, los informes de casos han reflejado positividad alta en la prueba cutánea de Montenegro en los pacientes con VIH.
En cuanto a la interacción HIV–leishmania, los estudios procedentes de cultivos celulares humanos han mostrado que la regulación al alza de la replicación del VIH en las células T CD4+ está impulsada por el lipofosfoglicano, la mayor proteína de superficie de Leishmania9. Además, las células T CD8+ exhiben una actividad citotóxica baja frente a los macrófagos infectados, con la consiguiente propagación sin restricciones de Leishmania10.
En conclusión, este caso ilustra los inconvenientes diagnósticos que podrían encontrarse en la LCD, para los que se sugieren diversas soluciones, de cara a abordar errores potenciales.
Conflicto de interesesLos autores declaran la ausencia de conflicto de intereses.
Los autores quisieran expresar su agradecimiento al Dr. Luis Fernando Palma Escobar, la Dra. María Janeth Vargas y la Dra. María Isabel González por su respaldo a la hora de guiar y tomar las fotografías histopatológicas que ilustran este caso clínico.