La lepra es una enfermedad granulomatosa crónica causada por una micobacteria (M. leprae) que presenta predisposición por la piel y los nervios periféricos. La lepra continúa siendo endémica en distintas regiones del mundo. La presentación clínica de la enfermedad depende del estado inmunológico del paciente al adquirirla y de la evolución de la misma. Es una infección que se asocia a discapacidad y marginación.
El diagnóstico de lepra es clínico y se hace al tener uno o más de los signos cardinales establecidos por la OMS: máculas hipopigmentadas o eritematosas con disminución de la sensibilidad, engrosamiento de los nervios periféricos y la demostración de bacilos ácido alcohol resistentes en una baciloscopia o biopsia de piel, con pérdida de anexos en los sitios afectados.
El tratamiento consta de tres fármacos: rifampicina, clofazimina y dapsona. Existen principalmente dos modalidades de tratamiento dependiendo de la presentación clínica del paciente: paucibacilar o multibacilar.
Leprosy is a chronic granulomatous disease caused by the bacillus Mycobacterium leprae. It primarily affects the skin and peripheral nerves and is still endemic in various regions of the world. Clinical presentation depends on the patient's immune status at the time of infection and during the course of the disease. Leprosy is associated with disability and marginalization.
Diagnosis is clinical and is made when the patient has at least 1 of the following cardinal signs specified by the World Health Organization: hypopigmented or erythematous macules with sensory loss; thickened peripheral nerves; or positive acid-fast skin smear or skin biopsy with loss of adnexa at affected sites.
Leprosy is treated with a multidrug combination of rifampicin, clofazimine, and dapsone. Two main regimens are used depending on whether the patient has paucibacillary or multibacillary disease.
La enfermedad de Hansen o lepra es una micobacteriosis clasificada dentro de las enfermedades granulomatosas crónicas que afecta principalmente la piel y los nervios periféricos, causada por un bacilo intracelular obligatorio: Mycobacterium leprae. El bacilo fue descubierto en el siglo xix por el noruego Gerhard Henrik Armauer Hansen1. Las manifestaciones clínicas e histopatológicas dependen de la capacidad inmunológica del paciente en el momento de la infección o durante el desarrollo de la evolución natural de la misma. El diagnóstico actual se basa en 3 signos cardinales señalados por la Organización Mundial de la Salud (OMS): lesiones en la piel de tipo parches hipopigmentados o eritematosos con pérdida de sensibilidad, engrosamiento de los nervios periféricos y presencia de bacilos ácido alcohol resistentes en la baciloscopia o en la biopsia de piel2. En la actualidad la multiterapia utilizada, así como los nuevos antibióticos que han demostrado efectividad, han hecho posible cumplir las metas de eliminación propuestas por la OMS, principalmente disminuir la incidencia a un caso por cada 10.000 habitantes en países endémicos para M. leprae. Recientemente se ha descrito una nueva micobacteria; Mycobacterium lepromatosis, endémica en México y el Caribe3. Estos hallazgos hacen posible contar con nuevas perspectivas para enfrentar un problema que, lejos de estar resuelto, sigue presentado nuevos retos a la Medicina.
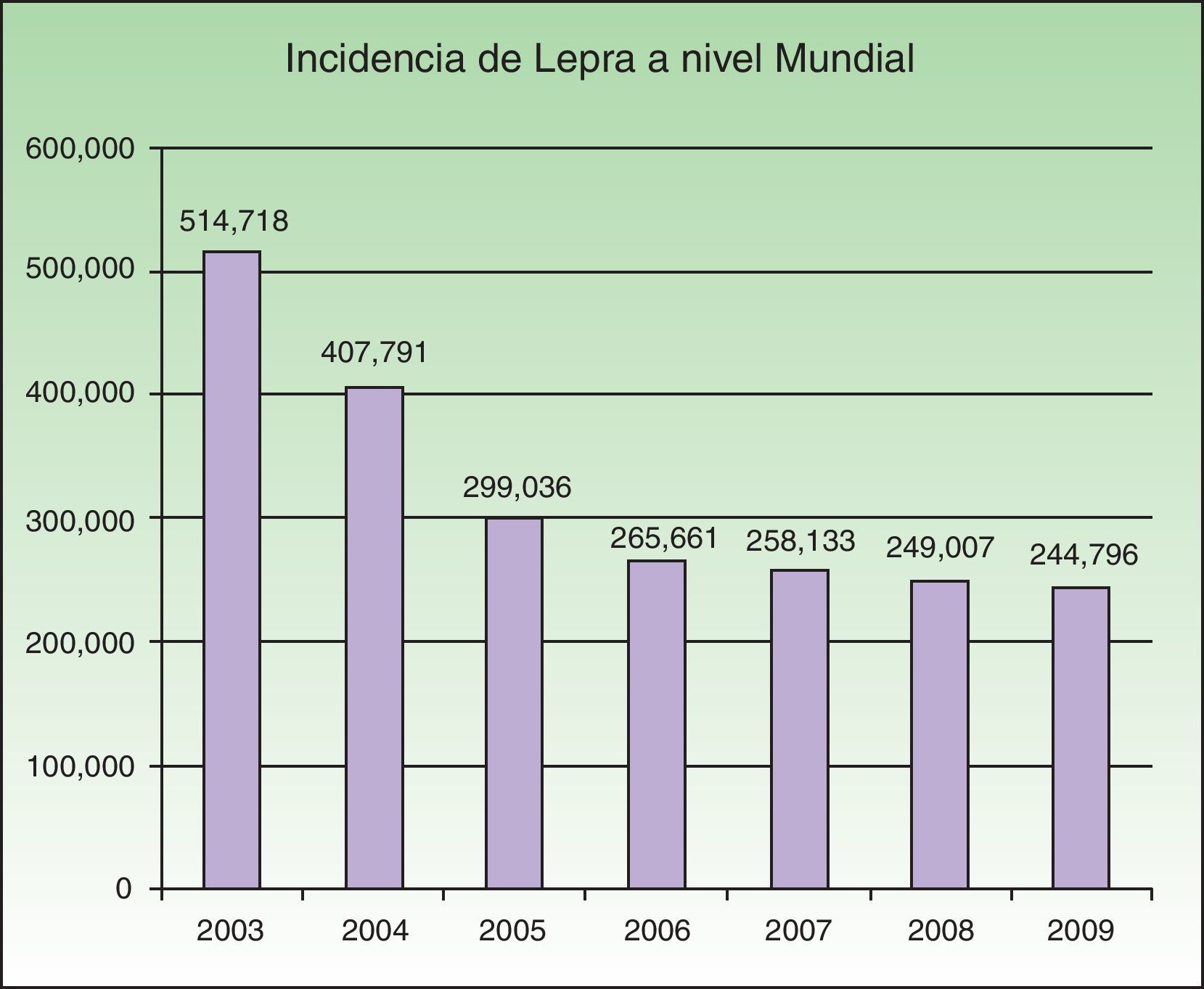
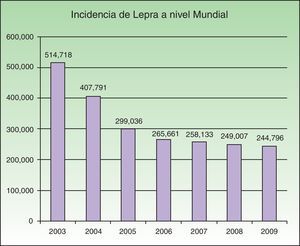
EpidemiologíaLos programas nacionales de lepra implementados en regiones endémicas han sido exitosos para la estrategia global de la OMS de eliminación de esta enfermedad en los años 2006 a 2010. Durante los últimos meses del año 2010 141 países enviaron a la OMS informes acerca de la situación de la lepra. En el año 2009 se reportaron 244.796 casos nuevos, siendo el Sureste de Asia la región con el mayor número de casos, con un total de 166.115. La prevalencia mundial a principios del año 2010 fue de 211.903 casos4. Actualmente hay más de 15 países endémicos para esta micobacteriosis, y el 83% de los casos registrados se concentran en 3 países: India, Brasil y Birmania2,4. India reporta el 64% de todos los casos a nivel mundial. En 2008 se registró una prevalencia de 212.802, mientras que en 2007 se registraron 254.252 nuevos casos. Se observó una disminución de 11.100 casos (4%) en 2007 en comparación con 2006 (fig. 1).
Número de casos nuevos registrados de 2003 a 2009 de 16 países que reportan más de 1.000 casos anuales. Fuente: Global Leprosy Situation 20104.
A principios de la década de los 90 la OMS propuso la «Estrategia del empuje final» con la clara idea de eliminar la lepra, definiendo la misma como una prevalencia menor a un caso por cada 10.000 habitantes en los países endémicos4. Países como la República del Congo y Mozambique reportaron dichas cifras, sin embargo aún persisten lugares altamente endémicos que no han podido alcanzar la meta. La disminución de la prevalencia no se relaciona con la reducción en el número de casos nuevos detectados. Este cambio en la prevalencia no se relaciona con la disminución de la trasmisión del M. Leprae, sino que más bien podría deberse al acortamiento del tratamiento indicado por la OMS o a la exclusión en los registros de los pacientes curados o fallecidos.
Países que han eliminado la lepra, como España, reportan un aumento de casos importados principalmente de países sudamericanos y sudafricanos5.
Microbiología e inmunologíaM. Leprae es un bacilo ácido alcohol resistente, gram positivo intracelular obligado, que presenta tropismo hacia células del sistema reticuloendotelial y del sistema nervioso periférico, principalmente las células de Schwann (única micobacteria con estas características). Taxonómicamente se clasifica en el orden Actinomycetalis, familia Mycobacteriacae. Es un bacilo ligeramente curvado que mide 1-8 micras de longitud y 0,3 micras de diámetro. Se divide por medio de fisión binaria, como lo hacen el resto de las micobacterias.
El macrófago es la célula predilecta por el bacilo; en ella se agrega para formar conjuntos bacilares intracelulares denominados globias. No se ha podido cultivar en medios artificiales, pero el bacilo se replica en los cojinetes pedios del armadillo de 9 bandas. La micobacteria tiene un tiempo de duplicación de 11-13 días (comparado con las 20 horas del Mycobacterium tuberculosis). El bacilo tiene predisposición por sitios fríos del cuerpo, como la piel, la mucosa nasal y los nervios periféricos, principalmente los superficiales, teniendo como preferencia una temperatura entre 27 y 30 °C. La estructura molecular del bacilo, principalmente la cápsula y la pared celular, le confieren ciertas propiedades que explican su efectividad en un nicho ecológico muy limitado6.
La cápsula se encuentra formada por una gran cantidad de lípidos, siendo los dos más importantes el dimicocerosato de tiocerol y el glucolípido fenólico-i, este último blanco de una intensa respuesta humoral mediada por IgM2,6,7. Otro componente importante de la pared celular es el lipoarabinomanano, que es el antígeno para el macrófago. Gran parte de los genes funcionales encontrados en otras micobacterias han sido inactivados o convertidos en pseudogenes, inhabilitando funciones como la reproducción extracelular. De esta manera diversas funciones metabólicas y de reproducción de M. leprae hacen que sea una bacteria intracelular obligada con un tiempo de replicación prolongado.
Existe una preferencia de M. leprae por la célula de Schwann, determinada por la unión del bacilo al dominio G de la cadena alfa2 de la laminina 2, la cual es un componente exclusivo de la lámina basal de los nervios periféricos, explicando la predisoposición de M. leprae por estas células. Una vez que penetra en la célula el bacilo se replica lentamente hasta que en algún momento las células T reconocen la presencia de antígenos de la micobacteria e inician la reacción inflamatoria crónica7.
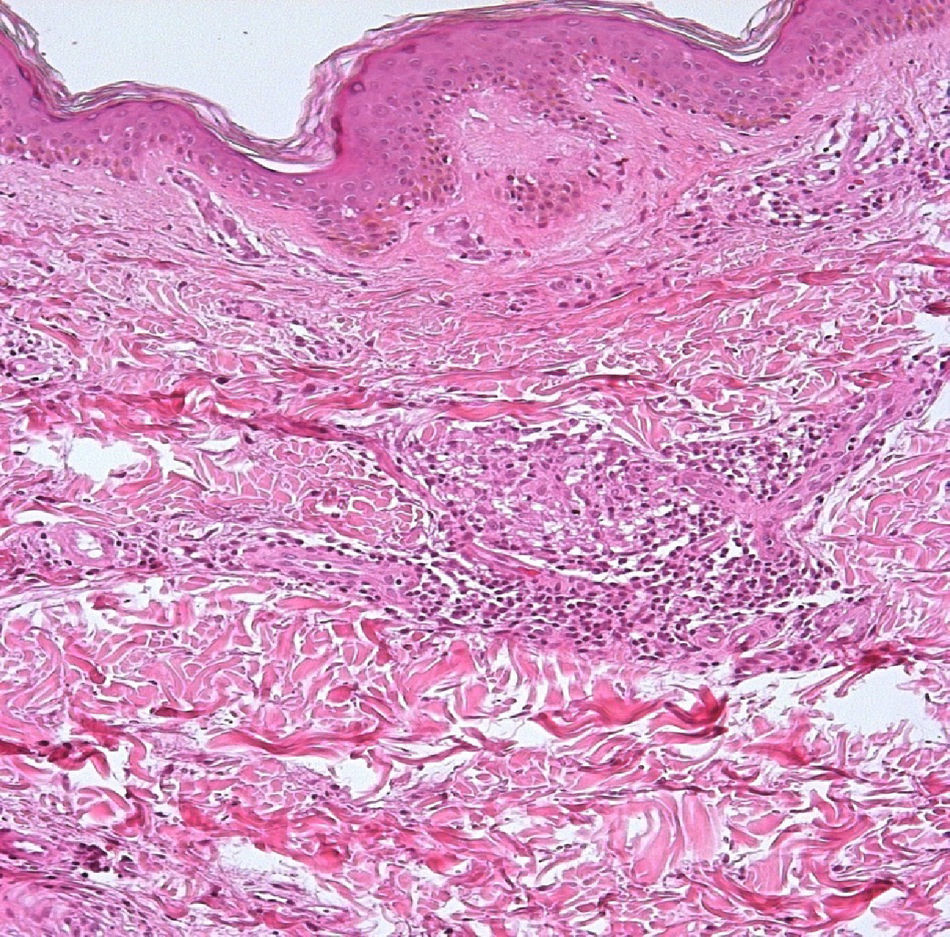
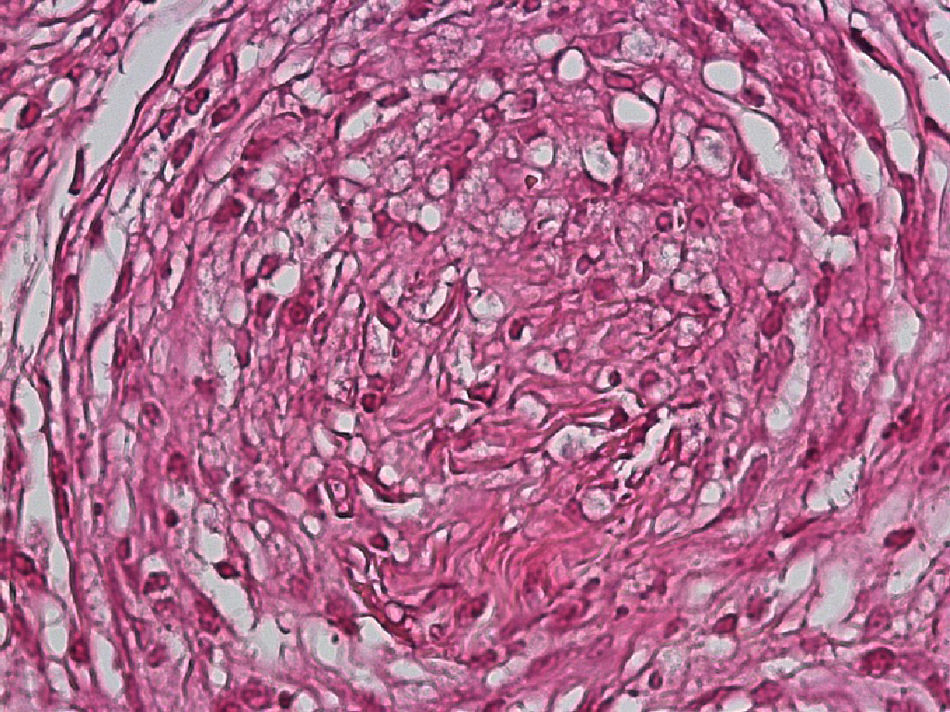
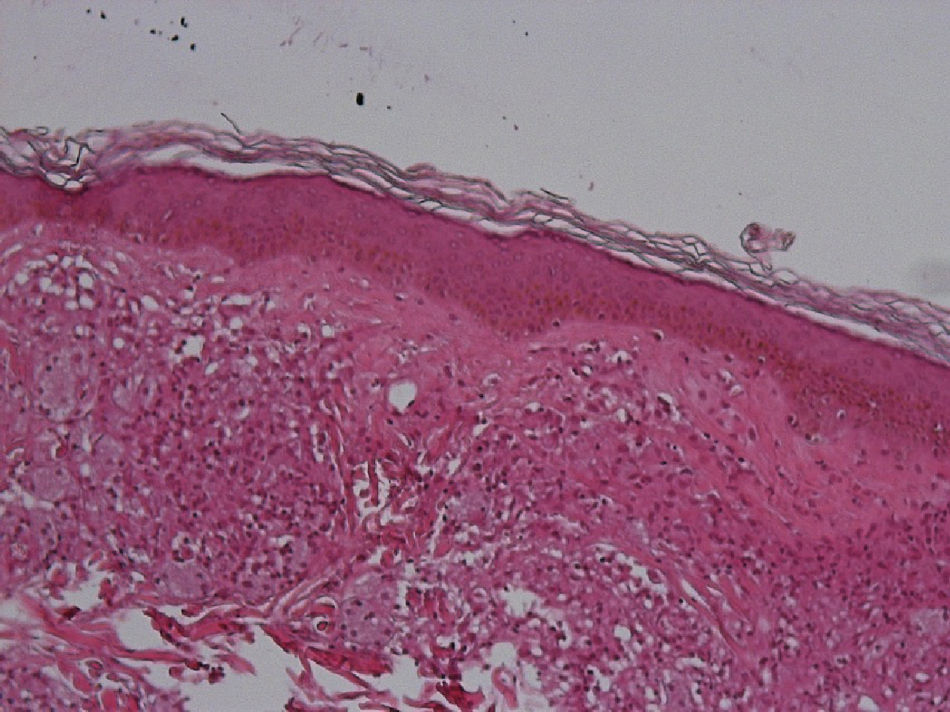
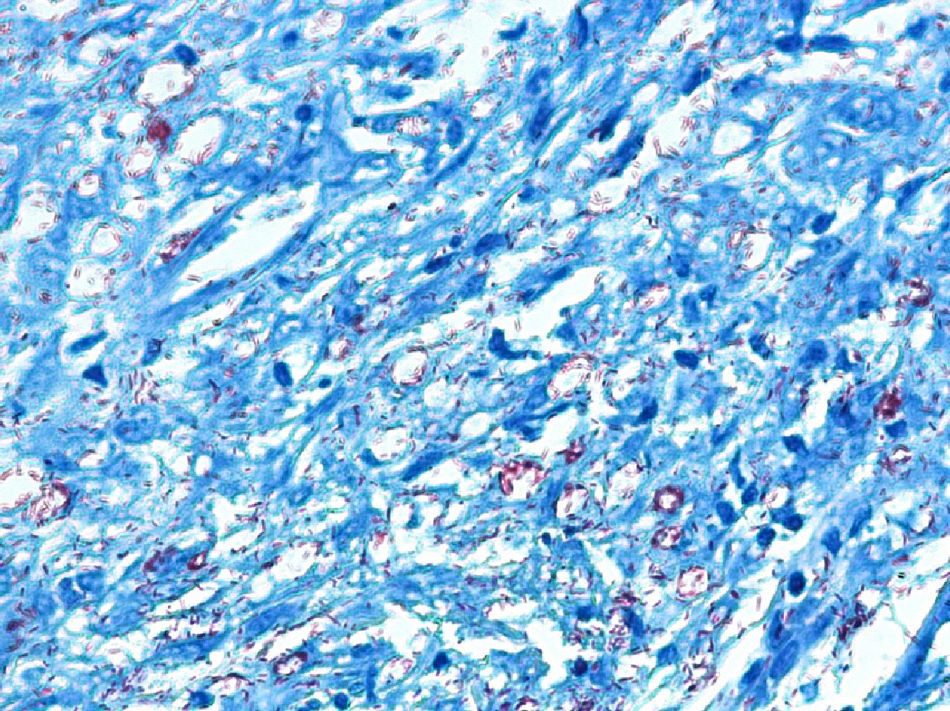
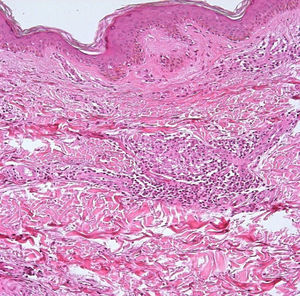
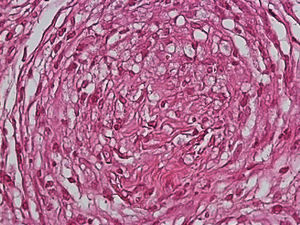
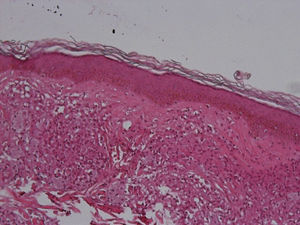
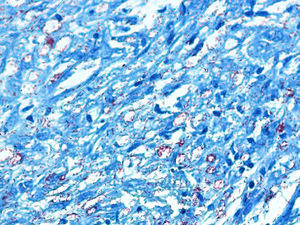
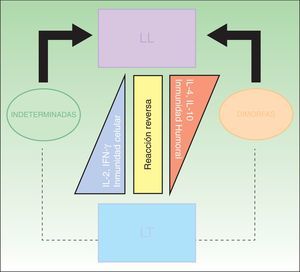
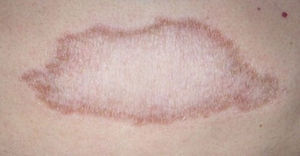
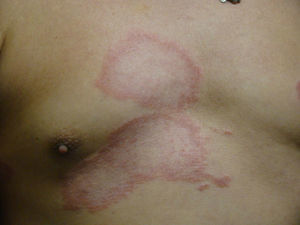
El desarrollo de la enfermedad y la presentación clínica dependen del estado inmunológico del paciente. Actualmente se habla de susceptibilidad genética asociada al cromosoma 10p13 localizado cerca del gen que codifica los receptores de manosa tipo 1, que funcionan como receptores fagocíticos de los macrófagos8. Así mismo, se ha visto relación entre genes de clase ii del complejo mayor de histocompatibilidad en el cromosoma 6 y el tipo de lepra a desarrollar. Los HLA DR2 y HLA DR3 se asocian al desarrollo de lepra tuberculoide (LT), mientras que el HLA DQ1 se presenta más frecuentemente en pacientes con lepra lepromatosa (LL). De esta manera se han asociado muchos otros elementos inmunológicos al tipo de lepra que se desarrolla clínicamente y a la evolución. En el polo tuberculoide hay una intensa respuesta celular organizada y específica, mientras que la ausencia de inmunidad específica se presenta clínicamente como LL. La LT afecta la piel y los nervios periféricos, se caracteriza por lesiones en forma de placa infiltradas, anulares, ovoides bien definidas, primordialmente anestésicas y afectando cualquier región del cuerpo. En la biopsia de piel y localizados alrededor de los filetes neurales, se observan granulomas con abundantes histiocitos epitelioides, células gigantes multinucleadas y linfocitos T CD4 secretores de interferón gamma, siendo la ausencia o la poca presencia de bacilos ácido-alcohol resistentes uno de los hallazgos histológicos más importantes (figs. 2 y 3). En ocasiones pueden ser encontrados escasos bacilos ácido-alcohol resistentes. La LL presenta una situación inmunológica y clínica distinta, en donde no hay una respuesta inmune específica, existe proliferación de los bacilos en los tejidos, se observan macrófagos espumosos y pocos linfocitos CD4 y CD8, característicamente sin formación de granulomas (figs. 4 y 5). En la inmunohistoquímica de la biopsia de piel se observa principalmente expresión de IL 4 y 102.
La respuesta inmunológica hacia M. lepraees variable y puede llevar a cambios espontáneos en el estado clínico de la enfermedad, presentando las reacciones lepromatosas tipo 1 y 2. Estas reacciones se desencadenan por situaciones que pueden modificar el sistema inmunológico, como los medicamentos antileprosos, el estrés y el embarazo. La reacción reversa o tipo 1 es una reacción de hipersensibilidad tipo iv9. Existe un aumento en las citocinas circulantes como interferón gamma, factor de necrosis tumoral (FNT) y mayor reactividad de los linfocitos T CD4. El eritema nodoso o reacción lepromatosa tipo ii corresponde a una reacción de hipersensibilidad tipo iii por depósito de inmunocomplejos asociada a toxicidad sistémica, aumento en los niveles circulantes de FNT-α, así como infiltración por neutrófilos y depósito de complemento en la piel. Cabe mencionar que se desarrolla principalmente en los casos de lepra dimorfa (LB) y LL.
ContagioEl mecanismo de transmisión no es conocido. Se sabe que M. leprae es una micobacteria con un poder de contagio muy pobre. Entre los principales factores de riesgo están el hacinamiento y el contacto prolongado10. Recientemente se ha estudiado la posibilidad de la vía respiratoria como canal importante de transmisión. Los pacientes con LL son quienes presentan una gran carga bacteriana en los tejidos, describiéndose hasta 7.000 millones de bacilos por gramo de tejido. Se sabe que los casos no lepromatosos tienen una carga bacteriana mucho más pequeña, del orden de un millón de organismos en total. El bacilo se ha encontrado en gran número en la mucosa nasal (100 millones de microorganismos viables por día)11. Si bien se creía que la piel podría ser una superficie de transmisión, esto nunca se ha podido comprobar. Se ha descrito una viabilidad del bacilo que oscila entre 36 horas hasta 9 días fuera del cuerpo humano, siendo así posible la transmisión por fómites. Parece que la vía de entrada podría ser el sistema respiratorio, el cual se ha investigado en ratones inmunocomprometidos siendo posible la inoculación por aerosoles.
Aún no se ha establecido una relación con un vector, pero no se ha podido descartar tal posibilidad. La lepra tiene un poder de contagio bajo, por lo que necesita circunstancias apropiadas para poder infectar al huésped. Se han reportado casos de LT asociados a tatuajes, principalmente en la India12. La transmisión vertical de madre a hijo se ha reportado, por lo que es imperativo el seguimiento en dichos casos13.
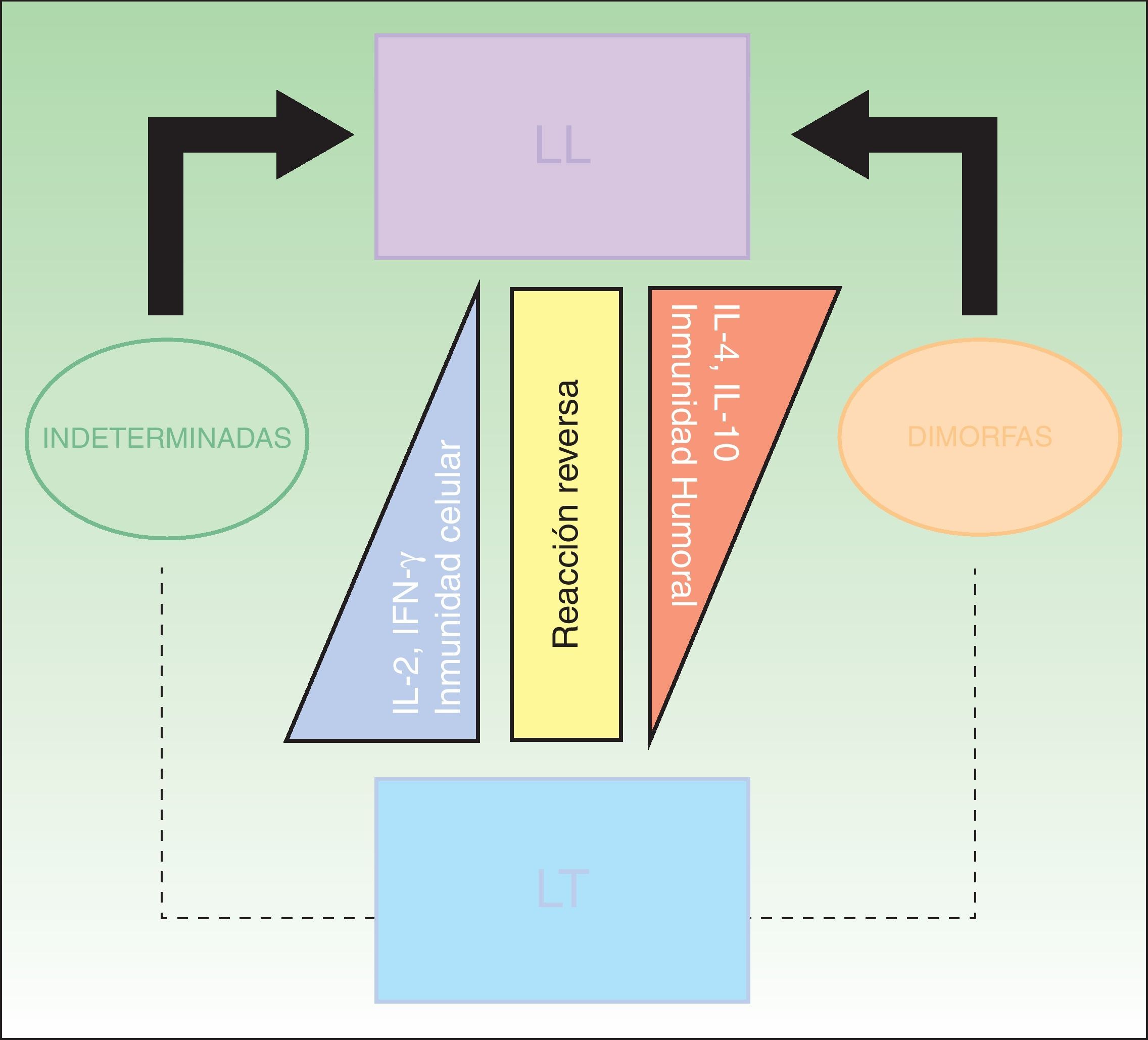
ClasificaciónLa clasificación clínica más utilizada es la de Ridley-Jopling, que se basa en el estado clínico e inmunológico del paciente (fig. 6)14. La enfermedad se divide en 2 polos y un estadio intermedio; LL, LT y lepra dimorfa (borderline). Los casos dimorfos se clasifican según se acerquen al polo L o T antecedidos por la palabra bordeline (BL, BT y BB). Existe un grupo de casos indeterminados que se consideran la etapa inicial de la lepra. Estos casos se encuentran en un estadio inestable que evoluciona eventualmente a una polaridad y puede ser interrumpido con tratamiento hacia la curación. En este estadio, a pesar de la dificultad del diagnóstico clínico, es donde la lepra puede ser curada fácilmente. Todos los casos dimorfos o indeterminados avanzan hacia un polo, principalmente a LL. En 1998 el Comité Experto en Lepra de la OMS determinó que las baciloscopias no eran esenciales para iniciar tratamiento, creando así, para fines prácticos y homologar criterios a nivel mundial, una clasificación rápida, concisa y que todo médico pudiera utilizar, sin equipo diagnóstico o riesgo laboral de por medio2,4,10. El caso paucibacilar se define como aquel que presenta 5 o menos lesiones en la piel. Aquellos pacientes con 6 o más lesiones en la piel se clasifican como multibacilares15. Aun así no es una clasificación perfecta, ya que de esta manera hay una cantidad no despreciable de pacientes multibacilares que quedan clasificados como paucibacilares, repercutiendo finalmente en el tratamiento.
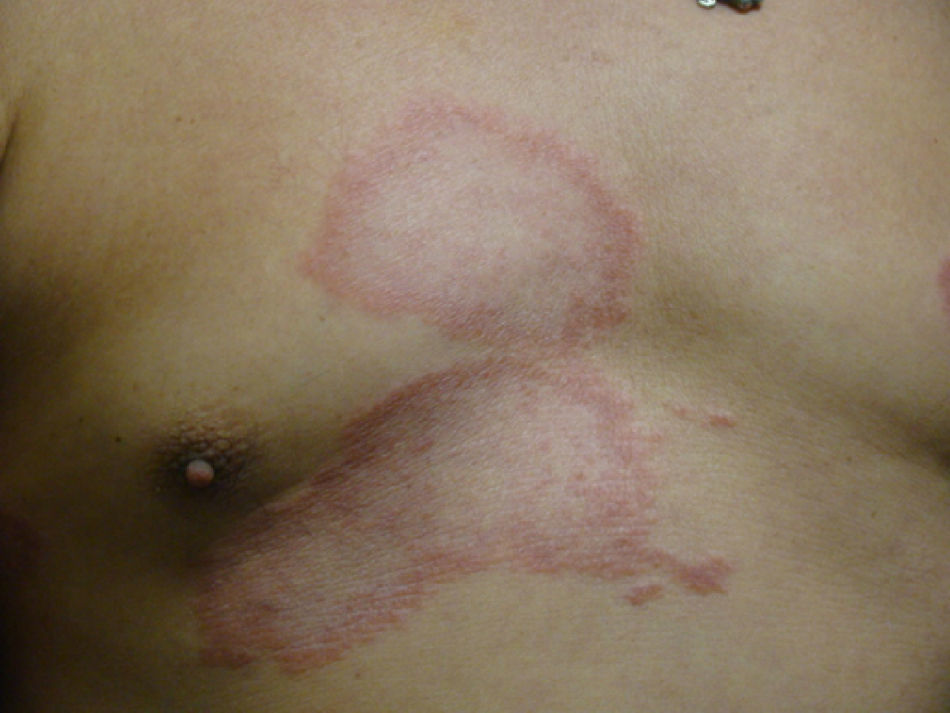
Aspectos clínicosLa lepra afecta principalmente la piel, los nervios periféricos superficiales, los ojos y otros órganos como los testículos. Es frecuente que el motivo de consulta de los pacientes con lepra sea la presencia una dermatosis diseminada, aunque también puede ser por paresias, parestesias o manifestaciones sistémicas como fiebre y pérdida de peso. La LL se considera en un espectro dinámico progresivo, sistémico e infectante (fig. 7). El estudio bacteriológico es positivo y la reacción de Mitsuda es negativa (intradermorreacción con lepromina) debido a la ausencia de inmunidad celular específica. La LT es estable, rara vez transmible y, en ocasiones, autolimitada (fig. 8). En el estudio bacteriológico hay ausencia de bacilos. Existe una reacción de Mitsuda positiva y en la biopsia se observan característicamente granulomas.
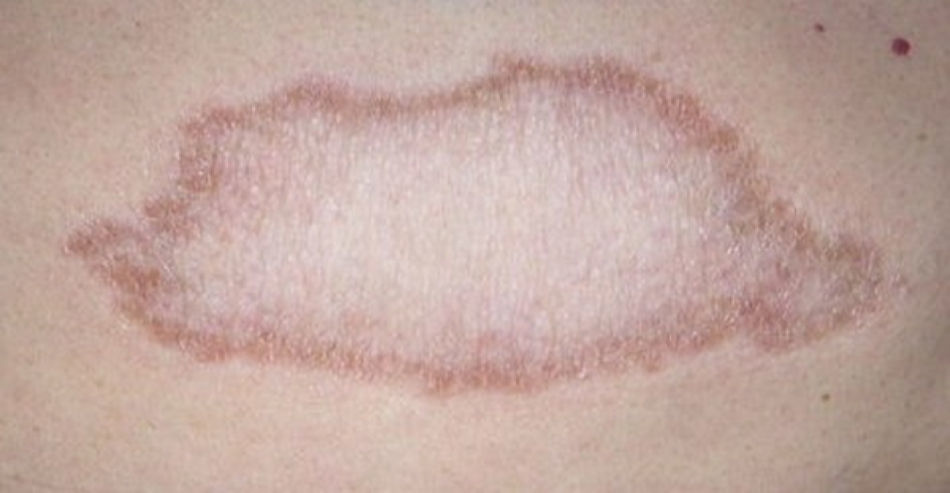
El espectro tuberculoide (LT y BT) se presenta como escasas máculas hipopigmentadas, hipoestésicas, bien delimitadas con bordes eritematosos elevados y zonas centrales atróficas. En el rostro es difícil encontrar disminución de la sensibilidad debido a una abundante inervación sensitiva. Se asocia con anhidrosis y pérdida de anejos. Debido a que la LT representa un estado inmunológico competente, no es típico observar lesiones grandes o en gran número. La LT puede presentar resolución espontánea debido al buen sistema inmunológico del huésped.
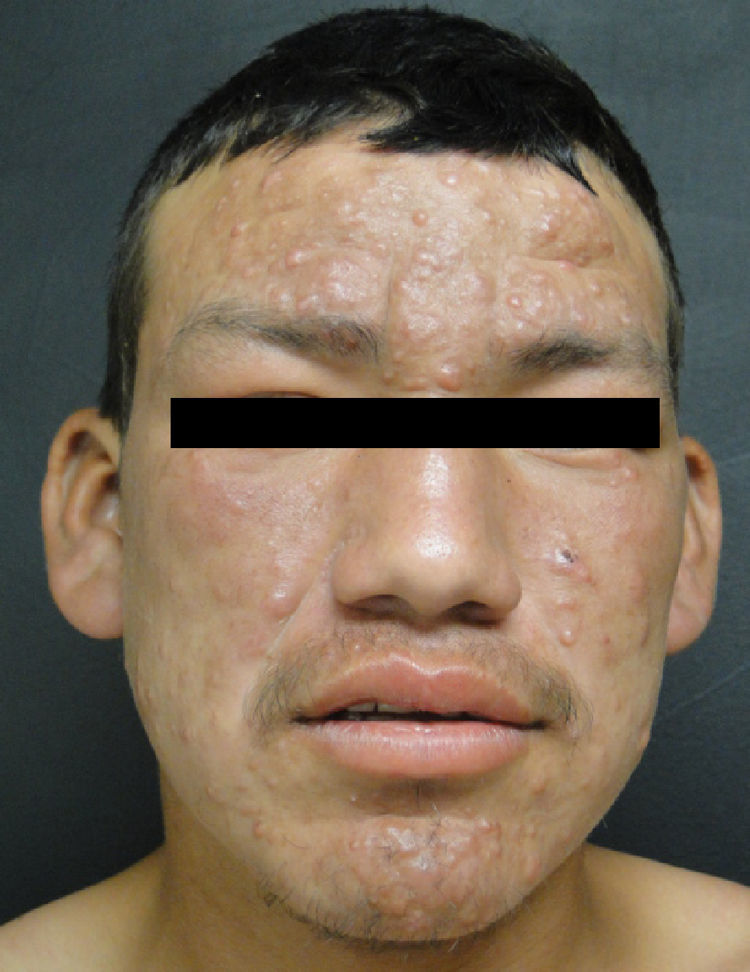
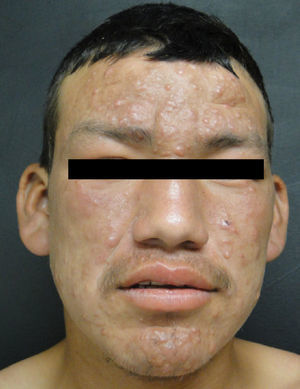
Lepra lepromatosaEl espectro categórico lepromatoso (LL y BL) se caracteriza por pápulas y nódulos que confluyen, pudiendo originar una marcada infiltración difusa de la piel que da lugar a la denominada facies leonina y a la madarosis. Las lesiones suelen ser simétricas y bilaterales. En etapas tempranas la piel suele tener una apariencia infiltrada y cérea. En esta polaridad suele haber más afectación nerviosa e incapacidad que en la tuberculoide. Existen dos variedades clínicas de la LL, que son la nodular y la difusa.
Casos dimorfosLos casos dimorfos tienen una presentación clínica aguda o subaguda y provienen de casos indeterminados (fig. 9). Se considera una situación clínica inestable y transitoria en la cual se le debe iniciar el tratamiento oportuno. Casi todos los casos dimorfos evolucionan hacia LL. Clínicamente se presentan como placas eritematoescamosas circulares o anulares con bordes externos difusos e internos bien delimitados. La evolución de la lesión deja atrofia y pérdida de los anejos de la piel. En ocasiones se ha descrito que si los bordes externos de la lesión anular están bien definidos tiende a evolucionar a LT, y si el interno es el más definido entonces evolucionará a LL.
Reacciones agudasEl eritema nodoso leproso (tipo ii) se acompaña de síntomas sistémicos como alteración del estado general, astenia, adinamia, fiebre, artralgias y pérdida de peso. Esta reacción leprosa se presenta hasta en un 60% de los pacientes con LL y puede aparecer en varias ocasiones a lo largo de la evolución15. Hay nódulos dolorosos que aparecen principalmente en las extremidades inferiores y, en ocasiones en el tronco, de evolución subaguda. Una variante de la reacción lepromatosa tipo ii es el eritema necrosante o fenómeno de Lucio, en el que hay máculas rojas congestivas que evolucionan a ampollas o escaras, dejando ulceraciones y posteriormente cicatrices atróficas. El mecanismo asociado es el depósito de inmunocomplejos. Actualmente se estudia una relación entre el fenómeno de Lucio y M. lepromatosis16.
La reacción reversa (tipo i) se presenta en casos interpolares y se asocia a cambios hormonales como el puerperio o a la farmacoterapia, principalmente a los fármacos antileprosos17. Es una reacción antigénica producida por variaciones en el estado inmunológico del paciente debido a un mecanismo de hipersensibilidad mediado por células. Se presenta a los pocos meses de haber iniciado el tratamiento o tras el abandono del mismo. Característicamente hay manchas eritematosas de aspecto congestivo asociadas a ampollas, ulceración y/o necrosis de tejidos. El aspecto más importante a considerar es la neuritis que presentan los pacientes, siendo imperativo la instauración de un tratamiento efectivo y oportuno antes de que el daño sea irreversible.
Manifestaciones clínicasEl sistema nervioso periférico es blanco del bacilo de la lepra y se asocia a una gran variedad de manifestaciones clínicas que caracterizan a esta micobacteriosis18. Puede haber lesión de nervios periféricos dérmicos, principalmente el tibial posterior, el cubital, el mediano y el peroneo lateral19. Existe una reacción osteofibrótica superficial perineural haciendo los nervios palpables a la exploración física. El compromiso de estos nervios ocasiona engrosamiento, dolor, pérdidas sensoriales y motoras. La afectación de pequeñas fibras nerviosas dérmicas ocasiona hipoanestesia, anhidrosis y pérdida de la sensibilidad térmica. Existe una variedad de lepra en la que hay afectación neurológica solamente con presentación neurítica asimétrica, que es más frecuente en India y Nepal. Otras enfermedades que se asocian con el engrosamiento de nervios periféricos y que forman parte del diagnóstico diferencial son: la amiloidosis primaria y otras enfermedades hereditarias, como la enfermedad de Charcot-Marie-Tooth, la enfermedad de Dejerine-Sottas y la enfermedad de Refsum20.
La afectación del sistema músculo esquelético se reporta hasta en un 95% de los casos21,22. Las manifestaciones óseas más frecuentes son las inespecíficas debidas a hipoanestesia secundaria a daño neurológico que provoca úlceras, deformidades y fracturas. Es importante mencionar la osteoporosis como la segunda manifestación más frecuente en los pacientes con lepra23.
En la LL se han reportado casos con compromiso testicular, principalmente atrofia y orquitis aguda asociados a eritema nodoso. El ojo se puede afectar por infiltración directa o por afección del nervio óptico. Hay reportes que apuntan que hasta un 11% de los pacientes multibacilares presentan amaurosis en el momento del diagnóstico19. Una variante frecuente en México es la LL difusa descrita en 1851 por Lucio y Alvarado. Se caracteriza por una infiltración difusa que da un aspecto mixedematoso y atrófico de la piel, con singular proyección en los pabellones auriculares24. Las manifestaciones oculares principales de la lepra son lagoftalmos, queratitis y entropión.
DiagnósticoEl diagnóstico de la lepra es clínico y se basa en 3 signos cardinales que fueron propuestos por el Comité Experto en Lepra de la OMS en 19972,15. Se define caso de lepra cuando un individuo no ha completado un curso de tratamiento y tiene uno o más de los siguientes signos cardinales:
- 1.
Lesiones dermatológicas hipopigmentadas o eritematosas en la piel con pérdida de la sensibilidad.
- 2.
Engrosamiento de los nervios periféricos.
- 3.
Baciloscopia positiva o bacilos en la biopsia.
Hay reportes que arrojan una sensibilidad de hasta un 97% cuando los tres signos son positivos (tabla 1)15. Cuando se utiliza la cuantificación de lesiones anestésicas hipopigmentadas en pacientes multibacilares un 30% de los casos pueden ser subdiagnosticados, en comparación con los pacientes paucibacilares en los cuales hasta el 90% de los casos son diagnosticados al observar dichas lesiones.
Signos cardinales para diagnóstico y clasificación clínica para tratamiento por la OMS
| Signos Cardinales (cualquiera hace diagnóstico) | Clasificación para tratamientoa |
| Parches hipopigmentados o levemente eritematosos con pérdida definitiva de sensibilidad | Paucibacilar (1 a 5 parches en piel) |
| Nervios periféricos engrosados | Multibacilar (6 o más parches en piel) |
| Bacilos ácido-alcohol resistentes en baciloscopia o biopsia de piel |
Fuente: Britton et al.2. Cualquier signo cardinal es diagnóstico y clasificación clínica para tratamiento según la OMS.
El engrosamiento de los nervios periféricos normalmente sucede después de la aparición de las máculas anestésicas. La afectación de los nervios periféricos tiene una distribución característica y suele ser más importante en los casos multibacilares.
BaciloscopiaLa baciloscopia tiene una especificidad del 100% y una sensibilidad del 50%. La baciloscopia se obtiene de la mucosa nasal, lóbulo de la oreja y/o lesiones en piel25–27. Se utiliza la tinción de Ziehl-Nieelsen para visualizar la micobacteria. El resultado arrojado se interpreta utilizando la escala logarítmica de Ridley o índice bacteriológico, reportado en cruces (dependiendo de si son abundantes o escasas) y equivalente a un número de bacterias por campo. El estándar de oro sigue siendo la histopatología.
Biopsia de pielLa biopsia de piel se obtiene de una lesión cutánea y se tiñe con la técnica de Fite-Faraco. En el polo LT no se observan bacilos, pero se buscan granulomas característicamente con afectación neural. En los casos que tienden a la polaridad lepromatosa, en la histología se observan infiltrados inflamatorios con células de Virchow repletas de bacilos y con ausencia de anejos. En la polaridad LT se observan granulomas tuberculoides con células epitelioides, células gigantes de Langerhans e infiltrado linfocitario.
Intradermorreacción con leprominaLa prueba de la lepromina proviene de M. leprae extraído de lepromas. Se realiza mediante inyección intradérmica 0,1ml de reactivo de lepromina y se aplica en la superficie flexora del antebrazo. La respuesta se interpreta de dos maneras: una reacción temprana llamada reacción de Fernández y una reacción tardía conocida como reacción de Mitsuda. La reacción de Fernández es sensible, pero puede mostrar reactividad cruzada a otras micobacterias y se interpreta a las 24 o 48 horas. La lectura de la reacción de Mitsuda se realiza a los 21 días e indica resistencia. Es positiva cuando se produce un nódulo >5mm. Es importante considerar que estas pruebas no son diagnósticas y su utilidad es más de clasificación y pronóstico. Como parte de la iniciativa global en países endémicos el diagnóstico se hace con la clínica y las baciloscopias, aunque existan herramientas más sofisticadas, como la serología.
Pruebas serológicasActualmente existe la determinación de anticuerpos antiglucolípido fenólico 1 (PGL-1) y reacción en cadena de la polimerasa (PCR). La determinación de anticuerpos anti PGL-1 es útil en pacientes con enfermedad multibacilar, pero de poca utilidad en pacientes con presentación paucibacilar28–30. La PCR es altamente específica y sensible, pero el coste y la infraestructura necesaria impiden su uso rutinario.
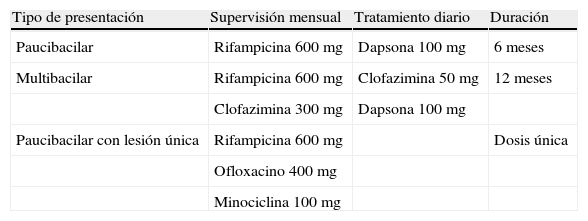
TratamientoLa eliminación de la lepra como un problema de salud pública es factible, ya que es una de las pocas enfermedades infecciosas que cumplen ciertos criterios estrictos para su eliminación. Entre ellos tenemos que existe una sola fuente de infección (personas infectadas sin tratamiento) y herramientas diagnósticas prácticas y sencillas. Además hay disponibilidad de tratamiento efectivo; es más, por debajo de cierta prevalencia en la población la probabilidad de la enfermedad de resurgir es muy baja y, a diferencia de la tuberculosis, la situación de la lepra no parece afectarse negativamente por la infección por el VIH. En 2003 fueron 117 países los que alcanzaron las metas de eliminación de lepra en el mundo, pero continúa siendo un problema de salud pública en 17 países2. La poliquimioterapia fue indicada por la OMS en 1981, siendo los fármacos de primera línea la rifampicina, la clofazimina y la dapsona (diaminodifenilsulfona)31. Todo paciente debe recibir terapia combinada con supervisión mensual (tabla 2).
Tratamiento asignado por la OMS
| Tipo de presentación | Supervisión mensual | Tratamiento diario | Duración |
| Paucibacilar | Rifampicina 600mg | Dapsona 100mg | 6 meses |
| Multibacilar | Rifampicina 600mg | Clofazimina 50mg | 12 meses |
| Clofazimina 300mg | Dapsona 100mg | ||
| Paucibacilar con lesión única | Rifampicina 600mg | Dosis única | |
| Ofloxacino 400mg | |||
| Minociclina 100mg |
Fuente: World Health Organization43.
Entre los medicamentos de segunda línea tenemos la minociclina, el ofloxacino y la claritromicina. Las fortalezas que tiene la poliquimioterapia son que previene la resistencia contra la dapsona, disminuye rápidamente la infectividad entre infectados y se asocia a menos recidivas y reacciones32. Aun así, desgraciadamente es una terapia larga, difícil de cumplir y asociada a dificultades de logística.
Medicamentos de primera líneaLa rifampicina es un derivado del hongo Streptomyces, que tiene como mecanismo bactericida la inhibición de la síntesis de ARN. Entre sus principales efectos secundarios están la hepatotoxicidad, las náuseas, los vómitos, el rash cutáneo y la fiebre. La clofazimina tiene una capacidad bactericida baja y se sabe que se une al ADN, pero no se conoce su mecanismo de acción. Se cree que genera radicales superóxido citotóxicos, además de tener propiedades antinflamatorias, y su uso se asocia a menos casos de eritema nodoso. La clofazimina está contraindicada en la insuficiencia renal y se asocia a cambios en la coloración de la piel. La dapsona se relaciona estructuralmente a las sulfonamidas, siendo bacteriostático por medio de un mecanismo de antagonismo de PABA, inhibiendo la biosíntesis de folatos. Se asocia a hemólisis (principalmente en pacientes con deficiencia de glucosa 6 fosfato deshidrogenasa), neuropatía periférica y eritema nodoso33. Se han descrito resistencias a la rifampicina y la dapsona en los genes rpoB y folP1 respectivamente34. Los medicamentos de segunda línea son altamente activos, pero por su coste permanecen como alternativas.
Tratamiento de las reacciones leprosasLa reacción leprosa tipo 1 se presenta con eritema, edema y neuritis, siendo más frecuente durante los primeros 2 meses de haber iniciado el tratamiento. El tratamiento para la neuritis es a base de prednisona 40–60mg/día, intentando suspenderla a las pocas semanas2,35,36. En el eritema nodoso hay fiebre, nódulos, dolor óseo, neuritis y dactilitis. La presentación es más frecuente entre el primer y segundo año con recaídas intermitentes. El tratamiento de elección es la talidomida y en ocasiones se puede utilizar prednisona y clofazimina. La talidomida se inicia a una dosis de 100 a 200mg al día, reportándose inicios hasta de 400mg al día e intentando retirarla a las 3-4 semanas37,38. Si hay recurrencias puede utilizarse un tiempo prolongado, teniendo en cuenta sus efectos secundarios como neuropatía y teratogenicidad. El mecanismo de acción de la talidomida aún no se conoce con exactitud, pero se sabe que inhibe la actividad del factor de necrosis tumoral alfa. La clofazimina es una buena opción por su efecto antiinflamatorio y puede utilizarse a dosis de 300mg/día en mujeres en edad fértil o en personas intolerantes a la talidomida.
SeguimientoSe sugiere realizar examen físico completo y baciloscopia cada 6 meses, durante el tratamiento de los pacientes multibacilares. Al terminar el ciclo del tratamiento se realizará un estudio histopatológico. En los pacientes paucibacilares solo se realiza un estudio histopatológico al haber terminado el tratamiento.
Prevención de discapacidadesLa clave del tratamiento es la educación del paciente. Es importante evitar los estigmas sociales y reafirmar que es una enfermedad poco contagiosa. La información hace que el paciente sea más responsable de su tratamiento. Es necesario insistir en que la deformidad es evitable. Un estudio epidemiológico de pacientes con lepra en Etiopía encontró discapacidad hasta en un 61,5%39.
La lepra, así como la diabetes mellitus, presentan neuropatía, motivo por el cual se debe tener un cuidado apropiado para evitar la incapacidad. La prevención de las secuelas es un apartado principal en la agenda del tratamiento del paciente con lepra. Se debe tener un cuidado especial de las extremidades, principalmente de los pies, contra traumatismos y microtraumatismos15. Se debe revisar al paciente e informarle, de forma intermitente y reiterada, sobre el calzado que debe de utilizar, así como del cuidado especial para sus pies. Las úlceras que se presentan secundarias a la lepra mejoran cuando se elimina la presión sobre ellas. Actualmente la muerte no debe ser parte del escenario de la lepra, pero cuando sucede es secundaria a infecciones (neumonía y tuberculosis), amiloidosis y/o fallo renal40.
VacunasExisten distintas vacunas probadas, en mayor o menor medida, en países endémicos. El efecto inmunoprofiláctico se logra mediante el restablecimiento del sistema inmune contra antígenos compartidos con otras micobacterias. Entre las vacunas utilizadas actualmente están la Mycobacterium (w) (Talwar 1978), el bacilo de Calmette-Guérin (BCG) más M. leprae inactivada por calor (Convit 1992), Mycobacterium ICRC (M. avium intracelular), Micobacterium tufu (Iushm y Kalianina 1995) y Micobacterium habana (Singh et al., 1997)41. Hay reportes que indican una protección con la vacuna BCG contra la lepra de hasta un 50%42. En un estudio realizado en la India la vacunación con BCG más M. leprae inactivada por calor reportó un éxito del 64%. En regiones donde se usa la vacuna w junto con medicamentos antileprosos se ha visto que hay una regresión clínica acelerada, así como mejoría en el índice bacteriológico en pacientes multibaciliares con respuesta parcial al tratamiento actual. Hay sitios donde se administra profilaxis a los familiares en contacto con el paciente mediante la aplicación de BCG a menores de 12 años.
ConclusiónLa enfermedad de Hansen es una realidad actualmente. Todo médico debe tener el mínimo conocimiento indispensable sobre ella para poder diagnosticarla, y así evitar la incapacidad y/o el contagio. Entender la inmunopatología de la enfermedad demuestra la complejidad de ciertas enfermedades y sirve de modelo para comprenderlas y tratarlas. El conocimiento que se tiene actualmente hace posible la eliminación de la enfermedad, por lo que se tienen que sumar esfuerzos médicos, sociales, políticos y científicos para evitar la propagación de una infección que ya no debería existir.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Deseamos expresar nuestro agradecimiento al Dr. Rodrigo Cepeda Valdés por su valiosa colaboración en la revisión del material bibliográfico.