El lentigo maligno (LM) es una variante de melanoma in situ que se desarrolla principalmente en áreas de exposición solar crónica en pacientes de edad media-avanzada. Puede evolucionar a su forma invasiva lentigo maligno melanoma (LMM) en el 5-50% de los casos. Su manejo en ocasiones en controvertido, destacando la ausencia de estudios prospectivos aleatorizados y de guías específicas o protocolos. Es necesario realizar un diagnóstico y tratamiento precoces para obtener la curación, si es posible, y evitar la evolución a melanoma invasivo con el consiguiente riesgo metastásico. El tratamiento de elección del LM es la cirugía. Cuando esta no es posible pueden utilizarse otras alternativas con resultados y tasas de recidiva variables. El objetivo del presente trabajo es realizar una revisión de los métodos y criterios diagnósticos de LM, así como de las diferentes modalidades de tratamiento quirúrgico y las alternativas al mismo, que favorezca el mejor enfoque en cada caso.
Lentigo maligna is a type of in situ melanoma. It develops mainly in middle-aged and elderly individuals on areas of the skin chronically exposed to sunlight. It progresses to its invasive form, lentigo maligna melanoma, in 5% to 50% of cases. Management of lentigo maligna is open to debate, with a notable lack of randomized trials and specific guidelines and protocols. Early diagnosis and treatment is necessary to achieve cure if possible and prevent progression to invasive melanoma with the corresponding risk of metastasis. The treatment of choice for lentigo maligna is surgery. When surgery is not possible, other alternatives are available although outcomes and rates of recurrence are variable. The objective of this study was to review the diagnostic methods and criteria for lentigo maligna, as well as the different surgical options and alternatives to surgery, in order to provide information on the best approach in each case.
El lentigo maligno (LM) es una variante de melanoma in situ que se desarrolla principalmente en áreas cutáneas de exposición solar crónica en pacientes de edad avanzada1. Representa el 79-83% de todos los melanomas in situ2 y puede tener una evolución muy prolongada, de hasta varias décadas, antes de evolucionar a su forma invasiva, el melanoma sobre lentigo maligno (LMM). El LM/LMM supone el 4-15% de todos los melanomas3, y es el más frecuente en la cabeza y el cuello, donde asienta el 86%4. Su incidencia está en aumento, y aunque el pico de edad se sitúa entre los 65-80 años se ha descrito en pacientes de 20-30 años, y el 10% de los casos en series grandes ocurre en menores de 40 años1,5.
No hay protocolos específicos publicados sobre el tratamiento del LM y aún existen controversias acerca del manejo debido a sus características especiales: pacientes de edad avanzada, afectación de zonas expuestas con daño solar crónico y compromiso estético/funcional, márgenes mal definidos clínica e histológicamente y recidiva común tras el tratamiento6. El objetivo del presente trabajo es realizar una revisión de los métodos y criterios diagnósticos, así como de las modalidades de tratamiento quirúrgico del LM y sus alternativas con las ventajas e inconvenientes de cada una de ellas, que sirva de ayuda en la toma de decisiones en cada caso.
MetodologíaSe realizó una búsqueda en la base datos Cochrane, así como en Medline.
Como término de búsqueda en Pubmed se indicaron las palabras clave Hutchinson melanotic freckle, lentigo maligna, diagnosis, therapy, surgery, radiotherapy. Se dio preferencia a los trabajos de revisión y a los publicados en lengua inglesa y española. También se revisaron las principales guías de manejo clínico del melanoma.
Diagnóstico del lentigo malignoDesde el punto de vista clínico se presenta como una mácula de bordes irregulares y mal definidos, de crecimiento lento y pigmentación variada (pardo, marrón claro, marrón oscuro, negro, zonas blancas de regresión) con distribución asimétrica3,7. En raras ocasiones el LM se presenta de forma primaria o después de un tratamiento como una lesión amelanótica clínica e histológicamente8,9.
La histología sigue siendo el método de referencia para el diagnóstico del LM10. Se caracteriza por la proliferación de melanocitos atípicos localizados a lo largo de la unión dermoepidérmica. Con frecuencia las células tienen una orientación perpendicular a la superficie y la afectación del epitelio perianexial es un hallazgo característico. En lesiones más avanzadas pueden verse nidos en la unión dermoepidérmica y células gigantes multinucleadas. A veces puede haber extensión pagetoide, atrofia epidérmica y elastosis solar en la dermis. La dermis papilar puede contener melanófagos y un infiltrado inflamatorio de tipo crónico8.
A veces es difícil distinguir los melanocíticos atípicos verdaderos de la hiperplasia melanocítica atípica juncional presente en la piel con daño actínico. Puede ser útil la toma de una biopsia control de la piel facial contralateral11.
En general, está indicada la biopsia de las lesiones pigmentadas faciales sospechosas o que cambian12. La biopsia excisional es la actuación más rentable para el diagnóstico del LM; sin embargo, debido a que estas lesiones son en muchas ocasiones grandes y se sitúan en zonas estéticamente comprometidas, la biopsia punch es el procedimiento más usado13, lo que puede llevar a error en el muestreo14. Para minimizar este error, basados en estudios observacionales de Stevens y Cocherell15, se recomienda una biopsia incisional profunda hasta el tejido subcutáneo, y si esta se realiza con un punch que sea al menos de 5mm. Para lesiones de gran tamaño puede realizarse un mapeo con varios punch de las zonas más representativas, seleccionando aquellas áreas más oscuras o palpables sospechosas de invasión. Conviene ayudarse de técnicas de imagen como la dermatoscopia y/o la microscopia confocal de reflectancia.
Algunas lesiones faciales clínicamente triviales, que no cumplen con la regla del ABCD, son histológicamente malignas16,17. Por ello, es útil la práctica de la dermatoscopia de rutina como complemento a la clínica para permitir la identificación y escisión precoz de lesiones aparentemente benignas. Según Schiffner y Stolz la dermatoscopia permite el diagnóstico precoz del LM con una sensibilidad del 89% y una especificidad del 96% cuando las características dermatoscópicas se presentan en combinación, ya que la presencia de un solo criterio dermatoscópico no es útil18.
Principales criterios dermatoscópicos del lentigo malignoLo más característico en las lesiones faciales es el denominado pseudorretículo pigmentado. Se trata de una interrupción de la pigmentación homogénea por las salidas foliculares o anexiales de la cara19.
Los criterios dermatoscópicos indicativos de LM/LMM se mencionan a continuación:
Salidas foliculares asimétricamente pigmentadas (refleja la invasión folicular de los melanocitos tumorales). Estructuras romboidales oscuras (refleja la proliferación de los melanocitos alrededor de los espacios interfoliculares). Puntos y glóbulos gris pizarra (son consecuencia de macrófagos cargados de melanina en la dermis superficial del LM. En algunas zonas constituyen imágenes granulares en anillo). Líneas oscuras (presencia de filas de células de melanoma en la epidermis o dermis superficial). Áreas homogéneas (oclusión completa de las salidas foliculares por la invasión de las células de melanoma). Estructuras en isobara (círculos concéntricos de pigmento alrededor de las salidas foliculares).
Recientemente se ha descrito otra estructura dermatoscópica: «patrón en zig-zag» (puntos marrones o azul-gris y líneas que se disponen en un patrón angulado)20.
La dermatoscopia es útil para: seleccionar el sitio de biopsia, realizar un diagnóstico diferencial con otras lesiones pigmentadas faciales18,19, delimitar los márgenes quirúrgicos y hacer el seguimiento y monitorización de la respuesta terapéutica.
Guía para biopsia punch/mapeo/biopsia incisionalDebe seleccionarse un área con estructuras romboidales o áreas homogéneas, evitando las zonas con regresión o melanofagia. Si la sospecha continúa siendo alta, y el diagnóstico histológico es negativo, debe repetirse la biopsia o extirpar la lesión entera si es posible. Hay que considerar la posibilidad de colisión de lesiones con criterios de benignidad y malignas, por lo que evitaremos biopsiar zonas con criterios de lesiones benignas: estructuras en huella digital marrón claro (lentigo senil), tapones córneos (queratosis seborreica), áreas amarillas opacas (queratosis seborreica)20.
Diagnóstico precoz. Modelo de progresión dermatoscópico de SchiffnerDurante el seguimiento es útil reconocer precozmente los primeros signos dermatoscópicos de un LM en fase inicial o detectar una recidiva después de un tratamiento. El modelo de progresión de Schiffner et al. establece un orden de estructuras de las más precoces a las más tardías: punteado anular perifolicular-líneas cortas-estructuras romboidales-aperturas foliculares-áreas homogéneas-obliteración de las salidas foliculares18,21 (figs. 1 y 2).
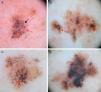
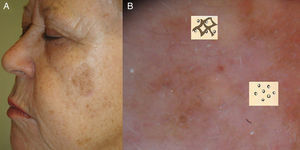
A. Imagen clínica de lentigo maligno. Mácula de pigmentación irregular de color pardo y marrón. B. Imagen dermatoscópica de la lesión donde se observan criterios dermatoscópicos de lentigo maligno en fase incipiente: salidas foliculares asimétricamente pigmentadas y estructuras romboidales.
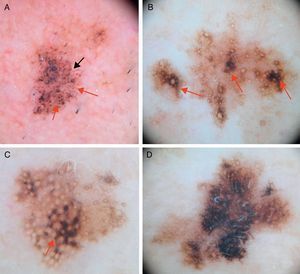
A. Imagen dermatoscópica de lentigo maligno incipiente donde se observan: puntos y glóbulos gris pizarra de distribución irregular (flechas rojas), líneas cortas oscuras y estructuras romboidales incipientes (flecha negra) y pigmentación perifolicular asimétrica (asteriscos). B. Imagen dermatoscópica de lentigo maligno donde se observan salidas foliculares asimétricamente pigmentadas, algunas con signos de oclusión incipiente (flechas rojas). C. En esta imagen se aprecian estructuras en isobaras (asterisco), estructuras romboidales (flecha roja) y salidas foliculares asimétricamente pigmentadas. D. Imagen de lentigo maligno melanoma confirmado histológicamente mediante biopsia tomada de la zona del asterisco, donde se aprecian áreas homogéneas con oclusión de las salidas foliculares.
Mediante una simple exploración visual puede ser complicado establecer el diagnóstico diferencial con otras lesiones pigmentadas: lentigos solares (LS), queratosis actínicas pigmentadas (QAP), queratosis seborreicas (QS), queratosis liquenoides benignas (QLB).
En ocasiones el diagnóstico diferencial puede ser difícil o incluso imposible usando solo la dermatoscopia, ya que varios patrones dermatoscópicos de LM pueden encontrarse en otras lesiones22,23.
En todo caso lo más útil para el diagnóstico no invasivo es la combinación de criterios dermatoscópicos junto con la correlación clínica. Algunas claves dermatoscópicas para el diagnóstico diferencial con otras lesiones pigmentadas faciales pueden verse en la tabla 1.
Diagnóstico diferencial dermatoscópico de las lesiones pigmentadas faciales
| LM | QAP | LS/QS | QLB | |
| Pseudorretículo | + | + | + | + |
| Áreas homogéneas | + | - | - | - |
| Estructuras romboidales | + | + | - | +/- |
| Patrón granular anular | + | + | - | + |
| Gránulos marrón grisáceos | Distribución y tamaño irregular | Similares en color, tamaño, distribución preferente perifolicular | - | Distribución difusa/localizada |
| Pigmentación asimétrica perifolicular | + | +/- | - | - |
| Borde apolillado | - | +/- | + | - |
| Estructuras en huella dactilar | - | - | + | - |
LM: lentigo maligno; LS/QS: lentigo solar/queratosis seborreica; QAP: queratosis actínica pigmentada; QLB: queratosis liquenoide benigna.
La similitud clínica entre LM y QAP es conocida, existiendo en algunos casos incluso dificultades en el diagnóstico histológico. Para ello pueden ser útiles los marcadores inmunohistoquímicos HMB-45 y Melan-A, que pueden combinarse con el Giemsa, que tiñe de un color verdoso los depósitos de melanina para diferenciar los melanocitos de los melanófagos.
Desde el punto de vista dermatoscópico las QAP pueden presentar casi todos los patrones observados en el LM, excepto las áreas homogéneas, siendo estas altamente específicas de LM/LMM10.
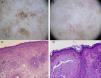
A modo de síntesis las estructuras más específicas que pueden hallarse en la QAP son10,24: múltiples puntos marrón-grises y glóbulos similares en color y tamaño con distribución perifolicular (más regular que en el LM), estructuras romboidales y patrón anular granular (las 3 estructuras anteriores son las más frecuentes) (fig. 3). Pseudorretículo marrón a gris y pseudorretículo fragmentado superficial. Aperturas foliculares con material amarillento queratósico rodeadas de un halo blanquecino con apariencia en diana.
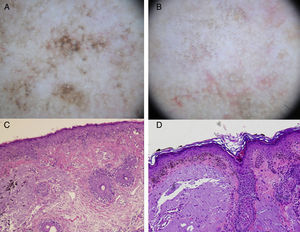
A. Imagen dermatoscópica de lentigo maligno (estructuras romboidales, pigmentación asimétrica perifolicular y patrón granular con glóbulos irregulares con distribución asimétrica). B. Imagen dermatoscópica de queratosis actínica pigmentada (múltiples puntos marrón-grises similares en color y tamaño con distribución principalmente perifolicular, estructuras romboidales). C. Imagen histológica (HE x100) de LM de la figura A: proliferación de melanocitos atípicos distribuidos a lo largo de la unión dermoepidérmica con afectación del epitelio perifolicular. También se observan melanófagos y elastosis solar en la dermis. D. Imagen histológica (HE x100) de la imagen B: queratinocitos atípicos pigmentados en la unión dermoepidérmica. Elastosis solar en la dermis.
Al asentar en zonas con daño solar crónico los márgenes del LM son difíciles de delimitar clínicamente. Sin duda la luz de Wood ayuda a definir los márgenes, pero estos son más precisos si además se utiliza la dermatoscopia por su correlación con la histología, como se demuestra en el trabajo de Robinson25. En dicho trabajo los márgenes extirpados con cirugía de Mohs fueron mayores (más exactos aún) que los marcados con dermatoscopia, si bien los márgenes con dermatoscopia fueron más exactos que los delimitados con luz de Wood.
La microscopia confocal de reflectancia (MCR) es una herramienta de imagen que permite la visualización de células y estructuras de la piel de forma no invasiva y en tiempo real. Permite obtener un diagnóstico in vivo con una resolución muy cercana a la de la histología convencional, con una profundidad limitada de 250-350 micras, lo que es suficiente para visualizar la epidermis, la dermis papilar y la dermis reticular superficial en secciones horizontales. Constituye un puente entre la dermatoscopia y la histología.
Utilidades de la microscopia confocal de reflectancia- 1.
Como segundo paso después de la dermatoscopia en el diagnóstico de los casos dudosos. Es particularmente útil en lesiones hipopigmentadas o amelanóticas debido a que la melanina aparece reflectante con el microscopio, incluso en pequeñas cantidades26,27.
- 2.
Guía en la toma de biopsia, evitando el frecuente error de muestreo.
- 3.
Demarcación prequirúrgica de melanomas con márgenes mal definidos en conjunción con la luz de Wood y la dermatoscopia28.
- 4.
Monitorización de la respuesta al tratamiento. Puede ser útil para la detección de la recurrencia subclínica o ante la ausencia de signos clínicos o dermatoscópicos por la cicatriz o la escasez de pigmento29–31 (fig. 4).
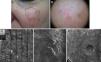
Figura 4.Paciente de 70 años con lentigo maligno recidivado en una cicatriz de crioterapia, localizado en la mejilla izquierda sin biopsia previa. La microscopia confocal demuestra la presencia de células atípicas compatibles con este diagnóstico que se confirma por biopsia. A. Imagen clínica donde se observa una lesión cicatricial hipocroma, posiblemente secundaria a crioterapia, y discreta pigmentación marrón claro inespecífica. Se aprecia el margen positivo por microscopia confocal para orientar el tratamiento. B. Dermatoscopia de la lesión con patrón homogéneo de pigmento sin signos de malignidad. La lesión presenta una cicatriz que distorsiona la estructura de la piel de la zona y borra el patrón típico pseudorreticulado, por lo que no es informativa. C: Microscopia confocal de reflectancia in vivo (VivaScope 1500®). Mosaico en plano de capa espinosa epidérmica con presencia de panal de abejas típico y abundantes estructuras lineales hiperrefráctiles a pequeño aumento, compatibles con células dendríticas melanocíticas en un lentigo maligno melanoma. D. Imagen de 500 micras x 500 micras al nivel del estrato espinoso, con células dendríticas atípicas hiperrefráctiles. E. Imagen de 500 micras x 500 micras a nivel granuloso con presencia de células dendríticas atípicas compatibles con melanocitos en crecimiento pagetoide (imágenes cedidas por cortesía del Dr. Josep Malvehy del Hospital Clinic de Barcelona).
Se han descrito una serie de patrones en MCR25,26,32: a) desorden epidérmico: áreas con pérdida completa o parcial de la estructura en panal de abejas. Pérdida de definición de los bordes de los queratinocitos; b) extensión pagetoide de melanocitos atípicos: células aisladas redondas o dendríticas en las capas superficiales de la epidermis; c) melanocitos atípicos en la dermis superficial d) melanófagos en la dermis superficial; e) aumento focal de melanocitos atípicos y nidos alrededor de los orificios anexiales. Este patrón se corresponde con puntos alrededor de las aperturas foliculares en la dermatoscopia; f) confluencia de melanocitos atípicos dendríticos entre las aperturas anexiales u obliterándolas. Este patrón se corresponde con las estructuras romboidales o romboidales y homogéneas de la dermatoscopia; g) crestas en forma de cordón en la unión dermoepidérmica: disminución del número de crestas y aplanamiento dermoepidérmico que se ven como estructuras tubulares y ramificadas con una reflectancia heterogénea. Las papilas dérmicas son difíciles de apreciar y no tienen un patrón definido; y h) infiltración de estructuras anexiales: células redondeadas a dendríticas nucleadas a lo largo de las estructuras anexiales.
La MCR tiene limitaciones, ya que la profundidad de análisis está limitada a la dermis reticular superficial y, por tanto, cualquier lesión palpable sospechosa de recidiva debería biopsiarse, independientemente de los resultados de la prueba. No es válida para lesiones en la región palmoplantar o lesiones costrosas. La interpretación de las imágenes debe realizarla personal entrenado, la técnica es laboriosa, aún está poco extendida y requiere un elevado consumo de tiempo.
Pronóstico del lentigo malignoNo se conoce el porcentaje exacto de casos de LM que progresan a LMM. Los estudios publicados hasta la fecha presentan datos muy variados que van del 5-50%3,33,34.
No existe en la actualidad ningún dato clínico, histológico o biológico que permita predecir qué LM va a evolucionar a una forma invasiva. En el 22% de los LM diagnosticados mediante una biopsia incisional se ha demostrado un componente invasor en el estudio histológico realizado después de la exéresis completa de la lesión2,7. El riesgo de LMM puede ser proporcional al tamaño de la lesión, siendo más frecuente encontrar focos de melanoma invasivo en lesiones grandes. El periodo de latencia entre LM y LMM puede ser largo (de 10 a 50 años), pero también se han descrito casos de progresión rápida (en 6 meses). Una vez que progresa a LMM el pronóstico, y por tanto el manejo, es como el de otros melanomas invasivos35–38. Las tasas de recidiva varían del 3 al 50% según el tratamiento, correspondiendo el 3% a las recidivas después de una escisión controlada al microscopio y el 50% a aquellos LM tratados mediante técnicas no quirúrgicas (llegando hasta el 100%). La mayoría de las recidivas se producen in situ3, pero también están descritas las formas invasivas que empeoran el pronóstico con riesgo de metástasis1,39,40.
TratamientoDestaca la ausencia de estudios prospectivos aleatorios y de guías específicas o protocolos sobre el manejo del LM. En las principales guías de manejo del melanoma se hace referencia al tratamiento del LM, por lo que recomendamos su lectura11,12,41,42. El objetivo del tratamiento es la curación, y de esta manera se previene la evolución a melanoma invasivo (LMM) con el consiguiente riesgo de metástasis regional y a distancia1. Debe realizarse un tratamiento precoz y eficaz, siendo el de elección el quirúrgico siempre que sea posible, especialmente en los pacientes más jóvenes5. En la práctica hay que tener en cuenta factores como: la edad, el estado general del paciente y las comorbilidades, la expectativa de vida, el tamaño de la lesión, la localización en zonas estéticas y funcionalmente comprometidas, la accesibilidad o conveniencia y las preferencias del paciente43. Debe informarse al paciente y a sus familiares de las ventajas e inconvenientes de cada opción terapéutica. Los niveles de evidencia y grado de recomendación aparecen en la tabla 2 (ver anexos 1 y 2).
Niveles de evidencia y grados de recomendación de los tratamientos para el lentigo maligno
| Tratamiento | Nivel de evidencia | Grado de recomendación |
| Cirugía | IIb | A |
| Crioterapia | III | C |
| Radioterapia | III | C |
| Imiquimod | III | C |
| Acido azelaico | IV | C |
| Láser | IV | C |
| Interferón intralesional | IV | C |
| Fluorouracilo | IV | C |
| Retinoides | IV | D |
Es el tratamiento de elección. Actualmente se recomienda extirpar los melanomas con un margen de seguridad de piel sana en función del nivel de Breslow. Así, está protocolizado un margen de 0,5cm para un melanoma in situ o un LM, medida con la que, en ocasiones, al no extirparse todo el tejido afectado puede aparecer una posterior recidiva. Zalla et al.44 publicaron una serie de 46 LM de la que solo el 50% se extirpó completamente con márgenes de 6mm. En otro trabajo el 58% de 92 LM requirieron más de 5mm de margen de piel aparentemente sana para su extirpación completa45. Estos datos reafirman que los márgenes recomendados por los National Institutes of Health (NIH) para el tratamiento del LM podrían ser insuficientes46.
El mejor procedimiento quirúrgico en el tratamiento del LM y LMM que asegura la extirpación completa de la lesión tumoral es aquel que conlleva el estudio tridimensional de la pieza extirpada, previo a cualquier tipo de reconstrucción, mediante una técnica denominada cirugía micrográfica de Mohs o cirugía controlada al microscopio, en sus diferentes variantes de congelación y parafina. Un estudio sobre pacientes con LM y LMM obtiene un 97% de curación utilizando la cirugía de Mohs convencional en congelación47. La técnica fue introducida en 1941 por Frederic Edward Mohs48,49. Con el paso de los años se han introducido cambios en la nomenclatura y en la técnica del procedimiento. Todas ellas valoran histológicamente la totalidad de la pieza extirpada, bien mediante un corte que incluye los bordes laterales y profundos obtenidos tras el «aplanamiento» del tejido con una pinza de criostato, bien mediante la realización de cortes verticales y horizontales de la lesión. Las variantes de cirugía histográfica que no incluyen el aplanamiento de los bordes laterales y estudian por separado márgenes laterales y profundos mediante cortes verticales y horizontales son perfectamente aplicables en el LM, siendo técnicamente más sencillas que la técnica de Mohs convencional.
Una revisión de la literatura en el tratamiento del LM y LMM confirma la existencia de un porcentaje menor de recidivas con la cirugía de Mohs o sus variantes, respecto a una cirugía convencional con márgenes de seguridad50. Esto concuerda con lo anteriormente expuesto, ya que el crecimiento radial de los melanocitos atípicos puede no ser uniforme y sobrepasar alguno de los bordes de extirpación, a pesar de contar con un amplio margen de tejido aparentemente sano. Por otra parte, estamos hablando casi por definición de tumores que asientan casi exclusivamente en la región facial, donde evitar la exéresis de tejido sano lleva a un mejor resultado cosmético y funcional, lo cual no está reñido con la curación oncológica. Esto es especialmente aplicable al LM recidivante tras tratamientos previos, donde la lesión está peor definida y las posibilidades de éxito terapéutico son menores.
La escisión seriada por etapas es una alternativa simple y aceptada en el tratamiento del LM y LMM con resultados comparables a la cirugía de Mohs (tablas 3 y 4) (fig. 5). De hecho, un artículo reciente aprecia una recidiva significativamente menor con esta técnica respecto a la cirugía de Mohs sin diferencias en el tamaño final del defecto51. Este procedimiento, descrito por primera vez como la técnica del «cuadrado», consiste en envolver la lesión sospechosa y el margen de seguridad en una figura geométrica (cuadrado) cuyos bordes laterales analiza el dermatopatólogo en parafina52,53.
Estudios sobre el tratamiento de lentigo maligno mediante escisión seriada por etapas
| Autor | Número de pacientes | Técnica | Recidiva | Seguimiento (tiempo medio y/o rango) |
| Johnson52 (1997) | 35 | Técnica del cuadrado | 0 | - |
| Hill y Gramp55 (1999) | 38 | Cortes verticales | 1 (2,6%) | 25 meses (10-48) |
| Anderson53 (2001) | 150 | Técnica del cuadrado | 1 (0,67%) | - |
| Agarwal-Antal45 (2002) | 93 | Similar al cuadrado. Cortes longitudinales de los márgenes.Cortes verticales de la porción central (bread loaf) | 0 | - |
| Malhotra56 (2003) | 109 | Cortes verticales | 4 (3,7%) | 32±26 meses |
| Bub57 (2004) | 55 | Cortes radiales | 2 (3,6%) | 57 meses (9-139) |
| Huilgol58 (2004) | 125 | Cortes verticales | 2 (1,6%) | 38±25meses |
| Mahoney54 (2005) | 11 | Técnica del perímetro | 0 | 4,7 (1-13 meses) |
| Jejurikar59 (2007) | 48 | Técnica del cuadrado | 0 | 31 meses (15-45 meses) |
| Walling51 (2007) | 41 | Cortes verticales | 3 (7,3%) | 60-240 meses |
| Lee y Ryman60 (2008) | 31 | Estudio de la circunferencia total mediante cortes verticales y horizontales en parafina. | 3 (9,7%) | 42 meses |
| Bosbous61 (2009) | 49 | Cortes en parafina verticales en la zona central y horizontales en periferia. | 1 | 2,2 años (0-10,29 años) |
Adaptada de McLeod M, et al.50.
Estudios sobre el tratamiento del lentigo maligno mediante cirugía micrográfica de Mohs
| Autor | Número de pacientes | Técnica | Recidiva | Seguimiento (tiempo medio y/o rango) |
| Dhawan62 (1990) | 1 | Mohs con cortes permanentes horizontales | 0 | 1 año |
| Robinson46 (1994) | 16 | Mohs convencional en congelación y cortes en parafina con IHQ S-100, HMB-45 | 1 (6,3%) | 5-9 años |
| Cohen47 (1998) | 26 | Cortes en congelación y después permanentes | 0 | 58 meses |
| Clayton63 (2000) | 81 | Cortes permanentes | 1 (1,2%) | 22 meses |
| Bienert64 (2003) | 67 | 0 | 33 meses | |
| Temple y Arlette65 (2006) | 119 | 0 | 29,8 meses | |
| Bhardwaj66 (2006) | 158 | Cortes en congelación. Mel-5 | 1 (0,67%) | 38,4 meses |
| Walling51 (2007) | 18 | 6 (33%) | 117,5±27,4 meses | |
| Bene67 (2008) | 116 | Cortes en congelación y permanentes sin IHQ | 1 (0,87%) | Mediana: 63 meses |
Adaptada de McLeod M, et al.50. IHQ: inmunohistoquímica.
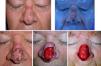
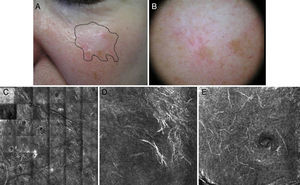
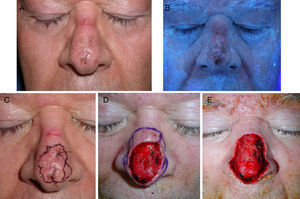
Varón de 65 años afecto de lentigo maligno en el dorso nasal. A. Imagen clínica. B. Mejor delimitación con luz de Wood. Nótese la erosión en el puente nasal secundaria al uso de CPAP. C. Tras la realización de biopsias confirmatorias, dibujo de márgenes basados en la exploración con luz de Wood. D. Defecto tras 2 pases de cirugía de Mohs en parafina, con todos los bordes afectos. E. Defecto final con bordes libres tras 3 pases de cirugía.
Más recientemente, como alternativa a estos procedimientos, se han descrito algunas variantes que, en esencia, tienen el mismo principio: analizar todos los márgenes laterales antes de la reconstrucción, aunque difieren en la metodología de la exéresis; se trata respectivamente de las técnicas del perímetro54 y del spaghetti68.
La principal dificultad para tratar adecuadamente un LM está en diferenciar un melanocito atípico o displásico de un melanocito normal sobre un área crónicamente expuesta al sol, lo que dificulta el diagnóstico y puede conducir a una lenta recidiva tumoral69. En el LM, por la dificultad de diferenciar en congelación los melanocitos displásicos en los bordes de la lesión, se considera de elección el estudio en parafina. De hecho, algunos tumores además pueden requerir técnicas de inmunohistoquímica para un diagnóstico definitivo. Aunque existen artículos recientes que utilizan técnicas de inmunohistoquímica para cirugía de Mohs en congelación, con tiempos cortos de 19, 20 y 35 minutos (para MART-1 y MITF respectivamente), y obtienen tinciones similares a las realizadas en parafina, sus resultados deberían confirmarse en series amplias o en estudios controlados60,70–72.
Tratamiento no quirúrgicoLas características del LM, afectando con frecuencia a pacientes de edad avanzada, con comorbilidades asociadas, lesiones de gran tamaño que requieren cirugías amplias en zonas anatómicas con compromiso cosmético o funcional, o el rechazo del paciente a la cirugía, hacen necesario el uso de otras alternativas. Aunque sus principales ventajas son los buenos resultados cosméticos y la baja morbilidad, desafortunadamente los tratamientos no quirúrgicos se asocian con una mayor frecuencia de recidiva. En el estudio e Zalaudek et al. la tasa de recidiva a los 5 años tras la escisión quirúrgica es de 6,8±1,3% mientras que la del conjunto de los tratamientos no quirúrgicos es de 11,3±8,5%. El estudio concluye que la mejor alternativa es la radioterapia (RT), con unas tasas similares a las de la extirpación quirúrgica73. Una encuesta a los dermatólogos británicos en 2001 puso de manifiesto que las alternativas a la cirugía más comúnmente usadas eran la crioterapia y la RT74. En general las limitaciones del tratamiento no quirúrgico son:
- 1.
Mayores rasas de recidiva: no se obtiene la pieza entera para el examen histológico, por lo que pueden perderse zonas de lesión invasiva (error de muestreo)2. Dificultad para el tratamiento de los melanocitos profundos perianexiales. Por este motivo es esencial que cualquier tratamiento tenga una profundidad de penetración de al menos 3-5mm.
- 2.
Durante el seguimiento la hipopigmentación asociada a algunos de los tratamientos puede llevar a retrasar el diagnóstico de una recidiva.
- 3.
No existen estudios aleatorizados comparativos controlados a largo plazo, por lo que la eficacia de estas terapias aún no está bien establecida.
Cuando elegimos una de estas opciones terapéuticas debemos realizar un seguimiento a largo plazo. A continuación se exploran los principales tratamientos no quirúrgicos utilizados en el LM.
CrioterapiaEs una de las alternativas más utilizada en la práctica para el tratamiento del LM. Los melanocitos son muy sensibles al daño por congelación. La crioterapia destruye selectivamente los melanocitos a temperaturas de -4,-7°C respetando los queratinocitos, si bien no hay datos que confirmen esto para los melanocitos neoplásicos. Es necesario que la técnica destruya también los melanocitos atípicos que se extienden a la piel normal y en profundidad en los folículos pilosos, por lo que se requiere al menos una profundidad de 3mm75. Otros autores plantean monitorizar la temperatura de la base72 para asegurar la profundidad del alcance, aunque no parece haberse correlacionado con las tasas de éxito. No existen protocolos y la técnica varía de unos centros a otros. En general, la crioterapia debe ser agresiva, usando ciclos dobles de congelación-descongelación con el spray a una distancia de 2-3 cm para alcanzar una temperatura de -40-50°C en la base de la lesión. El tiempo de congelación depende del tamaño de la lesión, varía de 45-60 segundos para conseguir un frente de congelación lateral de piel sana de 1cm (mínimo 5mm). Tras un periodo de descongelación de 2-3minutos se repite el ciclo anterior3,76. Las lesiones grandes deben tratarse en varias visitas para reducir la morbilidad y asegurarse de que se han alcanzado los márgenes laterales. La duración del tratamiento depende del tamaño de la lesión. Diferentes estudios reportan unas tasas variables de respuesta debido a la diferente técnica, evaluación histológica, periodos de seguimiento cortos, etc. Hay publicaciones con más de 200 LM tratados con crioterapia desde 1979 que muestran una tasa global de recidiva inferior al 9%, aunque otros hablan de 0%, 8-10%, o incluso hasta el 50%1,75–79. Se han descrito recurrencias 7-9 años después del tratamiento (tabla 5).
Principales estudios de lentigo maligno tratados con crioterapia
| Autor | Número de pacientes | Pauta | Recidiva | Seguimiento (tiempo medio y/o rango) | |
| Dawber y Wilkinson78 (1979) | 14 | 6 con torunda de algodón y 8 con spray | 0 | 7,5–30 meses | |
| Pitman77 (1979) | 4 | 2 (50%) | 3,5 años media | ||
| Coleman79 (1980) | 2 | 1 (50%) | 1-12 años, media 3 años | ||
| Kuflik80 (1980) | 4 | Spray. Ciclos simples-dobles-25°C -30°C Medición Tª base.1cm margen | 0 | 1-3 años | |
| Zacarian76 (1982) | 20 | Doble ciclo congelación- descongelación -50°C | 2 (10%) | 42,6 meses | |
| Lorenz81 (1983) | 33 | 0 | 2-5 años | ||
| Burge y Dawber82 (1984) | 14 | 6 con torunda de algodón 30 segundos, 8 con spray. Ciclos simples | 1 (7,1%) | >5 años. La recurrencia fue a los 6 años. Libre a los 6m tras retratamiento. | |
| Collins83 (1991) | 10 | 3 con torunda de algodón, doble ciclo, 8 con spray.Una vez cada 6 semanas 6 veces o hasta aclaramiento | 4 (40%) | media 4 años | |
| Böhler- Sommeregger84 (1992) | 20 | Doble ciclo congelación- descongelación -30 a -40°C.5mm margen | 3 (15%) | 7-80 meses | |
| Kuflik y Gage75 (1994) | 30 | Doble ciclo -40 a -50°C más allá de margen | 2 (6,7%) | media 3 años | |
| Machado85 (2007) | 18 | 2 ciclos de congelación 1min. separados por 2min. de descongelación | 0 | 53-98 meses, media 75,5 meses |
Las ventajas que ofrece la crioterapia son: la facilidad y rapidez de administración y que obtiene buenos resultados cosméticos. El retratamiento puede ser eficaz si la duración es adecuada. Por el contrario, los inconvenientes son: los periodos largos de cicatrización, mayores que con cirugía (hasta 3 meses), riesgo de cicatriz hipertrófica y las limitaciones comunes a los tratamientos no quirúrgicos.
RadioterapiaEs el tratamiento no quirúrgico más eficaz para el LM2,86,87. Se ha utilizado especialmente en pacientes mayores con lesiones grandes, en áreas anatómicas comprometidas, debido a una mínima morbilidad y buenos resultados cosméticos en general88. En Norteamérica se utiliza la RT convencional de ortovoltaje para tratar el LM y el LMM con buenos resultados89,90. Todos los autores enfatizan que la RT fraccionada convencional es muy eficaz en el tratamiento por la ausencia de recidivas subepidérmicas gracias a las dosis alcanzadas en el tejido subcutáneo (50% de la dosis entre 6mm-4cm). El inconveniente de la técnica con rayos X de alta energía es la posible afectación de los tejidos subyacentes, especialmente del hueso en el campo tratado, con riesgo de radionecrosis91. Este efecto secundario puede reducirse significativamente con la técnica de Miescher, que se utiliza en Europa de forma primaria o adyuvante a la cirugía desde su descripción en los años 5092. Consiste en la aplicación de altas dosis de rayos Grenz o rayos X superficiales con un voltaje muy bajo (12-50kV) que no penetran más allá de 2-3mm. La técnica de Miescher o sus variantes usan un tubo de rayos X con una ventana de berilio 12kV, 15 MAmp a una distancia de 20cm, alcanzando el 50% de la dosis a 1-1,3mm. Al afectar solo la epidermis y la dermis superficial induce una radiodermitis aguda, pero menos atrofia93. Un esquema muy utilizado y cómodo para el paciente es la administración de una dosis total fraccionada de 100Gy en 10 sesiones (5 sesiones semanales durante 2 semanas).
El tratamiento debe ser cuidadosamente diseñado para incluir todo el tumor con suficiente margen: 1cm para lesiones <2cm y 2cm para tumores más grandes.
En la práctica, tanto los rayos X superficiales (100 a 200kV) como los electrones de alta energía (de 6 a 9 MeV) son adecuados. Dosis de 45 a 50Gy en 15 a 25 fracciones pueden controlar la enfermedad en la mayoría de los pacientes. Se recomienda una dosis por fracción de 2-3,5Gy, dependiendo del tamaño, grosor de la lesión y el esquema de tratamiento empleado.
La RT postoperatoria es útil en lesiones grandes cuando los márgenes alcanzados por la cirugía no son adecuados, cuando la parte lentiginosa de la lesión no se puede extirpar completamente por añadir una importante morbilidad y en las recidivas.
Las tasas de curación tras la RT con rayos Grenz o rayos X superficiales usando la técnica de Miescher varían del 86-95%. Sin embargo, el número total de pacientes en estos estudios es pequeño y los tiempos de seguimiento cortos (2-5 años)2 (tabla 6). La regresión clínica se produce 2-8 meses tras el tratamiento91. Destaca el estudio retrospectivo publicado en el año 2002 por Farshad et al. con 150 pacientes: 93 con LM, 54 con LMM y 3 con ambas lesiones. La recidiva global fue del 7% (5,2% en los LM)93.
Principales estudios sobre tratamiento de lentigo maligno con radioterapia
| Autor | Número de pacientes | Pauta | Recidiva | Seguimiento (tiempo medio y/o rango) |
| Arma- Szachcic94,95 (1970) | 61 | Técnica de Miescher | 2 (28,4%) | |
| Kopf96 (1976) | 16 | Técnica de Miescher | 8 (50%) | 10 meses-9,5 años |
| Pitman77 (1979) | 8 | Técnica de Miescher | 3 (38%) | 3,5 años media |
| Dancuart89 (1980) | 8 | RT convencional de ortovoltaje, dosis 2.000-5.000rad en 1-20 fracciones100-280kV | 1 (12,5%) | 1-4,5 años1 paciente libre 11 años tras reirradiación |
| Harwood90 (1983) | 20 | RT convencional de ortovoltaje 100-280kV, 35-50Gy | 2 (10%) | 5 meses-8 años (mediana: 26 meses) |
| Panizzon (1997) | 104 | Técnica de Miescher | 1 | 7,3 años |
| Tsang98 (1994) | 36 | Rayos X superficiales30-50Gy100-250kV0,5-1cm margen | 4 (11%) | 1-12 añosMedia 6 años |
| Schmid- Wendtner91 (2000) | 42 | Técnica de Miescher modificada0,5-2cm margen | 0 | Seguimientos cortos1-96 mesesMedia 15 meses |
| Farshad93 (2002) | 96 | Rayos Grenz12kV100-120Gy7-10mm margen | 5 (5,2%) | La mayoría>2 años. Media 8 años |
| Hedblad97 (2011) | 593 (215 LM)188 solo RT26 escisión parcial+RT | Rayos Grenz.2 v/semana x 3 semanas100-160Gy | 27/188solo RT3/26 escisión parcial+RT | 425 al menos 2 años, 241 5 años |
Adaptada de Stevenson O, et al.1. LM: lentigo maligno; RT: radioterapia.
En el LMM la RT parece ser menos efectiva. En muchos casos se utiliza como adyuvante poscirugía tras la resección de la zona nodular88,91.
Efectos secundariosEn la mayoría de los casos aparece eritema, descamación y caída del vello local a partir de la segunda semana de tratamiento. Las complicaciones tardías son la atrofia y el adelgazamiento de la epidermis, la fibrosis, las telangiectasias, los cambios en la pigmentación (hiperpigmentación o hipopigmentación), así como el aumento en el riesgo de desarrollo de carcinoma espinocelular.
Entre sus ventajas se encuentran: su buena tolerancia, los buenos resultados cosméticos y que requiere pautas más cortas que otros tratamientos tópicos. Las tasas de curación son similares a la cirugía conservadora. La piel de los ancianos en zonas expuestas de la cabeza y el cuello es muy fina, por lo que parte sustancial de la dermis se alcanza con una penetración de 1,1mm91.
Sus inconvenientes son: la limitada penetración de los rayos X (que explica que la técnica de Miescher pueda fallar por la extensión en profundidad de los melanocitos por las estructuras anexiales91), la necesidad de múltiples sesiones, generalmente realizadas en un medio urbano con infraestructura adecuada93, y la dificultad para diferenciar los cambios pigmentarios que ocurren tras el tratamiento de una posible recidiva.
ImiquimodEl imiquimod es una amino imidazoquinolina sintética. Se usa como modificador tópico de la respuesta inmune, estimulando la inmunidad innata y adquirida. Se ha demostrado que también induce la apoptosis99 y tiene actividad antiangiogénica100.
Desde el primer caso de LM tratado con imiquimod en el año 2000101, hasta una revisión realizada en el año 2006 sobre 15 artículos en lengua inglesa, se trataron un total de 68 pacientes. Los autores concluyen que sin evidencia controlada ni seguimiento prolongado el uso de imiquimod debe considerarse experimental, ante la posibilidad de dejar enfermedad invasiva o residual102. Hasta la fecha se han descrito en la literatura un total de 234 pacientes con LM tratados con imiquimod en estudios no controlados, 161 de ellos revisados recientemente2. Llama la atención la variabilidad de los trabajos (tabla 7): series de casos, casos aislados o estudios abiertos, diferentes lesiones en cuanto al tamaño, primario vs recidiva, tratamientos previos, pautas (de 2 aplicaciones semanales a diario), tiempo de tratamiento (de 8 días a 9 meses), margen aplicado, verificación de la respuesta (no siempre se biopsia) y seguimientos más cortos que el estándar oncológico de 5 años. Muchos estudios tienen un seguimiento inferior al año.
Principales estudios de lentigo maligno tratados con imiquimod
| Autor | Número pacientes | Pauta | Margen | Respuesta | Confirmación histológica | Seguimiento (tiempo medio y/o rango) | Otros |
| Ahmed 101(2000) | 1 | 3 v/sem: 4 sem. Diario: 2 sem. Días alternos-7m | NI | RC | Sí | 9m | |
| Ormond124 (2002) | 5 | Diario: 6-12m | NI | RC y RP | Solo en 1 | Hasta 6m | |
| Chapman114 (2003) | 1 | 1-2 v/día | NI | RC | Sí | 3m | |
| Epstein125 (2003) | 1 | Días alternos | NI | RC | NI | 18m | |
| Fisher109 (2003) | 1 | Test: días alternos 3m. Resto 3v/sem: 14 sem | NI | RP. Desarrollo de LM amelanótico con satelitosis | Sí | Libre 17m después de Mohs e imiquimod | |
| Naylor5 (2003) | 30 | Diario: 12 sem | 2cm | 26/28 | Sí | 12m | Un caso curó en 8 días |
| Powell126 (2004) | 11 | 3 v/sem: 4-20 sem | 2cm | 6 RC, 4 RP | Sí | 9m | |
| Powell9 (2004) | 2 | 3 v/sem: 12 y 20 sem | NI | RC | Sí, 3m postratamiento | 9 y 18m | Tratan 2 LM amelanóticos |
| Kupfer127 (2004) | 2 | 3 v/sem: 3m3 v/sem: 4m | NI | RC | Sí, 3m postratamiento | 14 y 13m | |
| Flemming106 (2004) | 6 | Diario: 6 sem | 1cm | 4/6 | Sí (exéresis estándar 5mm margen tras tratamiento) | Primer estudio con extirpación completa | |
| Michapoulos128 (2004) | 1 | 5 v/sem: 2 sem3 v/sem: 16 sem | NI | RC | Sí | 9 meses | Estudia infiltrado inflamatorio |
| Muñoz129 (2004) | 1 | Diario: 1 sem2-3 v/sem: 16 sem | NI | RC | Sí | 4 meses | |
| Kamin130 (2005) | 1 | 5 v/sem: 6 sem. Segundo periodo de 3m tras 1m | NI | RC | Sí | 12m | |
| Wolf 131 (2005) | 6 | Diario: 5-13 sem | 0,5-1cm | 5/6 | Sí | 3-18m | Responde un LM amelanótico |
| Noel132 (2005) | 1 | 2 v/sem; 12 sem | NI | RC | Sí | 12m | |
| Ray133 (2005) | 3 | 3 v/sem-diario6-12 sem | 0,5-1cm | RC | Sí | 7-12m | |
| Van Meurs111 (2007) | 10 | 3 v/sem-diario según inflamación6-13 sem (sugieren mínimo 3m) | 2cm | 9/10 | Una biopsia no antes de 4 sem y la segunda al año | 31m | 4 recurrencias, una histológica sin evidencia clínica |
| Spenny121 (2007) | 12 | 2-7 v/sem: 7-44 sem | NI | RC | 4 sin confirmar | Media 18,3m | |
| Mahoney118 (2008) | 7 | Variable según inflamación12,4 sem de media | 0,5-1cm | 6/7 | Sí | 19,1m | Un caso herpes simple y elevación de enzimas hepáticas |
| Troya- Martin119 (2008) | 2 | 5 v/sem: 16 sem y 12 sem | NI | RC | Sí | 3 años | |
| Buetticker 110 (2008) | 34 | 1-2 v/día con/sin oclusión2-20 sem | Sin margen | RC | Sí (no todas) | 17,2m | Vitíligo. Recidiva a los 30m en paciente con linfoma B |
| Cotter105 (2008) | 40 | 5 v/día: 3m | 2cm | Clínico 83% Histológico 75% | 2m tras tratamiento extirpación por etapas con 2mm margen | 12-34m (media 18m) | 6 casos con disociación clínico-histológica. |
| Powell113 (2009) | 48a | 3 v/sem-diario de 6-12 sem | 2cm | 37/48 | Sí a los 4 m postratamiento | 25-72m | Seguimiento de más de 5 años sin recidivas |
| Ventura134 (2009) | 1 | Diario: 4m | NI | RC | Sí a los 3 m postratamiento | 1 año | LMMExtirpan nódulos y resto imiquimod |
| Woodmansee123 (2009) | 1 | Diario: 6-8 sem. A días alternos: 5 sem | 1cm | RC pero recidiva | Curación a los 4m, pero recidiva como LMM | 24m hasta la recidiva | Tras cirugía de Mohs libre 11m |
| Ramsdell135 (2009) | 1 | 3 v/sem hasta 1 año según la zona | NI | RC | Tras el tratamiento y a los 3 años | 3 años | Lesión de10cm (la mayor tratada) |
| Ly107 (2011) | 43 | 5 v/sem: 12 sem | 1cm | 20/38 | Extirpación completa tras el tratamiento |
LM: lentigo maligno; m: meses; NI: no indicado; RC: respuesta completa; RP: respuesta parcial; sem: semanas.
En general, no se recomienda su uso en tumores invasivos ni en pacientes jóvenes por el riesgo de progresión a enfermedad invasiva; también si no se puede realizar una monitorización estrecha del tratamiento103,104.
Respuesta y factores relacionados con la respuestaLa pauta sugerida como más eficaz es el tratamiento de 5 veces/semana durante al menos 12 semanas. Las tasas de respuesta son variables según las series de casos104. Así, aunque la tasa de respuesta clínica con confirmación histológica es del 85%91, la mayoría se realiza con biopsia punch del área previamente positiva2. En 3 trabajos se realiza la exéresis completa de la lesión tras el tratamiento, siendo las tasas de aclaramiento histológico del 75, 63 y 53%105–108. En 3 casos se describe una evolución a LMM durante el tratamiento5,109,110.
Por la variabilidad en los estudios no es posible identificar parámetros óptimos o factores que predigan el fracaso o la ausencia de respuesta110,111.
Se ha descrito el riesgo hipotético de favorecer la progresión del tumor por el uso de imiquimod103,112. Un estudio demuestra que solo la respuesta inflamatoria clínicamente evidente moderada a severa se asocia significativamente con la eficacia del tratamiento113. Se han utilizado distintos métodos para incrementar la respuesta inflamatoria: aumentar la frecuencia de aplicación (2 veces al día), oclusión, crioterapia y tazaroteno 0,1% en gel110,114,115. La respuesta clínica no debería usarse como único parámetro de respuesta al tratamiento, puesto que existe una disociación clínico-histológica (fig. 6). Por ello, la biopsia postratamiento debe hacerse en todos los casos116. En algunos casos se espera al menos 3 meses para realizar la biopsia, a menos que haya ausencia de respuesta inflamatoria o persistencia de pigmento anormal. Las biopsias demasiado tempranas son difíciles de interpretar porque a menudo hay una dermatitis de interfase florida. Algunos autores proponen una biopsia tardía (al año o a los 3 años) ya que están descritas recidivas tardías110. La dermatoscopia y la MCR pueden ser útiles en la monitorización de la respuesta, como se ha comentado.
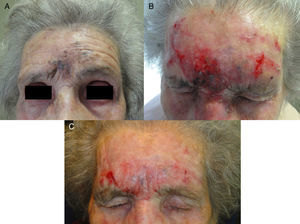
A. Lentigo maligno melanoma (0,125mm de Breslow tras la biopsia diagnóstica) en la frente de una paciente de 94 años. B. Importante reacción inflamatoria tras 2 meses de tratamiento. C. Hiperpigmentación grisácea interciliar residual tras 3 meses de tratamiento. El resultado histológico tras la biopsia descartó la persistencia tumoral.
Los efectos secundarios son: discromía postinflamatoria, eritema y edema frecuentes, erosión telangiectasias110, sobreinfección secundaria, queratopatía puntata reversible con disminución de la agudeza visual en lesiones perioculares117 y, a nivel sistémico, síndrome de liberación de citoquinas (dolor de cabeza, malestar gastrointestinal, fiebre, malestar general). También se ha descrito vitíligo110, herpes simple y elevación de enzimas hepáticas118.
Las ventajas son las comunes a los tratamientos no quirúrgicos.
Entre sus inconvenientes está la necesidad de definir protocolos y pautas así como criterios de respuesta clínica e histológica de forma homogénea111. La hiperpigmentación residual que deja puede confundirse con una recidiva119.
En conclusión, el uso de imiquimod debe restringirse a aquellos casos en los que no se puedan administrar tratamientos alternativos a la cirugía tales como RT, en espera de una mayor evidencia científica de eficacia y seguridad7.
Puede utilizarse como neoadyuvante previo a la cirugía para disminuir el área de extirpación quirúrgica108,113, o como adyuvante tras la extirpación del componente invasivo para tratar un componente in situ extenso120. Otros autores lo aconsejan para los casos de recidiva de LM tras la escisión con cirugía convencional o Mohs, en márgenes positivos (como adyuvante) o para prevenir recidivas37,100,121,122.
Otros tratamientos no quirúrgicosÁcido azelaicoEl ácido azelaico (C9-ácido dicarboxílico) al 20% en crema o al 15-35% en pomada se ha usado en el tratamiento del LM desde los años 70. Su mecanismo de acción es la citotoxicidad selectiva de los melanocitos anormales por inhibición reversible de la tirosina e inhibición de las enzimas mitocondriales136. Se aplica 2 veces al día durante 2-12 semanas, dependiendo de la respuesta1. No hay evidencia suficiente para recomendarlo en la práctica sobre otras alternativas, ya que los resultados han sido muy variables137–139.
LáserVarios tipos de láser pueden destruir los melanocitos. Se han utilizado el láser de argón, CO2, rubí, Q-switched Nd:YAG140,141 (tabla 8). Aunque existen resultados prometedores, de momento son escasos los datos para recomendar esta modalidad de tratamiento sobre otras alternativas1. Los melanocitos atípicos pueden ser resistentes al láser si pierden la capacidad para producir pigmento (tabla 9).
Principales estudios de lentigo maligno tratados con láser
| Autor | Número de pacientes | Pauta | Recidiva | Seguimiento (tiempo medio y/o rango) |
| Arndt et al. 145(1984) | 1 | Laser argón 5-cmDistancia, spot 1mm, 3,8W, 50 ms | No | 8 meses |
| Arndt140 (1986) | 3 | Láser argón. Igual al anterior | 33% (1/3) | 75 semanas de media |
| Kopera141 (1995) | 4 | Laser CO2.10,600-nm, 12W, spot 1mm, 2 pases | 0% (0/4) | 15 meses de media |
| Thissen y Westwrhof142 (1997) | 1 | Q-switched rubí 694nm | 0 | 12 meses |
| Orten143 (1999) | 1 | Q-switched Nd:YAG4 -11J/cm2, 532 y/o 1,064nm, 10-20ns, spot 2–3mm, 10Hz | 37,8% (3/8) | 8 meses-3,5 años |
| Iyer y Goldman144 (2003) | 1 | Q-switched alejandrita. Cinco tratamientos diferentes | 1/1 | 3,5 años |
| Niiyama146 (2007) | 1 | Q-switched rubí láser 5J/cm2. Spot 4mm | 1/1 | 2 años |
| Madan y August147 (2009) | 22 | Q-switched Nd:YAG 532nm, 6J/cm2, 2-mm spot, 5nsy alejandrita láser 755nm, 12J/cm2, 2-mm spot, 50ns | 23% (5/22) | 2-5 años |
Adaptada de McLeod M, et al.50.
Resumen. Puntos clave
| - La histología es el método de elección para el diagnóstico del LM. La biopsia excisional es lo más rentable. Para seleccionar las zonas de la biopsia podemos ayudarnos de técnicas de imagen como la dermatoscopia o la MCR. La dermatoscopia es útil como complemento a la clínica en el diagnóstico precoz de LM. La MCR es útil como segundo paso tras la dermatoscopia en el diagnóstico de los casos dudosos, particularmente en lesiones hipopigmentadas o amelanóticas- El tratamiento de elección es la cirugía. El porcentaje menor de recidivas se obtiene con la cirugía de Mohs o sus variantes respecto a una cirugía convencional con márgenes de seguridad. Esta técnica está especialmente indicada en lesiones grandes, recidivadas, con márgenes clínicamente mal definidos y localizaciones anatómicas comprometidas. A la hora de delimitar los márgenes prequirúrgicos podemos ayudarnos de la luz de Wood, la dermatoscopia y la MCR- En los casos en los que no es posible realizar tratamiento quirúrgico:- En pacientes con buen estado general y buena expectativa de vida se considera la RT el tratamiento no quirúrgico más eficaz para el LM- En aquellos pacientes con mal estado general, expectativa de vida corta, rechazo del paciente, etc. pueden utilizarse otras alternativas como el imiquimod o la crioterapia. Estas alternativas no disponen actualmente de una evidencia científica que las avale, y se necesitan métodos fiables no invasivos que permitan descartar un componente invasivo oculto- Debe realizarse un seguimiento a largo plazo. La dermatoscopia y la MCR son útiles en la monitorización. Conviene hacer una biopsia postratamiento ante una sospecha de recidiva, y siempre tras un tratamiento tópico |
Desde las primeras publicaciones al respecto, hace más de 20 años, no ha habido prácticamente trabajos que traten este tema79. La media de tasa de recurrencia en 11 pacientes tratados fue del 27%. En la actualidad no hay criterios para recomendarlo sobre otras alternativas. No se suele obtener un plano histológico adecuado que confirme la exéresis/destrucción completa, y pueden quedar melanocitos profundos sin tratar por la extensión anexial1,77,79.
Interferón intralesionalAunque una publicación describe la resolución de 11 lesiones en 10 pacientes, solo 4 se confirmaron histológicamente. Otros autores describen la resolución de 6 LM en un paciente con xeroderma pigmentoso. Los periodos de seguimiento son muy cortos y los datos escasos para recomendar su utilización1,148,149.
5-fluorouraciloSu mecanismo de acción es por inhibición de la síntesis de ADN. Litwan lo usó por primera vez en 1975 en 3 pacientes 2veces al día durante 6,9 y 13 meses. Obtuvo la resolución de los 3, uno tras retratamiento de la recaída. Otros autores trataron 3 pacientes con resolución inicial, aunque todos recurrieron. Existen pocos datos para apoyar su uso en la práctica1,79,150.
RetinoidesSe han usado debido a su acción de inhibir la proliferación e inducir la diferenciación en cultivos de melanocitos murinos. Un artículo reciente publica la resolución de las lesiones en 2 pacientes ancianos con gel de tazaroteno al 0,1% sin recidiva a los 18 y 30 meses151. Actualmente no hay datos para apoyar el uso de ácido retinoico o tretinoína tópica en el tratamiento del LM, aunque se han usado en combinación con otros tratamientos como el imiquimod, con el objeto de incrementar la respuesta inflamatoria110. Son necesarios más estudios1.
En la tabla 9 se resumen los puntos clave del diagnóstico y tratamiento del lentigo maligno.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosA la Dra. Estefanía Palacios del Servicio de Oncología Radioterápica del Complejo Asistencial Universitario de León por su colaboración en el apartado de radioterapia. Al Dr. Malvehy del Servicio de Dermatología del Hospital Clínic de Barcelona por su colaboración mediante la cesión de las imágenes de microscopia confocal de reflectancia.
| Ia | Evidencia obtenida de metaanálisis o ensayos clínicos controlados aleatorizados |
| Ib | Evidencia obtenida de al menos un ensayo clínico controlado aleatorizado |
| IIa | Evidencia obtenida de al menos un estudio bien diseñado controlado no aleatorizado |
| IIb | Evidencia obtenida de al menos un estudio bien diseñado cuasi-experimental |
| III | Evidencia obtenida de estudios descriptivos no experimentales |
| IV | Evidencia obtenida de opiniones de expertos o experiencia clínica |
Adaptado de Stevenson O, et al.1.
| A | Existe una buena evidencia para apoyar el uso del procedimiento |
| B | Existe una evidencia suficiente para apoyar el uso del procedimiento |
| C | Existe escasa evidencia para apoyar el uso del procedimiento |
| D | Existe evidencia suficiente para rechazar el uso del procedimiento |
| E | Existe buena evidencia para rechazar el uso del procedimiento |
Adaptado de Stevenson O, et al.1.