En este artículo de dermatología práctica se revisarán algunos de los artefactos encontrados frecuentemente en las biopsias, así como métodos para evitarlos. También se darán nociones básicas acerca de la realización de biopsias de lesiones melanocíticas, enfermedades ampollosas o de la biopsia de lesiones en localizaciones especiales, como el cuero cabelludo y la región ungueal. Por último se comentarán algunas de las aplicaciones de la biopsia cutánea al diagnóstico de enfermedades neurológicas y al diagnóstico prenatal de una manera breve. Con esta guía básica pretendemos mejorar la rentabilidad de la biopsia y resaltar la importancia de realizar una correcta correlación clínico-histológica, por lo que se comentarán también algunas nociones respecto a la interpretación del informe dermatopatológico.
In this article, we review some of the artifacts commonly observed in biopsies and the methods used to prevent their appearance. We describe the basic techniques for taking biopsies of melanocytic lesions, bullous diseases, and from special areas such as the scalp and nail region. We also provide a brief summary of the role of skin biopsy in the diagnosis of neurological diseases and prenatal diagnosis. The aim of this guide is to improve the diagnostic yield of biopsies and to highlight the importance of a correct clinical-histological correlation; we therefore provide clues to the interpretation of the dermatopathology report.
Como se ha revisado previamente, la elección de la zona a biopsiar, la consideración de la profundidad a la que se encuentra la dermatosis y la elección de una técnica de biopsia adecuada son pasos a tener en cuenta para aumentar en lo posible el rendimiento diagnóstico de la biopsia cutánea. En este segundo bloque trataremos:
- 1.
Artefactos en las biopsias.
- 2.
Indicaciones específicas: lesiones melanocíticas, enfermedades vesiculoampollosas, lesiones del cuero cabelludo, lesiones ungueales, diagnóstico de enfermedades neurológicas y diagnóstico prenatal.
- 3.
Conclusiones: el informe dermatopatológico.
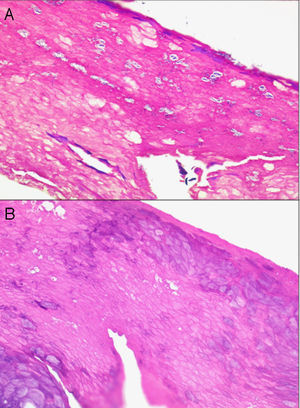
La desinfección de la piel realizando una presión tangencial demasiado intensa puede conllevar una pérdida de la capa córnea y, por consiguiente, de información. Así, pueden no encontrarse las hifas y esporas de un hongo en una dermatomicosis, la paraqueratosis de una psoriasis vulgar o la presencia de polimorfonucleares neutrófilos y de agregados bacterianos en un impétigo contagioso o en una queratólisis punctata (fig. 1).
Una inyección demasiado rápida de anestésico local, o el uso del dispositivo denominado Dermajet® puede dar lugar a la aparición de espacios ovalados en la dermis o incluso en la epidermis1. También el uso de anestésicos tópicos, como EMLA®, se ha asociado a vacuolización de las capas espinosa y granulosa, así como a cambios similares a los que se pueden observar en la epidermólisis ampollosa simple2.
La compresión mecánica con las pinzas o, en ocasiones, en el borde del recipiente para trasporte de las mismas, también produce cambios que deben reconocerse como artefactos, ya que pueden imitar una esclerodermia localizada o un fibroma péndulo1. En los epiteliomas basocelulares, especialmente de tipo nodular, la presión de las pinzas puede extruir el tumor, dejando espacios vacíos. A veces pueden observarse espacios vacíos similares en pacientes en los que se les ha realizado un curetaje previo de epiteliomas basocelulares de tipo superficial, y hay que diferenciar estos artefactos de lesiones como los linfangiomas. También pueden observarse ampollas subepidérmicas por la aplicación de presión excesiva, como sucede con cierta frecuencia en biopsias en sacabocados de lesiones de paniculitis1, o tras la realización de crioterapia2.
Se pueden observar áreas con necrosis grasa u otros artefactos secundarios al uso de corrientes eléctricas para conseguir una correcta hemostasia o a tratamientos con láser. En los márgenes de las biopsias en las que se ha realizado electrocauterización puede verse aumento de la eosinofilia citoplásmica, así como elongación de los núcleos celulares de los queratinocitos3 (fig. 2) o, incluso, de la neoplasia extirpada (fenómeno denominado por Ackerman «polarización» de las células), con cambios que pueden confundirse con la presencia de epiteliomas basocelulares4. Igualmente, la deshidratación secundaria a la aplicación de la corriente eléctrica produce vacuolización de los citoplasmas celulares.
La fijación de las muestras en formol al 10%, a temperaturas cercanas a 0° centígrados, produce la aparición de artefactos por congelación (figs. 2 y 3). La expansión de los cristales de hielo en el tejido conduce a cambios que van desde una vacuolización mínima a una destrucción celular completa. Para contrarrestar este artefacto es suficiente permitir la fijación adicional de la muestra durante 8-12 horas manteniéndola a temperatura ambiente. En caso de no disponer de ese plazo de tiempo, por tratarse de una biopsia urgente, se puede evitar el artefacto de congelación añadiendo etanol al 75-95% en una proporción de 1:101,5,6. En Suiza este problema sucede rara vez debido a las cortas distancias que debe recorrer el preparado. Es un problema más frecuente en Alemania, y posiblemente presente también en determinadas regiones de España. Si los recipientes que contienen el formol se abren los preparados no se fijan correctamente o lo hacen con aspectos peculiares. A esto se añade el envío de las muestras en recipientes de plástico frágil, que se rompen (incluso, en una ocasión una muestra fue enviada en un recipiente de lentillas). Esto último es excepcional, pero sí se observa con frecuencia el envío de varias lesiones en un único envase de transporte. Realizar el diagnóstico de un melanoma en una muestra que contenga diversas lesiones melanocíticas daría lugar a difíciles decisiones terapéuticas, y a una considerable dificultad en el seguimiento del paciente que podría haberse evitado fácilmente.
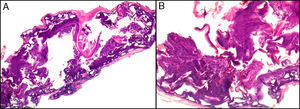
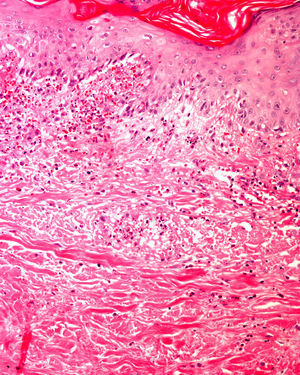
Por supuesto la biopsia en lesiones cutáneas rascadas o sobreinfectadas (fig. 4) de vesículas de más de 24 horas de duración, de áreas necróticas o ulceradas sin epidermis presentan importantes artefactos, y prácticamente nunca son útiles para el diagnóstico.
Por último, si bien excede la finalidad de este artículo, cabe recordar que existen diversos materiales exógenos que pueden producir reacciones características en la piel, tales como el cloruro de aluminio (usado para el tratamiento de la hiperhidrosis), el subsulfato férrico (usado como hemostático), la parafina, el mercurio o los diversos materiales empleados como rellenos, o el material de sutura (fig. 5), y que no deben ser etiquetados incorrectamente como artefactos7.
Indicaciones específicas y recomendacionesBiopsia de lesiones melanocíticasSe debería realizar una biopsia excisional en cualquier lesión pigmentada de diagnóstico clínico impreciso, y en especial si se sospecha melanoma. No obstante, en ocasiones se realiza una biopsia incisional para descartar malignidad. En otros tipos de tumores cutáneos puede ser suficiente, pero en el caso de lesiones melanocíticas el diagnóstico histológico está basado tanto en criterios arquitecturales como citológicos. Entre los criterios arquitecturales se evalúa la simetría/ asimetría y la presencia o no de límites difusos, ambos complicados o imposibles de evaluar en biopsias parciales. Además, no siempre existen atipias citológicas marcadas de manera homogénea en toda la lesión, por lo que pueden biopsiarse zonas citológicamente «pseudobenignas» con el consiguiente error diagnóstico8.
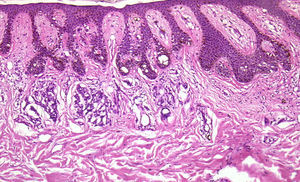
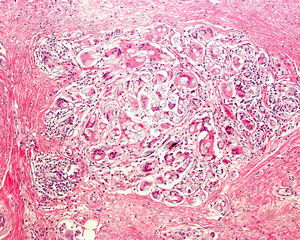
En caso de lesiones melanocíticas de gran tamaño que no puedan extirparse inicialmente por completo, sería recomendable elegir la zona de la biopsia para intentar enviar al dermatopatólogo una zona lo más representativa posible. Recientemente se está estudiando la utilidad de la dermatoscopia como ayuda para la elección de las zonas con mayor Breslow, al igual que se ha intentado hacer con la microscopía confocal9. También se están investigando los criterios que permitan identificar zonas con cambios diagnósticos de lentigo maligno en microscopía confocal10,11. Como hemos comentado, la realización de aplanamientos no es lo más indicado, aunque algunos autores aceptan que puede ser útil en algunos casos8,12. Ante dudas clínicas que confrontan los diagnósticos de melanoma frente a nevus, o de epitelioma basocelular esclerosante frente a tricoepitelioma desmoplásico (fig. 6), las biopsias por aplanamiento son demasiado superficiales como para permitir al dermatopatólogo un diagnóstico de certeza13.
Finalmente, hay que tener en cuenta que para ofrecer al paciente la mejor calidad asistencial hay que elegir no sólo una técnica quirúrgica lo más sencilla posible y con una morbilidad mínima, sino aquella que permita la realización de un diagnóstico más certero.
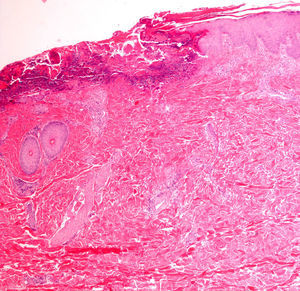
Realización de inmunofluorescencia. Biopsia de enfermedades de la piel vesiculoampollosasEn este grupo de dermatosis el estudio por inmunofluorescencia es especialmente útil. Incluye enfermedades como el penfigoide ampolloso, la epidermólisis ampollosa adquirida, el penfigoide gestacional/ herpes gestacional, el penfigoide cicatricial, la dermatitis herpetiforme, la familia de los pénfigos y otras dermatosis que pueden cursar con ampollas, como el lupus eritematoso o el liquen ruber plano. Para la correcta caracterización de estas enfermedades es útil la realización de estudios de IFD empleando autoanticuerpos frente a IgG, IgA, IgM, C3 y fibrina. Con ello se identifican proteínas localizadas en la unión dermoepidérmica o en la dermis papilar. Es un método útil para diferenciar, por ejemplo, un liquen plano erosivo de un lupus eritematoso o de un penfigoide mucoso, que pueden parecerse desde un punto de vista tanto clínico como histológico. El estudio de las vasculitis es útil en las sospechas de vasculitis de Schönlein-Henoch (fig. 7)14, debiendo realizar la técnica en lesiones de menos de 24 horas de evolución15 y, como se ha descrito recientemente, en la vasculopatía livedoide, en la que se han descrito porcentajes elevados de depósitos de fibrina y C3 en los plexos vasculares superficial y profundo16.
En el caso de las enfermedades ampollosas es recomendable biopsiar lesiones tempranas para evitar que presenten cambios secundarios a reepitelización. Sería óptima la toma de una muestra menor de 5mm de piel sana perilesional17. En el caso de biopsias tomadas de lesiones ampollosas de más de 24 horas de evolución, en el estudio histológico con hematoxilina-eosina el dermatopatólogo a menudo encuentra cambios reparativos18,19. No está tan clara la actitud a tomar en cuanto a los resultados de la inmunofluorescencia, ya que aunque se ha preconizado el procesamiento rápido de la muestra, algunos autores consideran que mantenerla en suero salino isotónico a temperatura ambiente durante 24-48 horas mejora los resultados, eliminando parcialmente la fluorescencia residual20. En caso de realizarse el estudio de inmunofluorescencia sobre una lesión ampollosa, los depósitos inmunes pueden estar distorsionados por la separación tisular o pueden haber sido degradados por la respuesta inflamatoria, con lo que se obtendría un resultado falsamente negativo17. Así, como se puede deducir, los mejores resultados del estudio de inmunofluorescencia en enfermedades ampollosas se obtienen realizándolos sobre piel sana perilesional. Esto es igualmente válido en el caso de la dermatitis herpetiforme. En cambio, en el caso de lupus eritematoso se recomienda la realización de la biopsia en la zona eritematosa21. Respecto a las epidermólisis ampollosas, algunos autores han recomendado inducir la formación de una ampolla mediante frotamiento con la goma de un lápiz justo antes de la biopsia en los casos severos, o instruyendo a los padres para realizar dicha técnica hasta conseguir eritema de la zona a biopsiar en casos menos severos22.
Es importante saber que el tejido utilizado para realizar la técnica de inmunofluorescencia directa (IFD) no debe ser fijado en formol, sino que debe ser enviado en una gasa empapada en suero salino fisiológico. Una alternativa es el uso de medio de Michel, que permite conservar la reactividad del tejido durante al menos 10 días15,23 y posiblemente hasta 6-8 semanas22.
Además, en algunas enfermedades como el penfigoide ampolloso, el área corporal biopsiada influye en el resultado del estudio de inmunofluorescencia, que es con más frecuencia negativo cuando se realiza en lesiones localizadas en los miembros inferiores24.
Por último, comentar que los resultados obtenidos mediante inmunofluorescencia pueden complementarse con la realización de otros métodos de diagnóstico en enfermedades ampollosas, como son la inmunofluorescencia indirecta y el análisis de antígenos mediante ELISA o Western Blot25. En la tabla 1 se observa un resumen de las medidas a tener en cuenta para la correcta realización de la técnica de IFD.
Biopsia de piel adecuada para la realización de inmunofluorescencia directa
| Medidas adecuadas | Problemas / circunstancias a evitar |
| Procesamiento de la muestra en las primeras 24 horas | Retraso en el procesamiento de la muestra |
| Biopsias tomadas del borde de las lesiones | Desecación de la muestra o envío de la misma fijada en formaldehído |
| Un tercio de la biopsia debe contener piel sana perilesional | Toma de la muestra en la región ulcerada o en el centro de una ampolla |
| Uso de medio de trasporte adecuado: medio de Michel o suero salino fisiológico (sólo en circunstancias especiales gasa y hielo) |
Para el estudio de las dermatosis que producen alopecia es imprescindible una correcta historia clínica, un examen físico completo, una cuantificación de la pérdida de cabello, una prueba de tracción y el reconocimiento de las aperturas foliculares26. A continuación se explicarán algunas de las más utilizadas.
En la exploración física deben buscarse signos de inflamación, descamación, eritema y cicatrices en el cuero cabelludo. Así mismo debe prestarse atención a la presencia de aperturas foliculares27. Puede realizarse también una prueba de tracción, la prueba del pellizco (cuando hay alopecia cicatricial el cuero cabelludo se puede pellizcar con facilidad), dermatoscopia del cuero cabelludo y un tricograma28.
En cuanto al uso del microscopio para el estudio de estas dermatosis, aparte de la toma de biopsia para su estudio, que comentaremos a continuación, puede realizarse microscopía óptica del tallo piloso sobre los tallos pilosos desprendidos tras tracción suave (se fijan a un portaobjetos, se hidratan 10 minutos y se analiza la morfología del pelo y la fase del ciclo en que se encuentra).
Las principales indicaciones de la biopsia de cuero cabelludo son la sospecha de alopecia cicatricial/permanente, la presencia de tumores en el cuero cabelludo, las enfermedades inflamatorias de cuero cabelludo de etiología no clara y los casos en los que se requiera conocer el potencial de crecimiento de los folículos presentes.
En el estudio de la alopecia no hay pruebas de laboratorio estándar, sino que debe individualizarse en función de la orientación clínica29,30.
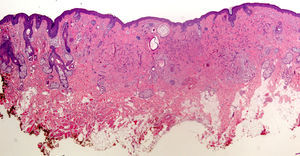
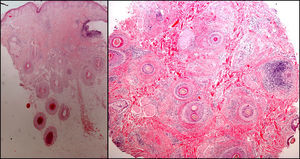
Conviene rasurar la zona a biopsiar previamente y emplear vaselina o cinta aislante para fijar los cabellos. La biopsia debe realizarse siguiendo la dirección de implantación del cabello, y no de manera perpendicular a la superficie cutánea, para evitar seccionar de forma artificial los folículos. Existen en el mercado unos sacabocados, denominados sacabocados tipo Orentreich, que aunque han sido utilizados principalmente para la realización de trasplante capilar, son especialmente adecuados para biopsiar esta zona por permitir la realización de biopsias más profundas para un mismo diámetro31. Es frecuente un sangrado importante debido a la rica vascularización del cuero cabelludo. Para conseguir una hemostasia óptima resulta útil la infusión de anestésicos locales con adrenalina. Algunos autores consideran que una biopsia de 4mm es suficiente30,32. En nuestra experiencia las biopsias de dicho tamaño muchas veces no contienen suficiente tejido subcutáneo y no permiten estudiar más que algún folículo aislado, dificultando un diagnóstico concreto. Como la mayoría de dermatopatólogos evalúan cortes longitudinales y trasversales, que ayudan a depurar el diagnóstico, se pueden realizar dos biopsias tipo punch de 3-4mm o una de 6mm y dividirla (fig. 8).
En el caso de dermatosis de cuero cabelludo que cursen con brotes de lesiones pustulosas, también es útil realizar además un estudio microbiológico para excluir infecciones bacterianas y fúngicas (fig. 9).
Ante una sospecha de alopecia cicatricial se enviará otra muestra para la realización de técnicas de inmunofluorescencia.
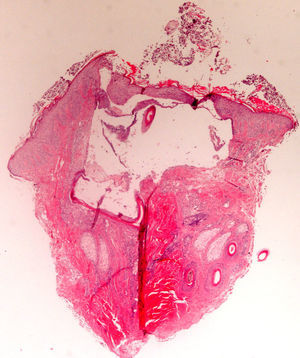
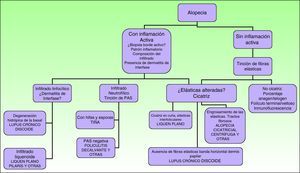
En alopecias cicatriciales (principalmente lupus eritematoso cutáneo y liquen plano pilaris) la biopsia debe realizarse en un margen activo, procurando elegir el borde de la lesión o áreas con presencia de eritema, evitando áreas ya cicatriciales (idealmente no más de un tercio de la superficie biopsiada debe corresponder a zona cicatricial). Es útil en nuestra opinión la realización de cortes seriados de la pieza, así como tinción de fibras elásticas, azul alcián, PAS, e incluso, en algunos casos, de Ziehl-Neelsen33.
El dermatopatólogo debe reconocer un mínimo de signos histológicos: densidad y estructura capilar (se deben observar unos 30 folículos terminales en las secciones trasversales en un punch de 4mm31), afectación anexial, cambios epiteliales, patrón, grado y localización de fibrosis, alteraciones de la interfase dermoepidérmica y, por último, distribución y célula predominante en el infiltrado (fig. 10).
Biopsia del aparato unguealLa biopsia ungueal está especialmente indicada en caso de alteraciones ungueales de difícil diagnóstico con el empleo de la clínica, la radiología u otras técnicas de laboratorio.
Desgraciadamente es una de las áreas del tegumento en que es más frecuente la realización de un diagnóstico erróneo, pese a suponer hasta el 10% de los motivos de consulta34.
Su principal indicación es el diagnóstico de neoplasias, tanto benignas como malignas, y especialmente del melanoma, que en esta área se puede presentar clínicamente como una melanoniquia longitudinal. También es útil en enfermedades de la piel inflamatorias que pueden afectar exclusivamente al aparato ungueal (liquen plano, psoriasis vulgar), para el diagnóstico de infecciones (principalmente onicomicosis y muy raramente parásitos) en las que el agente no se identifica mediante métodos microbiológicos y como método diagnóstico-terapéutico en casos de cambios ungueales dolorosos35,36.
La orientación de la biopia de la matriz ungueal debe ser paralela al eje longitudinal de la uña. La extracción ungueal se realiza con mucha frecuencia y supone un traumatismo de la matriz ungueal, así como del lecho ungueal. Por ello sus indicaciones deben ser seleccionadas37 y debe ser realizada en condiciones estériles, con anestesia local, preferiblemente locorregional, y tras la realización de técnicas que mejoren la hemostasia. Son muy útiles los bloqueos digitales, periungueales o la combinación de ambos, así como la realización previa de un torniquete digital para conseguir una isquemia adecuada y facilitar la visualización del campo quirúrgico34. La realización de un baño del dedo en agua jabonosa durante 10 minutos puede facilitar la biopsia al ablandar la placa ungueal37.
Al igual que con las biopsias de cuero cabelludo, es frecuente encontrar artefactos debidos a pinzamiento. Para evitarlos, en la extracción de la pieza se pueden emplear instrumentos sofisticados38: gancho de Joseph delicado, gancho de Gillies, o una sencilla aguja de jeringa doblada como gancho quirúrgico39.
Para conseguir un resultado óptimo es útil el conocimiento de la compleja anatomía y fisiología del aparato ungueal y, para evitar distrofia ungueal posquirúrgica, las biopsias del área de la matriz deberían ser realizadas por personal entrenado.
Determinados cambios en la morfología ungueal (hiperqueratosis, discromía, onicólisis, pits ungueales, dedos en palillo de tambor, etc.) pueden ser clasificados en función de la región ungueal afectada.
Se pueden realizar biopsias de la lámina ungueal, del lecho ungueal o de la matriz, en función de la sospecha clínica (tabla 2). La biopsia del lecho ungueal se realiza tras la avulsión de la lámina ungueal, con una biopsia elíptica de no más de 3mm de anchura o mediante la técnica del doble punch. En cuanto a la de matriz requiere escindir un colgajo del pliegue ungueal proximal para poder visualizar la matriz y biopsiarla, tratando siempre de evitar su zona proximal para minimizar el riesgo de distrofia ungueal34. La piel periungueal se puede biopsiar como el resto del tegumento o mediante una biopsia longitudinal lateral.
Biopsia ungueal
| Localicación | Indicaciones | Procedimiento |
| Del lecho ungueal | Tumores, onicólisis de etiología incierta, hiperqueratosis sin antecedentes claros de psoriasis vulgar u onicomicosis, pigmentaciones de etiología incierta, lecho ungueal doloroso (tumor glómico, metástasis, granuloma piogénico, tumor osteocartilaginoso, verruga vulgar, absceso subungueal) | Biopsia de 2 a 3 milímetros. Con o sin retirada previa de lámina ungueal.En forma de huso preferiblemente.Incisional o excisional |
| De piel periungueal | Paroniquia persistente, tumores, masas de etiología incierta en inflamación periungueal, quiste mixoide digital, otras dermatosis | Biopsia excisional. Excisión en bloque preferible en quistes o en lesiones tumorales. Aplanamiento en lesiones muy superficiales |
| De matriz ungueal | Neoplasia, melanoniquia longitudinal de etiología incierta, distrofia ungueal | Biopsias en ojal excisionales o incisionales |
| De lámina ungueal | Depósito de pigmento, onicomicosis, distrofias metabolicohereditarias | Biopsia en sacabocados o corte de la porción distal |
Modificada de34,35.
Sería interesante disponer de un registro de melanomas subungueales, que tienen su origen en la matriz ungueal. Se ha considerado que el retraso diagnóstico en el diagnóstico de los melanomas en esta localización conlleva un mal pronóstico con frecuencia. El melanoma subungueal se localiza principalmente en el primer dedo del pie y suele presentarse clínicamente como melanoniquia, y más raramente como una masa exofítica no pigmentada, una distrofia ungueal o una ulceración. En dichas situaciones la biopsia de la matriz ungueal es esencial para la realización del diagnóstico y para la decisión del abordaje terapéutico posterior en función del espesor del tumor40.
Conviene recordar que la biopsia ungueal es el método diagnóstico de onicomicosis más sensible, permitiendo demostrar las hifas incluso en casos en los que el cultivo ha sido repetidamente negativo41.
Biopsia cutánea en el estudio de enfermedades neurológicasEn 1969 Decloux y Friederici comunicaron 6 pacientes con mucopolisacaridosis en los que los cambios histopatológicos encontrados en la biopsia cutánea y en el tejido nervioso eran comparables42. Pese al tiempo trascurrido desde entonces, la realización de biopsias cutáneas para el estudio de enfermedades neurológicas se realiza en raras ocasiones, y entre ellas se distinguen varios tipos en función de la distribución de productos derivados de un metabolismo patológico y de la localización intracelular o extracelular.
En la mayoría de los casos se trata de enfermedades metabólicas que afectan el sistema nervioso y que producen alteraciones bioquímicas y genéticas que pueden ser identificadas prenatalmente. En ellas la microscopía electrónica permite, por ejemplo, demostrar ultraestructuralmente la presencia de depósitos lisosomales.
Las siguientes enfermedades neurológicas se pueden diagnosticar mediante biopsia cutánea (tabla 3).
Biopsia de piel como ayuda diagnóstica de enfermedades neurológicas
| Enfermedad | Hallazgo |
| Enfermedad de Lafora | Cuerpos de Lafora en glándulas apocrinas55 |
| CADASIL | Cuerpos densos granulares al microscopio electrónico. Material osmiófilo en músculo liso vascular43 |
| Enfermedad de depósito de glucosaminoglucanos | Depósitos de material en diversa localización según enfermedad |
| Enfermedad de Unverricht-Lundborg | Presencia de vacuolas de contenido claro en las glándulas ecrinas56 |
| Neuropatía periférica | Recuento del número de fibras nerviosas marcadas mediante inmunohistoquímica45 |
| Neuropatía diabética57 | |
| Neuropatía sensorial | |
| Neuropatía idiopática sensorial | |
| Rabia | Mediante uso de un anticuerpo específico o mediante R-PCR49 |
La enfermedad de Lafora o lipofuscinosis es responsable de una epilepsia con mioclonías que se asocia con un síndrome cerebeloso y demencia progresiva. En ella se encuentran depósitos patológicos homogéneos, los llamados cuerpos de inclusión de Lafora de localización paranuclear. Dichos cuerpos de inclusión se corresponden a gránulos de glucógeno y se acumulan de manera especial en las glándulas apocrinas de la piel. Por ello, es especialmente rentable la toma de la muestra de la región axilar, zona rica en glándulas apocrinas.
En el CADASIL (del inglés: Cerebral Autosomal Dominant Arteriopathy with Subcortical Infarcts and Leukoencephalopathy) se encuentran con microscopía electrónica gránulos de material osmiófilo en estrecho contacto con músculo liso vascular de pequeñas arteriolas. Dichos depósitos están presentes tanto en el cerebro como en los nervios y en la dermis43.
En algunas neuropatías del sistema nervioso periférico, con afectación de las fibras nerviosas sensitivas de pequeño calibre en la biopsia de la piel, también se encuentran hallazgos que ayudan al diagnóstico44. De hecho, en enero de 2010 se estableció una Guía de consenso que considera recomendable la realización de biopsia cutánea en la región distal de los miembros inferiores con una cuantificación de la densidad de fibras nerviosas que debe ponerse en relación con los valores estandarizados por edad45. La mayoría de artículos publicados sobre el tema consideran que una neuropatía de pequeñas fibras puede ser diagnosticada en pacientes con signos y síntomas sensitivos, pero con estudio de conducción del nervio sural normal.
Centrándonos en la técnica de la biopsia sería suficiente con realizar una biopsia en sacabocados de 3-4mm de diámetro y 6-8mm de profundidad que incluye glándulas ecrinas y folículos pilosos45. La zona cutánea a biopsiar es la región distal de la pierna, unos 10 centímetros por encima del maléolo o, en algunos casos, la zona laterosuperior del muslo (20 centímetros bajo la espina ilíaca anterior)45. Para procesar la muestra esta debe congelarse en el momento, mantenerse 24 horas a 4°C y posteriormente incubarse con anticuerpo de conejo policlonal anti-PGP 9.5 en una solución de parafolmaldehído-lisina-peryodato al 2%45. Posteriormente se cortará con un criostato para su estudio mediante microscopía de fluorescencia o confocal (según técnicas).
Dada la variabilidad encontrada en el recuento de fibras nerviosas de piel normal entre diferentes laboratorios, se requiere adaptación de las tablas estandarizadas en cada centro, así como un correcto entrenamiento del personal que interprete las muestras. No es una técnica estándar, y sólo es realizada en un pequeño número de centros de referencia mundiales.
En cuanto a la cuantificación de fibras nerviosas autonómicas se han propuesto varios métodos de visualización, y aunque no hay una metodología estándar algunos autores han comprobado correlación entre escalas de neuropatía y densidad de nervios pilomotores, si bien las densidades de estas últimas no se correlacionan con las de fibras nerviosas sensitivas de pequeño tamaño comentadas previamente46.
Además de los diversos métodos de visualización de los nervios periféricos a nivel cutáneo, el desarrollo de las técnicas destinadas a la extracción de proteínas a partir de una biopsia cutánea han ampliado el campo de investigación en neuropatías periféricas, permitiendo estudiar citocinas involucradas en la patogénesis del dolor neuropático que son difícilmente visualizables mediante técnicas inmunohistoquímicas47.
La expresión de distrofina en la musculatura lisa de la piel, es decir, en los músculos erectores del pelo, también puede ser útil en el diagnóstico de la distrofia muscular de Duchenne y en la variante de Becker. En estas enfermedades neuromusculares, mediante IHQ, se demuestra una disminución o ausencia de expresión de distrofina en la musculatura erectora del pelo, aun antes de la aparición de sintomatología clínica48.
La rabia, enfermedad causada por un Lyssavirus, también puede ser detectada ante mortem mediante técnicas de inmunofluorescencia usando un anticuerpo específico o mediante R-PCR en biopsias cutáneas49. A medida que avanza la infección el virus prolifera en los axones de los nervios craneales, y por tanto en los nervios cutáneos de la región facial y del cuero cabelludo. Como hay un mayor número de fibras nerviosas en las zonas perifoliculares, suele ser preferible realizar una biopsia de al menos 3mm de diámetro de la región occipital50.
Hasta ahora los autores de este artículo no tienen una experiencia propia en esta área que puedan compartir, ya que estas técnicas sólo se realizan en centros de referencia.
La biopsia cutánea y el diagnóstico prenatalSe pueden examinar mediante IHQ y microscopía electrónica biopsias cutáneas realizadas en el segundo trimestre del embarazo y guiadas ecográficamente51–53.
Las genodermatosis más frecuentemente diagnosticables prenatalmente son la epidermólisis ampollosa congénita, el albinismo oculocutáneo y algunas ictiosis.
El estudio histopatológico convencional resulta especialmente útil en casos en los que las alteraciones que produce la enfermedad son conocidas, pero no se conoce el gen o la mutación causante51. No obstante tiene riesgos, entre ellos entre el 1-3% de pérdidas fetales, escapes de líquido amniótico o cicatrices fetales51. Con ellas se pueden también estudiar defectos enzimáticos o mutaciones en los genes de las queratinas52. La biopsia de corion y la amniocentesis, que permiten estudiar ADN fetal, constituyen otro modo de abordaje52.
También es posible realizar un diagnóstico preimplantacional del embrión cuando se realizan técnicas de fertilización in vitro53. En este caso se estudia del ADN de los blastos de un embrión de hasta 6 células y se escoge para la implantación en el útero un embrión libre de la enfermedad.
Por último, se puede realizar un estudio cariotípico de queratinocitos aislados a partir de la biopsia cutánea, técnica útil en dermatosis como la hipomelanosis de Ito, la hipermelanosis lineal y en remolinos o en el síndrome de McCune Albright, en el que el estudio cariotípico de linfocitos no tiene por qué presentar alteraciones51,54.
Un paso más sería el diagnóstico de determinadas patologías fetales en hematíes nucleados procedentes del feto y presentes en pequeñas cantidades en la sangre materna, que constituiría un procedimiento mucho menos invasivo53.
Con la caracterización reciente de los defectos genéticos causales de gran parte de estas enfermedades se han disminuido el número de biopsias cutáneas fetales a favor de técnicas de estudio del ADN fetal, obtenidas mediante amniocentesis o punción de las vellosidades coriónicas51.
A pesar de los avances científicos este ámbito despierta importantes problemas sociopolíticos y éticos y, con la expansión de las posibles técnicas diagnósticas, requieren además de un equipo multidisciplinar (pediatra, genetista, ginecólogo, dermatólogo) y de una correcta comunicación con los padres.
Como dermatólogos debemos conocer que las principales indicaciones del diagnóstico prenatal son la presencia de estas enfermedades genéticamente determinadas en la familia o en anteriores hijos de la pareja. Un correcto estudio requiere de la toma de muestras de ambos progenitores y de los familiares afectos para caracterizar la mutación y descartar mutaciones de novo, disomías uniparentales o mosaicismos en las células germinales51.
Conclusión: el informe dermatopatológicoComo hemos comentado en la introducción, la biopsia cutánea es un procedimiento tanto diagnóstico como terapéutico en enfermedades cutáneas y sistémicas. En las enfermedades inflamatorias es importante la elección de una lesión de poco tiempo de evolución para que la biopsia sea lo más rentable posible. El tejido se tiene que extraer correctamente y fijarse en un medio adecuado. Como las enfermedades inflamatorias de la piel presentan un número limitado de patrones de reacción morfológica, es recomendable por parte del dermatopatólogo la realización de una correcta descripción microscópica, así como un listado de los diagnósticos diferenciales más probables, de manera ordenada. A veces las diferencias o las imágenes histológicas de algunas dermatosis no son muy llamativas (alteraciones de la pigmentación, reacciones medicamentosas) e incluso unas dermatitis pueden imitar a otras (dermatosis ampollosas, dermatitis de contacto/ eccema numular/ eccema dishidrótico, reacciones ide, eccemas). Así, el uso del término «compatible con» resulta de utilidad en caso de hallazgos histopatológicos no completamente específicos, pero que pueden encontrarse en biopsias de la dermatosis sospechosa. Por otra parte, el término «sugestivo de» indica una mayor especificidad de los hallazgos dermatopatológicos. Por tanto, por parte del clínico, cuanto más precisa sea la descripción de la configuración de las lesiones, su cronología y periodicidad, sintomatología acompañante, factores precipitantes y fármacos implicados, más preciso será el diagnóstico histopatológico del dermatopatólogo. Por ello, para aumentar la precisión diagnóstica, se requiere de una estrecha colaboración entre clínicos y dermatopatólogos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.