El abordaje de los pacientes «extremadamente ancianos» (pacientes mayores de 85 años) con el diagnóstico de carcinoma de células escamosas (CCE) debe ser adaptado a la inevitable presencia de sus múltiples comorbilidades, al mayor grado de dependencia tanto física como cognitiva y finalmente a su limitada esperanza de vida1.
El CCE es un tumor potencialmente mortal que afecta preferentemente a los pacientes «extremadamente ancianos»,2 hecho que con frecuencia conlleva a que las medidas terapéuticas sean tomadas de manera individualizada. En el CCE primario el tratamiento de primera línea es la cirugía, ya sea convencional (con la definición clínica de los márgenes) o con la cirugía de Mohs.3 Sin embargo, la creciente fragilidad de estos pacientes, junto con las consideraciones de su esperanza de vida, limitan sustancialmente la aplicabilidad de un tratamiento quirúrgico más radical y de índole curativo. Este hecho hace con que otras modalidades terapéuticas igualmente efectivas, pero menos invasivas, sean más atractivas.4
En el presente artículo se describen los hallazgos preliminares de un estudio de tipo abierto, realizado en cuatro pacientes de más de 85 años acerca del tratamiento del CCE localizado. Estos pacientes se trataron mediante técnicas de inmunocriocirugía, haciéndose además algunas modificaciones de los protocolos de manera individualiza, dependiendo de las características propias de los pacientes, así como de las tumoraciones.
Los pacientes se programaron siguiendo un protocolo de inmunocirugía específico, que implicaba un tratamiento por un periodo más prologado, así como con ciclos de mayor intensidad. La pauta que se diseñó fue la de una sesión de mayor intensidad de criocirugía (utilizando el N2 líquido con la técnica de pulverizador abierto, realizando dos ciclos de congelación-descongelación, 30 s cada uno vs. los 15 s en el carcinoma de células basales [CBC]5) en los días 14 y 28 de la aplicación diaria del imiquimod. La aplicación diaria del imiquimod debía de ser reanudada incluso en la misma noche de la sesión de criocirugía y continuar con su aplicación durante las siguientes tres semanas («esquema 5/1») o hasta la próxima sesión de criocirugía el día 28 y luego durante tres semanas más (siete semanas imiquimod/dos sesiones de criocirugía: «esquema 7/2»).
En el día 15 del tratamiento se valoraba la necesidad de utilizar algún otro tratamiento adyuvante (como el metotrexate intralesional o la crema de tretinoína). La tretinoína en crema al 0,05% en la semana 2 se utilizó únicamente en los casos en los que se observaba una escasa respuesta local inflamatoria. De manera similar, el uso del metotrexato intralesional se programó los mismos días de las sesiones de criocirugía, permitiendo adaptar su uso anticipadamente de manera individualizada. Las visitas programadas y de final del tratamiento se mantuvieron según lo determinado por el protocolo inicial.5
Un total de ocho CCE, confirmados histológicamente mediante biopsias, en cuatro pacientes (tres hombres: una mujer; mediana de edad: 88 años [rango: 85-89]), fueron tratados con inmunocriocirugía (tabla 1). A continuación, se presentan las adaptaciones que se realizaron, de manera individualizada, del esquema terapéutico inicial.
Características clínicas y parámetros terapéuticos de ocho carcinomas cutáneos de células escamosas tratados con inmunocriocirugía (± adyuvantes)
| Tumor | Paciente | Edad/sexo | Localización | Diámetro (mm) | Cirugía previa | Ciclos de tratamiento | Imiquimod (semanas) | Sesiones de Crioterapia | Terapia Adyuvante | Respuesta | Seguimiento (meses) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 1 | 87 Masculino | Cuero cabelludo | 20 | Hace 10 años | 2 | 1er. ciclo: 7; 2do. ciclo: 5 | 1er. ciclo: 2; 2do. ciclo: 1 | No | Completa | 42 |
| 2 | 2 | 85 Femenino | Mejilla, izquierda | 15 | No | 1 | 7 | 2 | Tre; 2xMTX (5 mg) | Completa | 14 |
| 3 | 2 | Sien, izquierda | 11 | No | 1 | 7 | 2 | Tre; 2 xMTX (5 mg) | Completa | 14 | |
| 4 | 2 | Mejilla, derecha | 8 | No | 1 | 5 | 1 | Tre | Completa | 12 | |
| 5 | 2 | Nariz, izquierda | 7 | No | 1 | 5 | 1 | Tre | Completa | 12 | |
| 6 | 3 | 87 Masculino | Cuero cabelludo | 30 | No | 2 | 1er. ciclo: 5; 2do. ciclo: 5 | 1er. ciclo: 1; 2do. ciclo: 1 | 1er. ciclo: 1 xMTX (5 mg); 2do. ciclo: ninguno | Completa | 12 |
| 7 | 3 | Cuero cabelludo | 25 | No | 1 | 7 | 2 | 1xMTX (5 mg) | Completa | 3 | |
| 8 | 4 | 89 Masculino | Mejilla, izquierda | 22 | No | 2 | 1er. ciclo: 9; 2do. ciclo: 5 | 1er. ciclo: 3; 2do. ciclo: 2 | 1er. ciclo: 3 Xmtx (5 mg); 2do. ciclo: 2 Xmtx (5 mg) | Respuesta parcial -recidiva | 8 |
Tre: tretinoína en crema; MTX: metotrexate.
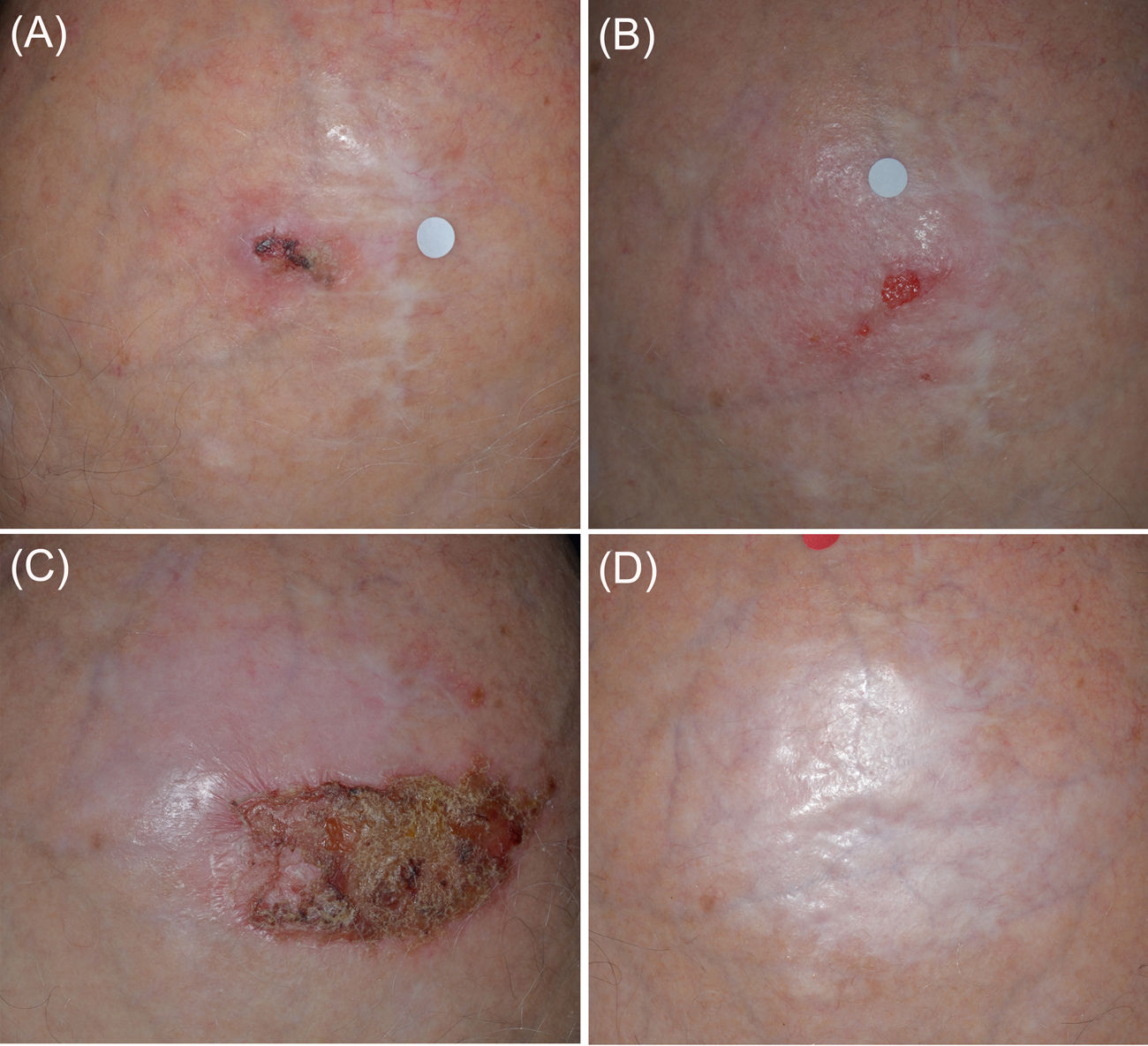
El paciente 1 (fig. 1) realizó inicialmente un «ciclo 7/2 de inmunocriocirugía» presentando una respuesta tumoral parcial (fig. 1B). Tras un «ciclo adicional modificado de inmunocriocirugía 5/1» se logró una respuesta completa (imiquimod durante cinco semanas con una sesión de criocirugía adicional en el día 35, el último día del ciclo. fig. 1C); después de 30 meses de seguimiento el paciente estaba libre de recidiva (fig. 1D).
Panel A) Presentación inicial del Tumor 1 localizado en la zona media del cuero cabelludo (Paciente 1). El tumor tenía un diámetro máximo de 20 mm y fue una recaída de una cirugía previa de hace 10 años. Panel B) Después del «ciclo de tratamiento 7/2» inicial (7 semanas de imiquimod y criocirugía en los días 24 y 28 del ciclo de tratamiento) se logró una respuesta parcial del tumor. Panel C) El área tumoral después del segundo ciclo de tratamiento de cinco semanas de imiquimod y una sesión de criocirugía («ciclo 5/1»). Panel D) Respuesta completa mantenida tras los 30 meses de seguimiento.
El paciente 2 desde un inicio presentaba dos CCE (los tumores 2 y 3); ambos presentaron una respuesta completa tras realizar, de manera simultánea, «ciclos de inmunocriocirugía 7/2» y dos inyecciones intralesionales de metotrexato (2,5 mg por tumor y por sesión en los mismos días de la criocirugía). Dos CCE (tumor 4 y 5) de menor tamaño, diagnosticados durante el seguimiento, se trataron cada uno con un «ciclo de inmunocriocirugía 5/1» estándar y con crema de tretinoína adyuvante. Al menos durante los 12 meses de seguimiento no se observaron recidivas.
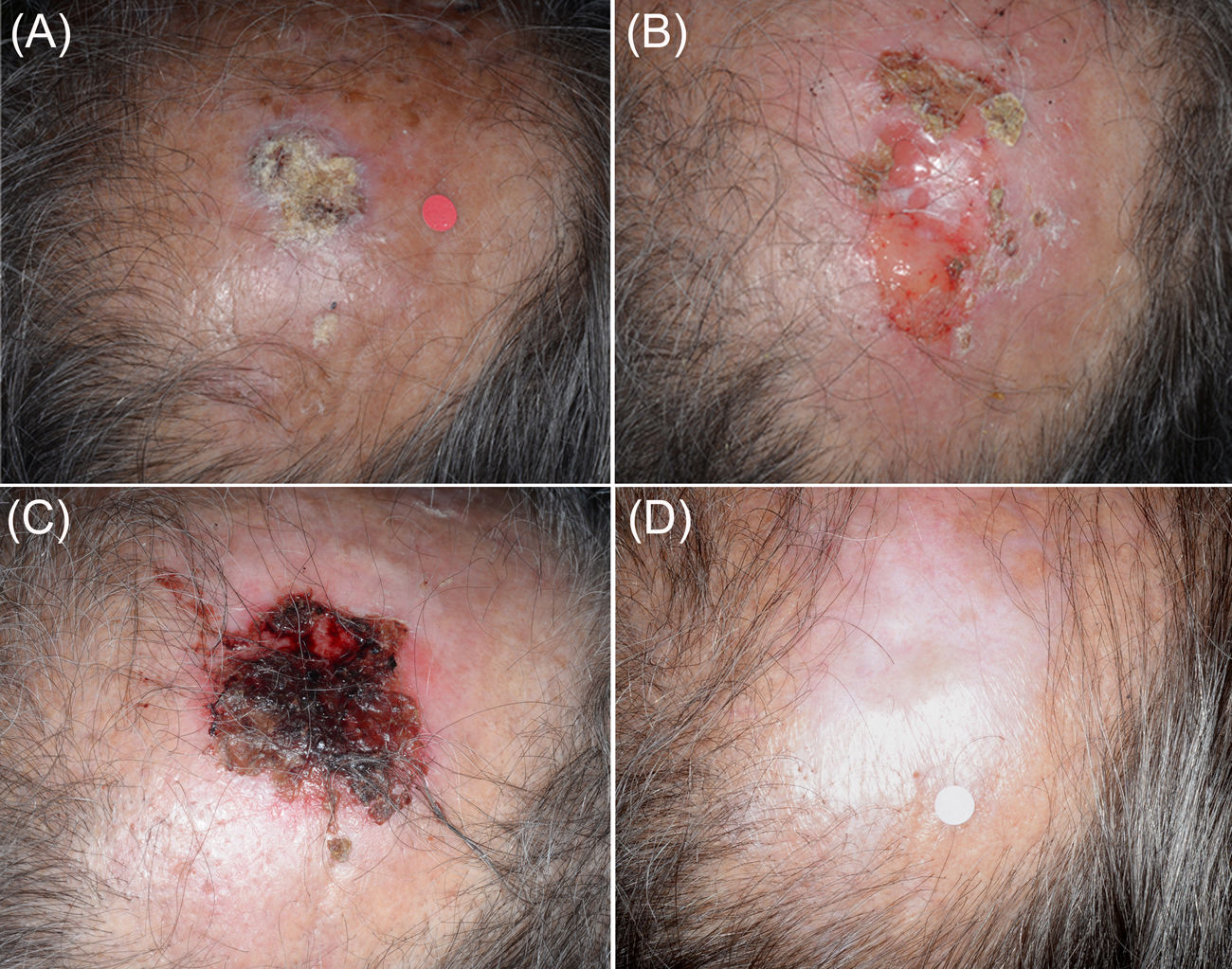
El paciente 3 (fig. 2) presentó una reacción inflamatoria intensa tras realizar la primera sesión de criocirugía del «ciclo de inmunocriocirugía 7/2» en la que se asoció además metotrexato de 5 mg intralesional adyuvante. Por este motivo, el paciente se negó a repetir el segundo ciclo de criocirugía en la semana 4. En lugar de ello, se indicó una semana adicional de imiquimod, con lo que se completó un «ciclo de inmunocriocirugía de 5/1». El tumor presentó una respuesta parcial al tratamiento (fig. 2B). Al mes de seguimiento se realizó un segundo «ciclo de inmunocriocirugía 5/1» sin ningún tratamiento adyuvante, obteniéndose un aclaramiento total del tumor (fig. 2C); dicha respuesta persistió tras 12 meses de seguimiento (fig. 2D). A los seis meses de seguimiento se diagnosticó un segundo CCE, el cual se trató con un «ciclo de inmunocriocirugía 7/2» combinando con metotrexato adyuvante en la primera sesión de criocirugía (en el día 14). Posteriormente se perdió el seguimiento del paciente.
Panel A) Presentación clínica inicial del tumor 6 (Paciente 3) localizado en la zona media del cuero cabelludo. Se observa una respuesta inflamatoria intensa tras la primera sesión de criocirugía del «ciclo de tratamiento 7/2». Panel B) Restos del tumor tras terminar el primer ciclo de tratamiento. Sólo se observó una respuesta parcial. Panel C) Zona donde se encontraba el tumor al final del segundo ciclo de tratamiento. Panel D) Imagen tras 12 meses de seguimiento. El proceso de curación es excelente en un área que normalmente requiere procedimientos complejos de reconstrucción quirúrgica.
El paciente 4 presentó un CCE de rápido crecimiento localizado en la mejilla izquierda (tabla 1). Inicialmente rechazó la posibilidad de realizar tratamiento quirúrgico o de radioterapia. Sin embargo, el tumor únicamente tuvo una respuesta parcial tras 14 semanas de aplicar el imiquimod, cinco sesiones de criocirugía y cinco inyecciones intralesionales de metotrexato (tabla 1). Finalmente, el paciente accedió al tratamiento con radioterapia y permaneció libre de enfermedad tras seis meses de seguimiento.
En total, de los ocho CCE, siete respondieron de manera completa a los ciclos de inmunocriocirugía de mayor intensidad, administrados por periodos más prolongados y complementados con tratamientos adyuvantes. De los pacientes que respondieron desde un inicio, seis permanecieron libres de recidiva durante al menos 12 meses tras el tratamiento.
Hoy en día, la inmunocriocirugía se ha utilizado de manera exitosa en el tratamiento del CBC5, la enfermedad de Bowen6 y el lentigo maligno.7 La inmunocriocirugía no se había considerado como una opción terapéutica en el CCE, ya que la criocirugía está considerada como un tratamiento de tercera línea, por lo que con frecuencia se utiliza de forma paliativa. En el caso del imiquimod, este incluso no está considerado dentro de las opciones terapéutica del CCE3. Sin embargo, la eficacia duradera de la inmunocriocirugía en el caso del CBC es indicativa de que existe una interacción sinérgica entre el imiquimod y la criocirugía, en el marco del esquema temporal propuesto, desencadenando probablemente una activación subyacente de mecanismos inmunoestimuladores tanto a nivel tisular como sistémico.8
Generalmente la cirugía no está contraindicada en los pacientes extremadamente ancianos; sin embargo, debido a que con frecuencia coexiste una fragilidad del paciente, se suele optar por opciones de tratamiento quirúrgico que difieren un poco a lo indicado en las guías terapéuticas.9
En conclusión, en este subgrupo etario de pacientes, los procedimientos mínimamente invasivos, así como aquellos esquemas basados en la inmunocriocirugía o en las combinaciones de tratamientos tópicos similares a la inmunocriocirugía (imiquimod, crema de tretinoína y solución de 5-fluorouracilo al 2%) con criocirugía10, tienen la ventaja de ofrecer un abordaje más flexible y adaptable a las necesidades individualizadas de tratamiento, y así mejorar la viabilidad y la efectividad del mismo, teniendo además una carga terapéutica mínima.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de interés.
Los autores desean expresar su agradecimiento a la profesora Petia Radeva por la edición lingüística.