Mycobacterium chelonae (M. chelonae) es una micobacteria atípica o no tuberculosa perteneciente al grupo de las micobacterias no pigmentadas de crecimiento rápido de Runyon. La presentación de la infección por M. chelonae es en forma de infección de tejidos blandos y hueso, que son el resultado de una inoculación directa (el espectro clínico varía de abscesos cutáneos localizados a franca osteomielitis), o como una infección diseminada que se suele dar en pacientes con inmunodepresión. Los síntomas más comunes son fiebre, sudores nocturnos y pérdida de peso, manifestándose las lesiones cutáneas como nódulos y abscesos subcutáneos difusos1.
Adalimumab es un anticuerpo anti-TNF alfa monoclonal humano. El factor de necrosis tumoral (TNF) desempeña un papel muy importante en la reacción inmune frente a patógenos intracelulares. Por ello, muchos de los efectos adversos que potencialmente pueden contribuir a una elevada tasa de morbimortalidad en pacientes con anti-TNF se deben a la disminución de la resistencia a infecciones. El TNF aumenta la capacidad fagocítica de los macrófagos, favorece la destrucción de los patógenos intracelulares y la formación de granulomas, permitiendo el secuestro de las micobacterias e impidiendo su diseminación2.
Presentamos el caso de una mujer de 76 años con antecedentes de diabetes mellitus tipo 1, hipertensión, hipercolesterolemia y artritis reumatoide, seropositiva de 20 años de evolución, en tratamiento con glucocorticoides y metotrexato desde el año 1992 al 2000; con glucocorticoides y azatioprina desde el 2000 al 2003, y desde entonces hasta 2009 con glucocorticoides y adalimumab, siendo éste último suspendido de octubre a diciembre de 2008 a causa de una infección por citomegalovirus, reintroduciéndose de nuevo en enero de 2009.
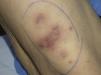
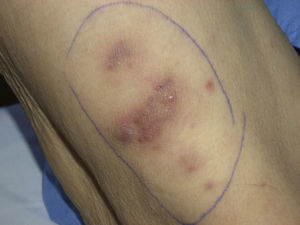
En septiembre de 2009 ingresó en el servicio de medicina interna de nuestro hospital para estudio de un episodio de hipoglucemia. Al realizar la historia clínica la paciente refería inflamación del pie derecho de un mes de evolución con un orificio fistuloso en el talón y episodios febriles 3-4 veces a la semana de meses de evolución. En la exploración física al ingreso la paciente presentaba placas y nódulos eritemato-violáceos infiltrados a la palpación de predominio en extremidades (fig. 1), motivo por el que se solicitó una interconsulta a dermatología.
En las pruebas complementarias solicitadas destacaba velocidad de sedimentación globular de 100, factor reumatoide 53,5 y en la gammagrafía ósea se apreciaba osteomielitis del primer metatarsiano y calcáneo del pie derecho. El resto de hemograma, bioquímica, coagulación, serologías y tomografía computarizada (TAC) toracoabdominal no presentaron alteraciones.
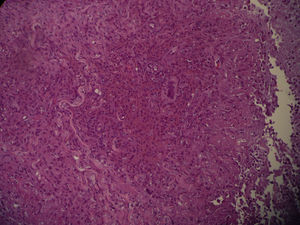
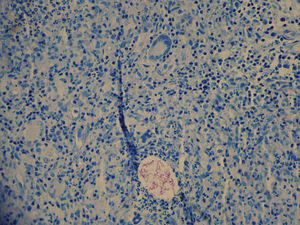
Se realizaron dos biopsias cutáneas una para estudio dermatopatológico, en el que se demostró un granuloma inflamatorio por micobacterias (fig. 2) que con la tinción de Ziehl mostró bacilos Ziehl (+) agrupados situados entre las células inflamatorias (fig. 3); y otra para microbiología, comprobándose una baciloscopia positiva para micobacterias y cultivo positivo para M. chelonae.
Con estos datos se llegó al diagnóstico de infección diseminada por M. chelonae y se instauró tratamiento con imipenem 0,5 g/6 horas vía intravenosa y claritromicina 500mg/día vía oral durante el mes que permaneció ingresada, y con levofloxacino 500mg/24 horas y claritromicina 500mg/24 horas vía oral durante 6 meses más. Quince días después del inicio del tratamiento antibiótico se procedió al curetaje y limpieza de pie derecho apreciándose macroscópicamente un tejido óseo con aspecto granulomatoso, osteomielitis crónica granulomatosa con tinción para bacilos ácido-alcohol resistentes negativa al microscopio, y una baciloscopia y cultivo negativos.
A pesar de que las infecciones por micobacterias más frecuentes en pacientes con terapia anti-TNF se producen por Mycobacterium tuberculosis (M. tuberculosis), cada vez se describen más infecciones por micobacterias atípicas. Esto puede ser debido al cribado activo que se realiza en el caso de M. tuberculosis como consecuencia de los casos de infecciones descritos, y a que la gran mayoría de casos de tuberculosis se han producido en los siguientes tres meses tras el inicio de tratamiento con anti-TNF, lo cual refleja una reactivación de una infección latente, hecho que no se ha demostrado en las infecciones por otras micobacterias.
Winthrop KL, et al. realizaron una revisión de la base de datos de la US Foodand Drug Administration MedWatch de los casos reportados de infecciones por micobacterias no tuberculosas en pacientes que recibían tratamiento con fármacos anti-TNF. Los resultados destacan una media de edad de 62 años, predominio de mujeres (66,65%), y la mayoría (73,70%) con artritis reumatoide como patología de base3.
Desde el año 2002 se han publicado varios casos de infecciones por micobacterias no tuberculosas o atípicas en pacientes con terapia anti-TNF4–7.
En concreto por M. chelonae hemos encontrado tres casos descritos, uno en 2006 por Sicot N, et al.8 en un paciente en tratamiento con infliximab, otro en 2008 en el que Díaz F, et al.9 describen a una paciente en tratamiento con adalimumab por una artritis reumatoide que comenzó con las lesiones dos meses después del inicio del tratamiento, y el último caso publicado por Adenis-Lamarre E, et al.10 en 2009 en el que describen el caso de una paciente con artritis reumatoide que empeoró de unas lesiones cutáneas tras el inicio de tratamiento con adalimumab, siendo diagnosticada posteriormente de infección por M. chelonae.
El caso presentado destaca respecto a los descritos anteriormente por el tiempo de tratamiento (6 años) de la paciente con adalimumab, ya que en el resto, la infección se produjo en los primeros meses de tratamiento. También consideramos que la osteomielitis puede ser debida igualmente a la infección por M. chelonae aunque no se ha podido demostrar con el estudio histológico ni microbiológico, ya que la paciente llevaba 15 días con tratamiento antibiótico correcto.
En conclusión, las infecciones oportunistas han sido asociadas a la terapia anti-TNF, y deben considerar a los pacientes que las reciben dentro del grupo de pacientes inmunodeprimidos. No se conoce todavía el riesgo de estos agentes a predisponer a infecciones por micobacterias no tuberculosas. La frecuente presencia concomitante de otros factores de riesgo adicionales, como la prescripción de otros inmunosupresores (corticoides, metotrexato, etc.) o la propia enfermedad de base dificultan, sin embargo, conocer el peso específico de estos nuevos fármacos en el desarrollo del proceso.