La vacuna antituberculosa de Calmette y Guérin (BCG), contiene cepas vivas y atenuadas de Mycobacterium bovis, y ayuda a evitar infecciones diseminadas graves por Mycobacterium tuberculosis (TBC)1–6. La OMS recomienda su aplicación en los países endémicos de TBC, por lo que en Argentina forma parte del calendario nacional de vacunación con aplicación dentro del primer mes de vida del recién nacido salvo casos especiales1,7. Si bien es considerada segura2,3,5,6, en casos raros puede presentar manifestaciones locales y/o sistémicas1,3,5,8,9. En este último supuesto, es mandatorio el estudio de la inmunidad, en particular el grupo de enfermedades genéticas que constituyen la entidad susceptibilidad mendeliana a mycobacterias (MSMD, por sus siglas en inglés2,10).
En este artículo se describe un caso con una infección diseminada por BCG (llamada también BCGosis) que fue el punto de partida para llegar al diagnóstico de una MSMD con una mutación en STAT1.
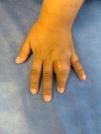
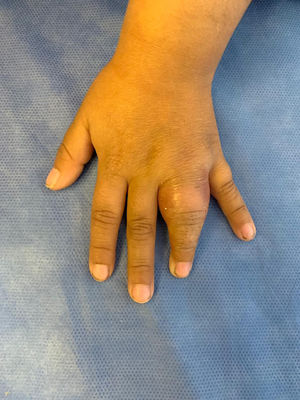
Una niña de 5 años fue evaluada por presentar una tumefacción y limitación de la movilidad del 4.° dedo de la mano izquierda, con aumento de temperatura local, de 20 días de evolución (fig. 1). La niña era hija de embarazo gemelar, nacida a término con un bajo peso para su edad gestacional (38 semanas, 1.915 g), y había recibido la vacunación completa según el calendario nacional de vacunación. Como antecedentes patológicos de interés, se le había diagnosticado una escoliosis lumbar a los 2 años que requirió de una corrección quirúrgica a los 4 años. Además, había presentado un episodio de tumefacción de codo izquierdo a los 4 años de vida (interpretado y tratado como celulitis), y múltiples internaciones por cuadros broncoobstructivos. Su hermana gemela no tenía antecedentes de interés, al igual que el resto de la familia.
La lesión se diagnosticó de celulitis por lo que recibió tratamiento antibiótico por vía oral con cefalexina. La paciente concurrió al cuarto día de tratamiento por una mala evolución de su cuadro, que requirió de su internación para estudio y tratamiento antibiótico intravenoso. Al ingreso presentaba, además, una placa eritemato-costrosa en el pabellón auricular derecho y una lesión similar sobre la cicatriz donde se administró la vacuna BCG. En el paladar duro se observaba una tumoración compatible con torus palatino.
El análisis de sangre mostró un hemograma y un perfil fosfocálcico dentro de límites normales, los reactantes de fase aguda elevados, y las serologías para VIH y VDRL no reactivas. Dos hemocultivos fueron negativos para los gérmenes comunes. Presentaba unas poblaciones linfocitarias en valores normales acordes a su edad, con una hipergammaglobulinemia de todos los isotipos, que fue interpretada como la resultante de un proceso reactivo al cuadro inflamatorio infeccioso (tabla 1).
Laboratorios
| Glóbulos blancos | 8.100/mm3 (N73%/L22%/M4%) |
| Hemoglobina | 10,3 g/d. |
| Hematocrito | 31% |
| Plaquetas | 463.000 μl |
| Proteína C reactiva | PCR 29 mg/ml |
| Eritrosedimentación | VSG 105 mm/h |
| Fosfatasa alcalina | FAL 215 U/l |
| Hemocultivos × 2 | Negativos gérmenes comunes |
| Poblaciones linfocitarias | CD3 65%, CD4 43%, CD8 21%, CD16/56 6%, CD19 29% |
| Serologías | HIV y VDRL negativas |
| IgG | 1880 mg/dl |
| IgA | 367 mg/dl |
| IgM | 210 mg/dl |
| IgE | 50 UI/ml |
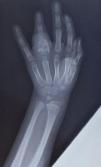
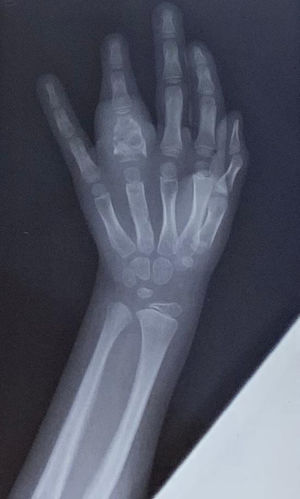
En la radiografías de manos, columna y ambos codos se evidenció la existencia de lesiones osteolíticas en la falange del 4.° dedo de la mano izquierda (fig. 2) y en el codo izquierdo. Una ecografía abdominal y una radiografía de tórax no mostraron particularidades. Se realizó una gammagrafía ósea corporal total que informó de una hipercaptación en el 4.° dedo de la mano izquierda, la epífisis proximal del húmero y el cúbito izquierdo y el tobillo derecho.
Se tomó una muestra para su estudio histológico de la lesión cutánea del pabellón auricular derecho y un cultivo para gérmenes comunes y atípicos del 4.° dedo de la mano izquierda.
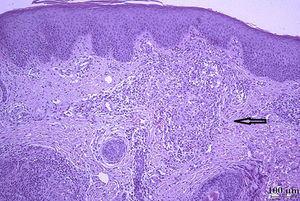
La histología evidenció la presencia de células gigantes multinucleadas de tipo Langhan, tinción de Ziehl Neelsen negativo (fig. 3). El cultivo fue positivo para Mycobacterium, caracterizado mediante reacción en cadena de polimerasa (PCR) como BCG. Actualmente la paciente continúa en tratamiento antituberculoso con buena adherencia y respuesta al tratamiento instaurado.
Dada la alta sospecha clínica de una inmunodeficiencia de base, se decidió ampliar la valoración inmunológica, con foco en las MSMD. En colaboración con el laboratorio de Biología Molecular de Inmunología del Hospital de Pediatría S.A.M.I.C. «Juan P. Garrahan» se realizó el estudio de secuenciación masiva de un panel customizado de 122 genes asociados a inmunodeficiencia primaria en el (Agilent Technologies; plataforma Illumina MiSeq®) que incluye genes involucrados en MSMD, encontrándose una variante de interés en el gen STAT1 (c.469G>C, p.Glu157Gln) en heterocigosis, no descrita en las bases de datos (Database of Single Nucleotide Polymorphism, dbSNP; Exome Aggregation Consurtium,ExAC; Ensembl, https://www.ensembl.org; Clinical Variant,Clinvar; Online Mendelian Inheritance in Man, OMIM; The Human Gene Mutation Database, HGMD) y pronosticada como probablemente patogénica por los programas de predicción in silico (SIFT, Polyphen, Mutation Taster). Otras variantes heterocigotas con pérdida de función en este gen están descritas como causales de MSMD.
A fin de valorar el impacto funcional de la variante, en colaboración con el laboratorio de Biología Celular de Inmunología del Hospital de Pediatría S.A.M.I.C. «Juan P. Garrahan» se realizó un ensayo de fosforilación de la proteína STAT1, observándose una disminución significativa de la capacidad de fosforilación, confirmando el diagnóstico de MSMD por deficiencia de STAT1 heterocigota.
La vacunación por BCG es inocua para la mayoría de los individuos1,3 y ayuda a evitar la infección diseminada por TBC1. Sin embargo, en personas con inmunodeficiencias puede generar infecciones (BCGosis) graves y potencialmente mortales3. Por ello, es importante la sospecha temprana de una MSMD.
Debemos destacar que, si bien existen múltiples publicaciones con BCGosis1,9,11, hay pocas publicaciones donde se asocia un compromiso óseo grave asociado a las manifestaciones cutáneas3–6,9,12. En nuestra paciente, la primera manifestación fue el compromiso óseo, hacia los dos años de vida, con una escoliosis que requirió tratamiento quirúrgico.
Múltiples inmunodeficiencias primarias o secundarias pueden causar una BCGosis2,5,8,10,11, por lo que es de vital relevancia una valoración inmunológica completa en aquellos pacientes con una infección diseminada. En nuestro caso, y en colaboración interhospitalaria, esa sospecha nos permitió llegar al diagnóstico de una susceptibilidad mendeliana a micobacterias con una mutación no descrita previamente en STAT12,8,10,11.
Por último, queremos recalcar la importancia del trabajo multidisciplinar e interhospitalario, que permitieron un diagnóstico preciso de la infección por BCG y de la enfermedad de base, posibilitando un tratamiento y seguimiento acorde, así como también mejoras en la calidad de vida y asesoramiento genético de la paciente y su entorno.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.