Introducción
La infección por Mycobacterium haemophilum es una micobacteriosis poco común del adulto inmunodeprimido causada por una micobacteria no tuberculosa de crecimiento lento. El microorganismo se adquiere a través de una exposición ambiental aunque su hábitat natural, modo de transmisión y periodo de incubación se desconocen. Las manifestaciones clínicas más frecuentes son las lesiones cutáneas, aunque también se han descrito infecciones pulmonares y articulares1,2. La dificultad para aislar el microorganismo en los medios de cultivo habituales a menudo retrasa el diagnóstico y el inicio de un tratamiento adecuado. Además, sus exigencias nutritivas dificultan enormemente los estudios de sensibilidad.
Caso clínico
Un varón de 37 años, VIH positivo conocido desde hace 12 años, mal cumplidor del tratamiento antirretrovírico y sin control el último año, con varios ingresos previos por infecciones oportunistas relacionadas con su enfermedad de base, ingresó en nuestro hospital por presentar desde hacía dos semanas una linfangitis ascendente en el miembro superior izquierdo, seguida de la aparición de lesiones nodulares inflamatorias y dolorosas en el trayecto del cordón linfático, que posteriormente se ulceraron y supuraron. El paciente tenía un acuario y refería, dos meses antes, la mordedura de un pez tropical (cíclico azul africano del lago Tanganika) en el dedo índice de la mano izquierda. Cinco días antes del ingreso, refiere dolor en la rodilla izquierda y extensión de las lesiones cutáneas a las extremidades derechas, sin fiebre ni síntomas generales.
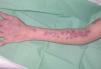
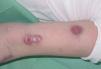
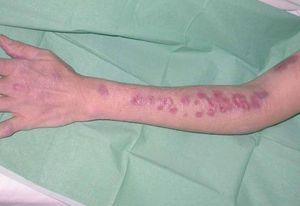
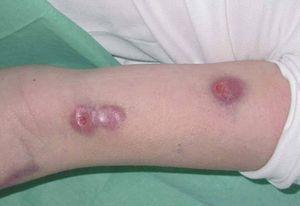
La exploración clínica mostró numerosos nódulos subcutáneos eritematosos fluctuantes al tacto, de distribución esporotricoide, en el lugar de la mordedura y a lo largo de la superficie extensora y la cara interna del brazo izquierdo (fig. 1), algunos de los cuales estaban ulcerados y drenaban material purulento (fig. 2). También presentaba lesiones cutáneas aisladas de similares características en el brazo derecho y ambas piernas, y signos de artritis en la rodilla izquierda.
Figura 1. Nódulos de distribución esporotricoide en el miembro superior izquierdo.
Figura 2. Nódulos ulcerativos en el brazo izquierdo.
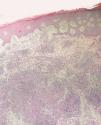
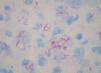
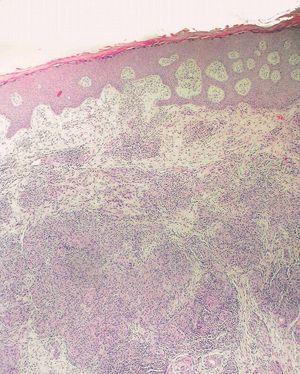
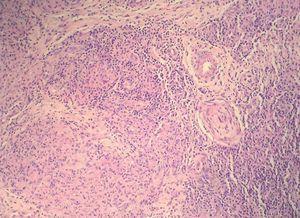
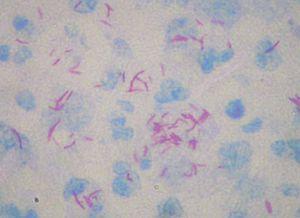
Los datos de laboratorio al ingreso incluyeron un recuento de CD4 de 26 células/ml, una carga viral de 740.000 copias/ml y una radiografía de tórax que fue normal. Se llevó a cabo una artrocentesis que mostró un líquido articular inflamatorio con baciloscopia y cultivo negativos y una radiografía de rodilla izquierda que fue normal. Se extrajeron hemocultivos que fueron negativos. En el estudio histológico de dos lesiones nodulares se objetivó, bajo una epidermis con acantosis, inflamación y reacción granulomatosa dérmica superficial y profunda inespecífica, constituida por granulomas no supurativos mal delimitados con presencia de linfocitos e histiocitos epitelioides sin células gigantes (figs. 3 y 4). Los cultivos microbiológicos de las muestras cutáneas fueron negativos, observándose numerosos bacilos ácido-alcohol resistentes en ambas muestras (fig. 5), siendo negativa la reacción en cadena de la polimerasa (PCR) para Mycobacterium tuberculosis.
Figura 3. Inflamación y reacción granulomatosa bajo una epidermis hiperplásica. Hematoxilina-eosina, x400.
Figura 4. Granulomas sin necrosis constituidos por linfocitos e histiocitos epitelioides. Hematoxilina-eosina, x100.
Figura 5. Bacilos ácido-alcohol resistentes.
En los primeros días del ingreso se inició tratamiento empírico de amplio espectro con isoniazida, rifampicina, etambutol, amikacina, claritromicina y ciprofloxacino y se reintrodujo simultáneamente tratamiento antirretrovírico con tenofovir, lamivudina y efavirenz, que hubo de suspenderse 8 días después por presentar rash cutáneo severo a este último. Tras una mejoría clínica inicial, presentó en la tercera semana de tratamiento una reacción inflamatoria paradójica en las manos, que se acompañó de fiebre y síntomas generales. Finalmente se mantuvo la terapia antibiótica y el paciente mejoró tras añadir un tratamiento de corta duración con corticoides que llevó a la remisión del cuadro. A los tres meses creció, en un medio de cultivo enriquecido con hierro, una micobacteria atípica que se identificó como Mycobacterium haemophilum mediante amplificación de secuencias específicas de ADN (GenoType® Mycobacterium CM/AS 12). En el micobiograma de esta cepa se demostró su resistencia a los antituberculosos de primera línea (isoniazida, rifampicina, etambutol y amikacina), siendo sensible a ciprofloxacino, claritromicina, cotrimoxazol y tetraciclinas.
Cinco meses después del ingreso hospitalario el paciente continúa realizando triple terapia antibiótica con ofloxacino, claritromicina y minociclina, con buena tolerancia y aclaramiento progresivo de las lesiones cutáneas. El paciente, natural de Alemania, dejó de venir a las visitas de control tras haber regresado a su país.
Discusión
En las últimas décadas están adquiriendo un interés notable las infecciones por micobacterias atípicas, incluyendo las causadas por Mycobacterium haemophilum, en relación, sobre todo, con la pandemia producida por el VIH y el número creciente de pacientes sometidos a terapias inmunosupresoras.
M. haemophilum es un bacilo ácido-alcohol resistente no cromógeno de crecimiento lento, aerobio, descubierto por vez primera en el año 1978 por Sompolinsky et al3,4 en una mujer israelí de 51 años con enfermedad de Hodgkin y úlceras cutáneas generalizadas. Los autores ya hacían referencia en dicho trabajo a la baja temperatura de incubación del bacilo, similar a la de M. marinum y M. ulcerans, y a la necesidad de añadir hierro para favorecer su crecimiento, lo que le distinguía de las otras micobacterias atípicas. Desde entonces, se han publicado menos de 150 casos de infección por M. haemophilum en la literatura médica1,5-7. Típicamente, es una micobacteriosis superficial del adulto inmunodeprimido que puede conducir a enfermedad sistémica potencialmente grave. Las manifestaciones clínicas más frecuentes son las lesiones cutáneas, con un espectro que va de la enfermedad localizada a la enfermedad sistémica con diseminación cutánea8. Las lesiones cutáneas suelen ser múltiples y existen numerosas formas de presentación, como pápulas eritematosas, placas, nódulos, abscesos necrosantes y úlceras crónicas que afectan generalmente a las extremidades y tienden a localizarse sobre las articulaciones, pero no es característica de esta micobacteria la distribución corporal de las lesiones en patrón esporotricoide1,2. También se han descrito lesiones purpúricas y anulares9. La evolución típica de las lesiones cutáneas es la progresión de pápulas a pústulas inicialmente asintomáticas, que desarrollan finalmente úlceras profundas muy dolorosas. Otras manifestaciones clínicas menos frecuentes incluyen bacteriemia, neumonía, linfangitis, artritis, tenosinovitis y osteomielitis10. Las formas cutáneas o articulares tienen un pronóstico más favorable que las que cursan con afectación pulmonar2.
Histológicamente no se observan diferencias entre las infecciones causadas por las diferentes especies de micobacterias atípicas11. El examen microscópico de las lesiones cutáneas muestra una dermatitis granulomatosa profunda, con o sin necrosis caseosa, que a menudo se delimita mal y compromete el panículo adiposo en los pacientes con sida. El tiempo de evolución influye notablemente en el patrón histopatológico, especialmente en el paciente inmunodeprimido. Las lesiones iniciales muestran un infiltrado inflamatorio predominantemente neutrofílico o mixto, que incluye granulocitos, linfocitos, monocitos, y ocasionalmente, células gigantes multinucleadas y macrófagos espumosos. Las lesiones más evolucionadas muestran una reacción inflamatoria granulomatosa. Es habitual la demostración de bacilos ácido-alcohol resistentes con tinciones específicas en el paciente inmunodeprimido12.
El diagnóstico microbiológico es difícil. En general, las biopsias son más rentables que las torundas o hisopos. En el examen directo de la muestra, M. haemophilum se tiñe de color rojo con la técnica de Ziehl-Neelsen, que detecta la presencia de bacilos ácido-alcohol resistentes, pero no permite la diferenciación de especies, por lo que siempre debe realizarse un cultivo5. Sus requerimientos nutritivos en los medios de cultivo la hacen diferente del resto de micobacterias atípicas. A diferencia de sus homólogas, M. haemophilum crece específicamente en medios de cultivo estándar para micobacterias, tanto sólidos como líquidos, enriquecidos con hierro1,2,13,14. En su defecto, los medios de cultivo con sangre fresca hemolizada constituyen una excelente alternativa de bajo coste15. Además, necesita una temperatura más baja, entre 30 y 32.º C, y un tiempo de incubación más prolongado que el resto de micobacterias atípicas para lograr un crecimiento óptimo. Es probable que M. haemophilum no se detecte suficientemente debido a sus requerimientos de crecimiento, ya que la metodología influye decisivamente en el aislamiento de esta nueva especie2,16. La identificación de los aislamientos obtenidos en los medios de cultivo se basa en las pruebas bioquímicas convencionales, las características de crecimiento, el análisis cromatográfico de los lípidos de membrana, y más recientemente, en el estudio genético molecular del ADN micobacteriano, que permite la identificación de un número cada vez mayor de las diferentes especies de micobacterias, y cuyos avances han facilitado enormemente el conocimiento de su espectro clínico y establecido el camino para detectarlas directamente en las muestras biológicas o a partir de cultivos en medios sólidos o líquidos, utilizando herramientas como la PCR5,15,17.
Tras el primer caso publicado en 19783,4 se han descrito posteriormente lesiones cutáneas causadas por M. haemophilum en pacientes sometidos a trasplante renal1,18-21, en trasplantados de médula ósea2,22,23 y de corazón24-26, así como en pacientes con linfoma2,18,27, artritis reumatoide28 y enfermedad de Crohn1.
El primer caso de infección por M. haemophilum en un paciente con sida se publicó en 1987; Males et al29 identificaron el bacilo en el líquido articular de un varón de 32 años que presentaba artritis séptica y lesiones cutáneas. Otros dos casos de infección cutánea diseminada en pacientes con sida fueron publicados un año después6. Hasta el año 2001 habían sido publicados 90 casos de infección por M. haemophilum en todo el mundo, la mayoría con manifestaciones cutáneas y de partes blandas2; 72 de ellos eran adultos que tenían en común la existencia de una inmunodepresión, ya fuera relacionada con el virus de la inmunodeficiencia humana o con situaciones de inmunosupresión terapéutica tras el trasplante de órganos2,21,23,29-31. Sin embargo, se han publicado varios casos de linfadenitis cervicofacial por M. haemophilum en niños inmunocompetentes1,13,32-34 con un cuadro clínico similar al producido por otras micobacterias (M. avium complex, M. tuberculosis y M. scrofulaceum) y casos anecdóticos en adultos sanos con lesiones cutáneas7,13.
Debido a la baja frecuencia de la enfermedad y a la difícil identificación de la micobacteria en el laboratorio, se desconoce el verdadero impacto epidemiológico de la infección por M. haemophilum1,31.
Parece probable que el reservorio del microorganismo, como sucede con otras micobacterias atípicas, se halle en el medio ambiente, pero se desconoce su hábitat natural y el mecanismo por el que infecta a los humanos. Una reciente observación haciendo referencia al agrupamiento de casos en ciudades situadas cerca de grandes extensiones de agua como lagos y océanos, no ha podido ser confirmada por la imposibilidad de recuperar el bacilo a partir de ecosistemas acuáticos31. La transmisión nosocomial interhumana también se ha sugerido como posible hipótesis epidemiológica, en relación con el brote de infecciones ocurrido en varios hospitales del área metropolitana de la ciudad de Nueva York entre 1989 y 1991, pero con la salvedad de la inmunodepresión no se han encontrado elementos epidemiológicos comunes entre los casos1,22,23,31,35. Ninguna de las pocas series publicadas ha sido capaz de asociar una exposición específica al desarrollo de la infección1,2,30,31.
M. haemophilum tiene un patrón de sensibilidad antimicrobiana muy diferente al del resto de micobacterias atípicas. Los métodos utilizados en los estudios de sensibilidad varían en los diferentes trabajos publicados, y se carece de protocolos de antibioterapia establecidos para tratar a los enfermos inmunodeprimidos infectados13,22,29,30,33,36. M. haemophilum es resistente a los antituberculosos de primera línea (isoniazida, pirazinamida y etambutol), y la sensibilidad a rifampicina es sólo del 56 %10.
Sin embargo, es sensible a otros antibióticos que se usan para tratar otras infecciones por micobacterias atípicas, como el ciprofloxacino, la claritromicina y la rifabutina1,2,30,31. Ocasionalmente muestra sensibilidad a tetraciclinas y cotrimoxazol1. Según una serie estudiada por Bernard et al36, con 17 aislamientos obtenidos de 12 pacientes inmunodeprimidos, los antibióticos más activos contra M. haemophilum fueron las rifamicinas, los macrólidos, las quinolonas, la clofazimina y la amikacina. En dicho trabajo se objetivó el desarrollo de resistencias a las rifamicinas durante el tratamiento en dos pacientes con enfermedad progresiva o recidivante. También se ha descrito de forma esporádica la falta de correlación entre las sensibilidades obtenidas in vitro y la respuesta clínica al tratamiento37.
Aunque actualmente no existen estudios de sensibilidad protocolizados para determinar las concentraciones mínimas inhibitorias de los agentes antimicrobianos con actividad frente a M. haemophilum, la experiencia clínica sugiere que la terapia antibiótica combinada con claritromicina, ciprofloxacino y rifampicina o rifabutina es un tratamiento empírico razonablemente pertinente2,28. En los pacientes más graves, incluyendo aquellos que presentan enfermedad pulmonar, se recomienda añadir amikacina y quizás también doxiciclina o minociclina2. Incluso con estos antibióticos, la respuesta clínica al tratamiento es variable y suele ser necesario un tratamiento de mantenimiento prolongado con varios fármacos durante meses o años, especialmente en aquellos enfermos con inmunodepresión mantenida10.
Dado que la micobacteria no es habitualmente patógena en los individuos inmunocompetentes, el tratamiento más eficaz parece ser en algunos casos la recuperación inmunológica del huésped cuando la inmunodepresión es potencialmente reversible38.
Presentamos un caso de infección cutánea esporotricoide por M. haemophilum en un paciente inmunodeprimido.
En la bibliografía revisada no hemos encontrado ningún caso de linfangitis nodular esporotricoide causada por M. haemophilum. Si bien es cierto que esta forma clínica de presentación está bien documentada en algunas infecciones causadas por otras micobacterias atípicas como M. marinum39, M. chelonae40 y M. kansasii41, su asociación a M. haemophilum es absolutamente excepcional.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.
Correspondencia:
Daniel Cameselle Martínez.
Servicio de Dermatología. Hospital Universitario Insular de Gran Canaria.
Avda. Marítima del Sur, s/n. 35016 Las Palmas de Gran Canaria. España.
dani.camel@hotmail.com
Aceptado el 15 de septiembre de 2006.