El lentigo maligno (LM) es una variante de melanoma in situ que se desarrolla principalmente en áreas cutáneas de exposición crónica en pacientes de edad avanzada1. Representa el 79-83% de todos los melanomas in situ y, en contraposición con las demás variantes de melanoma in situ, tiene una evolución muy prolongada, de hasta varias décadas, antes de evolucionar a su forma invasiva, el melanoma sobre lentigo maligno (LMM)1–3.
En nuestro medio el grupo de melanomas que incluye el LM y su variante invasiva, el LMM, probablemente debido a la economía agrícola de antaño, constituye un 15% de los casos4. No muestra predilección por ningún sexo y aproximadamente un 50% son LM. Se puede estimar una incidencia de cerca de 0,5 casos por cada 100.000 habitantes al año. El 86% de los LM/ LMM se localizan en la cabeza o en el cuello y se diagnostican a una edad mediana de 70 años4.
Clínicamente el LM es una mácula que suele tener varios tonos de marrón distribuidos asimétricamente, de bordes irregulares y mal definidos que crece muy lentamente.
Desde el punto de vista histológico se trata de un tumor compuesto por una proliferación de melanocitos atípicos, distribuidos de forma individual a lo largo de la unión dermo-epidérmica en una epidermis atrófica. Es característico que los melanocitos tumorales se extiendan por el epitelio folicular. En la dermis se suele encontrar una elastosis solar marcada, así como un infiltrado linfocitario de intensidad variable1.
El tratamiento de elección del LM es la cirugía2. En la actualidad se recomienda extirpar los melanomas in situ con un margen de seguridad de 0,5cm. Sin embargo, con este margen es frecuente la afectación de los márgenes, lo que conlleva la realización de intervenciones quirúrgicas adicionales3. Por esa razón se recomienda realizar una evaluación detallada y referenciada de todos los márgenes quirúrgicos por lo que, para muchos autores, la cirugía de Mohs modificada (con evaluación diferida de los márgenes en muestras procesadas en parafina) es la técnica quirúrgica de elección3,5.
Los LM se presentan habitualmente en pacientes de avanzada edad, en ocasiones con múltiples patologías concomitantes que pueden dificultar o incluso contraindicar la cirugía, y en la cara, por lo que también se han de tener presentes consideraciones estéticas o funcionales. Como alternativas terapéuticas se han propuesto diversas opciones no quirúrgicas, como son la radioterapia, la crioterapia o el imiquimod2,6,7.
Para la elección del tratamiento más adecuado del LM, además de la dificultad que existe para establecer los límites reales en el LM, deben ser tenidos en cuenta una serie de hechos importantes. El primero de ellos es que el LM evoluciona a un LMM en un 5-50% de los casos, porcentajes tan variables porque los estudios publicados hasta la fecha presentan datos con tiempos de seguimiento muy variados, y con sesgos de selección propios de series de origen hospitalario y no poblacional2,3. En cualquier caso, se trata de una lesión con un potencial demostrado para evolucionar a una forma invasiva. Sin embargo, no existe en la actualidad ningún dato clínico, histológico o biológico que permita predecir qué LM va a evolucionar a una forma invasora. Por otra parte, existe un dato especialmente relevante para la valoración del tratamiento más correcto, y es el hallazgo de un componente invasor en el estudio histológico realizado tras la exéresis completa de la lesión en el 22% de lesiones previamente diagnosticadas de LM mediante una biopsia incisional2.
El imiquimod es un modificador de la respuesta inmune que aplicado tópicamente consigue, mediante la estimulación de los receptores Toll-like 7 y 8, incrementar la respuesta inmune tanto innata como adquirida de manera eficiente para el tratamiento de tumores cutáneos y lesiones de origen vírico8. La respuesta innata se traduce en la maduración y la secreción de citoquinas por las células presentadoras de antígenos8. Además, mediado por la activación del factor nuclear-κB se aumenta la producción de citoquinas por las células T-cooperadoras de tipo 1, incluidos el factor de necrosis tumoral alfa, la interleucina 12, el interferón alfa y el interferón gamma. Como consecuencia se activan las células CD8 para constituirse en células T citotóxicas que destruyen células tumorales. Además, el imiquimod induce apoptosis en las células tumorales8. Su uso está aprobado por las autoridades sanitarias de nuestro país para el tratamiento de carcinomas basocelulares superficiales, queratosis actínicas múltiples y verrugas genitales externas.
El mecanismo de acción de imiquimod, la experiencia con la molécula en las indicaciones aprobadas, su eficacia y el excelente resultado estético, así como que se trate de una opción no quirúrgica, la convierten en una molécula especialmente atractiva para el tratamiento de muchas lesiones de tipo tumoral. Por estas razones, desde que imiquimod se encuentra en el mercado se ha utilizado con una respuesta clínica variable en indicaciones no aprobadas, entre las que se incluyen una gran cantidad de patologías tumorales.
Su uso en el LM fue inicialmente descrito en el año 2000 como una alternativa al tratamiento quirúrgico de una lesión en un paciente de edad avanzada y mal estado general que rehusó la cirugía9. El fármaco se administró durante 7 meses con una frecuencia de aplicación variable, modificada según el grado de inflamación local, entre una aplicación diaria tres veces por semana a dos aplicaciones diarias. Se realizó una biopsia al finalizar el tratamiento y el paciente fue seguido durante 9 meses sin recidiva clínica. Desde entonces se han descrito en la literatura un total de 234 pacientes con LM tratados con imiquimod en estudios no controlados, 161 de ellos revisados recientemente por Erikson et al2,10–16.
De la lectura detallada de estos trabajos se extraen una serie de aspectos relevantes. El primero de ellos es que existe una gran variabilidad en los protocolos terapéuticos y en la evaluación de la respuesta entre los trabajos que, además, varían desde la comunicación de casos aislados o de series de muy pocos pacientes hasta estudios abiertos de hasta 48 casos2,10–16. Por una parte, la pauta de aplicación varía desde tres veces por semana hasta diaria, y con una duración del tratamiento entre dos semanas y 7 meses. Por otra, el periodo de seguimiento de los pacientes tratados es corto, con una media inferior a 24 meses2.
El segundo aspecto es la evaluación de la respuesta del LM al tratamiento con imiquimod. En la revisión de Erikson et al se constató que la tasa de respuesta clínica con confirmación histológica era del 88%2. Sin embargo, esta tasa de respuesta es probablemente inferior debido a la manera en la que se evaluó la confirmación histológica de la curación clínica. En la mayoría de los trabajos se realizó mediante la obtención de una o dos biopsias en sacabocados de las áreas cutáneas donde previamente se tenía constancia clínica de la presencia de lesión. Por lo tanto, no se evaluó toda la zona tratada para hacer una adecuada estimación del valor predictivo positivo y negativo de la evaluación clínica de la respuesta. El único trabajo en el que la respuesta histológica fue evaluada mediante la extirpación completa de la lesión constató que sólo había curación completa en un 75% de los casos (30 casos en una serie de 40 pacientes) con un valor predictivo negativo del 91% (30 casos presentaron confirmación histológica de los 33 casos que tenían curación clínica)17. Además, hay que tener presente que incluso en este trabajo no se estudió toda la pieza, sino que tras extirpar la zona donde estaba la lesión inicial mediante cirugía de Mohs se hizo un análisis convencional del área central que, como es bien sabido, evalúa sólo un 5% del material, por lo que tanto la tasa de respuesta como el valor predictivo negativo aún podrían ser inferiores. Además, en uno de los tres casos en los que clínicamente no había lesión y se constató la presencia histológica de LM había componente invasor17.
Finalmente, existen tres casos en la literatura en los que se describe la evolución del LM a LMM durante el tratamiento con imiquimod o inmediatamente después de no haber obtenido una respuesta clínica12,15. En uno de los casos la lesión alcanzó un espesor tumoral de 3,3mm y desarrolló satelitosis. Existe la posibilidad teórica de que imiquimod haya sido el factor inductor de la capacidad invasiva del melanoma. Se sabe que imiquimod aumenta la producción de factor de necrosis tumoral alfa, que a su vez estimula la producción de metaloproteinasa 9, un factor implicado en la capacidad invasiva de los melanomas. En cualquier caso, existe un riesgo demostrado de tratar lesiones diagnosticadas de LM con un componente invasivo “clínicamente oculto” e, hipotéticamente, favorecer la progresión del mismo por el uso del imiquimod2.
Conviene hacer una reflexión crítica desde otro punto de vista. A día de hoy, 10 años después del primer caso descrito, llama la atención que imiquimod siga siendo objeto de un uso no controlado para el tratamiento del LM y de un goteo continuo de publicaciones que incluyen casos aislados o series cortas, sin tener una evidencia científica definitiva de la seguridad y de la eficacia real, tal y como se ha discutido anteriormente. En contraposición, en la comunidad dermatológica todavía se encuentran ciertas reticencias al uso del imiquimod en indicaciones aprobadas por la Agencia Española del Medicamento. Cabe recordar que para que un fármaco obtenga esta aprobación debe haber seguido un largo y riguroso proceso de evaluación en el que se precisan ensayos clínicos controlados que demuestren fehacientemente su eficacia y seguridad, como así ocurrió para el tratamiento del carcinoma basocelular superficial o las queratosis actínicas. Por lo tanto, el uso de imiquimod para el LM reclama una evaluación más rigurosa antes de considerarlo como una opción terapéutica más. Aunque algunos estudios han utilizado la dermatoscopia como técnica de seguimiento para los casos tratados con imiquimod, y como complemento para la valoración clínica de la respuesta, las evidencias científicas de su valor no han sido todavía probadas adecuadamente18–20. Es más prometedor el uso de la microscopía confocal que quizás permita realizar estudios más fiables en cuanto a la valoración de la respuesta, así como de la inclusión de casos en los que se haya descartado sin ninguna duda la presencia de invasión21.
Por último, no se debe olvidar que existe la radioterapia como una alternativa terapéutica válida para el tratamiento de LM que no puedan ser tratados quirúrgicamente. Se han comunicado tasas de curación que varían desde un 86 a un 95%2,6,22. El estudio que evaluó más pacientes incluyó 96 con LM y 54 con LMM22. La respuesta fue completa en todos los casos y se constató recidiva de la lesión en 5/96 LM y en 2/54 LMM tras un seguimiento de al menos dos años. En otro estudio de 64 pacientes que trataba LM y LMM (previa exéresis del nódulo invasor) no hubo recidivas tras dos años de seguimiento22. Por otra parte, desde el punto de vista de la comodidad del paciente, el régimen de radioterapia recomendado incluye la administración de 100Gy en 10 sesiones (5 sesiones semanales durante dos semanas), por lo que las molestias, pese a la radiodermitis aguda, son mucho más cortas que las descritas en cualquiera de los regímenes evaluados para imiquimod6. Además, se ha demostrado que la radioterapia es eficaz para el tratamiento del componente invasor, por lo que sería adecuado para dar cobertura al 22% de los casos de LM que realmente tienen tal invasión2,22.
La crioterapia también se ha utilizado como alternativa a la cirugía en los casos en los que pueda estar contraindicada. Aunque las tasas de recaída (6,6-8,3%) son similares a las que se obtienen con la radioterapia, la posibilidad de tratar un melanoma invasor con crioterapia sin saberlo, y la descripción de algún caso con evolución a melanoma invasor tras tratar un LM con crioterapia, no aconsejan su uso salvo en situaciones excepcionales en las que no existan otras alternativas posibles23,24.
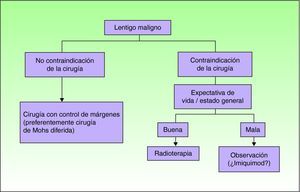
En la figura 1 se expone el algoritmo terapéutico propuesto para el tratamiento del LM. Tal y como se puede observar imiquimod no está excluido como opción, pero queda relegado a situaciones muy seleccionadas e individualizadas (cabe recordar que en las directrices británicas sólo se recomienda darlo en ensayos clínicos25) en las que haya habido una adecuada información al paciente o la familia de las evidencias científicas de su uso en el paciente y, en la medida de lo posible, previa discusión del caso en un comité de tumores. La posibilidad de tomar una actitud conservadora con un seguimiento clínico adecuado no debería descartarse para algunos de estos casos, y se considera en la literatura por algunos grupos de expertos como una actitud válida.
Como conclusión, la cirugía es el tratamiento de elección del LM, en particular con control exhaustivo de los márgenes, como ocurre con la cirugía de Mohs modificada. En la actualidad imiquimod no debe ser considerado como un tratamiento de primera línea para los casos en los que la cirugía no pueda ser realizada. Su uso debe restringirse a aquellos casos en los que no se puedan administrar otros tratamientos alternativos tales como la radioterapia, al menos hasta que no exista una mejoría en los métodos clínicos de valoración que permitan seleccionar verdaderos LM sin invasión “oculta”, como podría ocurrir con la microscopía confocal y, sobre todo, una mayor evidencia científica de su eficacia y seguridad.