En este trabajo describimos las características histopatológicas de las infecciones víricas cutáneas. El herpes simple y el virus varicela-zóster producen una vesícula intraepidérmica con grados variables de necrosis epitelial. Son característicos los queratinocitos con núcleos balonizados con aspecto de vidrio esmerilado y los queratinocitos gigantes multinucleados. El citomegalovirus produce grandes inclusiones nucleares eosinófilas rodeadas de un halo claro en los endotelios de los vasos dérmicos. El herpes virus tipo 8 se relaciona etiológicamente con el sarcoma de Kaposi, que en sus fases iniciales muestra luces vasculares de endotelios finos disecando los haces de colágeno dérmicos. En las fases en placa y nodular las luces vasculares son más visibles, aumenta progresivamente el número de células fusiformes tumorales con discreto grado de atipia y pleomorfismo y algunas mitosis. El infiltrado se compone de linfocitos y células plasmáticas. El orf y el nódulo de los ordeñadores inducen una epidermis acantósica con queratinocitos balonizados que contienen inclusiones víricas citoplasmáticas eosinófilas. El molusco contagioso muestra lóbulos de epitelio abiertos a la superficie epidérmica con característicos cuerpos de inclusión. En las verrugas vulgares aparece acantosis, papilomatosis e hiperqueratosis, con confluencia de las crestas epidérmicas hacia el centro de la lesión y coilocitos.
We describe the histopathological characteristics of viral skin infections. Herpes simplex virus and varicella-zoster virus produce an intraepidermal vesicle with variable degrees of epithelial necrosis. Typical findings include keratinocytes with ballooned nuclei with a ground-glass appearance and giant multinucleated keratinocytes. In the endothelial cells of the dermal blood vessels, cytomegalovirus produces large eosinophilic nuclear inclusions surrounded by a clear halo. Human herpes virus 8 is etiologically associated with Kaposi sarcoma. In its early stages, this tumor contains blood vessels with a fine endothelium passing through the dermal collagen bundles. In the plaque and nodular stages, the vessel lumens are more clearly visible and there is a progressive increase in the number of neoplastic spindle cells with a low degree of pleomorphism and atypia, and occasional mitoses. The infiltrate is made up of lymphocytes and plasma cells. Contagious ecthyma and milker's nodule give rise to an acanthotic epidermis with ballooned keratinocytes containing eosinophilic cytoplasmic viral inclusions. Molluscum contagiosum shows lobules of epithelium that open onto the epidermal surface and characteristic inclusion bodies. Acanthosis, papillomatosis, and hyperkeratosis are observed in common warts, with confluence of the epidermal ridges in the centre of the lesion and koilocytes.
En la tabla 1 se enumeran las infecciones víricas cutáneas más frecuentes, cuya histopatología se revisará en el presente trabajo.
Infecciones víricas cutáneas más frecuentes
| Herpes virus |
| Herpes simple 1 y 2 |
| Varicela y herpes zóster |
| Erupción variceliforme de Kaposi |
| Citomegalovirus |
| Virus de Epstein-Barr |
| Herpes virus humano tipo 6 |
| Herpes virus humano tipo 7 |
| Herpes virus humano tipo 8 |
| Parapoxvirux |
| Orf |
| Nódulo de los ordeñadores |
| Molusco contagioso |
| Papilomavirus |
| Verrugas |
| Hiperplasia epitelial focal de Heck |
| Papulosis bowenoide |
| Epidermodisplasia verruciforme |
| Parvovirus |
| Eritema infeccioso |
| Síndrome de púrpura en guantes y calcetines |
| Coxackie |
| Enfermedad mano-pie-boca |
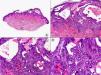
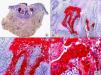
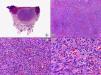
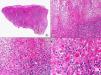
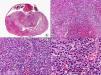
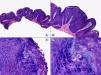
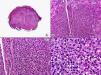
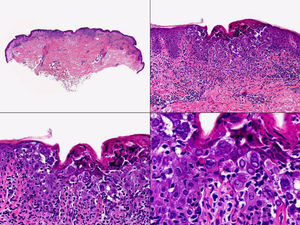
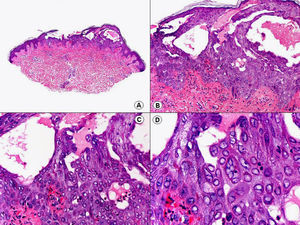
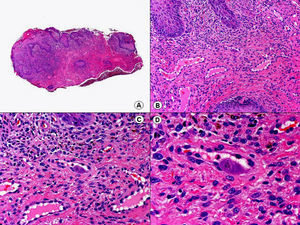
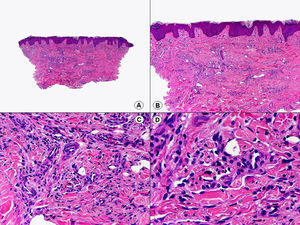
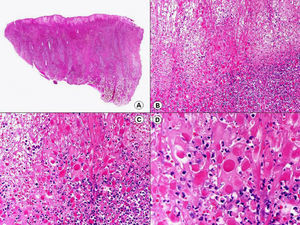
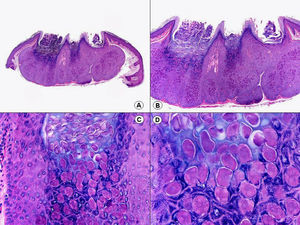
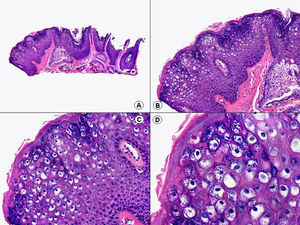
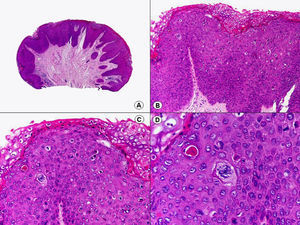
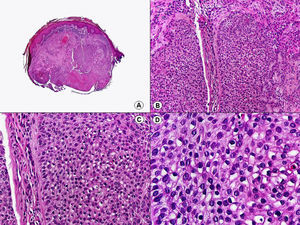
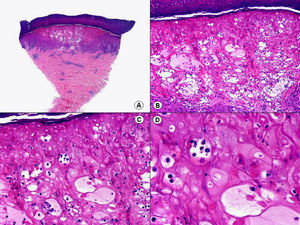
Los hallazgos histopatológicos en las biopsias cutáneas de vesículas completamente desarrolladas de herpes simple labial (fig. 1), herpes genital (fig. 2) y varicela (fig. 3) consisten en una ampolla intraepidérmica, con grados variables de necrosis epitelial. Las alteraciones más características se observan en los núcleos de los queratinocitos epidérmicos, y consisten en una marginación periférica de la cromatina, que aparece pegada a la membrana nuclear, y el resultado son queratinocitos de núcleo balonizado, en anillo y con aspecto de vidrio esmerilado. En el citoplasma de estos queratinocitos, la anomalía más precoz es la presencia de vacuolización. Inicialmente estas alteraciones se observan de manera focal a lo largo de la hilera basal de la epidermis, pero pronto se extienden a las capas altas, afectando a todo el espesor de la epidermis1. El mecanismo de formación de estas vesículas intraepidérmicas es doble, ya que intervienen tanto la balonización de los queratinocitos como la degeneración reticular de la epidermis. La balonización de los queratinocitos es una anomalía citológica característica de las infecciones víricas y las células afectadas aparecen hinchadas y separadas de las células vecinas por la pérdida de sus puentes intercelulares. Este tipo de acantólisis se ha denominado acantólisis secundaria para diferenciarla de la acantólisis primaria, que aparece en enfermedades autoinmunes por anticuerpos antidesmosomas como el pénfigo y sus variantes. El citoplasma de las células balonizadas muestra una coloración eosinófila homogénea y es frecuente la presencia de células gigantes multinucleadas, que muestran las mismas anomalías nucleares anteriormente citadas y que son las que se observan en las muestras obtenidas por raspado para el citodiagnóstico de Tzanck.
Histopatología de un herpes simple labial que muestra una ampolla intraepidérmica, con grados variables de necrosis epitelial. Las alteraciones más características se observan en los núcleos de los queratinocitos epidérmicos, que muestran una marginación periférica de la cromatina, que aparece pegada a la membrana nuclear y el resultado son queratinocitos de núcleo balonizado, en anillo y con aspecto de vidrio esmerilado. En el citoplasma de estos queratinocitos, la anomalía más precoz es la presencia de vacuolización. (Hematoxilina-eosina, A x10, B x40, C x200, D x400).
La degeneración reticular es el resultado de la hinchazón o degeneración hidrópica progresiva de los queratinocitos epidérmicos, que aparecen grandes y claros, con solo algunos restos del citoplasma en la periferia de las células. A medida que esta hinchazón progresa, las células se van rompiendo, lo que contribuye a la formación de la vesícula intraepidérmica. A diferencia de la balonización, la degeneración reticular no es exclusiva de las infecciones víricas, ya que puede observarse también en las lesiones de dermatitis de contacto aguda. En general, la balonización de los queratinocitos es más evidente en los queratinocitos de la base de la vesícula, mientras que la degeneración reticular se observa con mayor intensidad en las áreas superficiales de la vesícula, así como en sus márgenes laterales.
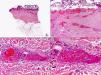
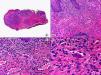
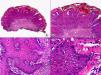
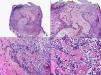
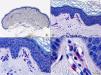
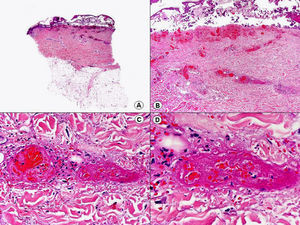
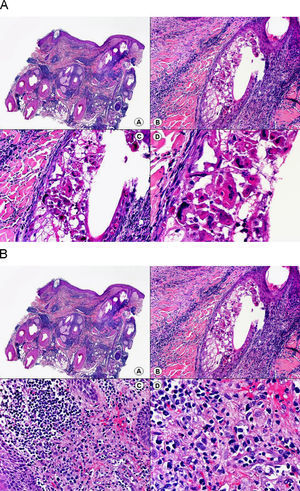
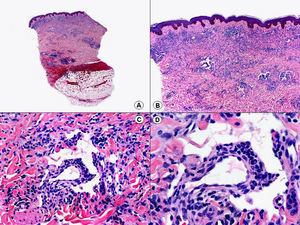
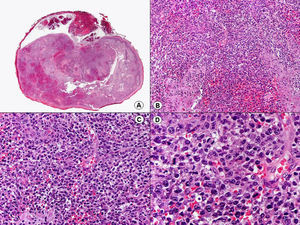
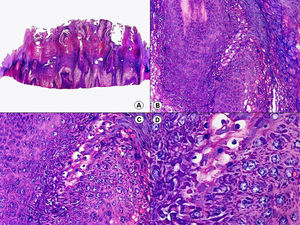
En las biopsias de las lesiones herpéticas es más fácil observar las inclusiones intranucleares eosinófilas que en las células obtenidas por raspado para el citodiagnóstico de Tzanck. Estas inclusiones son más evidentes en los núcleos de las células gigantes multinucleadas, sobre todo en las lesiones que ya tienen algunos días de evolución. Además de las células sueltas, con las características anomalías citopáticas en sus núcleos, en el interior de una vesícula herpética se suelen observar también neutrófilos y fibrina. Tanto en el herpes simple, como en la varicela y el herpes zóster, se han descrito hallazgos de vasculitis leucocitoclástica en la dermis superficial subyacente a las vesículas2,3 (fig. 4). En general, la inflamación dérmica acompañante es más marcada en el herpes simple que en el herpes zóster, y no es raro encontrar linfocitos atípicos en el infiltrado de un herpes simple4. En un estudio histopatológico reciente, se ha descrito que en algunos casos las infecciones cutáneas por virus herpes, tanto de virus herpes simple (VHS) como de virus varicela-zóster (VVZ), se puede observar un intenso infiltrado linfocitario simulando un linfoma cutáneo5 (figs. 5 A y B). El estudio inmunohistoquímico de este infiltrado demostró que estaba constituido predominantemente por linfocitos T, con un número variable de células que expresan CD30 y CD56, y en dos de estos casos se demostró por reacción en cadena de la polimerasa (PCR) la existencia de poblaciones monoclonales de linfocitos T, lo que aumenta la dificultad del diagnóstico diferencial histopatológico con un verdadero linfoma.
Histopatología de un seudolinfoma desarrollado sobre una lesión de un herpes zóster. A) El epitelio del folículo piloso y la glándula sebácea muestran los cambios citopáticos típicos de infección herpética. B) Abundan los linfocitos atípicos y las figuras de mitosis en el infiltrado alrededor de la lesión. (Hematoxilina-eosina, A x10, B x40, C x200, D x400).
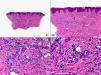
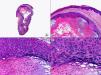
No es raro que en las lesiones de herpes zóster se produzca afectación del epitelio de la unidad folículo-sebácea y recientemente se ha propuesto que la afectación exclusiva de la unidad folículo-sebácea, con hallazgos citopáticos sutiles pero característicos confinados únicamente al epitelio del folículo piloso y la glándula sebácea y sin participación epidérmica, constituye un hallazgo característico y específico de un herpes zóster inicial6 (fig. 6). Estos hallazgos histopatológicos sutiles constituyen el denominado herpes incógnito o foliculitis herpética7 y se producen antes de que se desarrollen las lesiones vesiculosas. Las células epiteliales de la vaina radicular externa y los sebocitos muestran balonización, núcleo en vidrio esmerilado, multinucleación o momificación como resultado remanente de la necrosis de los mismos secundaria a la infección por VVZ. Desde el punto de vista clínico estas lesiones consisten en pápulas eritematosas y dolorosas, sin evidencia de vesiculación, y sólo unos días después se desarrolla la erupción vesiculosa típica del herpes zóster. Más rara es la afectación del epitelio ecrino, tanto de la porción secretora, como del conducto excretor dérmico o intraepidérmico8. A veces, las lesiones herpéticas del epitelio anexial no muestran hallazgos citológicos característicos en algunos de los cortes, y solo mediante la realización de cortes seriados se consigue demostrar la presencia de células gigantes multinucleadas con núcleo en vidrio esmerilado en el epitelio anexial. También se han descrito infecciones herpéticas por VVZ en las que estudios inmunohistoquímicos han demostrado la presencia de antígeno viral en las fibras nerviosas de la dermis subyacentes a la vesícula herpética9,10.
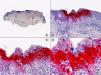
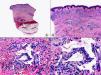
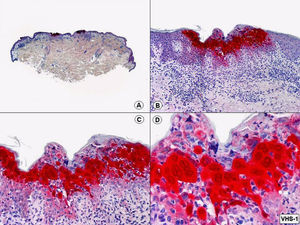
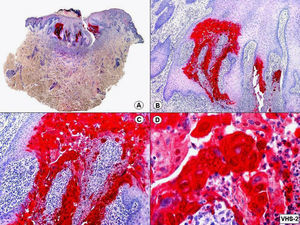
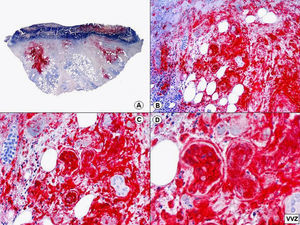
El diagnóstico diferencial histopatológico entre infecciones por VHS y VVZ puede establecerse mediante inmunohistoquímica. En la actualidad disponemos de anticuerpos monoclonales comercializados que van dirigidos específicamente contra antígenos del VHS1 (fig. 7), VHS2 (fig. 8) y VVZ (fig. 9)11,12. Estos estudios inmunohistoquímicos demuestran una tinción difusa de los núcleos de las células infectadas, con una mayor intensidad de la periferia de los núcleos, coincidiendo con las células que muestran marginación periférica de su cromatina. Pero además, estos estudios han demostrado que los antígenos de estos virus están presentes no solo en la epidermis, sino también (más frecuentemente en infecciones por VVZ) en el epitelio del folículo piloso y la glándula sebácea, y en menor proporción en nervios y estructuras de la dermis, mientras que los antígenos del VHS se localizan preferentemente en los queratinocitos de la epidermis, afectando sólo en raras ocasiones la porción más superficial del infundíbulo folicular y nunca la glándula sebácea ni los nervios de la dermis. Basándose en estos estudios inmunohistoquímicos y mediante la demostración de antígenos virales en las distintas estructuras cutáneas, se ha podido establecer que la secuencia de la reactivación de un herpes zóster es la siguiente: en fases iniciales y desde un ganglio raquídeo dorsal, el VVZ viaja a los nervios sensitivos de la dermis y a los dendrocitos perineurales (un hallazgo que no se observa en las lesiones de varicela) y a través de estos nervios sensitivos el virus alcanza las unidades folículo-sebáceas, que están ricamente inervadas y constituyen la primera estructura epitelial infectada. Desde esta localización folículo-sebácea la infección se extiende secundariamente a los queratinocitos de la epidermis. En otras palabras, la afectación folículo-sebácea constituye un hallazgo histopatológico de lesiones eritematosas incipientes, mientras que la afectación epidérmica con vesiculación se observa ya en lesiones completamente desarrolladas. Dentro del folículo piloso infectado por VVZ, los hallazgos citopáticos más llamativos se observan en los queratinocitos de la vaina radicular externa del istmo y en su conexión con la glándula sebácea, y son mucho menos llamativos en el epitelio del infundíbulo y del segmento inferior. Parece ser que esto es debido a que el VVZ muestra predilección por migrar a través de fibras nerviosas sensitivas mielinizadas que inervan el istmo folicular y no tiene apetencia por fibras nerviosas sensitivas no mielinizadas que inervan la epidermis6.
Inmunotinción para virus herpes simple (VHS)-1 de la lesión mostrada en la figura 1. (Inmunohistoquímica para VHS-1, A x10, B x40, C x200, D x400).
Inmunotinción para virus herpes simple (VHS)-2 de la lesión mostrada en la figura 2. (Inmunohistoquímica para VHS-2, A x10, B x40, C x200, D x400).
Finalmente, se ha descrito una larga serie de procesos cutáneos que se han desarrollado sobre cicatrices de herpes zóster13–51 (tabla 2). Estas lesiones que se desarrollan sobre las cicatrices de un herpes zóster pueden aparecer inmediatamente después de que el proceso vesiculoso se resuelva o bastante tiempo después. La patogenia es desconocida, y se han propuesto mecanismos de hipersensibilidad tipo II o IV y un fenómeno de Koebner como posibles factores desencadenantes. Se han obtenido resultados variables en las investigaciones encaminadas a tratar de demostrar la presencia de material genético del VVZ en estas lesiones desarrolladas sobre cicatrices de herpes zóster. Probablemente esta disparidad de resultados guarda relación con el intervalo de tiempo entre el episodio agudo y el desarrollo de lesiones secundarias sobre las cicatrices, y es más probable obtener resultados positivos en lesiones recientes que en lesiones de largo tiempo de evolución.
Lesiones que se han desarrollado sobre cicatrices cutáneas de herpes zóster
| Comedones13 |
| Xantomas14 |
| Granuloma anular15–28 |
| Granuloma sarcoideo16,29 |
| Granuloma tuberculoide30 |
| Vasculitis granulomatosa16,31 |
| Dermatitis granulomatosa inclasificable16 |
| Tiña32 |
| Erupción acneiforme33 |
| Forunculosis34 |
| Dermatitis de contacto34 |
| Degeneración elastótica nodular35 |
| Seudolinfoma16 |
| Psoriasis36 |
| Liquen plano16,37,38 |
| Morfea39,40 |
| Reacción injerto contra huésped liquenoide41 |
| Dermatosis eosinofílica42 |
| Colagenosis perforante reactiva43,44 |
| Linfoma45 |
| Leucemia46 |
| Sarcoma de Kaposi47 |
| Angiosarcoma48 |
| Carcinoma basocelular49 |
| Carcinoma espinocelular49 |
| Metástasis cutáneas de carcinoma visceral50 |
| Liquen escleroso y atrófico16 |
| Enfermedad de Rosai-Dorfman16 |
| Foliculitis granulomatosa16 |
| Urticaria crónica localizada51 |
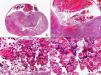
Los hallazgos más característicos de la infección por citomegalovirus (CMV) se observan en las células endoteliales de los vasos de la dermis, ya que el núcleo de estas células muestra grandes inclusiones nucleares eosinófilas rodeadas de un halo claro52 (fig. 10). Es frecuente también observar infiltración neutrofílica de las paredes de los vasos afectados, aunque no es habitual que exista una vasculitis leucocitoclástica incuestionable53. También se han descrito, aunque más raras que en las células endoteliales, las inclusiones intranucleares características de la infección por CMV en los fibroblastos y macrófagos, así como en el epitelio de los conductos ecrinos54. En las infecciones congénitas por CMV puede observarse hematopoyesis extramedular en la piel55.
La presencia de CMV en las lesiones cutáneas puede confirmarse por técnicas inmunohistoquímicas56,57 o de PCR58.
Histopatología de las infecciones cutáneas por el virus de Epstein-BarrEl virus de Epstein-Barr (VEB) es un virus gamma-herpes virus (HHV-4) que produce la mononucleosis infecciosa, la leucoplasia vellosa en pacientes con sida, diversos procesos linfoproliferativos y el carcinoma linfoepitelial nasofaríngeo. Desde el punto de vista dermatológico, también es frecuente observar una erupción máculo-papulosa en pacientes con mononucleosis infecciosa tratados con ampicilina debida a anticuerpos de tipo IgG o IgM contra penicilina y no a anticuerpos anti IgE, como sucede en la reacción de hipersensibilidad a penicilina. Desde el punto de vista histopatológico, los hallazgos en esta erupción cutánea son inespecíficos, observándose espongiosis epidérmica y un infiltrado linfohistiocitario perivascular superficial.
Respecto a la leucoplasia vellosa de los bordes laterales de la lengua, se observa acantosis con paraqueratosis, queratinocitos grandes y pálidos, especialmente en los estratos superficiales del epitelio, y distintos tipos de inclusiones intranucleares.
Histopatología de las infecciones cutáneas por virus herpes 6 y herpes 7Estos virus son virus gamma-herpes. El virus herpes 6 (HHV-6) produce el exantema súbito, también denominado roseola infantum o sexta enfermedad, mientras que el virus herpes 7 (HHV-7) se ha relacionado con una reactivación de exantema súbito por HHV-6 y con algunos casos de pitiriasis rosada de Gibert.
Desde el punto de vista histopatológico, los hallazgos de estas erupciones cutáneas son inespecíficos, observándose espongiosis epidérmica, a veces discreta degeneración vacuolar de la hilera basal de la epidermis y un infiltrado linfocitario perivascular superficial, como en otros exantemas víricos.
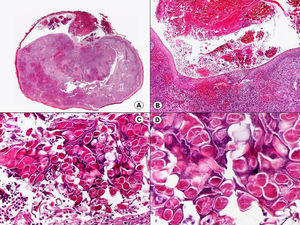
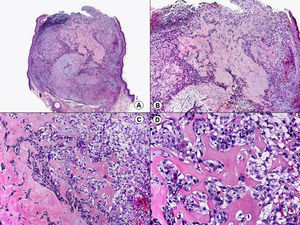
Histopatología del sarcoma de KaposiEn la actualidad está demostrado que el virus herpes tipo 8 (HHV-8) está etiológicamente relacionado con todas las variantes epidemiológicas de sarcoma de Kaposi59–61.
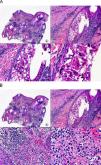
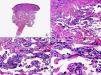
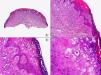
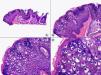
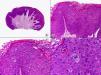
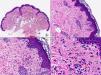
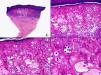
Las lesiones iniciales o en parche de sarcoma de Kaposi se caracterizan por mostrar hallazgos histopatológicos poco llamativos, que pueden confundirse con los de un proceso inflamatorio62. A pequeño aumento, estas lesiones muestran un discreto infiltrado inflamatorio superficial y profundo de células mononucleares dispuestas perivascularmente, y un incremento de espacios vasculares de morfología irregular y luz estrecha en forma de grieta y tapizados por células endoteliales aplanadas que aparecen salpicados por todo el espesor de la dermis (fig. 11). Estos espacios vasculares irregulares y de pared fina tienden a disponerse rodeando las estructuras vasculares, nerviosas y anexiales preexistentes en la dermis, y cuando disecan alrededor de los capilares preexistentes determinan la formación del denominado «signo del promontorio»63 (fig. 12). El infiltrado inflamatorio que salpica la lesión está constituido predominantemente por linfocitos y células plasmáticas, y estas últimas constituyen un hallazgo que debe hacer sospechar sarcoma de Kaposi en toda lesión vascular incipiente constituida por vasos irregulares de pared fina63. En casos raros, los vasos neoformados pueden agruparse en lóbulos y entonces la lesión recuerda a un pequeño hemangioma. Otro hallazgo característico de las lesiones iniciales de sarcoma de Kaposi lo constituye la presencia de células endoteliales necróticas salpicadas, que pueden observarse tanto con microscopio óptico64 como con el microscopio electrónico65. Con frecuencia se observan también abundantes hemosiderófagos salpicados por el estroma de la lesión. Estos hallazgos histopatológicos que caracterizan las lesiones iniciales del sarcoma de Kaposi se han descrito también en áreas de piel aparentemente normal de pacientes con sarcoma de Kaposi en otra localización, lo que apoya la idea de que el sarcoma de Kaposi es un proceso generalizado y difuso desde su comienzo66,67.
Las lesiones en placa tienden a afectar todo el espesor de la dermis y con frecuencia se extienden a las áreas superficiales del tejido celular subcutáneo. En este estadio se observa un incremento de células fusiformes dispuestas en fascículos entre los haces de colágeno de la dermis y alrededor de espacios vasculares neoformados. Estas células fusiformes delimitan también espacios vasculares irregulares con morfología de grieta o pequeñas luces que contienen un único hematíe en su interior. Habitualmente no se observa atipia citológica y el número de mitosis es muy escaso.
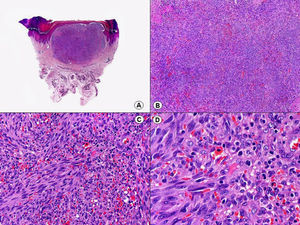
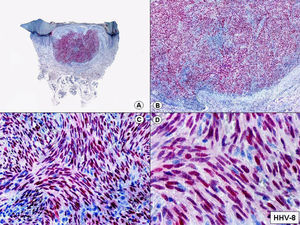
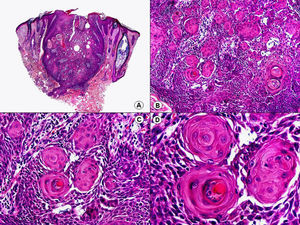
Cuando el número de células fusiformes se incrementa, las lesiones de sarcoma de Kaposi se transforman en nódulos. Entonces las células fusiformes aparecen agrupadas en fascículos interconectados con hematíes salpicados en los intersticios intercelulares (fig. 13). En estos nódulos el grado de pleomorfismo y atipia citológica es mayor y ya pueden observarse algunas figuras de mitosis, aunque no suelen ser muy numerosas. Sin embargo, en algunos casos raros, y especialmente en la variante africana del proceso, pueden observarse lesiones constituidas por células fusiformes muy atípicas y con numerosas figuras de mitosis. Un hallazgo histopatológico bastante característico, aunque no absolutamente específico de las lesiones de sarcoma de Kaposi, consiste en la presencia de los denominados glóbulos hialinos que, aunque son más frecuentes en lesiones en placa o en nódulos, pueden observarse en cualquier fase de la enfermedad. Estos glóbulos hialinos son PAS positivos y diastasa resistentes y consisten en esferas eosinófilas que miden entre 1 – 10μm de diámetro, y que se localizan tanto intra como extracelularmente. Parece ser que estos glóbulos hialinos representan hematíes degenerados que han sido fagocitados y se encuentran incluidos en los fagolisosomas de las células neoplásicas68,69. De todas formas, estos glóbulos hialinos no deben considerarse como exclusivos del sarcoma de Kaposi, ya que se han descrito también en otras proliferaciones vasculares, incluyendo angiosarcomas, granulomas piógenos o tejido de granulación69.
En algunos casos raros, las lesiones cutáneas de sarcoma de Kaposi muestran una apariencia clínica ampollosa, y entonces los hallazgos histopatológicos recuerdan a los de un linfangioma, ya que la lesión aparece constituida por vasos irregulares de pared fina, tapizada por una hilera discontinua de células endoteliales aplanadas, y no se observan hematíes ni en el interior de las luces vasculares ni extravasados en el estroma70,71 (fig. 14). La ausencia de depósitos de hemosiderina y la escasez de células fusiformes son hallazgos que también contribuyen a la apariencia linfangiomatosa de estas lesiones. Este patrón linfangiomatoso puede observarse focalmente en lesiones por otro lado típicas de sarcoma de Kaposi; de hecho, nosotros hemos observado pacientes con sarcoma de Kaposi clásico en los que algunas lesiones mostraban un patrón linfangiomatoso, y otras lesiones del mismo paciente correspondían a lesiones típicas de sarcoma de Kaposi con numerosos hematíes extravasados y abundantes depósitos de hemosiderina. Se ha postulado que el linfedema crónico o el antecedente de radioterapia en la zona afectada pueden ser factores que favorezcan el desarrollo de lesiones de sarcoma de Kaposi con un patrón histopatológico que recuerda al de un linfangioma.
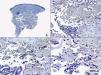
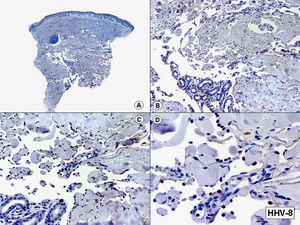
Desde el punto de vista histogenético, las evidencias en el momento actual indican que el sarcoma de Kaposi es una lesión que resulta de una proliferación de células endoteliales de naturaleza linfática, ya que se ha demostrado desde el punto de vista inmunohistoquímico que las células proliferantes expresan los nuevos marcadores linfáticos del receptor 3 del factor vascular de crecimiento endotelial (VEGFR-3), la podoplanina, el Lyve 1 y el Prox-172–75. Inmunohistoquímicamente también puede demostrarse la presencia de material genómico del HHV-8 en los núcleos de las células proliferantes en las lesiones de sarcoma de Kaposi en todas sus variantes epidemiológicas y desde las fases más iniciales del proceso76 (figs. 15 y 16).
Las infecciones cutáneas por parapoxvirus también muestran una histopatología característica.
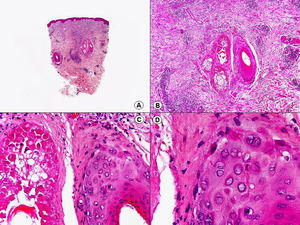
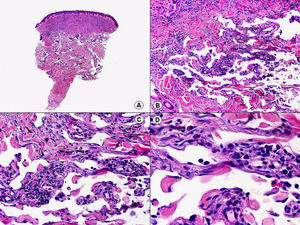
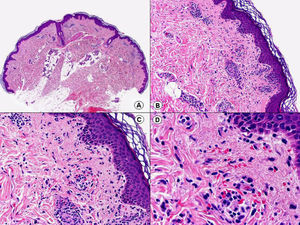
En el caso del orf se observa acantosis irregular con grandes queratinocitos de citoplasma amplio y pálido por balonización de las células, especialmente en las capas más superficiales de la dermis77 (fig. 17). Es frecuente observar inclusiones citoplasmáticas eosinófilas78 y a veces el daño epitelial es más intenso, observándose la denominada «degeneración espongiforme» de la epidermis y el epitelio de los folículos pilosos, que consiste en una intensa vacuolización de sus células epiteliales con gránulos eosinófilos de distintos tamaños78. En la dermis se observa una llamativa proliferación de vasos sanguíneos, que a veces es tan intensa que puede simular un hemangioma, y un infiltrado inflamatorio de linfocitos, eosinófilos, histiocitos y células plasmáticas79. A veces se observan también linfocitos atípicos CD30 positivos80, que no deberán confundirse con un linfoma anaplásico de células grandes CD30 positivo primario cutáneo.
El nódulo de los ordeñadores muestra una histopatología muy similar a la del orf, aunque en este caso es menos frecuente observar la afectación de todo el espesor de la epidermis como sucede en las lesiones del orf78,81 (fig. 18).
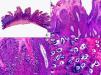
Las lesiones de molusco contagioso muestran lóbulos de epitelio abiertos a la superficie cutánea que penetran en la dermis82 (fig. 19). Es muy frecuente la afectación del epitelio de los infundíbulos foliculares y en estos casos las lesiones pueden mostrar una configuración quística82,83. En el citoplasma de muchos de los queratinocitos se observan los característicos cuerpos de inclusión, que aumentan de tamaño desde las capas basales a las más superficiales de la epidermis y también aumentan su grado de basofilia a medida que ascienden. En la dermis subyacente se observa un escaso infiltrado inflamatorio, aunque se han descrito también casos de un intenso infiltrado linfocitario que puede simular una infiltración leucémica84 de la piel o un linfoma cutáneo CD30 positivo85,86 (figs. 20 y 21).
Las infecciones cutáneas por el virus del papiloma humano muestran hallazgos histopatológicos diferentes dependiendo de la variante clínica de que se trate.
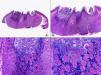
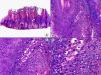
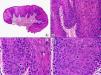
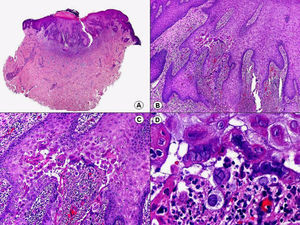
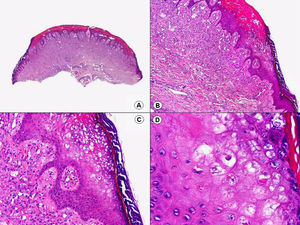
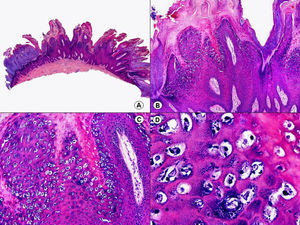
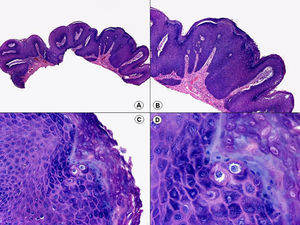
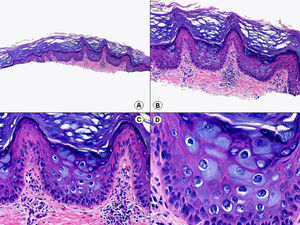
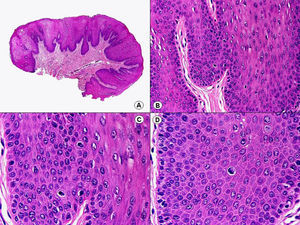
La verruga vulgar presenta un patrón histopatológico que comparte con la verruga filiforme y con la verruga plantar en mosaico. Desde el punto de vista estructural, la lesión se caracteriza por una papilomatosis con acantosis e hiperqueratosis, con columnas de paraqueratosis que asientan sobre los extremos puntiagudos de la papilomatosis87 (fig. 22). Esta papilomatosis tiene una configuración radial, con confluencia de las crestas epidérmicas subyacentes hacia un punto en el centro de la lesión. A mayor aumento se evidencia la presencia de células vacuoladas, con un núcleo pequeño e hipercromático rodeado de un halo claro y un citoplasma pálido y carente de gránulos de queratohialina. Estas células vacuoladas son más evidentes en las elevaciones papilomatosas del estrato granuloso. En la capa córnea se continúan con columnas de paraqueratosis, cuyas células presentan un núcleo más redondeado en comparación con el que presentan otras formas de paraqueratosis. En las depresiones del estrato granuloso se observan células granulosas con acumulación y desestructuración de los gránulos de queratohialina, que aparecen toscos y gruesos y con características tincionales variables. Todos estos hallazgos histopatológicos son menos evidentes o están ausentes en verrugas de largo tiempo de evolución, pero se pueden detectar con facilidad en verrugas recientes.
Las verrugas filiformes muestran hallazgos similares a los previamente descritos de las verrugas vulgares, con la salvedad de que la hiperqueratosis y la papilomatosis suelen ser más intensas y los capilares dilatados de la dermis papilar se alternan con pequeñas áreas de hemorragia.
Las verrugas planas presentan hiperqueratosis y acantosis como todas las verrugas víricas, pero la papilomatosis y la paraqueratosis suelen estar ausentes. Lo más característico de esta variante de verruga es el engrosamiento de la capa granulosa donde sus células, que son de un tamaño superior a lo normal, muestran un citoplasma vacuolado y un núcleo de localización central, pequeño y basófilo (fig. 23). En la capa córnea persiste esta vacuolización entre los corneocitos.
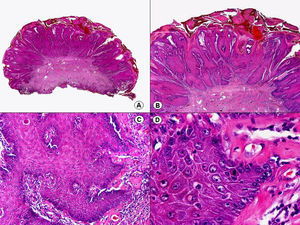
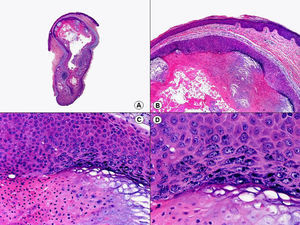
Respecto a las verrugas plantares, las lesiones en mosaico muestran una histopatología similar a la de las verrugas vulgares. En cambio, las verrugas plantares tipo mirmecia tienen unas características histopatológicas propias87–89. En todo el espesor de la epidermis se observan numerosos gránulos eosinófilos intracitoplasmáticos que aumentan de tamaño a medida que ascienden a estratos superiores, donde pueden unirse para formar cuerpos de inclusión, de coloración homogénea y morfología irregular (fig. 24). Estos cuerpos de inclusión engloban al núcleo de las células o están separados de él por un halo claro irregular. A diferencia de lo que ocurre en las lesiones de molusco contagioso, el núcleo de las células de las lesiones de mirmecia no está desplazado por las inclusiones citoplasmáticas. Estas anomalías persisten también en los corneocitos de la capa córnea.
Histopatología de una verruga plantar tipo mirmecia que muestra en todo el espesor de la epidermis numerosos gránulos eosinófilos intracitoplasmáticos que aumentan de tamaño a medida que ascienden a estratos superiores, donde pueden unirse para formar cuerpos de inclusión, de coloración homogénea y morfología irregular. (Hematoxilina-eosina, A x10, B x40, C x200, D x400).
Los condilomas acuminados presentan una marcada acantosis y papilomatosis, pero carecen de hiperqueratosis o ésta es muy discreta (fig. 25). A diferencia de lo que sucede en las verrugas de otras localizaciones, las verrugas anogenitales muestran una coloración más basófila del epitelio acantósico y un número considerable de mitosis90. Existen también células vacuolizadas. Hay que tener en cuenta que las células normales del epitelio de las mucosas son habitualmente vacuolizadas pero, a diferencia de éstas, en las verrugas anogenitales las células vacuolizadas se extienden también hasta los estratos inferiores de la epidermis. El condiloma gigante de Buschke-Löwenstein es un carcinoma verrugoso de localización genital, con histopatología similar a la de otros carcinomas verrugosos91 (fig. 26).
La papulosis bowenoide muestra una histopatología que puede ser indistinguible de la de la enfermedad de Bowen, aunque clásicamente se dice que los hallazgos de atipia y displasia intraepidérmica son más focales, sin afectar a todo el espesor de la epidermis92,93 (fig. 27). Otros hallazgos más frecuentes en la papulosis bowenoide que en la enfermedad de Bowen son la presencia de células gigantes multinucleadas monstruosas, mayor vacuolización citoplasmática y la existencia de una capa granulosa bien desarrollada y que no muestra células atípicas.
Las lesiones de epidermodisplasia verruciforme muestran una histopatología muy similar a la de las verrugas planas, aunque la presencia de células vacuolizadas puede observarse también en los estratos inferiores de la epidermis94. Clásicamente se describen una serie de alteraciones citológicas en las lesiones de epidermodisplasia verruciforme que incluyen queratinocitos de gran tamaño, hinchados, con morfología irregular y con un citoplasma amplio de coloración basófila95 (fig. 28), que para algunos autores es un marcador citopatológico de infección por papilomavirus en pacientes inmunodeprimidos.
El quiste verrugoso muestra una pared epitelial con un borde luminal papilomatoso, con acantosis en la que destaca la hipergranulosis con gránulos de queratohialina toscos, gruesos y de morfología irregular96 (fig. 29).
La queratosis folicular invertida muestra la arquitectura general de una verruga vulgar, pero con un crecimiento más endofítico que exofítico y con la peculiaridad de la presencia de abundantes remolinos escamosos salpicando un epitelio escamoso que deriva de una hiperplasia de infundíbulos foliculares97 (fig. 30). Habitualmente la lesión está cubierta por una hiperqueratosis ortoqueratósica, pero como en otras variantes histopatológicas de verruga vulgar, no es raro encontrar columnas de paraqueratosis emanando verticalmente sobre las puntas de las papilas dérmicas. La capa granulosa suele estar engrosada, al menos focalmente, y no es raro observar gruesos gránulos de queratohialina, mientras que en la dermis subyacente destacan unos capilares congestivos y tortuosos con abundantes hematíes en su luz, que suelen ocupar el vértice de las papilas dérmicas, así como un infiltrado inflamatorio constituido predominantemente por linfocitos y dispuesto perivascularmente. No existe unanimidad respecto al origen de los denominados remolinos escamosos que se observan en el espesor de los lóbulos epiteliales de las lesiones de queratosis folicular invertida, aunque cortes seriados de estas estructuras demuestran en muchos casos su continuidad con una glándula sebácea adyacente, por lo que podría tratarse de conductos sebáceos hiperplásicos atrapados en el interior de la lesión que desarrollan una metaplasia escamosa en su interior. De todas formas, estos remolinos escamosos no son exclusivos de la queratosis folicular invertida, ya que también pueden observarse con relativa frecuencia en queratosis seborreicas irritadas y, de forma episódica, en queratoacantomas.
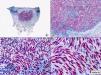
El tricolemoma muestra la arquitectura general de una verruga vulgar y la lesión a pequeño aumento aparece constituida por uno o más infundíbulos foliculares hiperplásicos, cuyo epitelio muestra una diferenciación similar a la vaina radicular externa del segmento inferior de un folículo piloso anágeno. El proceso afecta generalmente a varios infundíbulos foliculares contiguos. La mayoría de las lesiones tiene un doble componente, exo y endofítico, y en general adopta una disposición vertical. La superficie de la lesión es discretamente papilomatosa o marcadamente verrugosa. No es raro observar focos de hipergranulosis en los valles de las papilas de la superficie de la lesión, mientras que los vértices de estas papilas están cubiertos por columnas de paraqueratosis, hallazgos que recuerdan mucho a los observados en las verrugas vulgares98,99. A menudo se observan también unos collaretes de epitelio anexial que rodean la lesión en sus márgenes laterales. El tricolemoma propiamente dicho está constituido por lóbulos epiteliales sólidos de células claras monomorfas, con un citoplasma eosinófilo pálido u ópticamente vacío debido a su abundante contenido en glucógeno y un núcleo de pequeño tamaño, vesiculoso, redondeado y situado excéntricamente (fig. 31). En muchas áreas, la hilera celular periférica muestra una disposición en empalizada, que descansa sobre una gruesa membrana basal similar a la membrana vítrea que rodea el folículo piloso normal. En ocasiones, en el espesor de estos lóbulos epiteliales de células claras se observan remolinos escamosos similares a los de la queratosis folicular invertida, lo que demuestra que estas dos lesiones están estrechamente relacionadas98. El estroma del tricolemoma es escaso y está constituido por colágeno fibrilar, que en las papilas dérmicas contiene capilares sanguíneos dilatados y tortuosos con numerosos hematíes en su luz. A menudo existe un discreto infiltrado inflamatorio linfohistiocitario en la dermis subyacente a la lesión. El denominado tricolemoma desmoplásico100,101 muestra una configuración general similar a la del tricolemoma clásico, pero en algunas áreas, particularmente en las áreas profundas de la lesión, los lóbulos epiteliales se continúan con cordones epiteliales de células pálidas o basaloides que se entremezclan con un estroma desmoplásico y con haces de colágeno esclerótico, lo que puede plantear problemas de diagnóstico diferencial histopatológico con el carcinoma basocelular morfeiforme (fig. 32). Sin embargo, la arquitectura general de estos tricolemomas desmoplásicos es la de una lesión benigna, y además de estas áreas de cordones epiteliales inmersos en un estroma desmoplásico, en las áreas superficiales y laterales de la lesión se observan los lóbulos epiteliales sólidos de células claras, con su empalizada celular periférica sobre una gruesa membrana basal, característicos del tricolemoma.
Histopatología de un tricolemoma constituido por lóbulos epiteliales sólidos de células claras monomorfas, con un citoplasma eosinófilo pálido u ópticamente vacío debido a su abundante contenido en glucógeno y un núcleo de pequeño tamaño, vesiculoso, redondeado y situado excéntricamente. En muchas áreas, la hilera celular periférica muestra una disposición en empalizada, que descansa sobre una gruesa membrana basal. (Hematoxilina-eosina, A x10, B x40, C x200, D x400).
Histopatología de un tricolemoma desmoplásico que muestra una configuración general similar a la del tricolemoma clásico, pero en algunas áreas, particularmente en las áreas profundas de la lesión, los lóbulos epiteliales se continúan con cordones epiteliales de células pálidas o basaloides que se entremezclan con un estroma desmoplásico y con haces de colágeno esclerótico. (Hematoxilina-eosina, A x10, B x40, C x200, D x400).
En las lesiones de hiperplasia epitelial focal de Heck se observa acantosis, papilomatosis, con anastomosis de las crestas interpapilares en la profundidad y presencia de células vacuolizadas en las capas altas del epitelio. Se ha descrito como un hallazgo característico la presencia salpicada de las denominadas células mitosoides, que son queratinocitos de núcleo irregular e hipercromático, que simula figuras de mitosis, pero que en realidad se trata de núcleos degenerados sin capacidad mitótica102,103 (fig. 33).
Histopatología de una lesión de hiperplasia epitelial focal de Heck que muestra acantosis, con anastomosis de las crestas interpapilares en la profundidad y presencia de células vacuolizadas en las capas altas del epitelio. Un hallazgo característico consiste en la presencia salpicada de las denominadas células mitosoides, que son queratinocitos de núcleo irregular e hipercromático, que simula figuras de mitosis, pero que en realidad se trata de núcleos degenerados sin capacidad mitótica. (Hematoxilina-eosina, A x10, B x40, C x200, D x400).
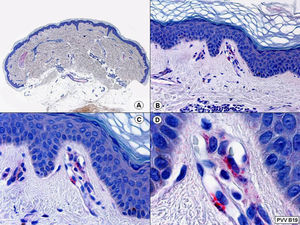
En general, los hallazgos histopatológicos del eritema infeccioso y del síndrome de púrpura en guantes y calcetines son inespecíficos, observándose grados variables de espongiosis epidérmica, focos de paraqueratosis y un discreto infiltrado perivascular alrededor del plexo vascular superficial de la dermis. En el síndrome de guantes y calcetines se suele observar además la presencia de hematíes extravasados alrededor de los capilares superficiales de la dermis (fig. 34) y, a veces, se consigue demostrar por inmunohistoquímica la presencia del parvovirus B19 en las células endoteliales de estos capilares (fig. 35).
Histopatología del síndrome de púrpura en guantes y calcetines que muestra discreta espongiosis epidérmica, focos de paraqueratosis y un ligero infiltrado perivascular alrededor del plexo vascular superficial de la dermis. Se observa además la presencia de hematíes extravasados alrededor de los capilares superficiales de la dermis. (Hematoxilina-eosina, A x10, B x40, C x200, D x400).
Las lesiones cutáneas de este proceso debidas a la infección por el virus Coxackie A16 muestran vesículas intraepidérmicas con una llamativa balonización de los queratinocitos de las capas altas en las lesiones recientes (fig. 36) y una degeneración reticular de toda la epidermis en las lesiones más evolucionadas. En la dermis se observa edema de las papilas y un infiltrado inflamatorio discreto constituido mayoritariamente por linfocitos que se disponen preferentemente de manera perivascular.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.