La foliculitis decalvante (FD) es una alopecia cicatricial primaria (ACP) neutrofílica, cuya patogenia se ha relacionado con una respuesta cicatricial a la infección por Staphylococcus aureus en sujetos predispuestos. Aparece en adultos jóvenes, predominantemente varones, y se caracteriza por la presencia de unas placas alopécicas pruriginosas o dolorosas, localizadas habitualmente en el vértex, con pústulas, costras y penachos foliculares.
En los últimos años ha aumentado el interés por una forma de FD con características liquenoides, que pueden aparecer de forma simultánea o durante la evolución de la enfermedad.
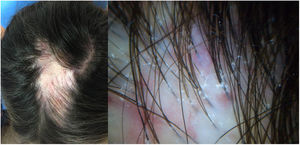
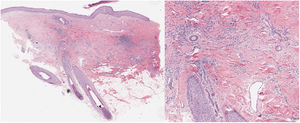
Una mujer de 32 años presentaba una placa de alopecia pruriginosa en el cuero cabelludo de 12 años de evolución. El cuadro se inició con una placa alopécica en la región parietal, cicatricial, de bordes irregulares, acompañada de eritema y costras, y de una descamación perifolicular (fig. 1). El estudio histológico de una biopsia mostró una alopecia cicatricial linfocitaria, con neutrófilos escasos y focales. Se realizó una analítica sanguínea, incluyendo el estudio de autoinmunidad, sin hallazgos patológicos. Con el diagnóstico clínico de FD, la paciente se trató con distintas pautas de corticoides y antibióticos tópicos, corticoides intralesionales, doxiciclina, rifampicina/clindamicina, corticoides orales e hidroxicloroquina, con una estabilización inicial de los brotes, pero con una progresión posterior (fig. 2). Durante el seguimiento, presentó brotes de pústulas aisladas en la periferia de la placa, así como penachos foliculares. Ante la falta de respuesta terapéutica y de correlación clínico-patológica (con una clínica sugestiva de FD, pero una histología de ACP linfocitaria) se realizó una segunda biopsia coincidiendo con la presencia de lesiones activas, en la que se objetivó de nuevo una alopecia cicatricial linfocitaria (fig. 3).
La clasificación de la North American Hair Research Society de las ACP en función de la célula predominante en el infiltrado inflamatorio1 ha llevado a considerar el liquen plano pilar (LPP) y la FD como ejemplos prototípicos de ACP linfocitaria y neutrofílica, respectivamente. Sin embargo, la presencia simultánea de características de FD y LPP sugiere un espectro fenotípico FD-LPP.
En 2017, Morais et al.2 describieron una serie de 13 pacientes con lo que denominaron «liquen plano pilar con pústulas» basándose en la presentación clínica de eritema y descamación perifolicular, junto con costras, penachos foliculares y pústulas. En la histología, sin embargo, solo un 54% presentaron una perifoliculitis liquenoide, mientras que un 77% presentaron una foliculitis neutrofílica y un 62%, penachos. Más recientemente, Yip et al.3 describieron 13 pacientes con características de FD (penachos, pústulas) y de LPP (eritema y moldes perifoliculares), de forma secuencial o simultánea. Las biopsias de áreas de FD mostraron un infiltrado perifolicular con neutrófilos, linfocitos y células plasmáticas, mientras que las áreas liquenoides demostraron inflamación linfocitaria. Por otra parte, Egger et al.4 describieron 7 pacientes con presentación clínica y tricoscópica de LPP junto con características propias de FD como son los penachos foliculares, el aislamiento en el cultivo de S. aureus y características histológicas como las estructuras foliculares compuestas.
Se han postulado distintas hipótesis para explicar el solapamiento entre estas dos entidades. Yip et al.3 apuntaron a la disbiosis del microbioma presente en la FD como el desencadenante de un colapso del privilegio inmunológico del folículo piloso exponiendo autoantígenos que podrían desencadenar una respuesta inmune liquenoide. También se ha propuesto que los signos clasificados como LPP sean la manifestación de una vía final común, que esta imagen sea la forma atenuada o frustrada de FD modificada por el tratamiento, o que5 la fugacidad de las pústulas y, por tanto, de los neutrófilos en el infiltrado inflamatorio pueda llevar a que estén ausentes en el estudio histológico y conducir a un diagnóstico erróneo de LPP. En este sentido, las costras son más constantes, y su presencia, junto con la de penachos foliculares, apoya el diagnóstico de FD frente al de LPP. Cuando los neutrófilos desaparecen, la presencia de células plasmáticas en el infiltrado inflamatorio apoya el diagnóstico de FD6,7, así como la ausencia de dermatitis de interfase y la hiperplasia epidérmica8,9.
Nuestra paciente presentaba unas características liquenoides como son el eritema y descamación perifolicular, así como un infiltrado linfocitario en el estudio histológico. Sin embargo, la presencia de costras, folículos en penacho y la aparición de pústulas durante la evolución apoyaban el diagnóstico de FD.
En la práctica, puede ser imposible diferenciar un LPP y una forma liquenoide de FD ante una ACP con solo eritema e hiperqueratosis perifolicular. La biopsia de un área de aspecto liquenoide puede mostrar un infiltrado linfocitario pero otros datos histológicos, junto con los signos clínicos sugestivos de FD descritos previamente, pueden corregir el diagnóstico. La importancia del reconocimiento de esta forma liquenoide de la FD radica en las implicaciones terapéuticas.
En conclusión, hemos descrito una paciente con FD con características liquenoides tanto clínica como histológicamente, que ilustra la dificultad en el diagnóstico de esta entidad y la necesidad de conocer esta forma de presentación para evitar un diagnóstico erróneo de LPP y realizar una aproximación terapéutica adecuada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.