La morfea en placas y la fascitis eosinofílica (FE) son entidades incluidas en los síndromes esclerodermiformes1–3. Aunque su mecanismo fisiopatogénico sigue siendo desconocido, se ha asociado al consumo de múltiples fármacos desde su descripción1,2. Existen casos publicados que relacionan el uso del natalizumab, un anticuerpo monoclonal empleado para el tratamiento de la esclerosis múltiple, con el desarrollo de estas entidades4,5.
Describimos un caso de ambas manifestaciones en una paciente tratada con natalizumab que precisó un cambio de tratamiento a ocrelizumab para su control.
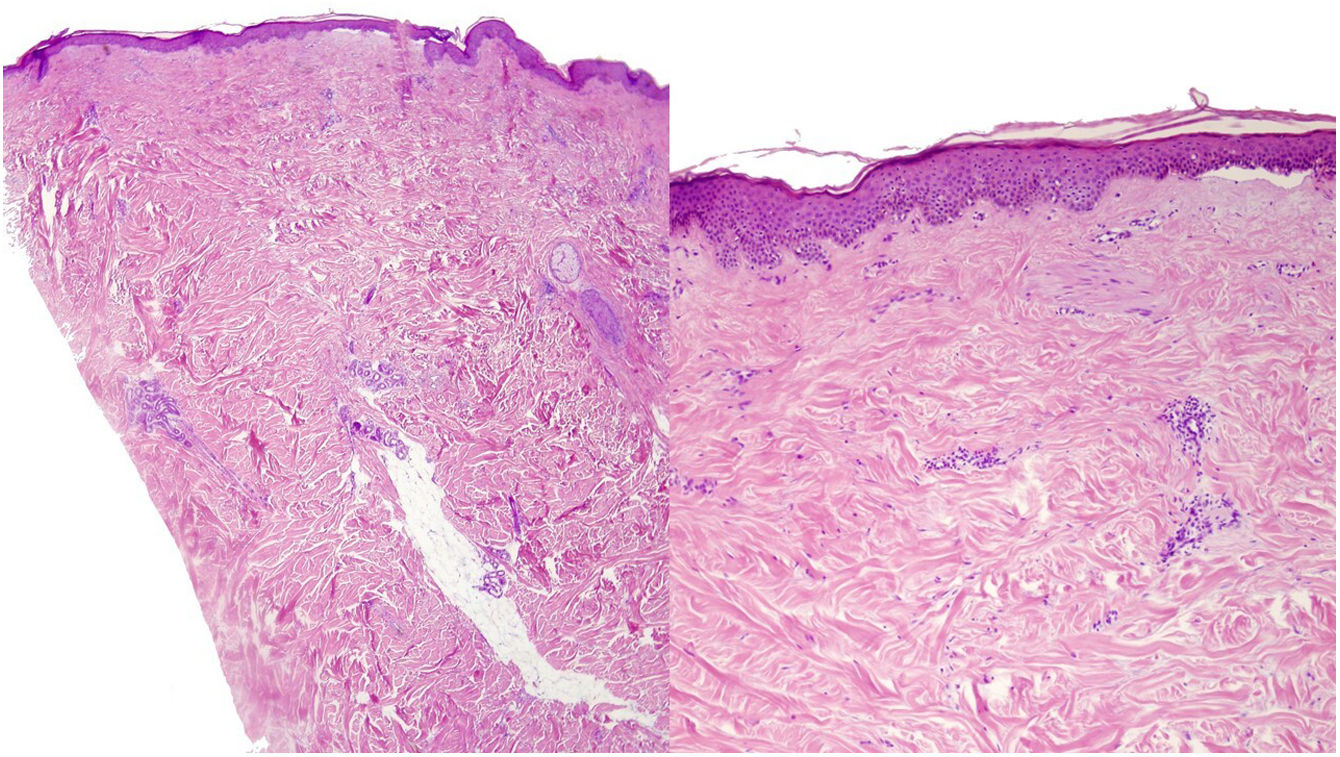
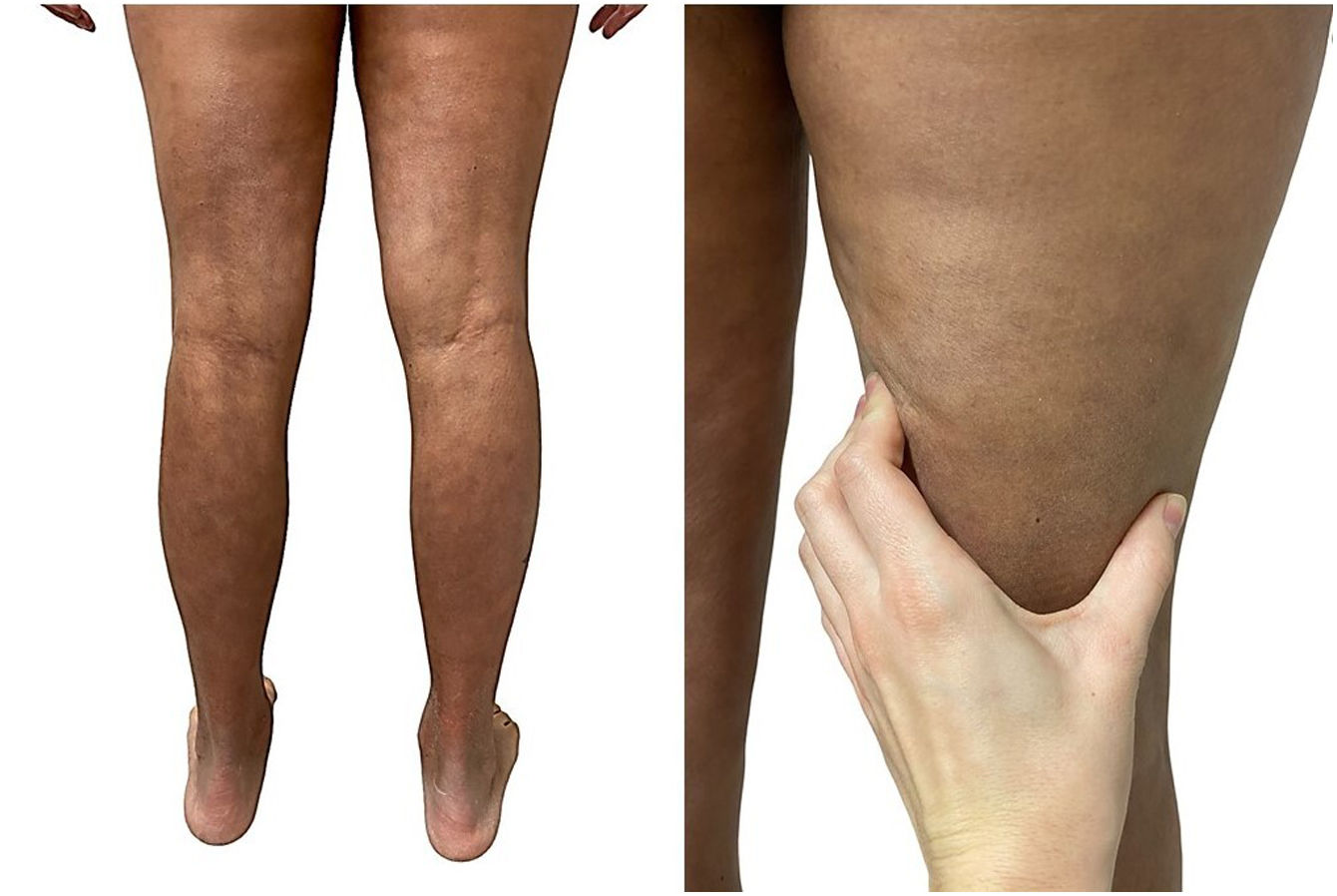
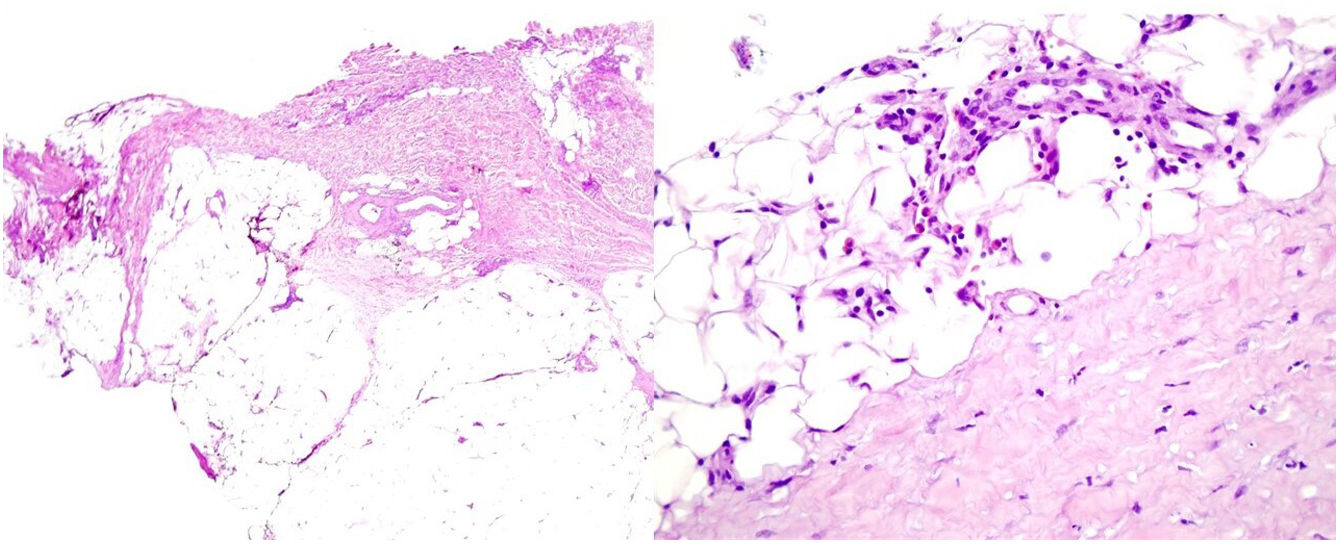
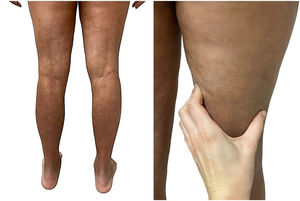
Una mujer de 39 años con esclerosis múltiple (EM) estaba en tratamiento con natalizumab desde 2010. Acudió a nuestra consulta en 2018 por la aparición de unas placas induradas en ambos flancos abdominales. Con la sospecha de una morfea en placas se realizó una biopsia cutánea, que mostró unos cambios típicos que incluían la esclerosis de la dermis y una pérdida de los anejos cutáneos (fig. 1). La analítica general y las serologías, incluyendo para Borrelia burgdogferi, fueron normales o negativas. Se administró propionato de clobetasol al 0,05%, 20 días al mes durante 4 meses. Tras observarse una escasa mejoría se aplicó fotoquimioterapia tópica (PUVA), con una remisión completa de las lesiones tras una dosis total de 6J/cm2. A los 3 meses de finalizar el tratamiento la paciente consultó de nuevo por percibir tensión y endurecimiento de los brazos y las piernas. A la exploración física destacaba, con carácter bilateral y simétrico, la induración generalizada de todas las extremidades, sin afectarse el tronco, las manos y los pies, que impedía el pellizco y le confería un aspecto de piel de naranja (figs. 2A y B). Ante la sospecha de una FE se realizó una biopsia profunda, incluyendo la fascia, que resultó compatible con el diagnóstico, observándose una esclerosis cutánea superficial y profunda, así como un engrosamiento fascial asociado a un infiltrado mixto de linfocitos, eosinófilos y alguna célula plasmática (figs. 3A y B). En una analítica general se constató la presencia de eosinofilia y una elevación de los reactantes de fase aguda, persistiendo la serología para Borrelia negativa.
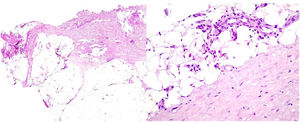
A y B. H-E (2×, 20×). Morfea en placas. Biopsia cutánea con una marcada pérdida de los anejos cutáneos y la presencia de abundantes bandas de fibrosis que ocupan la dermis media y profunda. B. Detalle de unas bandas colágenas engrosadas, hallazgos sugestivos de una morfea en placas.
Tras revisar la bibliografía4,5 se recomendó la supresión de natalizumab y se administró una pauta descendente de prednisona oral con una dosis inicial de 1mg/kg/día y PUVA con una mejoría parcial, pero con un rebrote de las lesiones al descender de 20mg/día de prednisona oral.
El servicio de neurología suspendió el tratamiento con natalizumab y lo sustituyó por ocrelizumab, que se inició 6 meses más tarde, sin haber evidenciado brotes de su enfermedad neurológica en este intervalo de tiempo.
Tras la segunda dosis de ocrelizumab hubo una mejoría progresiva de la clínica cutánea que permitió suspender el PUVA y la prednisona oral 8 meses después de su inicio. Desde entonces la paciente se encuentra asintomática cutánea y neurológicamente.
La FE es una entidad caracterizada por el endurecimiento agudo o subagudo de la piel de las extremidades de manera bilateral y simétrica, respetando las manos y los pies1,2. El cuadro se inicia con una sensación de dolor o tirantez en la piel que progresa hasta el endurecimiento franco, consecuencia del desarrollo de bandas de esclerosis entre la dermis profunda y la fascia que producen el aspecto clínico en «piel de naranja»1–3. Se ha descrito que hasta el 30% de los pacientes presentan unas lesiones típicas de morfea en placas, que pueden aparecer antes, sincrónicamente o meses después de la FE6. Entre los desencadenantes más conocidos se han incluido el ejercicio extenuante, los traumatismos, las picaduras de artrópodos y múltiples fármacos1–3.
Existen en la literatura 2 artículos que relacionan el uso de natalizumab, un anticuerpo recombinante humanizado empleado en el tratamiento de la EM, con el desarrollo de FE4,5. Se trata de 2 casos aislados, donde el desarrollo del cuadro clínico se produjo durante el primer año de tratamiento, con una rápida mejoría tras la supresión, pero sin recaída tras su reintroducción. Según los criterios de causalidad actualizados de la OMS7, tanto en estos casos como en el nuestro la asociación entre el fármaco y la enfermedad sería únicamente posible. Concretamente, en nuestro caso, la temporalidad y la falta de mejoría al suspender el natalizumab nos hacen plantear otros posibles desencadenantes, y en este sentido, sí encontramos ampliamente descrito en la literatura la asociación de FE con otras enfermedades autoinmunes, incluyendo otro caso de EM tratado con fumaratos8.
El ocrelizumab es un anticuerpo monoclonal humanizado anti-CD20 de los linfocitos B aprobado en 2017 por la FDA para el tratamiento de la EM, con un mecanismo de acción similar al rituximab. Dado que en la literatura existen 8 casos de FE refractarias con una buena respuesta al rituximab9,10, esperábamos un control de la enfermedad con este fármaco, siendo, hasta la fecha, el primer caso de FE con respuesta a ocrelizumab descrito en la literatura. Creemos importante destacar la eficacia de este fármaco y tenerlo en cuenta en los casos refractarios.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.