Las metástasis cutáneas locorregionales (en tránsito y satelitosis) constituyen un evento poco estudiado en la progresión del melanoma, con diferencias patogénicas y pronósticas respecto a otras formas de recaída locorregional. Conocer las variables predictivas de este evento sería de gran utilidad en su prevención, diagnóstico precoz y tratamiento. El objetivo de este trabajo fue evaluar los posibles factores de riesgo asociados a la aparición de metástasis cutáneas locorregionales como primera forma de recaída en la progresión metastásica del melanoma.
Material y métodosEntre 2000 y 2010, los datos de 1.327 pacientes diagnosticados de melanoma en estadios i y ii fueron recogidos de forma prospectiva en nuestras consultas. Durante el seguimiento, un total de 112 (8,4%) pacientes sufrió progresión metastásica de su enfermedad. De ellos, 36 pacientes presentaron metástasis cutáneas locorregionales no concurrentes con otras formas de recurrencia. Las características clínicas e histológicas de este subgrupo fueron evaluadas.
ResultadosEn el análisis univariante, los factores predictivos significativos fueron la edad del paciente, el espesor del tumor primario, la localización, la ulceración, el índice mitósico y el tipo histológico. Después del análisis multivariante, se mantuvieron como factores de riesgo independientes el espesor (razón de riesgo [RR] 5,6 e IC 95%: 2,7-11,5), la localización del tumor primario en miembros inferiores (RR 3,4 e IC 95%: 1,0-11,5), en cabeza/cuello (RR 4,8 e IC 95%: 1,7-13,5) y en zonas acrales (RR 6,7 e IC 95%: 2,2-20,8).
ConclusiónLos pacientes con melanomas de más de 2mm de Breslow, localizados en miembros inferiores, cabeza/cuello y zonas acrales tienen un mayor riesgo de padecer metástasis cutáneas locorregionales. Estos datos podrían ser útiles en el diseño de futuras guías para el seguimiento y manejo del melanoma.
While locoregional cutaneous metastases (in transit and satellite) in melanoma have received little attention from researchers to date, they have pathogenic and prognostic features that distinguish them from other forms of locoregional recurrence. Identifying predictors of these metastases would be of great value for their prevention, early diagnosis, and treatment. The aim of this study was to identify the risk factors associated with locoregional cutaneous metastases as the first form of recurrence in the metastatic progression of melanoma.
Material and methodsBetween 2000 and 2010, we prospectively collected the data of 1327 patients diagnosed with stage I and II melanoma. During follow up, 112 patients (8.4%) developed metastases. Of these, 36 had exclusively locoregional cutaneous metastases. The clinical and histological characteristics of this subgroup were evaluated.
ResultsIn the univariate analysis, significant predictors were patient age, primary tumor thickness, site, ulceration, mitotic index, and histological type. After multivariate analysis, the independent risk factors were tumor thickness (risk ratio [RR] 5.6; 95% CI: 2.7-11.5) and the location of the primary tumor on the lower limbs (RR 3.4; 95% CI: 1.0-11.5), on the head or neck (RR 4.8; 95% IC: 1.7-13.5), or in acral sites (RR 6.7; 95% IC: 2.2-20.8).
ConclusionPatients who have melanomas with a Breslow thickness of more than 2mm located on the lower limbs, head, neck, or acral sites have a higher risk of developing locoregional cutaneous metastases. These findings could be useful in the design of future guidelines for the monitoring and management of melanoma.
El melanoma cutáneo (MC) es uno de los tumores malignos que presentan un mayor incremento de su incidencia en poblaciones caucásicas. Además, es una neoplasia caracterizada por un elevado potencial metastásico1.
El 20% de los pacientes que sufren una recurrencia lo hace con una afectación exclusiva cutánea locorregional (recurrencia local, satelitosis o metástasis en tránsito)2,3. En las recurrencias locales del melanoma (las que presentan células tumorales en la cicatriz de la resección primaria), se distingue entre aquellas en las que se asume que existe una diseminación metastásica del tumor tipo satelitosis y las que se cree que podrían estar ocasionadas por células persistentes de un tumor primario incompletamente extirpado. Habitualmente, las satelitosis y/o las metástasis en tránsito preceden a las metástasis ganglionares, mientras que el desarrollo de metástasis a distancia parece ser un evento independiente dentro de la diseminación neoplásica2,4. Hay pocos estudios en los que se evalúa los factores de riesgo para la progresión tumoral exclusiva en la piel locorregional en los pacientes con melanoma5–13. En ellos, el riesgo para la recaída se ha relacionado con las características clínicas y patológicas de la lesión primaria (espesor, localización, ulceración), la extensión de la enfermedad, la edad y el sexo del paciente5–13. Otros factores, como el índice mitósico, apenas han sido valorados12,14. En el caso concreto de las metástasis intralinfáticas (metástasis en tránsito y satelitosis), se ha observado que la localización del tumor primario en las extremidades inferiores, la invasión intralinfática y la presencia de metástasis ganglionares actúan como factores de riesgo5,6,15–20. Estas 2 últimas características definen en la actualidad a pacientes con estadio iii de acuerdo con la última clasificación de la AJCC8. Sin embargo, ningún estudio previo ha evaluado en pacientes sin afectación linfática previa (metástasis cutáneas o ganglionares locorregionales) los factores de riesgo para la presentación de metástasis cutáneas locorregionales (MCLR) (en tránsito y satelitosis) como un evento aislado en la progresión del melanoma, no concurrente con otras formas de recaída (metástasis ganglionares o a distancia). Conocer y caracterizar los factores de riesgo específicos de las MCLR es fundamental, dado que el pronóstico y el manejo de estos pacientes difieren del de otras formas de progresión tumoral8.
El objetivo principal de este trabajo fue evaluar los posibles factores de riesgo tanto clínicos como patológicos para el desarrollo de MCLR como primera y única localización de diseminación metastásica en los pacientes con un melanoma cutáneo.
Material y métodosUn total de 1.327 pacientes consecutivos, diagnosticados de MC primario localizado (estadios patológicos i y ii)8 entre enero de 2000 y julio de 2010, fueron identificados en las bases de datos de melanoma del Instituto Valenciano de Oncología y el Consorcio Hospital General Universitario de Valencia21. La tabla 1 muestra las características de los pacientes incluidos. Fueron excluidos del estudio los pacientes con tumores primarios de localización desconocida o no cutánea, con un segundo melanoma primario y, por definición, aquellos que tuvieran satelitosis microscópica o invasión vascular (AJCC N2c) y/o una biopsia del ganglio centinela (BGC) positiva.
Características de los 1.327 pacientes incluidos en el estudio
| HGUV | IVO | Total | ||||
| Variable | n | % | n | % | n | % |
| Edad | ||||||
| ≤60 años | 342 | 54,8 | 436 | 62,0 | 778 | 58,6 |
| >60 años | 282 | 45,2 | 267 | 38,0 | 549 | 41,4 |
| Sexo | ||||||
| Hombre | 311 | 49,8 | 338 | 48,1 | 649 | 48,9 |
| Mujer | 313 | 50,2 | 365 | 51,9 | 678 | 51,1 |
| Localización | ||||||
| Cabeza y cuello | 120 | 19,2 | 121 | 17,2 | 241 | 18,2 |
| Tronco | 312 | 50,0 | 282 | 40,1 | 594 | 44,8 |
| EESS | 51 | 8,2 | 106 | 15,1 | 157 | 11,8 |
| EEII | 104 | 16,7 | 141 | 20,1 | 245 | 18,5 |
| Acral | 37 | 5,9 | 53 | 7,5 | 90 | 6,8 |
| Tipo histológico | ||||||
| LMM | 87 | 13,9 | 35 | 5,0 | 122 | 9,2 |
| MES | 465 | 74,5 | 498 | 71,1 | 963 | 72,7 |
| MN | 42 | 6,7 | 112 | 16,0 | 154 | 11,6 |
| MLA | 28 | 4,5 | 29 | 4,1 | 57 | 4,3 |
| Sin clasificar/Otros | 2 | 0,3 | 26 | 3,7 | 28 | 2,1 |
| Breslow (mm) | ||||||
| ≤1,00 | 434 | 69,7 | 383 | 54,6 | 817 | 61,7 |
| 1,01-2,00 | 86 | 13,8 | 167 | 23,8 | 253 | 19,1 |
| 2,01-4,00 | 69 | 11,1 | 93 | 13,3 | 162 | 12,2 |
| >4,00 | 34 | 5,5 | 58 | 8,3 | 92 | 6,9 |
| Ulceración | ||||||
| No | 541 | 90,6 | 552 | 81,4 | 1093 | 85,7 |
| Sí | 56 | 9,4 | 126 | 18,6 | 182 | 14,3 |
| Regresión | ||||||
| No | 476 | 81,8 | 501 | 94,5 | 977 | 87,9 |
| Sí | 106 | 18,2 | 29 | 5,5 | 135 | 12,1 |
| Índice mitósico | ||||||
| 0 mitosis/mm2 | 380 | 64,5 | 146 | 31,5 | 526 | 50,0 |
| 1-5 mitosis/mm2 | 161 | 27,3 | 267 | 57,7 | 428 | 40,7 |
| 6-10 mitosis/mm2 | 31 | 5,3 | 37 | 8,0 | 68 | 6,5 |
| >10 mitosis/mm2 | 17 | 2,9 | 13 | 2,8 | 30 | 2,9 |
EEII: extremidades inferiores; EESS: extremidades superiores; HGUV: Consorcio Hospital General Universitario de Valencia; IVO: Instituto Valenciano de Oncología; LMM: lentigo maligno melanoma; MES: melanoma de extensión superficial; MLA: melanoma lentiginoso acral; MN: melanoma nodular.
La variable respuesta fue definida para el análisis estadístico como la presencia de MCLR durante el seguimiento como recaída inicial en la progresión de su enfermedad, no acompañada de otras formas de recurrencia. Por lo tanto, los pacientes que presentaban metástasis cutáneas concurrentes con afectación ganglionar o metástasis sistémicas fueron también excluidos.
Para el análisis, las MCLR fueron divididas en 3 grupos: locales (las recurrencias que tuvieron lugar en la cicatriz de la resección del melanoma), satelitosis (≤5cm del tumor primario original) y en tránsito (>5cm del tumor primario). Aquellas recurrencias locales cuyas características clínicas o histológicas sugerían, de acuerdo con los criterios descritos en trabajos previos, el crecimiento del tumor primario en el sitio de una resección incompleta fueron excluidas del análisis22,23.
El manejo de todos los pacientes se realizó de acuerdo con la Guía propuesta por el grupo para el melanoma cutáneo del Plan Oncológico de la Comunidad Valenciana24. De acuerdo con las recomendaciones de la Guía, después del diagnóstico de melanoma, los tumores primarios o la cicatriz de su biopsia/exéresis fueron sometidos a una escisión amplia/ampliación. Los márgenes de escisión/ampliación empleados fueron de 1cm para aquellos tumores con un espesor de Breslow <2mm y de 2cm para los melanomas con un espesor mayor. En nuestros centros, la BGC se llevó a cabo en pacientes con melanomas primarios de espesor ≥0,75mm, o en tumores primarios de menor espesor que presentaban ulceración y/o regresión.
El seguimiento de los pacientes incluyó exploraciones clínicas en cada visita y la realización de pruebas de laboratorio y exámenes radiológicos (radiografía de tórax, ecografía abdominal y de los ganglios linfáticos regionales y tomografía axial computarizada tóraco-abdominal) de acuerdo con nuestro protocolo. Las visitas se realizaron cada 3-6 meses durante los 3 primeros años, cada 6-12 meses los 2 años siguientes y, después, de forma anual. Todos los pacientes fueron sometidos a procedimientos radiológicos en el momento de diagnóstico y cada 6-12 meses durante los primeros 5 años de seguimiento.
El objetivo de nuestro estudio fue evaluar los posibles factores de riesgo implicados en el desarrollo de MCLR como única forma de recaída. Las variables seleccionadas para el análisis fueron tanto clínicas como histológicas. Las variables clínicas incluían la edad (clasificada en ≤60 y >60 años), el sexo (masculino o femenino) y la localización del tumor primario (categorizada como cabeza y cuello, tronco, extremidades inferiores y extremidades superiores).
Los parámetros histopatológicos empleados fueron el tipo histológico (lentigo maligno melanoma, melanoma de extensión superficial, melanoma nodular, melanoma lentiginoso acral y otros/sin clasificar), el espesor de Breslow (clasificado en ≤2 o >2 mm), la ulceración (ausencia o presencia), la regresión (ausencia o presencia) y el índice mitósico del tumor primario (medido en mitosis por mm2, evaluado en 1 mm2 a partir del área con mayor número de mitosis y categorizado en <6 o ≥6 mitosis/mm2, punto de corte que fue elegido dado que ha demostrado ser el más preciso para la valoración del riesgo de recaída en estudios previos)25.
Las diferencias en el riesgo de presentar MCLR asociado a las distintas variables estudiadas fueron calculadas por el método de Kaplan-Meier y evaluadas mediante la prueba de log-rank. El análisis multivariante para los factores predictivos de MCLR fue estimado según el modelo de riesgos proporcionales de Cox. Para todas las pruebas fue considerado como estadísticamente significativo un valor de p<0,05.
ResultadosDurante una mediana de seguimiento de 37 meses (rango intercuartílico: 13-62) se documentó progresión tumoral en 112 (8,4%) de los 1.327 pacientes incluidos con melanoma en estadios i o ii de la AJCC. Un subgrupo de 36 pacientes (32% de las recaídas) presentó MCLR como forma inicial única de progresión en su enfermedad, es decir, no concurrente con recaída ganglionar ni metástasis a distancia. La tabla 2 muestra las características de estos 36 pacientes. La mediana del intervalo de tiempo desde la exéresis del tumor primario hasta el desarrollo de las MCLR fue de 13,4 meses (rango intercuartílico, 6,4-23,6 meses). De los 36 pacientes con MCLR, 27 presentaban en el momento del diagnóstico de su recaída una única metástasis cutánea (18 de tipo local, 7 satelitosis y 2 metástasis en tránsito). De los restantes 9 pacientes con 2 o más lesiones en el momento de la recaída, uno presentaba solo lesiones locales, 2 tenían exclusivamente satelitosis, 2 solo metástasis en tránsito y 4 combinaban distintos tipos de MCLR.
Características de los pacientes con metástasis cutáneas locorregionales como primera forma de recurrencia (n=36)
| n | % | |
| Variable | ||
| Sexo | ||
| Hombre | 19 | 52,8 |
| Mujer | 17 | 47,2 |
| Edad (años) | ||
| Media (DE) | 68,1 (13,5) | |
| Mediana (rango) | 72 (38-96) | |
| ≤60 | 9 | 25 |
| >60 | 27 | 75 |
| Localización del tumor primario | ||
| Cabeza y cuello | 14 | 38,9 |
| Tronco | 5 | 2,8 |
| Extremidades superiores | 1 | 13,9 |
| Extremidades inferiores | 6 | 16,7 |
| Acral | 10 | 27,8 |
| Características histológicas del tumor primario | ||
| Breslow (mm) | ||
| ≤1 | 8 | 22,2 |
| 1,01-2,00 | 5 | 13,9 |
| 2,01-4,00 | 12 | 33,3 |
| >4,00 | 11 | 30,6 |
| Tipo histológico | ||
| LMM | 7 | 19,4 |
| MES | 11 | 30,6 |
| MN | 10 | 27,8 |
| MLA | 6 | 16,7 |
| Otros/Sin especificar | 2 | 5,6 |
| Ulceración | ||
| Sí | 14 | 42,4 |
| (v.p.=3) | ||
| No | 19 | 57,6 |
| Índice mitósico | ||
| <6(mitosis/mm2) | 21 | 72,4 |
| (v.p.=7) | ||
| ≥6(mitosis/mm2) | 8 | 27,6 |
| Tipo de metástasis cutáneas en el momento de la recaídaa | ||
| Local | ||
| Sí | 22 | 61,1 |
| No | 14 | 38,9 |
| Satelitosis | ||
| Sí | 12 | 33,3 |
| No | 24 | 60,7 |
| En tránsito | ||
| Sí | 7 | 19,4 |
| No | 29 | 80,6 |
DE: desviación estándar; LMM: lentigo maligno melanoma; MES: melanoma de extensión superficial; MLA: melanoma lentiginoso acral; MN: melanoma nodular; v.p: valores perdidos.
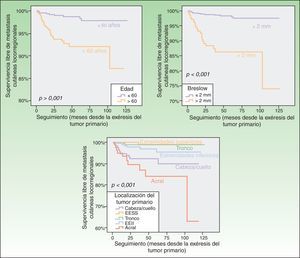
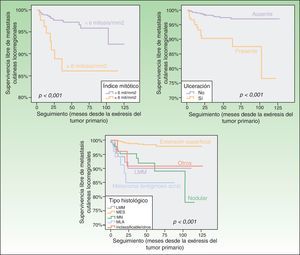
En el análisis univariante, los factores que mostraron influir de forma estadísticamente significativa en la probabilidad de desarrollar MCLR fueron el espesor del tumor primario, el tipo histológico, la ulceración, el índice mitósico, la localización del tumor primario y la edad de los pacientes (tabla 3; figs. 1 y 2). No se observaron diferencias en el riesgo de padecer MCLR en relación con el sexo de los pacientes y la existencia o no de regresión en el tumor primario.
Análisis univariante de los factores asociados a la recaída inicial en forma de metástasis cutáneas locorregionales
| Variable | RR (IC 95%) | Probabilidad de recaída (desde la exéresis del tumor primario) | ||
| 5 años | 10 años | Valor de p | ||
| Edad | <0,001 | |||
| ≤60 años | 1 | 1% | 2% | |
| >60 años | 5,7 (2,7-12,1) | 8% | 13% | |
| Localización | <0,001 | |||
| Tronco | 1 | 1% | 1% | |
| EESS | 0,7 (0,1-5,8) | 1% | 1% | |
| Cabeza y cuello | 8,4 (3,0-23,4) | 8% | 10% | |
| EEII | 2,9 (1,0-9,4) | 3% | 5% | |
| Acral | 15 (5,0-43,8) | 16% | 37% | |
| Tipo histológico | <0,001 | |||
| MES | 1 | 2% | 2% | |
| LMM | 7,6 (2,9-19,7) | 10% | - | |
| MN | 6,7 (2,9-15,9) | 5% | 11% | |
| MLA | 12 (4,4-32,5) | 15% | - | |
| Inclasificables/Otros | 5,8 (1,3-26,3) | 9% | 9% | |
| Espesor tumoral (Breslow) | <0,001 | |||
| ≤2mm | 1 | 1% | 2% | |
| >2mm | 9,1 (4,6-18,1) | 14% | 26% | |
| Ulceración | <0,001 | |||
| No | 1 | 2% | 3% | |
| Sí | 5,3 (2,6-10,6) | 10% | 23% | |
| Índice mitósico | <0,001 | |||
| <6 mit/mm2 | 1 | 3% | 8% | |
| ≥6 mit/mm2 | 4,2 (1,9-9,5) | 14% | - | |
EEII: extremidades inferiores; EESS: extremidades superiores; IC 95%: intervalo de confianza al 95%; LMM: lentigo maligno melanoma; MES: melanoma de extensión superficial; MLA: melanoma lentiginoso acral; MN: melanoma nodular; RR: Razón de riesgo.
Los pacientes mayores de 60 años, con espesores de Breslow mayores de 2mm y con tumores primarios localizados en cabeza/cuello, extremidades inferiores y zonas acras presentaron en las curvas de Kaplan-Meier, de forma estadísticamente significativa, un mayor riesgo de padecer metástasis cutáneas locorregionales como evento inicial en la progresión del melanoma no asociado a otras formas de recaída.
En el análisis multivariante, los factores que obtuvieron significación estadística en el análisis univariante fueron incluidos en el modelo de riesgos proporcionales de Cox, con inclusión por pasos (método hacia adelante o forward) de las variables significativas y ajuste por edad y sexo. Las únicas variables que persistieron como significativas fueron el espesor de Breslow y la localización del tumor primario (tabla 4).
Análisis multivariante ajustado por edad y sexo de los factores que influyen en la aparición de metástasis cutáneas locorregionales
| Wald | RR | RR IC 95% (inferior-superior) | p | |
| Breslow (≤2mm vs.>2mm) | 22,2 | 5,6 | 2,7-11,5 | <0,001 |
| Localización del tumor primario | ||||
| Tronco | - | 1 | - | - |
| EESS | 0,2 | 0,6 | 0,1-5,3 | 0,654 |
| Cabeza y cuello | 8,6 | 4,8 | 1,7-13,5 | 0,003 |
| EEII | 3,8 | 3,4 | 1,0-11,5 | 0,049 |
| Acral | 10,9 | 6,7 | 2,2-20,8 | 0,001 |
EEII: extremidades inferiores; EESS: extremidades superiores; IC 95%: intervalo de confianza al 95%; RR: razón de riesgo.
En el presente trabajo se evalúan los factores de riesgo que influyen en la aparición de MCLR a partir de una serie amplia de pacientes, requisito necesario para poder llevarlo a cabo dado que su presentación sin otras formas de progresión es un evento poco frecuente8,13. Este estudio se basó en las bases de datos de los Servicios de Dermatología del Instituto Valenciano de Oncología y el Hospital General Universitario de Valencia dado que comparten un diseño similar y recogen más de 3.500 melanomas documentados21. A los efectos de este estudio 1.327 pacientes en estadio i y ii de melanoma fueron seleccionados y solo 36 (2,8%) pacientes con MCLR fueron identificados para el análisis posterior. Este porcentaje puede parecer inferior a las tasas habitualmente recogidas en la literatura (más del 10%)2,3,26,27. Sin embargo, se explica fácilmente por la inclusión relativamente reciente de la BGC en el procedimiento de clasificación patológica del melanoma, tal y como parece corroborarse en los datos presentados en publicaciones más recientes, en los que recogen la incidencia de MCLR en pacientes sin metástasis en el ganglio centinela5,20.
Se deben tener en cuenta las limitaciones de este estudio que incluyen el diseño retrospectivo, el corto tiempo de seguimiento y un pequeño número de pacientes con MCLR pese a partir de un número considerable de pacientes con melanoma. Esto último es probable que sea una consecuencia de un seguimiento más corto que en otros estudios. El número pequeño de pacientes con MCLR implica interpretar nuestros resultados con cautela.
Las MCLR (en tránsito y satelitosis) constituyen un evento precoz en la progresión linfática del melanoma diferente en su patogenia, y pronóstico a otras formas de recaída locorregional5,6,8,28,29. El análisis histopatológico revela que las MCLR se desarrollan como resultado de la embolización de células tumorales en los vasos linfáticos dérmicos27. Además, varios estudios muestran que en los pacientes con MCLR las metástasis viscerales son habitualmente precedidas por recaídas ganglionares, lo que apoya el origen intralinfático de metástasis en tránsito y satelitosis2,4,6. Las MCLR (metástasis intralinfática) están incluidas en el estadio iiiB de la clasificación AJCC debido a que este grupo es estadísticamente el más cercano en cuanto a pronóstico. Sin embargo, los pacientes con melanoma en estadio iiiB son un grupo heterogéneo y aquellos con MCLR parecen presentar una mayor supervivencia3,8,15. El mejor pronóstico observado en los pacientes con MCLR podría deberse a un comportamiento biológico menos agresivo de este tipo de recaída, aunque también podría explicarse por la mejor respuesta terapéutica obtenida en las MCLR con los distintos tratamientos disponibles (exéresis, radioterapia, perfusión de quimioterapia en un miembro aislado, imiquimod tópico)20,30–32.
Dado que las recaídas en el melanoma se caracterizan por un manejo habitualmente insatisfactorio con un pronóstico sombrío, sería de gran utilidad identificar a aquellos pacientes en riesgo de recidiva para aplicar medidas preventivas o al menos permitir un diagnóstico y un tratamiento precoces. Parece de especial interés poder predecir formas de progresión potencialmente tratables como las MCLR.
En nuestro estudio, los únicos factores independientes que influyeron de forma significativa en el riesgo de padecer MCLR como recaída inicial, no concurrente con otras formas de diseminación metastásica, fueron el espesor del tumor primario y su localización. Por ello, consideramos que el grupo de pacientes con un riesgo mayor de padecer MCLR (con un espesor tumoral >2mm y localizados en áreas acrales, en las extremidades inferiores o en la cabeza o cuello), podría beneficiarse de un seguimiento clínico más estrecho para realizar un diagnóstico precoz de estas lesiones.
Varios trabajos han demostrado la asociación entre el espesor del tumor primario y la presencia de afectación linfática con MCLR. La mayor profundidad tumoral puede suponer un incremento en el potencial de contactar y penetrar en los vasos linfáticos dérmicos17,33–35. En nuestro trabajo, el otro factor que mantuvo su influencia en el análisis multivariante sobre el riesgo de padecer MCLR fue la localización del tumor primario en la cabeza o el cuero cabelludo, las extremidades inferiores y, en particular, en la zona acral. Este hallazgo está de acuerdo con estudios previos, aunque la razón por la que son más frecuentes las MCLR en tumores primarios de miembros inferiores no está del todo aclarada. Algunos autores sugieren que el riesgo se debe al mayor tamaño y longitud de los vasos linfáticos que drenan las piernas. Otra explicación posible sería el mayor estasis linfático presente en los miembros inferiores debido a la gravedad, lo que haría más permeables sus paredes a las células neoplásicas y permitiría su persistencia como enfermedad locorregional. Nuestro trabajo es el primero que describe un mayor riesgo de padecer MCLR en relación con la localización del tumor primario en cabeza y cuello. Serán necesarios futuros trabajos para esclarecer esta última asociación.
En conclusión, de las posibles variables evaluadas en este estudio 2 demostraron ser factores independientes asociados con el riesgo de padecer MCLR. El espesor de Breslow fue el factor más potente implicado en la aparición de MCLR, seguido en importancia por la localización del tumor primario. Estos datos podrían ser útiles en el diseño de futuras guías para el seguimiento y manejo de los pacientes con melanoma. Debido a que los hallazgos presentados se basan en datos retrospectivos, serán necesarias futuras series de mayor tamaño, y preferiblemente prospectivas, para validar los resultados de nuestro estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.