El vitíligo es un trastorno pigmentario en el que se ha evidenciado el estrés oxidativo como parte de la patogenia. Se conocen vías encargadas de proteger a los melanocitos del daño causado por las especies reactivas de oxígeno, como por ejemplo la vía del factor nuclear eritroide similar al factor 2 (Nrf2).
El Nrf2 es un factor de transcripción que cuando el organismo se encuentra en homeostasis permanece inhibido, pero en presencia de estrés oxidativo permite la codificación de enzimas antioxidantes de fase ii.
En el vitíligo se evidencian anomalías en la localización y función del Nrf2, así como polimorfismos que aumentan el riesgo de esta enfermedad. Así mismo, se han investigado múltiples moléculas que actúan en el Nrf2 buscando encontrar tratamientos emergentes útiles para el vitíligo.
Se realizó una búsqueda de artículos en español e inglés en las bases de datos PubMed, Ovid, Scopus y Web of Science Clarivate, utilizando las palabras clave «Vitiligo AND nuclear factor erythroid derived 2 like 2 OR NRF2» sin restricción de tiempo. Se incluyeron todos los estudios in vitro, revisiones narrativas, series de casos, estudios de cohorte y ensayos clínicos aleatorizados y no aleatorizados que abordaban específicamente el tema del Nrf2 asociado a vitíligo.
Vitiligo is a pigmentary disorder, in which oxidative stress has been evidenced as part of the pathogenesis. Pathways responsible for protecting melanocytes from damage caused by reactive oxygen species are known as the nuclear factor erythroid factor 2 (Nrf2) pathway.
Nrf2 is a transcription factor that remains inhibited when the organism is in homeostasis, but in the presence of oxidative stress it allows the encoding of phase ii antioxidant enzymes.
In vitiligo there are abnormalities in the location and function of Nrf2 as well as polymorphisms that increase the risk of this disease. Currently, multiple molecules that act on Nrf2 have been investigated in order to find useful emerging treatments for vitiligo.
A search for articles in Spanish and English was carried out in the PubMed, Ovid, Scopus and Web of Science Clarivate databases, using the keywords “Vitiligo AND nuclear factor erythroid derived 2 like 2 OR NRF2” without time restriction. All in vitro studies, narrative reviews, case series, cohort studies, and randomized and non-randomized clinical trials that specifically addressed the issue of Nrf2 associated with vitiligo were included.
El vitíligo es un trastorno cutáneo multifactorial, caracterizado por manchas acrómicas de aparición y evolución variable, secundario a la pérdida de la función de los melanocitos. Afecta aproximadamente al 1% de la población a nivel mundial. Su etiología exacta no es del todo conocida, pero se ha evidenciado que el estrés oxidativo favorece que se desencadene la lesión diana en las células productoras del pigmento de la piel, comprometiendo la supervivencia y función de estas. Las especies reactivas de oxígeno (ROS) pueden alterar el metabolismo, la proliferación y la diferenciación celular de los melanocitos, lo que induce la activación de la respuesta inmune y la generación de un ambiente proinflamatorio causante de daño celular1,2.
La capacidad de los melanocitos de adaptarse al entorno y la presencia de moléculas antioxidantes y oxidantes para mantener el equilibrio en el medio son requisitos indispensables para la supervivencia de las células. Existen vías encargadas de proteger a los melanocitos del daño celular, como la vía del factor nuclear eritroide similar al factor 2 (Nrf2), que es un potente regulador redox celular3.
Patogenia del vitíligoSe han propuesto 4 teorías para explicar la patogenia del vitíligo: la genética, la inmunológica, la del estrés oxidativo y la de generación de mediadores inflamatorios. Ninguna de estas teorías por sí sola es suficiente para explicar el origen del vitíligo, aunque en la actualidad se acepta su naturaleza autoinmune y su etiología multifactorial4,5. Se refiere que el 20% de los pacientes con vitíligo tienen al menos un pariente de primer grado afectado. Se ha reportado un riesgo relativo de presentar vitíligo en los parientes de primer grado de 7 a 10 veces mayor que en la población general. Los gemelos monocigóticos tienen una tasa de concordancia del 23%, lo que nos muestra que los factores ambientales son indispensables para el desarrollo de la enfermedad. Se han identificado alrededor de 50 loci genéticos diferentes asociados a la regulación inmunológica innata y adaptativa, la melanogénesis y la apoptosis celular, los que confieren riesgo para desarrollar vitíligo. Un ejemplo de esto es el gen TYR, que codifica una tirosinasa que funciona como autoantígeno en estos pacientes. Otro ejemplo es el gen NALP1, que codifica la proteína 1 rica en repeticiones de leucina –NACHT–, que es una proteína reguladora del sistema inmunológico innato y también se ha visto asociada al desarrollo de vitíligo y otras enfermedades y síndromes autoinmunes4.
Vitíligo y estrés oxidativoSe ha señalado al estrés oxidativo como el posible evento inicial para la destrucción de melanocitos. El sistema antioxidante en los melanocitos de los pacientes con vitíligo se encuentra desequilibrado, con marcadores de estrés oxidativo elevados y agotamiento significativo de los mecanismos antioxidantes6; lo anterior se ha relacionado con una mayor sensibilidad intrínseca de los melanocitos a estímulos externos prooxidantes. Además, en los bordes de las manchas y de la piel no lesionada de pacientes con vitíligo, se ha detectado una disminución de la adhesión entre los melanocitos y los queratinocitos que se asocia al fenómeno de Koebner. Las mitocondrias de pacientes con vitíligo parecen ser inductores clave del estrés oxidativo, ya que presentan alteraciones en el potencial transmembrana y en los canales de calcio en la membrana celular, que desencadenan la apoptosis celular y la oxidación; además, se ha documentado que el retículo endoplásmico de los melanocitos en estos pacientes se encuentra dilatado y alberga algunas moléculas, como la calreticulina, que se expresan bajo un estado de estrés oxidativo. La sobreproducción de ROS estimula a los melanocitos a secretar exosomas con antígenos específicos de melanocitos. Estos antígenos son presentados a las células dendríticas, que activan las células T auxiliares y causan disfunción de células T reguladoras. Las células T CD8 de las lesiones con vitíligo producen citocinas como el IFN-γ, que activan vías como la de JAK-STAT y que finalmente conducen a la secreción de múltiples citocinas proinflamatorias4.
Definición y estructura del factor nuclear eritroide similar al factor 2El Nrf2 es un factor de transcripción que forma parte de la familia de las proteínas cap-n-collar. El gen que codifica este factor de transcripción se encuentra en el cromosoma 2q31 y consta de 5 exones y 4 intrones1,7.
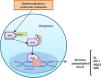
El factor de transcripción Nrf2 está formado por 5 dominios denominados «Neh» y un dominio llamado cremallera de leucina (bZIP); estos dominios tienen funciones específicas y a su vez albergan motivos formados por aminoácidos y residuos de lisina. De los dominios nombrados, el Neh2 se ha propuesto como el principal, ya que es fundamental en la activación o inhibición de este factor de transcripción (fig. 1)3.
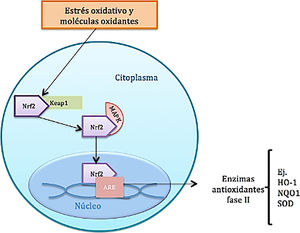
Función del factor nuclear eritroide similar al factor 2En condiciones homeostáticas, la actividad del Nrf2 se encuentra constantemente inhibida por su unión a una proteína citoplasmática llamada proteína 1 asociada a ECH parecida a Kelch (Keap1), que es una subunidad adaptadora de la ubiquitina ligasa E3 que se encarga de adicionar cadenas de ubiquitina al Nrf2 como marcaje para que este sea degradado por el proteosoma. La vida media del Nrf2 en condiciones normales es de 20min; sin embargo, bajo estrés oxidativo, los oxidantes se unen a sensores de cisteína del Keap1, provocando un cambio conformacional en el mismo que permite que el Nrf2 se disocie de la proteína inhibidora, se estabilice y se trasloque al núcleo8. Una vez está en el núcleo celular, forma un complejo mediante heterodimerización con proteínas fibrosarcoma musculoaponeuróticas. Estos heterodímeros reconocen elementos de respuesta a los antioxidantes (ARE) localizados en la región promotora del ADN de genes, que codifican enzimas antioxidantes de fase ii, como por ejemplo la hemooxigenasa 1, la superóxido dismutasa, la NADH quinina oxidorreductasa 1, la subunidad catalítica de glutamato cisteína ligasa y la subunidad moduladora de glutamil cisteína ligasa, además de proteínas antioxidantes no enzimáticas, como la tiorredoxina o ferritina; estas moléculas actúan neutralizando las ROS a través de reacciones de eliminación y reducción (fig. 2)8–10 (tabla 1).
Descripción de aportaciones de estudios sobre el funcionamiento del Nrf2
| Autor/año | País | NEGR | Tipo de estudio | Aportaciones |
|---|---|---|---|---|
| Königsberg Fainstein3, 2007 | México | 5 D | Revisión narrativa | Mecanismo de regulación y activación del Nrf2 |
| Schallreuter et al.6, 1991 | Alemania | NA | Estudio de biología Molecular | Moléculas oxidantes en pacientes con vitíligo |
| Song et al.7, 2016 | China | 3b B | Casos y controles | Polimorfismo en el gen Nrf2 que afecta la susceptibilidad al vitíligo |
| Gęgotek y Skrzydlewska9, 2015 | Polonia | 5 D | Revisión narrativa | Acción del Nrf2 en el metabolismo celular |
| Mou et al.13, 2018 | China | NA | Estudio de biología molecular | Disminución de la expresión de Nrf2 secundaria al aumento de HMGB1 |
| Jian et al.14, 2014 | China | 4 C | Transversal | Expresión celular del Nrf2 y traslocación del Nrf2 en respuesta al H2O2 |
| He et al.15, 2017 | China | NA | Estudio de biología molecular | Desregulación de la vía Nrf2-p62 en los melanocitos de vitíligo |
| Kim et al.16, 2014 | Corea | NA | Estudio de biología molecular | Molécula PAR-2 y su acción al alza de la traslocación nuclear de Nrf2 |
| Guan et al.17, 2008 | China | 3b B | Casos y controles | Polimorfismo en el gen Nrf2 que afecta la susceptibilidad al vitíligo |
HMGB1: proteína de alta movilidad del grupo 1; H2O2: peróxido de hidrógeno; NA no aplica, cumple con uno de los 11 criterios de causalidad de Bradford Hill (plausibilidad biológica); NEGR: nivel de evidencia y grado de la recomendación de acuerdo con la escala Centre for Evidence-Based Medicine de Oxford; Nrf2: factor nuclear eritroide similar al factor 2; PAR-2: receptor 2 activado por proteasa.
Algunas otras proteínas como las que forman parte de las vías de las proteínas cinasas activadas por mitógenos, como la ERK, la JNK, la p62 y la fosfatidilinositol 3-cinasa, son importantes reguladoras del Nrf2 antes de su activación o su degradación, ya que participan en la disociación de Nrf2 de Keap1 y la posterior traslocación nuclear del mismo8,11.
Otros mecanismos de acción adicionales para la activación del Nrf2 son la acetilación/desacetilación de histonas, la fosforilación de la molécula Bach1 y la participación del marcador de autofagia celular12,13.
Factor nuclear eritroide similar al factor 2 y vitíligoLa localización del factor de transcripción Nrf2 en los melanocitos de pacientes con vitíligo se ha mostrado principalmente a nivel citoplasmático, al contrario de pacientes sanos, en los cuales la mayor proporción de Nrf2 se localiza en el núcleo; además, el Nrf2 en pacientes sanos expuestos al peróxido de hidrógeno presenta una mayor elevación en comparación con pacientes enfermos. Lo anterior evidencia que la traslocación nuclear de Nrf2 en respuesta al estrés oxidativo está relativamente reducida en pacientes con vitíligo, causando desbalance en el sistema redox14. Por lo cual, se han investigado métodos para aumentar la activación de Nrf2. En estudios recientes, se identificó la glucógeno cinasa 3 beta sintetasa como un nuevo regulador de Nrf2 que estimula la acumulación nuclear del factor de transcripción, a través de la fosforilación del mismo13. Otro estudio realizado en pacientes asiáticos demostró que la inhibición de la proteína de alta movilidad del grupo 1, una molécula que es liberada por células del sistema inmune ante el estrés oxidativo y que en condiciones normales actúa como un mediador proinflamatorio, mejora la expresión de Nrf2 de forma significativa13.
Además del sistema antioxidante clásico, el mecanismo de autofagia celular puede proteger a los melanocitos del estrés oxidativo. Este mecanismo consiste en la agrupación de orgánulos y proteínas intracelulares en autofagosomas para su degradación, es controlado por la vía Nrf2-p62 y en pacientes con vitíligo se encuentra disregulado a la baja15.
No solo en las células productoras de pigmento se han observado alteraciones en la función del Nrf2, también en los queratinocitos de pacientes con vitíligo se ha visto un aumento de la apoptosis celular y alteraciones en la viabilidad celular, por lo que Kim et al. investigaron la estimulación del receptor 2 activado por proteasa en los queratinocitos de 8 pacientes con vitíligo estable no segmentario. El estudio reportó que este receptor puede activar y hacer que el Nrf2 se vuelva más estable a través de la degradación acelerada de Keap1, permitiendo la posterior inducción de enzimas de la fase ii, además de que la expresión del receptor 2 activado por proteasa y de Nrf2 era menor en la piel lesionada en comparación con la piel no lesionada de un mismo paciente con vitíligo16.
Además de las anomalías en la localización y función del factor de transcripción, se han encontrado polimorfismos en la región del gen promotor de Nrf2, como la sustitución de T por C en la posición 653, la sustitución de G por T en la posición 617 y la sustitución de C por A en la posición 650. Estos polimorfismos aumentan el riesgo de desarrollar vitíligo7,17.
Moléculas que actúan sobre el factor nuclear eritroide similar al factor 2 en pacientes con vitíligoLos fenoles como el monobencil éter de hidroquinona y el 4-tertiaril butil fenol son moléculas citotóxicas que mostraron aumentar la traslocación nuclear y la activación del Nrf2 de melanocitos en prepucios neonatales y de 2 personas con vitíligo estable7. En contraste, la glicirricina, que es un compuesto natural de las raíces y rizomas del regaliz, reduce el estrés oxidativo a través de la activación del Nrf2 y el aumento de la expresión de la hemooxigenasa 1 en macrófagos1. La berberina es un alcaloide de isoquinolina natural con actividad antioxidante que ejerce su acción mediante la activación de la vía Nrf2-ARE2 (tabla 2).
Descripción de estudios con moléculas con efecto sobre el funcionamiento del Nrf2
| Autor/año | País | NEGR | Tipo de estudio | Aportaciones |
|---|---|---|---|---|
| Mou et al.1, 2019 | China | NA | Estudio de biología molecular | La glicirricina como protector del estrés oxidativo en los melanocitos a través de la activación de la vía Nrf2 |
| Jiang et al.2, 2019 | China | NA | Estudio de biología molecular | La berberina como estimulante de la traslocación nuclear del Nrf2 y los niveles totales de Nrf2 en sangre |
| Ma et al.8, 2018 | China | NA | Estudio de biología molecular | Qué es la baicaleína y su regulación al alza de la vía de señalización de Nrf2 |
| Arowojolu et al.10, 2017 | Estados Unidos | NA | Estudio de biología molecular | Acción de 4-TBP y MBEH sobre el Nrf2 (aumento del Nrf2 posterior al estrés oxidativo producido por 4-TBP y MBEH) |
| Kim et al.11, 2017 | Corea del Sur | 4 C | Transversal | 4-TBP e HQ como causa de la disminución de la activación de la vía del Nrf2 |
| Ben-Yehuda Greenwald et al.12, 2017 | Suiza | NA | Estudio de biología molecular | Yodo y yoduro como activadores de la vía Nrf2 |
| Tsuji et al.18, 2017 | Japón | NA | Estudio de biología molecular | PAPLAL como inductor de la traslocación nuclear de Nrf2 |
| Jung et al.19, 2017 | Corea | NA | Estudio de biología molecular | La afezelina como activador de la vía de señalización de Nrf2-ARE in vitro |
| Chang et al.20, 2017 | China | NA | Estudio de biología molecular | Dosis altas de simvastatina como activadora del Nrf2 |
| Vanderweil et al.21, 2017 | Estados Unidos | 1b A | Ensayo clínico | Simvastatina para el tratamiento del vitíligo |
| Fang et al.22, 2020 | China | NA | Estudio de biología molecular | Molécula de hidrógeno como activador de la vía de señalización Nrf2-ARE |
| Yang et al.23, 2020 | China | NA | Estudio de biología molecular | Extracto de jengibre como activador de la vía de señalización Nrf2 |
| Yuan et al.24, 2020 | China | NA | Estudio de biología molecular | Derivado de la planta Paeonia lactiflora como activador de la vía de señalización Nrf2 |
| Zhang et al.25, 2020 | China | NA | Estudio de biología molecular | Extracto de origen vegetal como activador de la vía Nrf2 |
| Du et al.26, 2021 | China | NA | Estudio de biología molecular | Ácido fólico y su acción en la vía de señalización Nrf2 |
| Zhang et al.27, 2019 | China | NA | Estudio de biología molecular | Extracto de Ginkgo biloba como activador de la vía de señalización Nrf2-ARE |
ARE: elementos de respuesta a los antioxidantes; HQ: hidroquinona; MBEH: monobencil éter de hidroquinona; NA no aplica, cumple con uno de los 11 criterios de causalidad de Bradford Hill (plausibilidad biológica procedente de investigación básica); NEGR: nivel de evidencia y grado de la recomendación de acuerdo con la escala Centre for Evidence-Based Medicine de Oxford; Nfr2: factor nuclear eritroide similar al factor 2; PAPLAL: solución de nanopartículas de paladium y platino; 4-TBP: 4-tertiaril butil fenol.
Las nanopartículas metálicas como el paladio y el platino ejercen actividades catalíticas antioxidantes, por lo que en Japón se creó una emulsión que contiene las 2 sustancias y es utilizada para el tratamiento del vitíligo y el envejecimiento de la piel, actuando a través de la inducción de la traslocación de Nrf2 al núcleo con regulación al alza de la vía Nrf2-NADH quinina oxidorreductasa 1 y de forma secundaria induciendo la producción de superóxido dismutasa 118.
Otras sustancias que se han probado en melanocitos epidérmicos humanos de personas con vitíligo son los flavonoides; un ejemplo de esto es la afzelina, que ha demostrado inhibir significativamente la muerte celular inducida por el peróxido de hidrógeno, la producción de ROS y la peroxidación de lípidos en los melanocitos, provocando la inactivación de la vía de señalización glucógeno cinasa 3 beta sintetasa y permitiendo una mayor activación de la vía Nrf2-ARE19.
En el año 2004 se reportó que un paciente con vitíligo e hipercolesterolemia mostraba repigmentación rápida de la piel después de recibir dosis altas de simvastatina. Recientemente, se realizó un ensayo clínico aleatorizado con simvastatina oral en pacientes con vitíligo no segmentario que no mostró beneficio del tratamiento; sin embargo, estudios in vitro han mostrado a la simvastatina como una molécula que puede ser útil para activar el mecanismo de autofagia celular, mejorar la viabilidad celular y potenciar la actividad de las enzimas antioxidantes20. Es probable que los hallazgos dispares entre los estudios in vivo e in vitro sean secundarios a una dosificación limitada de simvastatina en humanos por el riesgo de complicaciones como la rabdomiólisis. Otro estudio reportó que la atorvastatina junto con fototerapia UVB pueden ser útiles para disminuir la propagación de las lesiones en pacientes con vitíligo activo. Estos resultados fueron dependientes de la dosis de medicamento administrada21.
Algunos fitoquímicos como el extracto de cinamaldehído se reportan como estimuladores de la traslocación nuclear de Nrf2 y reguladores al alza de la expresión de hemooxigenasa 1 en la línea celular HaCat de los queratinocitos, a través de la modificación oxidativa o covalente de su represor citosólico Keap1, o por fosforilación del Nrf29.
Un estudio más reciente evaluó el efecto de la molécula de hidrógeno en la vía del Nrf2-ARE en células bajo estrés oxidativo. Se encontró que dicha molécula es capaz de regular de forma drástica la expresión de Nrf2 citosólico y nuclear, además de promover la traslocación de Nrf2 al núcleo y mejorar la expresión de genes diana del Nrf2. Se concluyó que la molécula de hidrógeno puede ejercer un efecto antioxidante en los melanocitos al promover la activación de la vía Nrf2-ARE22.
Actualmente se han estudiado nuevos extractos de hierbas que parecieran tener un efecto antioxidante, como el 6-Shogaol, que es un compuesto activo del jengibre, que demostró ser útil para proteger a los melanocitos del estrés oxidativo ocasionado por el peróxido de hidrógeno mediante la activación de la vía Nrf2 y la expresión aumentada del mismo23. Otro derivado de plantas es la Paeoniflorina, que es un compuesto químico derivado de la planta Paeonia lactiflora que parece tener la capacidad de disminuir la apoptosis celular, mejorar la viabilidad celular y activar la vía del factor Nrf2, entre otras funciones24. La apigenina, una aglicona de origen vegetal, también ha sido estudiada como regulador del estrés oxidativo25. Recientemente se reportó el ácido fólico como activador efectivo de la vía del Nrf226.
Otros compuestos que podrían activar el Nrf2 serían los esteroles vegetales, los carbonitrilos, los suplementos dietéticos que contienen ácido elágico o Ginkgo biloba, el tratamiento con solución yodada y algunos fármacos como el ketoconazol9,12,27.
ConclusionesEl Nrf2 es fundamental para el mantenimiento redox celular a través de la estimulación de enzimas antioxidantes fase ii. Se han encontrado múltiples variaciones en la localización celular, la estructura y la función de este factor de transcripción, lo que puede estar muy relacionado con el inicio de enfermedades como el vitíligo. Es importante investigar cómo funciona y cómo puede estimularse este factor de transcripción, ya que su conocimiento contribuirá a tener nuevas alternativas terapéuticas para personas con vitíligo. Por el momento, el nivel de evidencia no es suficiente para establecer recomendaciones, sin embargo, es conocimiento que contribuye al entendimiento de la enfermedad y potenciales alternativas de tratamiento a futuro28.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Dra. Martha Morales, jefe de Enseñanza e Investigación, y al Dr. Fermín Jurado Santa-Cruz, director del Centro Dermatológico Dr. Ladislao de la Pascua, por su apoyo en la redacción de este trabajo.