A pesar del mal pronóstico del melanoma metastásico, las metástasis cutáneas constituyen un grupo especial por su fácil accesibilidad que lo hace susceptible al abordaje local por parte del dermatólogo. Describimos nuestra experiencia de tratamiento intralesional con interleucina 2 (IL-2) en 7 pacientes con metástasis cutáneas de melanoma maligno.
Material y métodosUn total de 244 lesiones en 7 pacientes con satelitosis y/o metástasis cutáneas de melanoma maligno han sido tratadas con IL-2 intralesional administrada dos veces a la semana. Las dosis máximas por pacientes variaron entre los 3 y 18 millones de unidades/sesión, en función del número y tamaño de las lesiones.
ResultadosSe han obtenido remisiones completas (95,9 %) o parciales (3,7 %) en la gran mayoría de lesiones tratadas, una sola lesión (0,4 %), de localización subcutánea y de mayor tamaño, no respondió al tratamiento intralesional y precisó de alcoholización y posterior extirpación quirúrgica para su resolución. Todas las respuestas parciales se observaron en lesiones de localización subcutánea y mayores de 2 cm. El tratamiento fue bien tolerado, con escasos efectos secundarios de intensidad leve (grado 1-2).
ConclusionesLa IL-2 puede ser una buena opción para el tratamiento de pacientes con satelitosis y metástasis cutáneas de melanoma con elevada eficacia y escasos efectos secundarios. Las lesiones menores de 2 cm y localizadas en epidermis o dermis superficial responden mejor que las mayores de 2 cm o localizadas en el tejido celular subcutáneo. Son necesarios más estudios para establecer las dosis y pautas de tratamiento adecuadas.
Although metastatic melanoma has a poor prognosis, cutaneous metastases represent a special case given their ready accessibility, making it possible for dermatologists to apply local treatment. We report our experience with intralesional treatment with interleukin (IL) 2 in 7 patients with cutaneous metastases from malignant melanoma.
Material and methodsA total of 244 lesions in 7 patients with satellitosis and/or cutaneous metastases from malignant melanoma were treated with intralesional IL-2 twice a week. The maximum dose in each patient ranged from 3 to 18 million units per session, according to the number and size of lesions.
ResultsComplete or partial remission was achieved in almost all lesions (95.9 % and 3.7 %, respectively). Only 1 lesion (0.4 %)—the largest and located subcutaneously—did not respond to intralesional treatment and required alcoholization and subsequent surgical removal to achieve cure. All partial responses occurred in subcutaneous lesions larger than 2 cm. Treatment was well tolerated with only a few mild side effects (grade 1-2).
ConclusionsIL-2 may be an effective and well-tolerated treatment option in patients with satellitosis and cutaneous metastases from melanoma. Lesions smaller than 2 cm and located in the epidermis or superficial dermis respond better than those larger than 2 cm or located in the subcutaneous cellular tissue. More studies are necessary to establish appropriate doses and regimens.
El tratamiento del melanoma maligno (MM) en estadio avanzado constituye actualmente un reto para la comunidad científica en el siglo xxi, por lo que el diagnóstico precoz sigue siendo esencial para su curación. En estadios iniciales la escisión quirúrgica proporciona una tasa de curación cercana al 100 %, en cambio, no existe hasta el momento ninguna terapia adyuvante capaz de evitar las recidivas en los pacientes que presentan factores de mal pronóstico, como tampoco ningún tratamiento es eficaz cuando el melanoma se encuentra en estadio avanzado.
El pronóstico del melanoma en estadio III es por lo general bastante sombrío, con una supervivencia media a los 5 años que varía del 69 (IIIA, N1a) al 26 % (IIIC, N3)1. Si analizamos el estadio IV el pronóstico es aún peor, aunque varía mucho en función del número, tamaño y localización de las metástasis. Las metástasis cutáneas de melanoma, tanto locorregionales (IIIB/N2c, IIIC/N3) como a distancia (IV/M1a), se asocian a un mejor pronóstico y a una mayor supervivencia media en comparación con otras metástasis viscerales1,2. Además, por su localización más accesible, las metástasis cutáneas constituyen una entidad especial al tener una fácil y pronta detección y ser susceptibles del abordaje terapéutico precoz por el dermatólogo.
En las últimas décadas se han ensayado numerosos fármacos para el tratamiento del melanoma en estadios avanzados con eficacia variable, sin embargo, la capacidad del melanoma para inducir una respuesta inmunológica, junto a su frecuente resistencia a la quimioterapia y radioterapia, ha conducido a la búsqueda de soluciones terapéuticas en la manipulación del sistema inmune del paciente.
A continuación describimos nuestra experiencia de tratamiento intralesional con interleucina 2 (IL-2) en 7 pacientes con metástasis cutáneas de MM acumulada a lo largo de dos años.
Material y métodosPacientesSe han tratado un total de 7 pacientes (5 mujeres y dos varones) con edades comprendidas entre los 59 y 84 años, con satelitosis y metástasis cutáneas a partir de melanoma primario (5 lentiginosos acrales de extremidad inferior, uno en el cuero cabelludo y otro melanoma de extensión superficial en el tronco). En total hemos tratado 244 metástasis, correspondiendo más del 80 % de las lesiones tratadas a un único paciente (202 lesiones), distribuyéndose las restantes 42 entre los otros 6 pacientes.
Criterios de selección de pacientesSe consideraron elegibles aquellos que presentaban satelitosis o metástasis cutáneas de MM con ausencia de metástasis viscerales (tomografía por emisión de positrones [PET] o tomografía axial computarizada [TAC] negativas) y que no eran susceptibles de tratamiento quirúrgico o este había fallado (recidivas, continua aparición de lesiones) en más de una ocasión.
Régimen terapéuticoEn todos los casos se preparó una solución acuosa que contenía 18 millones de unidades internacionales (MUI) de IL-2 humana recombinante (Proleukin®) en 6ml de suero glucosado al 5 y al 1 % de albúmina. La solución se distribuía en jeringuillas de 1ml (administración de insulina), y en la primera sesión, para comprobar la tolerancia, se inyectaban 3 MUI de IL-2 (1ml de solución) en una o dos de las lesiones más grandes, o se distribuían en el resto si eran más pequeñas. Aunque con variaciones (ajuste al tamaño o a la respuesta progresiva de la lesión), seguimos las indicaciones sugeridas por el grupo de Garbe et al3, respecto a la dosis en relación con el tamaño de la lesión (< 5mm, 0,2ml; 5-10mm, 0,4ml; 10-20mm, 1ml; > 20mm, 2ml). La administración se realizaba en principio los martes y viernes, de forma continuada, hasta comprobar la desaparición clínica de las lesiones. En la mayoría de los casos se reducía a una única inyección semanal en las últimas sesiones hasta la total desaparición de las lesiones. En todos los pacientes el tratamiento se prolongó durante 4-6 semanas con posterioridad a la desaparición clínica y dermatoscópica de las lesiones.
Valoración de la respuestaComo criterio de respuesta terapéutica se utilizó la desaparición clínica y dermatoscópica de las lesiones tratadas. En los primeros casos se realizaron biopsias para confirmar histopatológicamente la desaparición de la metástasis, pero para simplificar, y una vez que tomamos experiencia, decidimos utilizar el criterio clínico y dermatoscópico para modificar la dosis o frecuencia de la administración de IL-2. En todos los casos nuestro objetivo era hacer un tratamiento de pacientes con melanoma, no realizar un estudio de validación de la utilidad de la IL-2.
En todos los casos se abrió una ficha de seguimiento (tabla 1) para el control de la dosis, la evolución, el control analítico y el registro de efectos adversos.
Ficha de seguimiento terapéutico: interleucina 2
| Nombre | Médico responsable (sello y firma) | Episodio n.º = | ||||||||||||||
| Diagnóstico | Tfno. | Historia clínica | Inicio | Fin | Motivo | □ Alta□ Rotación□ Otro: | ||||||||||
| Criterios de inclusion | Control | Basal | 1 semana | 2 semanas | 3 semanas | 4 semanas | 5 semanas | 6 semanas | 7 semanas | 8 semanas | 9 semanas | 10 semanas | 11 semanas | 12 semanas | > Final | |
| MTX cutáneas o subcutáneas de melanoma | Fecha: ___/___/___ | |||||||||||||||
| Exploración | ||||||||||||||||
| N.º MTX tratadas | ||||||||||||||||
| Rx tórax | ||||||||||||||||
| Toxicidad principal | Presión arterial (mmHg) | |||||||||||||||
| Urea/creatinina (mg/dl) | |||||||||||||||
| Hemograma | Leucocitos (10^3/μl) | |||||||||||||||
| Neutrófilos (10^3/μl) | ||||||||||||||||
| Linfocitos (10^3/μl) | ||||||||||||||||
| Hb (g/dl) | ||||||||||||||||
| Contraindicaciones | Plaquetas (10^3/μl) | |||||||||||||||
Absolutas:
| Bilirrubina (mg/dl) | |||||||||||||||
| GOT/GPT U/l | ||||||||||||||||
| LDH/FA UI/dl | ||||||||||||||||
| Cl/Na/K (mEq/l) | ||||||||||||||||
Relativas:
| ||||||||||||||||
| S-100B/MIA | ||||||||||||||||
| ECG (repetir según clínica) | ||||||||||||||||
| Reacción adverse | ||||||||||||||||
| * | ||||||||||||||||
| Consulta ENF | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | ||
| Consulta MED | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | □ | ||
| Otras reacciones y efectos medicamentosos (ver dorso) | Dosis utilizada/día Total acumulada (peso) = | |||||||||||||||
ECG: electrocardiograma; ENF: enfermera; FA: fosfatasa alcalina; GOT: transaminasa glutámico oxalacética; GPT: transaminasa glutámico pirúvica; Hb: hemoglobina; LDH: lactato deshidrogenasa; MED: médico; MIA: melanoma inhibitory activity; MTX: metástasis; Rx: radiografía.
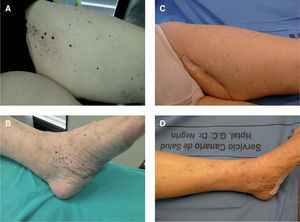
Se trata de una mujer de 63 años, sin antecedentes personales de interés, diagnosticada en diciembre de 2005 de MM primario en la planta del pie izquierdo, estadio IIIA (T3b- N1M0). Tras la extirpación quirúrgica de la lesión y disección ganglionar inguinal ipsilateral se inició el tratamiento coadyuvante con interferón (IFN) a2b a dosis altas. Cuatro meses más tarde la paciente consultó por la aparición de múltiples lesiones pigmentarias milimétricas que se extendían por toda la extremidad inferior derecha, desde la planta hasta la raíz del muslo (figs. 1A y B). La biopsia de una de las lesiones cutáneas confirmó el diagnóstico de metástasis de MM. El estudio de extensión (TAC corporal) realizado en este momento resultó negativo. En este punto se plantearon varias opciones terapéuticas, entre ellas la perfusión del miembro afectado con melfalán y factor de necrosis tumoral a (TNF-a), que finalmente fue descartada porque las lesiones excedían el área de perfusión del miembro y por la inexperiencia con este tratamiento en nuestro hospital, decidiéndose entonces iniciar tratamiento con taxol intravenoso e IL-2 intralesional. La dosis máxima diaria de IL-2 intralesional fue de 18 MUI administradas dos veces a la semana, repartidas en un total de 202 lesiones pigmentarias milimétricas a lo largo de toda la extremidad inferior izquierda (tabla 2). El tratamiento fue bien tolerado, sin efectos secundarios significativos salvo fiebre, escalofríos y dolores musculares que aparecían el mismo día de la administración de la IL, tras 4-6 horas, y cedían con antitérmicos. Tras 4 semanas de tratamiento comprobamos que algunas lesiones cutáneas comenzaban a rodearse de un halo acrómico para luego ulcerarse y terminar desapareciendo completamente. En este momento decidimos realizar biopsias de 4 lesiones en diferente estadio (tabla 3 y fig. 2). Finalmente, tras 18 semanas de tratamiento las lesiones habían desaparecido completamente, dejando una ligera hipopigmentación residual (fig. 1C y D). Una lesión dermo-hipodérmica de mayor tamaño (4 × 4cm) localizada en la región inguinal, adyacente a la cicatriz de linfadenectomía, no respondió al tratamiento intralesional con IL-2 y precisó alcoholización y posterior extirpación quirúrgica para su resolución. Pasados 6 meses del tratamiento, tras la remisión completa de todas las lesiones cutáneas, la paciente presentó progresión visceral de su enfermedad con múltiples metástasis hepáticas y pulmonares, falleciendo tres meses más tarde a pesar del tratamiento sistémico con temozolomida y bevacizumab. En total recibió 553 MUI de IL-2 durante 38 semanas.
Resumen de los datos clínicos y evolutivos de los pacientes
| Caso | Sexo | Edad | Localización MM primario | Índice de Breslow (mm) | Ganglio centinela | Tiempo hasta metástasis (meses) | N.° de metástasis | Metástasis < 5mm | Metástasis 5-10mm | Metástasis > 10mm | N.° sesiones | Duración (semanas) | Dosis total (MUI) | Acromía | Efectos adversos (grado OMS) | Metástasis viscerales | Tratamiento asociado | Tiempo desde las metástasis hasta la actualidad (meses) | Situación actual |
| 1 | F | 63 | Planta izquierda | 1,44 | + | 9 | 202 | 191 | 9 | 2 | 64 | 38 | 553 | En las lesiones tratadas | Fiebre, SP, dolor local | + | TMZ, BZM, Cirugía | 13 | RC de MTS cutáneas. Falleció a los 13 meses por diseminación visceral de MM |
| 2 | M | 76 | Cuero cabelludo | ND (Clark IV) | + | 4 | 16 | 16 | 0 | 0 | 30 | 20 | 90 | − | Fiebre, SP | − | TMZ | 24 | Vivo, libre de enfermedad, sin tratamiento desde hace 6 meses |
| 3 | F | 68 | Mama derecha | 1,3 | (−) | 5 | 8 | 6 | 2 | 0 | 20 | 15 | 90 | − | Fiebre, SP, dolor, disgeusia | − | − | 7 | RC, libre de enfermedad, desde hace 1 mes sin tratamiento |
| 4 | M | 84 | Pierna izquierda | 2,5 | (−) | 10H | 3 | 0 | 3 | 0 | 22 | 18 | 66 | − | Fiebre, infección local | − | − | 6 | Vivo, actualmente en tratamiento, sin evidencia de enfermedad |
| 5 | F | 59 | Pie izquierdo | MTS | NR | 0 | 8 | 0 | 1 | 7 | 25 | 16 | 98 | Vitíligo a distancia | Fiebre, SP, broncoespasmo | − | Cirugía | 6 | Viva, actualmente en tratamiento con 6 MUI/2 veces/semana, sin lesiones clínicas evidentes. Estudio de extensión (−) |
| 6 | F | 84 | Pierna izquierda | 4,12 | + | 1 | 6 | 4 | 2 | 0 | 20 | 13 | 120 | − | Linfangitis, SP | − | − | 5 | Viva, actualmente en tratamiento con 6 MUI/ semana, lesiones en fase costrosa, no nuevas lesiones. Estudio de extensión (−) |
| 7 | F | 71 | Tobillo izquierdo | 6,0 | NR | 60H | 1 | 0 | 0 | 1 | 27 | 17 | 81 | − | SP | − | Cirugía | 38 | Viva, libre de enfermedad, sin tratamiento desde hace 18 meses |
+: positivo; (−): negativo; BZM: bevacizumab; MM: melanoma maligno; MTS: metástasis; ND: no disponible; NR: no realizado; OMS: Organización Mundial de la Salud; RC: remisión completa; SP: síntomas pseudogripales; TMZ: temozolomida.
Correlación clínico-patológica de lesiones cutáneas en diferente estadio en la paciente 1
| Lesión | Descripción clínica | Descripción histopatológica |
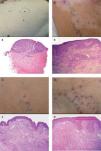
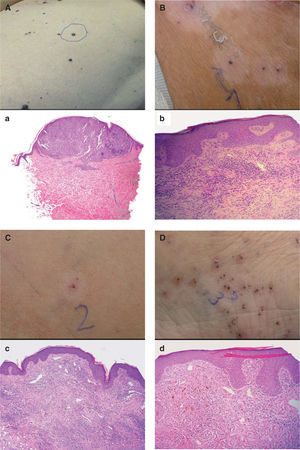
| 1 | Lesión metastásica de reciente aparición en el muslo izquierdo antes del tratamiento con IL-2 intralesional (fig. 2A) | La biopsia demostró la presencia de nidos de melanocitos en la dermis superficial con abundantes mitosis, confirmándose el diagnóstico de metástasis de melanoma (fig. 2a) |
| 2 | Lesión pigmentada (aparentemente persistente) rodeada de halo hipopigmentado, localizada en la cara interna de muslo izquierdo, tras 4 semanas de tratamiento con IL-2 intralesional (fig. 2B) | La biopsia mostró un infiltrado linfocitario intra y peritumoral con necrosis del tejido tumoral y melanófagos. También se apreciaban algunos eosinófilos pero no células tumorales viables (fig. 2b) |
| 3 | Lesión ulcerada (aparentemente desaparecida) rodeada de halo hipopigmentado, localizada en la cara interna de muslo izquierdo, tras 4 semanas de tratamiento con IL-2 intralesional (fig. 2C) | La biopsia mostró un infiltrado linfocitario aun más denso que en la lesión 2, con presencia de abundantes melanófagos pero sin apreciarse células tumorales (fig. 2c) |
| 4 | Lesión pigmentada (aparentemente persistente) sin halo hipopigmentado, localizada en la cara interna del pie izquierdo, tras 4 semanas de tratamiento con IL-2 intralesional (fig. 2d) | Se apreciaba un infiltrado linfocitario en la dermis superficial menos denso que en las lesiones anteriores, pero al igual que en éstas no existían células tumorales vitales ni en la hematoxilina-eosina ni en la inmunohistoquímica con S-100 y HMB45 (fig. 2D) |
IL-2: interleucina 2.
Paciente 1. Correlación clínico-patológica de diferentes lesiones en la paciente. (A) Lesión metastásica en el muslo izquierdo previa al tratamiento con interleucina 2 (IL-2). a. Aspecto histológico de la lesión A (hematoxilina-eosina, 100×). (B) Lesión pigmentada en la cara interna del muslo izquierdo, rodeada de halo hipopigmentado tras 4 semanas de tratamiento con IL-2. b. Aspecto histológico de la lesión B (hematoxilina- eosina, 400×). (C) Lesión ulcerada en el muslo izquierdo, rodeada de halo hipopigmentado, tras 4 semanas de tratamiento con IL-2. c. Aspecto histológico de la lesión C (hematoxilina- eosina, 200×). (D) Lesión pigmentada en la cara interna del pie izquierdo tras 4 semanas de tratamiento con IL-2. d. Aspecto histológico de la lesión D (hematoxilina- eosina, 400×).
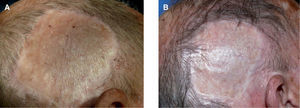
Se trata de un varón de 76 años, diagnosticado en mayo de 2006 de MM en el cuero cabelludo, región temporal derecha, con presencia de lesiones satélites. Se realizó extirpación de las lesiones cutáneas y biopsia de ganglios centinelas, obteniéndose dos ganglios afectados de melanoma en el territorio retroauricular y cervical, respectivamente; el posterior vaciamiento de la cadena cervical y retroauricular ipsilateral resultó negativo (0/34). El estudio de extensión practicado en ese momento (TAC corporal y PET) también resultó negativo (estadio IIIC [T3b- N3M0]). Se inició tratamiento adyuvante con IFN a2b a altas dosis y un mes más tarde consultó por presentar una lesión pigmentada de 0,5cm en la zona temporal derecha, de reciente aparición, junto al borde superior de la cirugía previa. La biopsia de la lesión cutánea confirmó el diagnóstico de metástasis de MM. El paciente continuó el tratamiento de mantenimiento con IFN por vía subcutánea y 4 meses mas tarde presentó 4 nuevas lesiones pigmentarias, puntiformes, en la zona adyacente a la cirugía que se biopsiaron con diagnóstico de metástasis de MM. En este momento se interrumpió el tratamiento con IFN y se realizó un nuevo estudio de extensión que también resultó negativo, decidiéndose iniciar tratamiento con temozolomida oral, a pesar del cual durante los 4 meses posteriores se le extirparon al paciente hasta 18 lesiones pigmentarias milimétricas compatibles con metástasis de melanoma. En ese momento, dada la escasa respuesta del paciente a la quimioterapia sistémica y la ausencia de metástasis viscerales, decidimos iniciar tratamiento con IL-2 intralesional, 3 MUI por sesión, dos veces a la semana, distribuidas por todas las lesiones clínicamente identificables. En total se trataron 16 lesiones pigmentadas, milimétricas, localizadas sobre el injerto cutáneo de reconstrucción quirúrgica o en las zonas adyacentes al mismo (fig. 3A), consiguiéndose la remisión completa del 100 % de las lesiones tras 14 semanas de tratamiento, aunque éste se prolongó durante 6 semanas con posterioridad a la resolución clínica de las lesiones cutáneas. El tratamiento fue bien tolerado, presentando solamente como efecto secundario un síndrome pseudogripal con febrícula y malestar general que aparecía alrededor de las 8 horas de la administración de la IL-2 y cedía con paracetamol oral. En la actualidad, tras 6 meses de finalización del tratamiento con IL-2 intralesional, no solamente han desaparecido las lesiones que presentaba, sino que no han aparecido nuevas lesiones pigmentarias sospechosas en el territorio (fig. 3B). En total recibió 90 MUI de IL-2 durante 20 semanas.
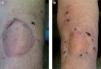
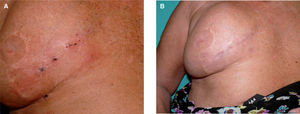
Paciente 3Se trata de una mujer de 68 años, diagnosticada en mayo de 2007 de MM en la región mamaria derecha estadio IB (T2aN0M0) con ganglio centinela negativo. Siete meses más tarde experimentó la aparición brusca de 6 lesiones pigmentadas milimétricas (la mayor de ellas de 0,8cm de diámetro) en la región pericicatricial, confirmándose el diagnóstico de satelitosis de melanoma en el estudio histopatológico (fig. 4A). El estudio de extensión en ese momento resultó negativo, evolucionando la paciente a un estadio IIIB (T2aN2cM0). Como en los casos anteriores se ofreció un tratamiento paliativo de las lesiones cutáneas metastásicas con la administración de IL-2 intralesional, a dosis de 6 MUI por sesión, distribuidas entre las 8 lesiones, durante dos veces a la semana. El tratamiento fue bien tolerado a excepción de dolor y quemazón local en las horas posteriores a la administración del fármaco y febrícula que se controló con paracetamol a dosis habituales. La respuesta al tratamiento fue excelente; a las 6 semanas las lesiones comenzaron a ulcerarse, con posterior formación de costra y terminaron por desaparecer completamente tras 12 semanas de tratamiento (fig. 4B). Actualmente la paciente se encuentra en remisión completa de las lesiones cutáneas, con TAC corporal normal y sin tratamiento desde hace un mes. En total recibió 90 MUI de IL-2 durante 15 semanas.
Paciente 4Se trata de un varón de 84 años; en diciembre de 2006 se le extirpó un MM en la región pretibial izquierda de 2,5mm de Breslow, con estudio de ganglio centinela negativo (estadio IIA [T3aN0M0]). Trece meses más tarde presentó una lesión nodular hipocrómica inferior a la cicatriz previa que se extirpó con diagnóstico histopatológico de metástasis de melanoma. En ese momento el estudio de extensión resultó negativo estadio (IIIB [T3aN2cM0]). En las semanas posteriores continuaron apareciendo lesiones similares pericicatriciales, por lo que se le ofreció tratamiento con IL-2 intralesional. Se le administraron entre 3-6 MUI por sesión, repartidas en un total de tres lesiones, durante dos días a la semana. El tratamiento fue bien tolerado, sin embargo el paciente desarrolló un cuadro de infección cutánea en la zona de inyección durante la sexta semana de tratamiento que obligó a la suspensión del mismo durante 10 días y a la administración de antibióticos orales de amplio espectro (amoxicilina + ácido clavulánico), reanudándose posteriormente el tratamiento sin efectos secundarios significativos. Actualmente, tras 18 semanas de tratamiento, las lesiones cutáneas han desaparecido clínicamente y el paciente se encuentra sin tratamiento desde hace una semana con TAC corporal normal. En total recibió 66 MUI de IL-2 durante 18 semanas.
Paciente 5Se trata de una mujer de 59 años, con antecedentes personales de asma bronquial y artrosis cervical. Refería historia de patología ungueal en el primer dedo del pie izquierdo desde hace varios años que precisó de onicectomía en varias ocasiones por su podólogo. En enero de 2008 comenzó con múltiples nódulos de localización dermo-hipodérmica distribuidos en todo el miembro inferior izquierdo, desde el dorso del pie hasta la ingle. La biopsia de una de las lesiones confirmó el diagnóstico de metástasis de melanoma (con primario desconocido, probablemente subungueal, estadio IIIC [TxN3M0]). La PET confirmó la presencia de 8 lesiones nodulares en el trayecto linfático del miembro inferior izquierdo, sin evidencia de metástasis en otras localizaciones. En ese momento se decidió iniciar tratamiento con IL-2 intralesional a dosis de 9 MUI por sesión distribuidas en todas las lesiones, dos veces a la semana. Tras 4 semanas de tratamiento, y al confirmarse que las lesiones habían disminuido de tamaño y no habían aparecido otras nuevas, se decidió realizar extirpación de las 8 lesiones, encontrándose en todas ellas metástasis de melanoma con intenso infiltrado inflamatorio intra y peritumoral y extensas áreas de necrosis intratumoral y en el tejido adiposo circundante. Tras tres semanas la paciente presentó una nueva lesión pigmentada de localización periungueal en el primer dedo del pie izquierdo, por lo que se retomó el tratamiento con IL-2 intralesional a dosis de 3 MUI, dos veces a la semana. El tratamiento fue bien tolerado, presentando la paciente dolor local con la administración y febrícula que aparecía horas más tarde de la administración del fármaco. Además en dos ocasiones presentó broncoespasmo, coincidiendo con la administración del fármaco, que no se repitió en dosis posteriores. Cabe destacar también que tras 12 semanas de tratamiento la paciente desarrolló lesiones acrómicas simétricas en ambos hombros que fueron diagnosticadas clínicamente de vitíligo. Actualmente la paciente continúa en tratamiento con 6 MUI dos veces por semana, sin evidencia de lesiones nuevas y con remisión clínica de las tratadas. El estudio de extensión (TAC corporal) realizado hace una semana resultó negativo. En total recibió 98 MUI de IL-2 durante 16 semanas.
Paciente 6Se trata de una mujer de 84 años; en enero de 2008 se le extirpó un MM ulcerado en la región pretibial izquierda, con índice de Breslow de 4,12mm. La técnica quirúrgica se completó con la cobertura del defecto quirúrgico con un injerto libre de piel parcial y el estudio del ganglio centinela que resultó positivo. Se realizó entonces la linfadenectomía regional inguinal izquierda con el estudio de 11 ganglios, de los que 7 fueron positivos para metástasis de melanoma (estadio IIIC [T4bN3M0]). En ese momento la paciente y su familia declinaron la posibilidad de continuar con tratamientos sistémicos para el control de su enfermedad.
En visitas posteriores se objetivó la aparición progresiva de lesiones pigmentadas milimétricas en zonas adyacentes al injerto y algo más alejadas (fig. 5A), compatibles clínicamente con satelitosis de melanoma, que se confirmó con la biopsia de una de ellas. En ese momento se realizó una TAC corporal que resultó negativa y se le puso tratamiento paliativo con IL-2 intralesional a dosis de 3-6 MUI por sesión, durante dos días a la semana. Las dosis se distribuyeron de manera uniforme entre un total de 6 lesiones cutáneas localizadas alrededor del injerto quirúrgico. La paciente toleró bien el tratamiento, sin el desarrollo de efectos adversos significativos salvo edema y eritema en la extremidad afectada, que obligó a realizar ecografía doppler de dicho miembro para descartar trombosis venosa profunda proximal que fue informada con el diagnóstico radiológico de linfangitis y seroma secundarios a la cirugía de vaciamiento inguinal. Actualmente la paciente se encuentra en la decimotercera semana de tratamiento, recibiendo 6 MUI de IL-2 una vez a la semana. Todas las lesiones cutáneas se encuentran en fase costrosa (fig. 5B) y con estudio de extensión negativo. En total recibió 120 MUI de IL-2 durante 13 semanas.
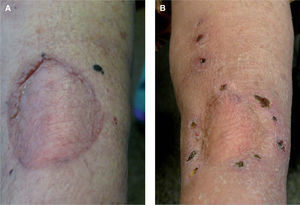
Paciente 7Se trata de una mujer de 71 años, diagnosticada en marzo de 2000 de MM en el tobillo izquierdo con índice de Breslow de 6mm y Clark V, estadio IIB (T4aN0M0). Cinco años más tarde presentó un nódulo de 3 × 2cm de diámetro en la región inguinal izquierda que se extirpó, confirmándose el diagnóstico de metástasis ganglionar de melanoma que se extendía fuera del ganglio y correspondía a un conglomerado adenopático (estadio IIIC). La paciente recibió tratamiento con IFN a2b a dosis altas y 8 meses más tarde consultó por presentar una nueva lesión nodular subcutánea, profunda, indurada, de 4 × 3cm de diámetro en la cara interna de la rodilla izquierda, sin evidencia de metástasis en otras localizaciones que se confirmó con una TAC corporal. Se le propuso tratamiento quirúrgico y la paciente lo rechazó, así como la posibilidad de tratamiento quirúrgico y/o quimioterapia sistémica, por lo que se le planteó iniciar tratamiento con IL-2 intralesional que finalmente aceptó. Tras 4 meses de tratamiento con 3 MUI/dos veces por semana de IL-2 intralesional, con escasos efectos secundarios (fiebre y dolor articular coincidiendo con la administración del fármaco, pero que desaparecía en pocas horas con paracetamol 500mg vía oral), la lesión había reducido notablemente su tamaño, por lo que se planteó nuevamente tratamiento quirúrgico de la misma. La extirpación confirmó la presencia de metástasis de melanoma con marcada reacción inflamatoria y necrosis. Desde entonces la paciente se encuentra en remisión completa, sin medicación y sin evidencia de enfermedad diseminada, habiendo transcurrido 18 meses hasta la fecha. En total recibió 81 MUI de IL-2 durante 17 semanas.
DiscusiónLa progresión intralinfática del melanoma conduce a la aparición de satelitosis y metástasis en tránsito entre la localización primaria y los ganglios linfáticos regionales, que de forma indistinta e independientemente del número de las mismas asocian un empobrecimiento del pronóstico para el paciente (53 % de supervivencia estimada a los 5 años), en caso de no existir afectación concomitante de ganglios linfáticos regionales (estadio IIIB), o aún peor si asocian afectación locorregional linfática (estadio IIIC, 26 % de supervivencia estimada a los 5 años)1,4. La incidencia de este evento de progresión varía según los autores entre el 1 y el 19 %1,5, y se reconoce que afecta mayoritariamente a las extremidades inferiores (hasta el 70 % de los casos)6. De nuestra serie 5 casos desarrollaron las metástasis en las piernas, uno en el tronco y otro en el cuero cabelludo.
En esta situación clínica de pacientes con metástasis en tránsito y satelitosis se han utilizado diversas alternativas terapéuticas: quimioterapia sistémica, inmunoterapia, radioterapia, cirugía, bio y quimioterapia en perfusión aislada de extremidad, inyección intralesional de diversos fármacos y agentes terapéuticos o procedimientos de destrucción local entre los que se encuentran la crioterapia, la electrofulguración, el láser de CO2 y la electroquimioterapia7,8.
Las respuestas obtenidas con la mayoría de estas modalidades son muy pobres, con escaso impacto en la supervivencia global. De ellas, la perfusión aislada de extremidad con TNF-a y melfalán es la que quizás muestre una tasa de respuesta superior al resto, especialmente en los casos en los que aparecen metástasis regionales de gran tamaño o devastadoras9. No obstante, esta modalidad terapéutica requiere una combinación de situación clínica del paciente y un cierto adiestramiento técnico, que no siempre está al alcance de todos los servicios que atienden estos casos, por lo que su uso no está generalizado10,11. Los pacientes 1 y 5 de nuestra serie podrían haber sido candidatos a dicha técnica, pero nos fue imposible realizarla, por lo comentado anteriormente. Entre las otras alternativas terapéuticas más asequibles se ha utilizado la inyección intralesional de IL-2 con una elevada tasa de respuesta en algunos estudios y con escasos efectos secundarios significativos3, que fue nuestra opción terapéutica en este grupo de pacientes que cumplían, en nuestra opinión, los criterios de elección.
La IL-2 es una glucoproteína, descrita en 1976 como factor de crecimiento de linfocitos T (LT)12. Estructuralmente es una linfocina de 133 aminoácidos, 4 a hélices, codificada por un gen único en el cromosoma 4q2613. Es secretada principalmente por LT helper activados, aunque también por linfocitos CD8 + y células dendríticas.
Desempeña un papel central en la regulación del sistema inmune, estimulando la citotoxicidad de LT y natural killer, además de actuar como cofactor en la activación de células B y macrófagos14,15. Ejerce su acción a través de la estimulación del receptor transmembrana (IL-2R), un receptor transmembrana formado por tres subunidades proteicas, cuyo dominio intracitoplasmático se encuentra asociado a una serie de proteincinasas de la familia Janus Kinasa (Jak 1, Jak 3). Al ser estimulado por el ligando, el receptor sufre un cambio conformacional que provoca la fosforilación de las proteincinasas asociadas, activándose unas a otras, lo que en última instancia provoca la estimulación de otro grupo de proteínas citoplasmáticas de la familia STAT(signal transducer and activator of transcription). Estos factores de transcripción al ser estimulados por las Jak activadas se dimerizan, translocándose al núcleo donde actuarán directamente sobre el ADN promoviendo la expresión de genes específicos que intervienen en el mecanismo de la inflamación14,16.
La IL-2 fue aprobada en 1992 para el tratamiento del carcinoma de células renales y en 1998 para el MM17. Clínicamente ha sido evaluada en múltiples dosis y esquemas por vía intravenosa18, inhalada19 o intralesional3. La administración intravenosa ha conseguido eficacias cercanas al 20 %, siendo su principal limitante la alta toxicidad que impide el empleo de dosis adecuadas en muchos pacientes. Uno de los principales efectos secundarios es el denominado síndrome de debilidad capilar, que consiste en una acumulación de líquidos en el espacio extravascular, secundario al aumento de permeabilidad capilar inducido por las dosis de IL-2, que puede producir edema generalizado, aumento de peso, hipotensión, taquicardia, congestión pulmonar, oliguria, insuficiencia renal y muerte15. La principal ventaja de la administración intralesional, además de su elevada efectividad, es la escasez de efectos secundarios y la leve intensidad de los mismos. Esto es posible debido a las elevadas concentraciones del fármaco en el interior del tumor que se consiguen por esta vía, utilizando dosis mucho menores que por vía intravenosa3.
En nuestro caso hemos obtenido remisiones completas o parciales (criterio clínico y dermatoscópico para la mayoría de casos, e histopatológico en algunos de ellos, por los motivos que se han explicado en la metodología) de las lesiones cutáneas en todos los pacientes con ausencia de efectos secundarios significativos. Una sola lesión de localización subcutánea y de mayor diámetro (4 × 6cm), en la paciente 1, no respondió al tratamiento y precisó de alcoholización y posterior extirpación quirúrgica para su resolución.
Los efectos secundarios más frecuentemente presentados por nuestros pacientes consistieron en fiebre, escalofríos y dolores articulares a las pocas horas después de la administración del fármaco, que no imposibilitaban las actividades de la vida diaria y que cedían con tratamiento analgésico o antitérmico. Otros efectos han sido: dolor de la zona de inyección, vómitos, infección local, linfangitis superficial y broncoespasmo. No hemos encontrado en ningún caso afectación neurológica o psicológica como se ha descrito previamente20. Es importante resaltar que todos los efectos secundarios observados en nuestros pacientes han sido de intensidad leve-moderada (grados 1 y 2), según la última clasificación de la graduación de los efectos adversos del National Cáncer Institute (NCI)21.
La paciente 1 (y sólo ella) desarrolló en muchas de las lesiones tratadas una acromía perilesional, sin que refiriera antecedentes personales ni familiares de vitíligo o halo nevus previos. Por otra parte, la paciente 5 desarrolló lesiones acrómicas simétricas en ambos hombros, que fueron diagnosticadas de vitíligo, mientras recibía la decimotercera dosis de IL-2. El desarrollo de vitíligo en asociación a melanoma, o en respuesta a su tratamiento, es un hecho conocido y se ha relacionado con un mejor pronóstico o mejor respuesta terapéutica22-26, sugiriéndose su aparición en relación con la respuesta inmunológica inducida por el tratamiento contra antígenos compartidos por las células de melanoma y los melanocitos normales27,28. Curiosamente, la acromía de la paciente 1 aparecía antes de la desaparición de las lesiones, lo que podría sugerir lo mencionado respecto a la respuesta inmunológica compartida por antígenos melanocitarios secundarios a respuesta terapéutica, si bien las lesiones que no los presentaron desaparecieron al mismo tiempo, por lo que este hallazgo, aparte del interés teórico, no parecer guardar valor práctico. Histopatológicamente, las lesiones con acromía clínica mostraban un denso infiltrado linfocitario intratumoral y peritumoral con necrosis del tejido tumoral, melanófagos y algunos eosinófilos, pero no se apreciaban células tumorales vitales ni con hematoxilina ni en la inmunohistoquímica con S-100 y HMB45. En las lesiones tratadas pero que no presentaron acromía tampoco se encontraron células tumorales vitales, aunque en estos casos el infiltrado intra y peritumoral era mucho más escaso.
Las dosis óptimas de tratamiento todavía no están establecidas. En nuestro caso empleamos un máximo de 18 MUI/día en la paciente 1 y un mínimo de 3 MUI/día en el paciente 2, variando en función del tamaño y el número de lesiones, con un máximo de 6 MUI/lesión, administradas dos veces a la semana, hasta la desaparición completa de las lesiones. La pauta fue muy flexible, reduciendo la dosis y frecuencia de aplicación en función de la paulatina desaparición de las lesiones.
Lo que sí parece establecido, y nosotros hemos podido comprobar en nuestros pacientes, es que la respuesta no depende del número ni el tiempo de evolución de las lesiones, si no del tamaño y localización histológica de las mismas, respondiendo mejor las lesiones de pequeño tamaño y localizadas en epidermis y/o dermis superficial respecto a las mayores de 2cm o localizadas en el tejido celular subcutáneo, tal como se ha descrito previamente.3,29. En nuestra experiencia las lesiones de mayor tamaño o localizadas en el tejido subcutáneo responden más lentamente, o no acaban de responder completamente. En algunas lesiones de gran tamaño, incluso, observamos que la administración intralesional de IL-2 produce una inflamación metastásica central («nuclear»), con la subsiguiente necrosis y cavitación de la lesión, pero sin llegar a desaparecer, por lo que requieren posterior exéresis quirúrgica. Ejemplo de ello fueron las pacientes 1 y 7, presentando esta última una única lesión en la cara interna de la rodilla izquierda, en la que se descartó de entrada tratamiento quirúrgico por temor al daño colateral en la estructura osteotendinosa de la rodilla. Tras la inyección repetida de IL-2 la lesión se necrosó y cavitó, pero no desapareció, aunque sí se redujo de tamaño y posteriormente fue extirpada con buenos resultados (de hecho la paciente sigue libre de enfermedad tras 7 años de diagnóstico, tres de ellos en estadio IIIC).
Desde luego, cuando el número de metástasis locales o en tránsito es escaso, la extirpación quirúrgica puede ser la primera medida de elección. Sin embargo, nos parece mucho más fácil el manejo de los casos de múltiples lesiones (la paciente 1 presentaba en su inicio más de 100 lesiones) con IL-2 intralesional. Además, hay que tener en cuenta que con frecuencia el melanoma primario localizado en la pierna o la planta tiene una gran capacidad de producción de lesiones metástasicas múltiples (nuestros pacientes 1 y 2 presentaron múltiples lesiones, de forma consecutiva, que fueron extirpadas en varias ocasiones, antes de decidir terapia con IL-2 intralesional, por lo que ante ese tipo de melanoma es esperable tener que recurrir a esta elección terapéutica. Esta postura se vería además apoyada por la experiencia de que cuanto menor sea el tamaño de las lesiones tratadas mejor resultado se obtiene, como hemos señalado en el párrafo anterior.
Su elección sería más dudosa en los casos en los que se acompañan de metástasis viscerales o a distancia, dado que no parece, según estudios previos, que la administración intratumoral de IL-2 tenga actividad sistémica medible, ejerciendo su actividad sólo a nivel local3,30. Sin embargo, en este punto discrepamos ligeramente con los trabajos previos, pues aunque en nuestros casos no hemos podido observar ninguna respuesta a distancia atribuible a la administración local de IL-2, al no observar regresión en otras metástasis presentes simultáneamente y no tratadas (fueron tratadas todas las lesiones clínicamente identificables), suponemos que pueda existir algún efecto sistémico, o al menos locorregional, pues el paciente 2 desarrolló múltiples metástasis cutáneas progresivamente (le habían extirpado un total de 28 metástasis cutáneas en cuatro meses) y desde la administración de la IL-2 intralesional no sólo desaparecieron las metástasis existentes, sino que no ha desarrollado ninguna nueva metástasis en los 8 meses transcurridos hasta la fecha desde el inicio del tratamiento con IL-2 intralesional. Por otra parte, también consideramos que la presencia de vitíligo a distancia tras 12 semanas de tratamiento en la paciente 5 se corresponde con la actividad sistémica de la IL-2 intralesional.
No obstante, y aun en casos con metástasis múltiples de pacientes en estadio IV, no sería desdeñable el uso de IL-2 intralesional, en combinación con otra terapia paliativa, dado el enorme efecto beneficioso que tiene para el paciente el observar cómo sus lesiones visibles (las cutáneas) van desapareciendo en respuesta al tratamiento. Desde luego la elección del paciente ideal para la administración de IL-2 intratumoral sería aquel con exclusivas lesiones en tránsito o con pocas metástasis viscerales o estables, como por ejemplo las de pulmón (M1b), donde además cabría la posibilidad de asociar IL-2 inhalada31.
A modo de resumen, nos gustaría destacar que 4 de los pacientes tratados (casos 2, 3, 4 y 7) se encuentran actualmente en remisión completa de las lesiones y sin tratamiento, siendo la paciente número 7 la de mayor tiempo en remisión completa (18 meses hasta la fecha). Otros dos pacientes (casos 5 y 6) permanecen en tratamiento actualmente sin evidencia de lesiones metastásicas nuevas y con remisión completa de las metástasis tratadas. Por último, la paciente 1, pese a la buena respuesta local (desaparición completa de todas las lesiones cutáneas) desarrolló diseminación visceral de la enfermedad, por lo que nos vimos obligados a suspender el tratamiento intralesional y administrar tratamiento quimioterápico sistémico.
Si bien el objetivo terapéutico teórico del tratamiento del melanoma metastásico es la obtención de respuestas totales, la obtención de objetivos intermedios, como por ejemplo la respuesta parcial y la estabilización de la enfermedad, sobre todo en aquellos casos que se presentan de forma concomitante o consecutiva con metástasis locorregionales en tránsito y diseminadas, pueden ser bastante realistas. En este sentido, puede ser muy esperanzadora la utilización combinada de IL-2 a dosis bajas junto a otros fármacos (temozolomida, factor estimulante de colonias de macrófagos-granulocitos, etc.), como señalan algunos trabajos32-35. Nuestros pacientes 1 y 2 asociaron tratamiento intralesional de IL-2 con temozolomida oral (el paciente 2 incluso mantuvo el tratamiento con temozolomida tras la suspensión de la IL-2). En un reciente ensayo se ha propuesto un protocolo de asociación de tratamiento tópico con imiquimod a la inyección intralesional de IL-2, con prolongación del tratamiento con IL-2 a dosis intermedias incluso después de la desaparición de metástasis cutáneas36, con posteriores resultados de su potencial acción inmunológica sistémica37. Éste es otro punto, el de la utilización de dosis intermedias y seriadas de IL-2, que puede ser prometedor, aunque habrá que validarlo en el futuro. En definitiva, y ante la carencia de un tratamiento curativo para el melanoma, parece ser que la estrategia de « pequeñas » intervenciones inmunológicas, sumadas o seriadas, puede ser una vía útil, práctica y no agresiva para manejar de forma paliativa este escenario clínico.
En resumen, presentamos nuestra experiencia del tratamiento intratumoral con IL-2 en 244 lesiones correspondientes a 7 pacientes con satelitosis y metástasis en tránsito de melanoma cutáneo. Señalamos la buena respuesta obtenida en todos los casos, y resaltamos la importancia de iniciar el tratamiento ante la aparición de las primeras metástasis en tránsito, al haber comprobado una mayor eficacia en las lesiones de pequeño tamaño. Queda aún por establecer las dosis óptimas del tratamiento y la efectividad del mismo en relación con la supervivencia global, si bien creemos que pueden tener un papel importante en la estabilidad de la enfermedad. Asimismo, queda aún por esclarecer el posible efecto sistémico de la IL-2 administrada intratumoralmente, como agente único, o en asociación con otras moléculas inmunomoduladoras o quimioterápicas.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.