Los ensayos clínicos han validado el uso de nivolumab y pembrolizumab en adyuvancia, en términos de supervivencia libre de recaída, en pacientes con melanoma resecado en estadios III y IV. La evidencia en pacientes en la práctica clínica es limitada.
Material y métodoPara el estudio CADIM (Caracterización de la ADyuvancia con Inmunoterapia en pacientes con Melanoma) se seleccionó de febrero de 2018 a diciembre de 2022, a 81 pacientes con melanoma en estadios III y IV resecados que recibieron nivolumab o pembrolizumab en adyuvancia.
ResultadosLa distribución por estadios fue del 81,5% (n=71) para estadios III, mientras que 15 pacientes (18,5%) presentaban un estadio IV resecado. Entre los estadios III, 38 pacientes eran IIIC (46,9%). Con una mediana de seguimiento de 22,8 meses, la supervivencia libre de recaída en la población con intención de tratar fue del 84% a un año y del 81,5% a 2 años. La supervivencia global fue del 99% a un año y del 91,4% a 2 años. Los efectos adversos relacionados con el tratamiento de grado 3-4 aparecieron en el 12,3% de los pacientes.
ConclusionesEste estudio presenta los resultados de pacientes con melanoma en estadios III y IV resecados tratados con anti-PD-1 en adyuvancia. En él se confirma la eficacia y seguridad observada en ensayos clínicos. Contrastar los datos de los ensayos clínicos con la evidencia encontrada en práctica clínica es necesario para hacer más útil, confiable y cercano el uso de estos fármacos.
Clinical trials have validated the use of nivolumab and pembrolizumab as adjuvant therapies regarding relapse-free survival in patients with resected stage III and IV melanoma. Evidence in real-world patients is currently limited.
Material and methodThe CADIM trial (Characterization of adjuvant immunotherapy in melanoma patients) recruited a total of 81 patients with resected stage III and IV melanoma on nivolumab or pembrolizumab as adjuvant therapy from February 2018 through December 2022.
ResultsThe stage distribution rate was 81.5% (n=71) for stage III, while 15 patients (18.5%) had resected stage IV. Among stage III patients, 38 were stage IIIC (46.9%). With a median follow-up of 22.8 months, the relapse-free survival in the intention-to-treat population was 84% at one year and 81.5% at 2 years. The overall survival rate was 99% at one year and 91.4% at 2 years. Grade 3-4 treatment-related adverse events were reported in 12.3% of the patients.
ConclusionsThis study shows the results of resected stage III and IV melanoma patients on adjuvant therapy with anti-PD-1, and eventually confirmed the safety and efficacy profile described by clinical trials. Comparing clinical trial data with real-world evidence is necessary for a more practical, reliable, and accessible use of these drugs.
Tanto la inmunoterapia como la terapia dirigida han mostrado eficacia en los pacientes con melanoma metastásico, lo que ha modificado el escenario actual de estos pacientes1-3 y ha mostrado posteriormente el beneficio en situación adyuvante en pacientes de alto riesgo3,4. Los ensayos CheckMate 238 y Keynote 054 son ensayos en fase III que incluían a pacientes con melanoma en estadios (AJCC 7.a edición) iiiB, iiiC y IV resecados y iiiA (con afectación ganglionar mayor de 1mm), iiiB y iiiC, respectivamente. Si bien el brazo control difería (ipilimumab a dosis altas para el CheckMate 238 y placebo para el Keynote 054), ambos fármacos (nivolumab y pembrolizumab) demostraron un beneficio en la supervivencia libre de recaída (SVLR): 50% para nivolumab y 39% con ipilimumab a los 5 años y 59,8% para pembrolizumab frente al 41,4% en el grupo placebo a 5 años. Actualmente, la SVLR, siguiendo la clasificación de la AJCC en su 8.a edición, con nivolumab a 5 años es del 66% y del 49% con ipilimumab en estadios iiiB, del 44% vs. 39% para estadios iiiC y del 28% vs. 0% para los iiiD5. La supervivencia libre de metástasis a distancia para pembrolizumab a 3,5 años es del 80,8% en estadio iiiA vs. 70,8% con placebo, del 68,1% vs. 51% en estadios iiiB y del 55,8% vs. 39,2% en estadios iiiC (AJCC 7.a edición)5.
Los efectos secundarios de grado 3-4 relacionados con el tratamiento aparecieron en el 14,4% de los pacientes con nivolumab y en el 14,5% con pembrolizumab, con una tasa de abandono del 7,7% y del 14,4%, respectivamente6,7. La calidad de vida no se alteró con nivolumab ni con pembrolizumab7,8.
Los resultados en la práctica clínica habitual pueden ser distintos a los de los ensayos. Los estudios de registro se realizaron utilizando la 7.a edición de la clasificación de la AJCC y todos los pacientes fueron intervenidos con linfadenectomía tras la positividad de la biopsia selectiva del ganglio centinela (BSGC). Sin embargo, actualmente se utiliza la 8.a edición de la AJCC9 y, tras los resultados de los estudios MLST II y DeCOG10,11, hay un uso mínimo de la linfadenectomía, por lo que es útil obtener datos del uso de adyuvancia en pacientes con melanoma en la práctica clínica.
Estos datos son necesarios para validar los obtenidos en los ensayos, si bien en adyuvancia disponemos de pocos estudios. De Meza et al. han comunicado un análisis de práctica clínica de 641 pacientes en estadios III o IV en adyuvancia con nivolumab y pembrolizumab tras linfadenectomía y reclasificación a la 8.a edición de la AJCC. A un año, la SVLR fue del 70,6%, y la toxicidad de grado 3 o mayor apareció en el 18% de los pacientes12. En otro estudio de Hofmann et al., de 30 pacientes tratados con nivolumab, observaron el 40% de recurrencias, la mitad durante la adyuvancia, con el 16,7% de toxicidad de grado 3-413. El grupo alemán comunicó los resultados de un análisis retrospectivo de 100 pacientes que recibían inmunoterapia con una SVLR estimada a un año del 64,8%, con una toxicidad de grado 3 o mayor del 16% y una suspensión por efectos adversos del 22%14. Más recientemente, se comunicaron los resultados de una gran cohorte de Alemania, Austria y Suiza, con 1.198 pacientes tratados con anti-PD1 y anti-BRAF/anti-MEK. La SVLR a un año fue del 74,1% con un 12,3% de los pacientes que interrumpieron el tratamiento debido a los efectos adversos15. Asimismo, han sido comunicados los datos de una cohorte italiana de acceso expandido, con una SVLR y supervivencia global a un año del 76,6% y del 93,8%, respectivamente16.
Con el estudio CADIM (Caracterización de la ADyuvancia con Inmunoterapia en pacientes con Melanoma) se pretende analizar las características de los pacientes con melanoma tratados en adyuvancia con inmunoterapia en la Comunidad Autónoma de la Región de Murcia fuera de ensayo clínico. Se presentan los datos finales actualizados de los 81 pacientes tratados en el Hospital Clínico Universitario Virgen de la Arrixaca (HCUVA) de la ciudad de Murcia y en el Complejo Hospitalario de Cartagena (CHC).
MétodosPlan de estudio y esquema de tratamientoDesde febrero de 2018 hasta diciembre de 2022, 81 pacientes con melanoma resecado en estadio III o IV recibieron, fuera de ensayo clínico, nivolumab (3mg/kg iv cada 2 semanas) o pembrolizumab (3mg/kg iv cada 3 semanas) hasta completar un año como práctica clínica habitual, incluyendo las suspensiones precoces a causa de la recurrencia de la enfermedad, toxicidad inaceptable o retirada del consentimiento.
Todos los pacientes firmaban el consentimiento informado habitual usado en los centros donde se ha realizado el estudio. El estudio fue aprobado por el Comité de Ética de Investigación Clínica del Hospital Virgen de la Arrixaca.
Fueron criterios de inclusión:
- a)
Edad ≥18 años.
- b)
Melanoma en estadios III (con afectación ganglionar igual o mayor de 1mm) o IV de la 8.a edición de la AJCC resecados. Los melanomas de mucosas se estadificaron utilizando la propuesta de Cui et al. basada en la 8.a edición de la AJCC17.
- c)
Se incluyen melanomas acrales, de mucosas y de primario desconocido.
- d)
Inicio de adyuvancia ≤ 12 semanas de la última cirugía.
- e)
Los pacientes no han recibido previamente otros tratamientos (sistémicos, radioterapia).
- f)
El estado libre de enfermedad se documenta antes del inicio de la adyuvancia, a través de la exploración física y las técnicas de imagen utilizadas en la práctica clínica habitual. El seguimiento se realiza con las mismas técnicas cada 3-4 meses.
- g)
ECOG ≤ 2.
- h)
Pruebas de laboratorios normales antes del inicio (2 semanas) del tratamiento.
- i)
Ausencia de metástasis cerebrales.
Se excluyeron del estudio los pacientes con:
- a)
Otros tumores activos al menos 3 años antes de iniciar el tratamiento adyuvante, salvo cáncer de piel (no melanoma) o carcinomas in situ.
- b)
Enfermedades autoinmunes conocidas y activas, salvo aquellos que requirieran reposición hormonal o alteraciones cutáneas sin necesidad de tratamiento sistémico.
- c)
Melanoma ocular.
El análisis estadístico se realizó utilizando el programa Statistical Package for the Social Sciences versión 20. Se hizo un análisis descriptivo de los datos. Las variables categóricas se describieron como valores absolutos y porcentajes y las cuantitativas como medianas e intervalos. Los tiempos de supervivencias se calcularon utilizando el método de Kaplan-Meier. La SVLR se calculó desde la fecha de inicio del primer ciclo hasta la fecha de la recaída, ya fuera locorregional o a distancia, o de muerte (relacionada o no con el melanoma) o hasta la de censura del último seguimiento. La supervivencia global se calculó desde la fecha de inicio del tratamiento hasta la fecha del fallecimiento o la fecha de censura en el último seguimiento.
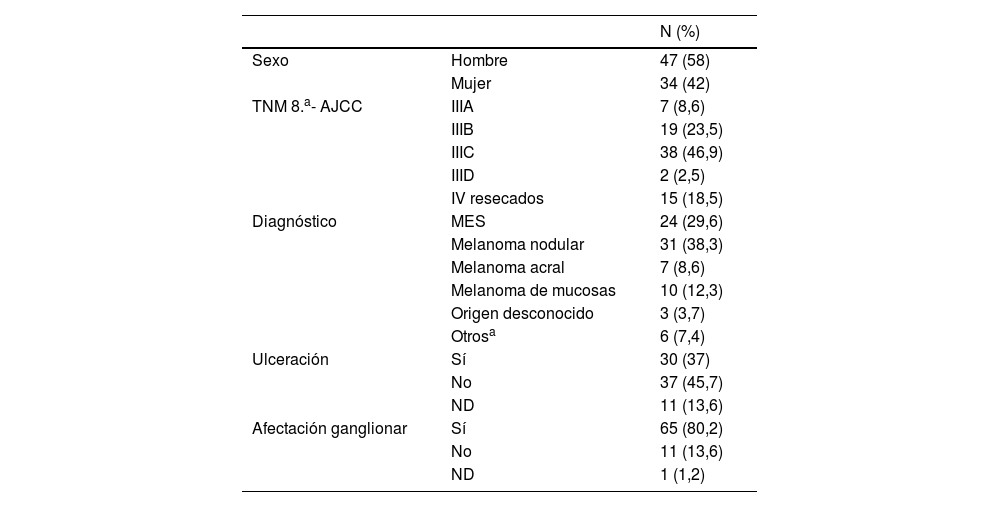
ResultadosPoblación a estudioLas características de los pacientes se resumen en la tabla 1. Se incluyeron un total de 81 pacientes, con una mediana de edad de 58 años (18-82), la mayoría hombres (58%). El subtipo de melanoma más frecuente fue el cutáneo (76,5%), seguido del de mucosas (12,3%). Con relación a los estadios, según la clasificación TNM de la AJCC 8.a edición, el 81,5% (n=66, 7 de ellos eran melanoma de mucosas) eran estadios III, la mayor parte de ellos estadio iiiC (n=38; 46,9%) y 15 pacientes (18,5%) en estadio IV resecados. De los 10 pacientes con melanoma de mucosas, 7 eran estadio iii y los 3 restantes, estadio iv resecados.
Características de los pacientes
| N (%) | ||
|---|---|---|
| Sexo | Hombre | 47 (58) |
| Mujer | 34 (42) | |
| TNM 8.a- AJCC | IIIA | 7 (8,6) |
| IIIB | 19 (23,5) | |
| IIIC | 38 (46,9) | |
| IIID | 2 (2,5) | |
| IV resecados | 15 (18,5) | |
| Diagnóstico | MES | 24 (29,6) |
| Melanoma nodular | 31 (38,3) | |
| Melanoma acral | 7 (8,6) | |
| Melanoma de mucosas | 10 (12,3) | |
| Origen desconocido | 3 (3,7) | |
| Otrosa | 6 (7,4) | |
| Ulceración | Sí | 30 (37) |
| No | 37 (45,7) | |
| ND | 11 (13,6) | |
| Afectación ganglionar | Sí | 65 (80,2) |
| No | 11 (13,6) | |
| ND | 1 (1,2) |
La mayoría de los pacientes eran BRAF nativo (40,7%), el 28,4% eran BRAF mutados, y el 30,9% de los casos, desconocido.
La BSGC se realizó en el 79% de los pacientes y el 45,7% de los pacientes fueron intervenidos de linfadenectomía ganglionar.
Supervivencia libre de recaída y supervivencia globalAl corte de datos en diciembre de 2022, la mediana de seguimiento era de 22,8 meses.
La SVLR fue de 45,6 meses (IC 95%: 40,2-51,1) sin haberse alcanzado la mediana, con un porcentaje del 84% de pacientes libres de recaída a un año y del 81,5% a los 2 años.
La SVLR en función de estadio fue de 18,4 meses (IC 95%: 0-40,2), 19,1 meses (IC 95%: 0-38,6), 19,9 meses (IC 95%: 10,3-29,4), 3,6 meses (valor único) y 8,3 meses (IC 95%: 0-16,9) para los estadios iiiA, iiiB, iiiC, iiiD y iv, respectivamente.
La mediana de supervivencia global fue de 49,3 meses (IC 95%: 44,3-54,2) sin alzanzar la mediana, con 12 pacientes fallecidos a la fecha de corte de datos. El 98% seguía vivo al año del inicio del tratamiento y el 91,4% a los 2años.
La mediana de supervivencia global en función de estadio fue de 18,4 meses (IC 95%: 0-40,2), 25,1 meses (IC 95%: 15,6-34,6), 23,2 meses (IC 95%: 18,2-28,2), 38,6 meses (valor único) y 16,9 meses (IC 95%: 07,1-24,7) para los estadios iiiA, iiiB, iiiC, iiiD y IV, respectivamente.
Se han observado diferencias estadísticamente significativas a favor de aquellos pacientes que completan la adyuvancia tanto en SVLR, con HR 0,138 (0,040-0,471; p=0,002), como en supervivencia global con HR 0,189 (0,057-0,624; p=0,006). No se observaron otras diferencias estadísticamente significativas en función del resto de las variables, incluyendo el estado mutacional de BRAF.
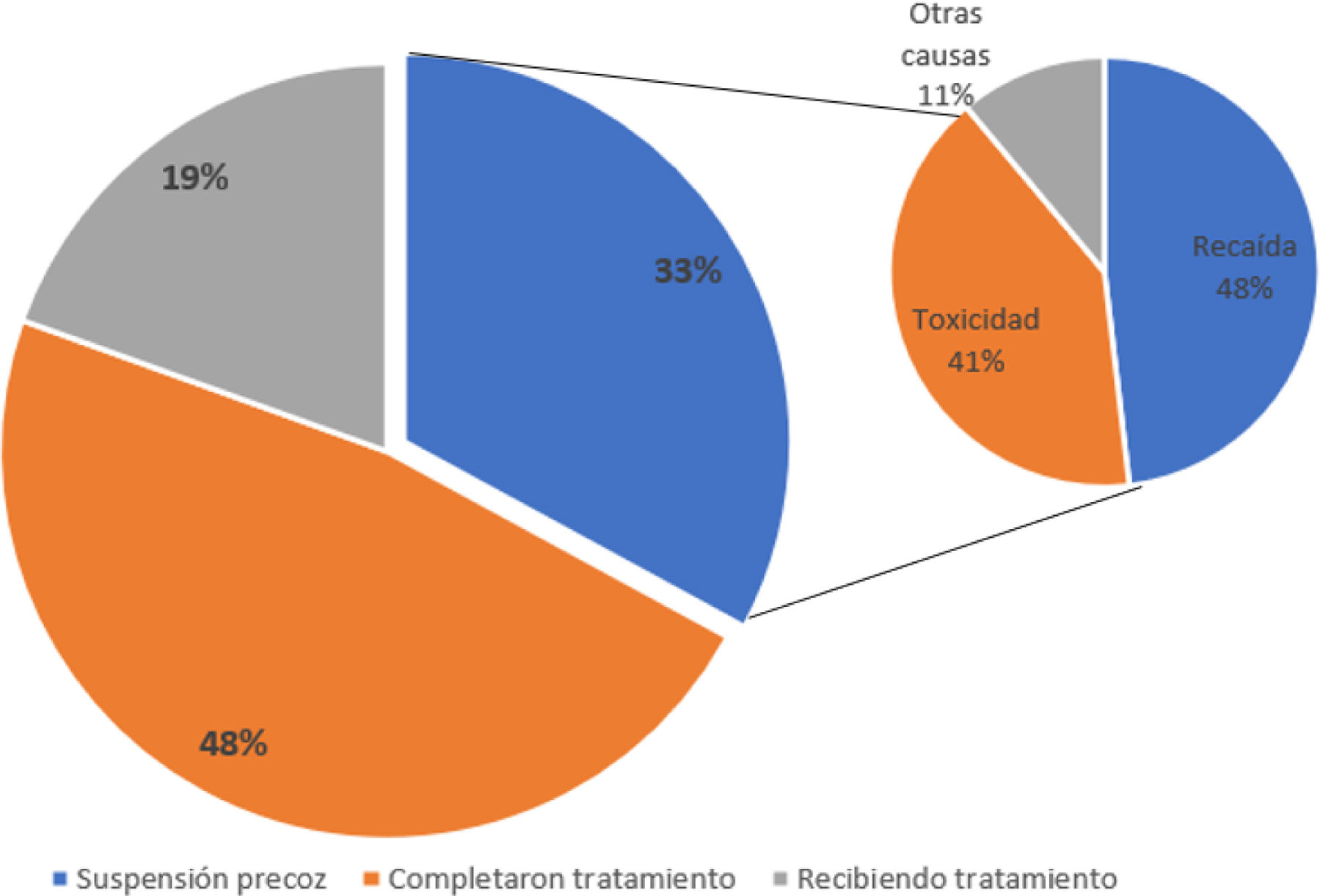
Causas de finalización de tratamiento y patrones de recurrenciaEl tratamiento lo completaron el 48% de los pacientes (n=39). De los pacientes que no acabaron el tratamiento (n=41), 16 lo estaban recibiendo en el momento de corte de los datos y 27 lo interrumpieron de forma precoz por recaída (n=13), toxicidad (n=11) u otras causas (n=3) (fig. 1).
Hasta 16 pacientes presentaron recurrencia de la enfermedad (19,8%), la mayoría (n=13; 81,2%) durante la adyuvancia. Las metástasis se produjeron de forma local (n=8; 50%) y a distancia (n=8; 50%).
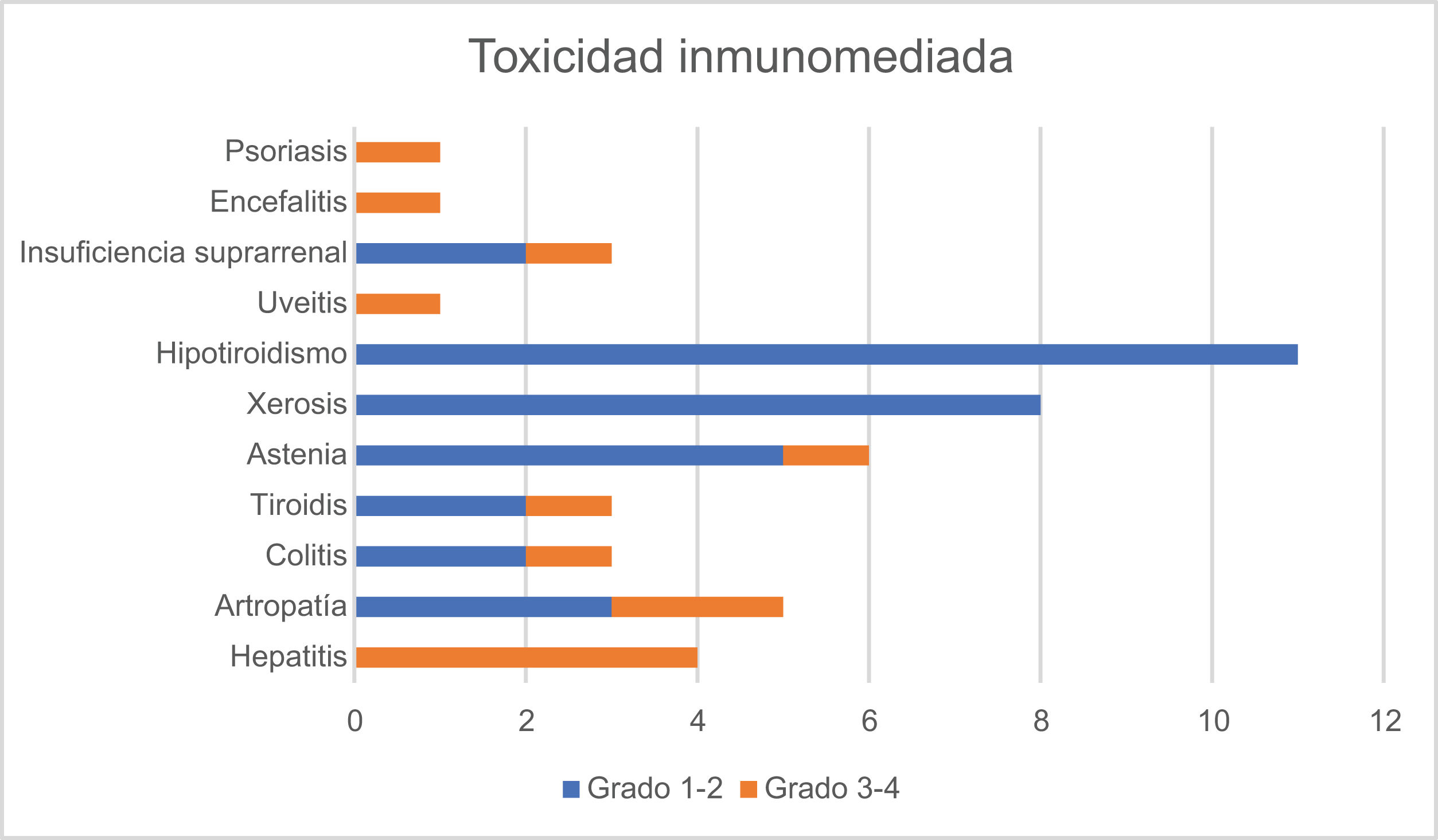
SeguridadEl 39,5% de los pacientes presentó efectos adversos inmunomediados (tabla 2). La mayor parte fueron leves, con un 34,5% de toxicidades de grado 1-2. El 12,3% de los pacientes presentó toxicidad inmunorrelacionada igual o superior al grado 3. La suspensión definitiva del tratamiento por efectos adversos ocurrió en el 13,6% de los casos (n=11).
El efecto adverso grave más frecuente fue la toxicidad hepática (n=4; 4,9%) seguida de la artropatía (n=2; 2,4%) con casos aislados (n=1) de colitis, uveítis, encefalitis y tiroiditis. No se registraron casos de neumonitis ni de toxicidad cardíaca en nuestra serie.
Ocurrieron 4 fallecimientos durante el tratamiento en pacientes sin recidiva, uno de ellos debido a toxicidad grave inmunomediada (crisis tirotóxica y encefalitis).
DiscusiónLos resultados del estudio CADIM se han comunicado parcialmente en diversas reuniones y congresos18. En este documento comunicamos los resultados finales de los 81 pacientes tratados en el HCUVA y en el CHC. Consideramos la población seleccionada como representativa de la población global de nuestra comunidad autónoma, al englobar estos centros más del 90% de la población total de los pacientes con melanoma tratados en adyuvancia con inmunoterapia.
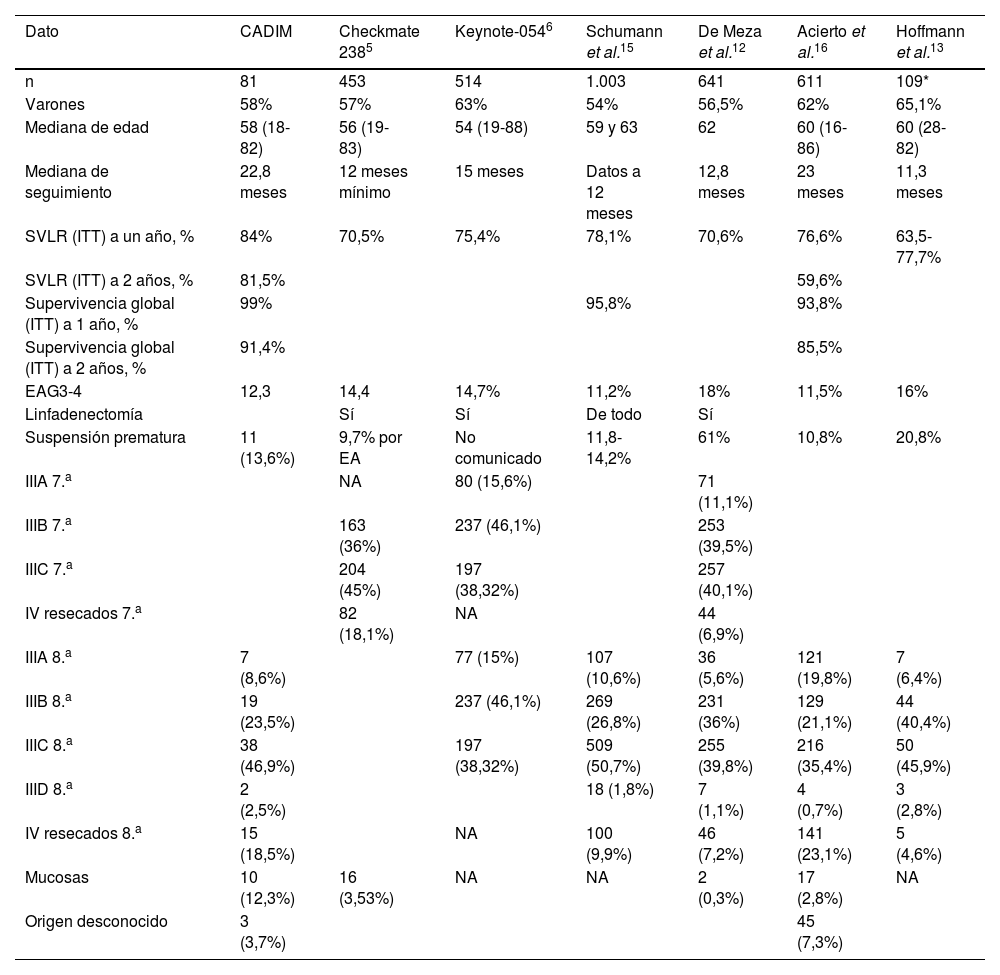
Con relación a la población analizada, las características de nuestra población son similares a las comunicadas en otros estudios de práctica clínica, tanto en sexo12,13,15,16, como en edad12,13,16,19,20. En esta serie, la presencia de melanoma de primario desconocido es algo menos frecuente (3,7%) que en otros estudios de práctica clínica, en los que representa desde el 5,9% hasta el 11,9% de los pacientes12,13,16,19. La distribución por estadios es similar a la de otros estudios; destaca la proporción de pacientes en estadios IV resecados (18,5%), superior a la de estudios similares12-15,19,20 salvo en el análisis del acceso expandido italiano16 (23,1%). Destaca también el porcentaje de pacientes en tratamiento adyuvante con melanoma de mucosas (12,3%), superior también al de otros análisis (0,3-2,8%)12,16. La mayoría de los pacientes que componen nuestra serie no presentan mutación en BRAF, lo que coincide con la distribución de la mayoría de las series de práctica clínica12,16,19,20. La alta proporción (30,9%) de pacientes con BRAF desconocido se podría explicar porque no se solicita su determinación en situación de adyuvancia, pues no es un dato determinante para la toma de decisiones sobre el tratamiento en situación adyuvante, al no estar financiada la terapia dirigida a esta población en España. Por último, con relación a las características de los pacientes, en la serie presentada se realizó BSGC a un porcentaje importante de pacientes (79%), de manera similar a las series publicadas en la práctica clínica (60-65,8%)14,15,17; ocurre lo mismo con el porcentaje de pacientes tratados mediante linfadenectomía: el 45,7% en nuestra serie frente a otras (del 45,1 al 85,8%)14,15,17,19.
Los resultados obtenidos de SVLR son numéricamente superiores (84% a un año) a los comunicados en la práctica clínica. Los datos de la cohorte austriaca son del 64,8%14, los de la neerlandesa del 70,6%12 y los de la italiana del 76,6% de SVLR a un año. Todos ellos reflejan unas diferencias en supervivencia a favor de nuestro estudio, posiblemente debidas al número limitado de pacientes, pues la distribución por sexo, edad y estadios es similar, si bien la proporción de pacientes con melanomas de mucosas, ulcerados o con estadios IV resecados en nuestra serie es mayor, lo que no favorece inicialmente una mayor supervivencia.
En nuestro estudio, el 49,2% de los pacientes habían completado el tratamiento, el 19,8% lo continuaban y el 30,9% habían suspendido el tratamiento, la mayoría por progresión (n=13; 16%) y toxicidad (n=11; 13,7%). Otros análisis muestran una amplia variación en los pacientes que completan el tratamiento, entre el 63,2%16 y el 42%19, que dejan el tratamiento precozmente por recidiva (el 18,7 y el 19%, respectivamente) o por toxicidad (el 10,3% y el 32%, respectivamente), entre otras causas.
La mayor parte de los pacientes que presentaron recaída de su enfermedad (n=13/16; 81,3%) lo hicieron intraadyuvancia, porcentaje discretamente más elevado que el 76% observado por Owen et al.21.
Las distintas supervivencias observadas en los principales ensayos de práctica clínica se muestran en la tabla 3. Aquellos estudios con un mayor seguimiento16,19,20 son los que presentan también una SVLR a 12 meses más elevada y cercana a nuestros datos (84% de pacientes libres de recaída a un año). En nuestro estudio se han identificado diferencias estadísticamente significativas que favorecen a los pacientes que finalizan la adyuvancia en términos de SLVR y supervivencia global, si bien otros estudios19 no encuentran diferencias en supervivencia entre los que finalizan y los que abandonan de forma prematura el tratamiento.
Datos comparativos de nuestra población con ensayos clínicos y estudios en práctica clínica
| Dato | CADIM | Checkmate 2385 | Keynote-0546 | Schumann et al.15 | De Meza et al.12 | Acierto et al.16 | Hoffmann et al.13 |
|---|---|---|---|---|---|---|---|
| n | 81 | 453 | 514 | 1.003 | 641 | 611 | 109* |
| Varones | 58% | 57% | 63% | 54% | 56,5% | 62% | 65,1% |
| Mediana de edad | 58 (18-82) | 56 (19-83) | 54 (19-88) | 59 y 63 | 62 | 60 (16-86) | 60 (28-82) |
| Mediana de seguimiento | 22,8 meses | 12 meses mínimo | 15 meses | Datos a 12 meses | 12,8 meses | 23 meses | 11,3 meses |
| SVLR (ITT) a un año, % | 84% | 70,5% | 75,4% | 78,1% | 70,6% | 76,6% | 63,5-77,7% |
| SVLR (ITT) a 2 años, % | 81,5% | 59,6% | |||||
| Supervivencia global (ITT) a 1 año, % | 99% | 95,8% | 93,8% | ||||
| Supervivencia global (ITT) a 2 años, % | 91,4% | 85,5% | |||||
| EAG3-4 | 12,3 | 14,4 | 14,7% | 11,2% | 18% | 11,5% | 16% |
| Linfadenectomía | Sí | Sí | De todo | Sí | |||
| Suspensión prematura | 11 (13,6%) | 9,7% por EA | No comunicado | 11,8-14,2% | 61% | 10,8% | 20,8% |
| IIIA 7.a | NA | 80 (15,6%) | 71 (11,1%) | ||||
| IIIB 7.a | 163 (36%) | 237 (46,1%) | 253 (39,5%) | ||||
| IIIC 7.a | 204 (45%) | 197 (38,32%) | 257 (40,1%) | ||||
| IV resecados 7.a | 82 (18,1%) | NA | 44 (6,9%) | ||||
| IIIA 8.a | 7 (8,6%) | 77 (15%) | 107 (10,6%) | 36 (5,6%) | 121 (19,8%) | 7 (6,4%) | |
| IIIB 8.a | 19 (23,5%) | 237 (46,1%) | 269 (26,8%) | 231 (36%) | 129 (21,1%) | 44 (40,4%) | |
| IIIC 8.a | 38 (46,9%) | 197 (38,32%) | 509 (50,7%) | 255 (39,8%) | 216 (35,4%) | 50 (45,9%) | |
| IIID 8.a | 2 (2,5%) | 18 (1,8%) | 7 (1,1%) | 4 (0,7%) | 3 (2,8%) | ||
| IV resecados 8.a | 15 (18,5%) | NA | 100 (9,9%) | 46 (7,2%) | 141 (23,1%) | 5 (4,6%) | |
| Mucosas | 10 (12,3%) | 16 (3,53%) | NA | NA | 2 (0,3%) | 17 (2,8%) | NA |
| Origen desconocido | 3 (3,7%) | 45 (7,3%) |
La frecuencia de toxicidades inmunomediadas graves en nuestro estudio ha sido del 12,3%, similar a los estudios de adyuvancia, con el 14,4% en el estudio Checkmate 238 y el 14,7% en el Keynote 054 y a la de otros datos de práctica clínica15,16, pero inferior a los comunicados en otros estudios12,20, probablemente debida a una recogida menos estricta de la toxicidad en estudios retrospectivos, como el presentado.
La suspensión del tratamiento por toxicidad fue similar al estudio Keynote 054 (13,6% vs. 13%) e inferior a la mostrada en otros estudios de práctica clínica con suspensión, entre el 17,9% y el 22%12,14.
A pesar de las diferencias con otros ensayos y estudios y las limitaciones de las comparaciones indirectas, consideramos que la prolongada mediana de seguimiento en nuestro estudio y la concordancia en los datos de seguridad validan los resultados obtenidos, por lo que nuestros resultados avalan la actividad clínica de la inmunoterapia en pacientes con melanoma en estadios III y IV resecados.
Como debilidades, cabe señalar el carácter retrospectivo de nuestro estudio y el limitado número de pacientes. En cualquier caso, la mayoría de los pacientes completaron el tratamiento, el seguimiento de los pacientes es prolongado y ha sido posible obtener la gran mayoría de las variables consideradas.
ConclusiónUn mayor seguimiento nos permitirá conocer el posible desarrollo de efectos inmunomediados a largo plazo, caracterizar las recaídas en estos pacientes y determinar el potencial impacto en la supervivencia de la finalización precoz del tratamiento. Iniciativas europeas, como EuMelaReg22, facilitarán y harán más homogénea la recogida de datos, lo que aportará mayor calidad a los estudios de la práctica clínica.
FinanciaciónNo se ha precisado financiación para la elaboración de este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.