Introducción
El melanoma cutáneo (MC) es uno de los tumores que ha experimentado mayor aumento tanto en su incidencia como en su mortalidad en las últimas décadas en Europa1. Sin embargo, se comienzan a publicar estudios que sugieren una disminución de la mortalidad a partir de la década de los noventa en algunos países de la Unión Europea2, entre los que se encuentra España3. Nuestro país cuenta con una de las tasas de mortalidad más bajas de Europa4.
Es bien conocido el potencial maligno del MC. Aproximadamente la mitad de los casos que metastatizan lo hacen a los ganglios linfáticos regionales5. Este hecho ha favorecido el desarrollo de la técnica conocida como biopsia selectiva del ganglio centinela, técnica ampliamente usada hoy en día, pero que sigue siendo de utilidad controvertida en el manejo del MC6,7. Existen pocos datos sobre su impacto real en la supervivencia de los pacientes con MC, al menos hasta que se publiquen los resultados de los ensayos actualmente en marcha8. Por otro lado, del resto de recidivas del MC, en torno al 20 % lo hacen directamente como metástasis sistémicas, y alrededor del 30 % restante como satelitosis o metástasis en tránsito, definidas, respectivamente, según ocurran a menos de 2 cm del tumor primario o en el área anterior al ganglio linfático de drenaje, pero a más de 2 cm del tumor primario.
Los factores que condicionan uno u otros tipos de recidiva son, en la actualidad, escasamente conocidos. Existen pocos estudios que hayan profundizado en la historia natural del MC, en particular atendiendo al tiempo de evolución de las distintas localizaciones metastásicas y si influye de alguna forma el tiempo de aparición de metástasis sistémicas con el surgimiento previo o no de satelitosis/metástasis en tránsito y/o metástasis linfáticas regionales que suelen ocurrir en la progresión del MC. Conocer estos aspectos sería muy útil para la elaboración de protocolos diagnósticos, terapéuticos y de seguimiento.
El objetivo principal del presente estudio ha sido analizar las distintas vías de diseminación metastásicas del MC (divididas en satelitosis/metástasis en tránsito, metástasis linfáticas regionales y metástasis sistémicas), haciendo especial hincapié en evaluar el tiempo de aparición de las metástasis y de su progresión hacia distintas rutas de los casos de melanoma de los servicios de Dermatología de los hospitales incluidos. Otros objetivos han sido analizar las frecuencias de aparición de estas metástasis y comparar una serie de características clínicas e histopatológicas del tumor primario de aquellos melanomas que desarrollaron en su evolución como primera localización metastásica una satelitosis/metástasis en tránsito, o una metástasis linfática regional, y que en su seguimiento desarrollaron o no metástasis sistémicas.
Material y métodos
Entre los años 1990 y 2004 el Servicio de Dermatología del Hospital Universitario Virgen de la Victoria de Málaga atendió 480 casos de melanoma. De los casos diagnosticados inicialmente como enfermedad limitada, 56 desarrollaron algún tipo de metástasis en su evolución. De igual modo, el Servicio de Dermatología del Hospital Costa del Sol de Marbella entre los años 2001 y 2004, de un total de 95 pacientes atendidos con MC, 11 pacientes, diagnosticados igualmente como enfermedad limitada, desarrollaron metástasis en su evolución posterior. En total se incluyeron en el estudio 67 pacientes de los 575 atendidos con melanoma.
El protocolo de seguimiento de estos pacientes fue similar en ambos centros. Se realizaron revisiones cada 3 meses durante los 2 primeros años tras el diagnóstico, y cada 6 meses hasta los 5 años. A partir de entonces se realizaron exploraciones anualmente. El protocolo incluía en cada control exploración física de toda la piel, áreas ganglionares y abdomen, y analítica de sangre, incluyendo lactato deshidrogenasa (LDH). El estudio radiográfico de tórax y la ecografía abdominal se realizaron al inicio, cada 6 meses los dos primeros años y anualmente hasta los 5 años. Estudios de imagen, tales como tomografía axial computarizada o resonancia magnética nuclear, tan sólo se realizaron ante la sospecha de posible presencia de metástasis detectada en los controles periódicos.
En primer lugar, se analizaron las distintas vías metastásicas en la progresión del MC. Se consideró vía metastásica a la primera vía de diseminación en su progresión. De esta forma se categorizó en tres grupos: satelitosis/metástasis en tránsito, metástasis linfáticas regionales y metástasis sistémicas. Se determinaron las frecuencias de cada una de ellas en función de la localización y el grosor.
Por otro lado, la implicación de una, dos o las tres vías de diseminación en aquellos melanomas con progresión sistémica condiciona distintos patrones de diseminación, a los que se denominó rutas metastásicas. Se consideraron cuatro rutas principales de diseminación progresiva, tal y como fueron descritas en un trabajo anterior9: a) ruta 1: desarrollo de satelitosis/metástasis en tránsito seguido de la aparición de metástasis linfáticas regionales y metástasis sistémicas; b) ruta 2: desarrollo de satelitosis/metástasis en tránsito seguidas de metástasis a distancia; c) ruta 3: desarrollo de metástasis linfáticas seguidas de metástasis sistémicas, y d) ruta 4: desarrollo de metástasis a distancia como primera recurrencia del tumor.
Por último, dentro de los grupos de pacientes que progresaron como primera vía metastásica a satelitosis/metástasis en tránsito o a metástasis linfáticas regionales, se compararon una serie de características clínicas e histopatológicas entre los casos que progresaron a enfermedad sistémica y los que no progresaron.
Las variables estudiadas para este análisis comparativo incluyeron una estratificación de la localización anatómica del tumor primario en cuatro grupos: cabeza y cuello (CyC), tronco, miembros superiores (MMSS) y miembros inferiores (MMII). También se valoró la edad y el sexo de los pacientes. Como tipos anatomoclínicos se consideraron las formas tradicionales de MC: melanoma lentigo maligno (MLM), melanoma de extensión superficial (MES), melanoma nodular (MN) y melanoma lentiginoso acral (MLA). El grosor tumoral se dividió en cuatro grupos según la clasificación TNM de la American Joint Committee on Cancer (AJCC)10: # 1 mm, 1,01-2 mm, 2,01-4 mm y > 4 mm. El nivel de invasión se clasificó según el sistema descrito por Clark et al11. Se tuvo en cuenta la presencia o no de ulceración y el número de mitosis por cada 10 campos de gran aumento (400). Finalmente, el tiempo de evolución de la primera metástasis se categorizó en: < 12 meses, 12-24 meses y > 24 meses.
El análisis estadístico se llevó a cabo mediante el sistema SPSS 12.0 para Windows. Las diferencias entre las distribuciones se evaluaron mediante la Chi-cuadrado o la prueba exacta de Fisher, según fuera necesario. La comparación entre variables cuantitativas se realizó con la t de Student. La probabilidad de metástasis en la comparación de grupos se realizó por el método de Kaplan-Meier. Las diferencias estadísticas se consideraron positivas con una p < 0,05.
Resultados
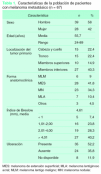
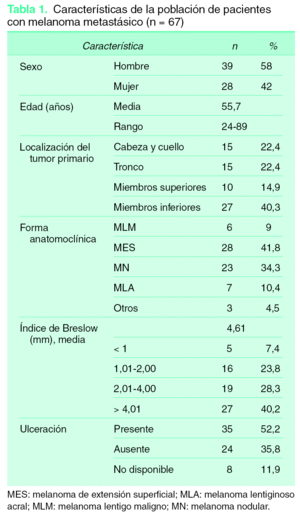
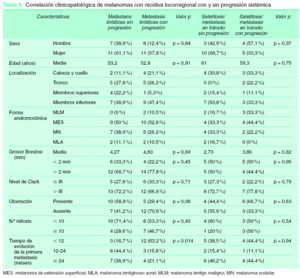
Del total de 67 pacientes con melanoma atendidos en estadio localizado y que posteriormente desarrollaron algún tipo de recidiva, la media de seguimiento fue de 64 meses. En la tabla 1 se describe la muestra estudiada. Los hombres predominaban sobre las mujeres (58 % frente al 42 %). La edad media fue de 55,7 años. La forma anatomoclínica más frecuente fue el MES (41,8 %), seguido del MN (34,3 %). Los menos frecuentes, el MLA (10,4 %) y el MLM (9 %). La localización anatómica más frecuente ocurrió en los MMII (40,3 %), seguida de CyC (22,4 %), tronco (22,4 %) y MMSS (14,9 %).
El 40,2 % de los MC tenían un índice de Breslow superior a 4 mm. El 28,3 % tuvo un grosor entre 2,01-4 mm, el 23,8 %, entre 1,01-2, y el 7,4 % midió menos de 1 mm. Más de la mitad de los casos presentaron ulceración (52,2 %).
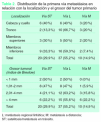
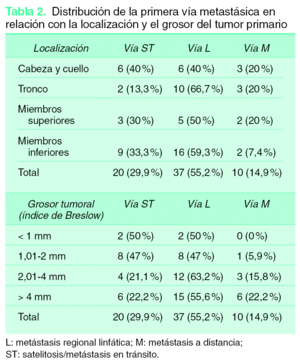
El estudio de la primera vía metastásica en relación con la localización del tumor primario mostró que más de la mitad de las recidivas primarias fueron linfáticas (55,2 %) (tabla 2), siendo esta vía el tipo más frecuente de metástasis en cualquier localización, en especial los MC de localización en el tronco (66,7 %). La localización en ambas extremidades, MMSS y MMII, mostró una distribución similar, con un porcentaje de satelitosis/metástasis en tránsito en torno al 30 %. El menor porcentaje de desarrollar directamente metástasis sistémicas se dio en el caso de los MC localizados en los MMII (7,4 %). Para los pacientes con melanoma localizado en CyC el porcentaje de satelitosis/metástasis en tránsito y de metástasis linfáticas regionales fue del 40 % en ambas.
Cuando la primera vía metastásica se relacionó con el grosor tumoral (tabla 2) se observó que para los melanomas menores de 2 mm la frecuencia de aparición de una satelitosis/metástasis en tránsito y una metástasis regional linfática estaba en torno al 50 % aproximadamente. Este porcentaje, en el caso de la vía satelitosis/metástasis en tránsito, se redujo de forma importante cuando el grosor del tumor era mayor (21,1 % para grosor entre 2,01-4 mm y 22,2 % para un grosor > 4 mm). Sin embargo, es reseñable la mayor frecuencia de metástasis regionales linfáticas para tumores con un grosor comprendido entre 2,01-4 mm (63,2 %). Por último, el porcentaje de metástasis sistémicas como primera vía metastásica aumentó correlativamente con el grosor tumoral hasta un 22,2 %, con un índice de Breslow mayor de 4 mm.
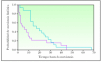
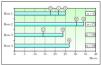
El análisis de las rutas metastásicas aparece gráficamente en la figura 1. La ruta que con más frecuencia siguieron los MC en su progresión fue la 3 (desarrollo de metástasis linfáticas seguidas de metástasis sistémicas) con 19 pacientes, seguida de la ruta 4 (desarrollo de metástasis a distancia como primera recurrencia del tumor) con 14 pacientes. La más infrecuente fue la ruta 2 (desarrollo de satelitosis/metástasis en tránsito seguidas de metástasis a distancia) con solo 2 pacientes. La aparición de satelitosis/ metástasis en tránsito fue muy diferente dependiendo de la ruta metastásica. De este modo, en la ruta 1 la media de aparición fue de 17 meses y en la ruta 2 de 31 meses. La media de aparición de metástasis linfáticas regionales en la ruta 3 fue de 14 meses. Estas mismas metástasis tuvieron en la ruta 1 una media de aparición de 22 meses.
Figura 1. Representación gráfica del curso temporal de las distintas rutas metastásicas en la progresión desde el diagnóstico del melanoma primario. L: metástasis linfática regional; M: metástasis sistémica; ST: satelitosis/metástasis en tránsito.
Un dato destacable fue que la ruta 4 mostró una media de aparición de metástasis sistémicas de 26 meses, que se aproximaba a las medias de aparición de las metástasis sistémicas en las rutas 1 y 3, con 25 y 24 meses, respectivamente. La ruta 2 mostró una media de aparición de las metástasis sistémicas de 34 meses.
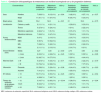
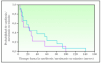
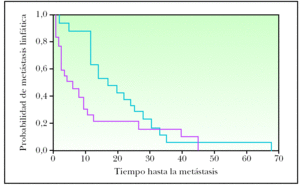
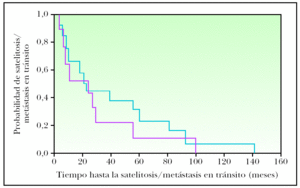
Dentro del estudio de comparación de casos con recidiva inicial como satelitosis/metástasis en tránsito o metástasis linfática regional con y sin diseminación sistémica posterior, las metástasis linfáticas regionales del grupo de pacientes con evolución posterior a metástasis sistémicas se manifestaron antes que las metástasis linfáticas regionales del grupo de pacientes que no desarrollaron metástasis sistémicas en su evolución (fig. 2), aunque esta diferencia no alcanzó significación estadística (p = 0,14). Cuando se categorizó el tiempo de evolución, las metástasis linfáticas con progresión sistémica fueron más frecuentes en el intervalo de menos de 12 meses con respecto a los casos que recidivaron como metástasis linfáticas regionales sin progresión sistémica (63,2 % frente al 16,7 %). Este resultado alcanzó significación estadística (p = 0,014) (tabla 3). Las variables sexo, edad, localización de la lesión primaria, forma anatomoclínica, índice de Breslow, nivel de Clark y número de mitosis mostraron homogeneidad en ambos grupos. La presencia de ulceración fue superior en el grupo que evolucionó a metástasis sistémicas (58,8 % frente al 29,4 %), acercándose a la significación estadística (p = 0,08). El grupo de MC con desarrollo de satelitosis/metástasis en tránsito que progresaron a metástasis sistémicas también fue algo más precoz en su aparición que el grupo de satelitosis/metástasis en tránsito que no progresaron (fig. 3), aunque sin ser estadísticamente significativo (p = 0,52). La comparación de las distintas variables en estos dos grupos no mostró diferencias reseñables.
Figura 2. Tiempo de evolución hasta la aparición de metástasis linfática regional para melanomas con progresión a enfermedad sistémica (rojo) y sin progresión posterior (azul) (p = 0,14).
Figura 3. Tiempo de evolución hasta la aparición de satelitosis/metástasis en tránsito de melanomas con progresión a enfermedad sistémica (rojo) y sin progresión posterior (azul) (p = 0,52).
Discusión
En nuestro estudio, de un total de 575 pacientes con melanoma en estadio inicial, 67 presentaron metástasis en su seguimiento. Los ganglios linfáticos regionales constituyeron el lugar más frecuente como primera vía metastásica (55,2 %). A continuación la satelitosis/metástasis en tránsito (29,9 %), y por último las metástasis sistémicas (14,9 %). Los pocos estudios disponibles hasta la fecha reflejan índices similares de recidiva en las mismas localizaciones9,12.
Atendiendo a la primera vía metastásica en relación a la localización del tumor primario, la mayor frecuencia de metástasis linfáticas regionales se produce en el tronco (66,7 %), mientras que las satelitosis/metástasis en tránsito son más frecuentes en la localización de CyC (40 %). Las metástasis sistémicas han resultado ser igual de frecuentes en todas las localizaciones (20 %), salvo en los MMII, que presentó la frecuencia más baja (7,4 %). Estos datos sugieren que los melanomas localizados en el tronco, MMSS y CyC tienen un pronóstico más desfavorable que los localizados en los MMII. Algunos autores lo atribuyen a que en los MMII la longitud de los vasos linfáticos y el mayor número de ganglios linfáticos hasta alcanzar la circulación general actuarían como barreras contra las células metastásicas13.
La mayor frecuencia de satelitosis/metástasis en tránsito como primera vía metastásica ocurre en melanomas menores de 2 mm, mientras que la mayor frecuencia de la vía primaria hacia metástasis sistémicas ocurre proporcionalmente al grosor tumoral. Las metástasis linfáticas regionales tienen su máxima frecuencia como primera vía metastásica en melanomas con un grosor comprendido entre 2,01-4 mm. Actualmente no se dispone de marcadores que justifiquen esta variabilidad en las distintas vías metastásicas dependiendo del grosor tumoral, aunque está bastante bien establecido que a mayor grosor mayor capacidad de metástasis sistémicas. No está explicado por qué no sigue la misma frecuencia proporcional la satelitosis/metástasis en tránsito y las metástasis linfáticas regionales.
El análisis temporal de las distintas rutas metastásicas muestra que con independencia de la ruta metastásica inicial, el diagnóstico de las metástasis sistémicas se realiza de forma constante, en torno a los 25 meses, intervalo muy similar al obtenido por otros autores9,12. Este hallazgo adquiere relevancia en el contexto de las distintas hipótesis o modelos de diseminación del melanoma. En la actualidad existen tres grandes modelos que intentan explicar cómo se disemina el melanoma. El primero es el denominado «modelo de diseminación secuencial», en el que el melanoma diseminaría primero por vía linfática hacia los ganglios linfáticos regionales. Desde ahí, con cierta latencia temporal se iniciaría la diseminación sistémica. Entre los defensores de esta propuesta se encuentran Balch14, Leong15 y Morton7. Este último autor se refiere a este modelo como la «hipótesis de la incubadora». Aunque estos autores reconocen que algunos melanomas se podrían diseminar directamente por vía hemática, consideran que esto ocurriría tan sólo en una minoría de casos. En este modelo se encuentran los defensores del uso rutinario de la biopsia selectiva del ganglio centinela, para quienes esta técnica podría prevenir en algunos casos la diseminación a distancia de la enfermedad, ofreciendo una ventaja terapéutica sobre la linfadenectomía diferida.
El modelo de diseminación simultánea es el modelo propuesto por autores como Zitelli16 o Ackerman6, opuestos a la realización de la biopsia selectiva del ganglio centinela. Morton ha denominado a este modelo como «la hipótesis del marcador», en la que el melanoma primario metastatizaría simultáneamente por vía linfática y hemática, siendo por tanto la afectación ganglionar un marcador de enfermedad sistémica7. Es bien conocido que en cerca del 70 % de los pacientes en estadio III de la enfermedad finalmente aparecen metástasis viscerales10. En este grupo de pacientes este modelo se muestra plenamente operativo. Sin embargo, es incompatible con el hecho de que en el 30 % restante una linfadenectomía regional resulta curativa.
Por último, tenemos el modelo de patrones diferenciales de diseminación. Se trata de un modelo alternativo basado en la hipótesis de «las semillas y los campos de cultivo» expuesta por Paget17,18 en 1889, en el que se consideran varios patrones de diseminación independientes. Según este modelo habrá melanomas sin capacidad biológica de formar metástasis, otros con capacidad de formar metástasis exclusivamente en los ganglios linfáticos regionales, o bien con capacidad para formar metástasis tanto en los ganglios linfáticos regionales como en otros órganos y tejidos. Finalmente, habrá melanomas con capacidad de formar metástasis exclusivamente a nivel sistémico. Cada melanoma estaría probablemente encuadrado en alguno de estos cuatro grupos desde fases relativamente iniciales del proceso de progresión, con mínima capacidad de trasvase de un grupo a otro a lo largo del desarrollo de la enfermedad.
Este modelo permite explicar algunas premisas sobre la historia natural del melanoma que no pueden ser explicadas si se consideran los otros modelos. Por una parte, explica por qué la linfadenectomía terapéutica logra una remisión completa duradera en cerca de un 30 % de pacientes en estadio III al existir melanomas que metastatizan exclusivamente a los ganglios linfáticos. También explicaría por qué ni la linfadenectomía profiláctica ni la linfadenectomía guiada por la biopsia selectiva del ganglio centinela mejoran la supervivencia final. Ya que hay pacientes que desarrollan metástasis linfáticas y sistémicas de forma simultánea y ningún tipo de linfadenectomía será curativa en estos casos. Por último, explica por qué un resultado negativo en la biopsia selectiva del ganglio centinela no es garantía absoluta de supervivencia por la existencia de melanomas con metástasis exclusivamente sistémicas.
Nuestros datos referentes al estudio temporal de las distintas rutas metastásicas justifican más tanto el modelo de diseminación simultánea como el modelo de patrones diferenciales de diseminación. Apoyando, al igual que el trabajo de Meier9, que las recidivas previas, tanto las satelitosis/metástasis en tránsito como las metástasis regionales linfáticas, no influyen en el tiempo de aparición de las metástasis sistémicas. También se sugiere que la capacidad para metastatizar puede estar predeterminada en cada melanoma desde fases iniciales de su progresión tumoral, como ocurre con otros tumores sólidos19. En este sentido, existen estudios preliminares que permiten una clasificación molecular del melanoma primario según el perfil de expresión genético y que podría predecir la tendencia del melanoma a metastatizar hacia un tejido y otro20.
Por último, como se ha comentado, el modelo de patrones diferenciales de diseminación habla de la existencia de melanomas con capacidad sólo de metastatizar a ganglios linfáticos regionales. Teniendo en cuenta este modelo, en nuestro estudio estos melanomas se diferenciaron de aquellos que además de metástasis linfáticas regionales desarrollaron enfermedad sistémica, en que estas metástasis linfáticas regionales aparecieron en un mayor porcentaje de casos en el primer año de seguimiento en el grupo de melanomas con progresión sistémica (63,2 % frente al 16,7 %; p = 0,014). Estos además presentaban ulceración del tumor primario con más frecuencia (70,6 % frente al 41,2 %; p = 0,08).
En conclusión, más de la mitad de las progresiones de los pacientes con melanoma tienen como primera vía de diseminación los ganglios linfáticos regionales. Sin embargo, a tenor de nuestros resultados parece que la aparición de metástasis sistémicas es un evento independiente tanto de la aparición previa de estas metástasis linfáticas regionales como de las satelitosis/metástasis en tránsito. Estos hallazgos justificarían por qué una técnica tan ampliamente utilizada hoy en día, como es la biopsia selectiva del ganglio centinela, si bien es útil en el estadiaje y control regional de la enfermedad21, no ha demostrado un beneficio claro en la supervivencia global de estos pacientes22. Son necesarios futuros estudios para concretar el beneficio real de la biopsia selectiva del ganglio centinela en los pacientes con MC.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.
Correspondencia:
Antonio Tejera Vaquerizo.
Servicio de Dermatología.
Hospital Universitario Virgen de la Victoria.
Campus Universitario Teatinos. 29010 Málaga. España.
antoniotejera@aedv.es
Aceptado el 12 de marzo de 2007.