Introducción
La psoriasis es una enfermedad crónica que afecta a un 2-3 % de la población mundial1. Hasta los años ochenta se consideraba un trastorno primario del queratinocito, en el que una alteración en la diferenciación del mismo llevaba a una hiperproliferación de los queratinocitos2,3. Hoy en día se considera uno de los trastornos autoinmunes mediados por linfocitos T más comunes4. Se ha caracterizado el infiltrado de linfocitos en la placa psoriásica y se ha encontrado un predominio de linfocitos T CD4+ en dermis y de linfocitos T CD8+ en epidermis5,6. Diversos estudios han mostrado la importancia del factor de necrosis tumoral alfa (TNF-α) en el desarrollo y mantenimiento de las lesiones de psoriasis7,8.
Etanercept (Enbrelì, Wyeth) es un fármaco modificador de la enfermedad de naturaleza proteica completamente humano compuesto por la porción extracelular de 75 kd (p75) del receptor natural del TNF-α unido a la región Fc de la inmunoglobulina G1 (IgG1)9,10. Actúa como un inhibidor competitivo del TNF-α mediante su unión a esta citoquina, impidiendo su interacción con sus receptores en la superficie de distintas poblaciones celulares. A diferencia de otros anti-factores de necrosis tumoral (TNF), etanercept no induce la muerte celular mediada por el complemento in vitro.
Nosotros diseñamos un estudio para evaluar el efecto del bloqueo del TNF-α sobre los linfocitos T en la psoriasis, evaluando la respuesta de las poblaciones linfocitarias tras la administración del fármaco etanercept en un grupo de pacientes con psoriasis.
Objetivos
El objetivo primario fue determinar la respuesta histológica mediante la determinación de las poblaciones linfocitarias (CD4+ y CD8+) de las lesiones psoriásicas. Los objetivos secundarios fueron determinar la respuesta clínica a etanercept mediante el Psoriasis Area and Severity Index (PASI) y valorar el efecto de etanercept sobre las poblaciones linfocitarias (CD4+ y CD8+) en sangre.
Material y métodos
En este estudio se incluyeron un total de 10 pacientes con psoriasis en placas moderada-severa durante un periodo de seis meses. Los pacientes no habían recibido en las ocho semanas previas ningún tratamiento sistémico y dos semanas antes habían abandonado los tratamientos tópicos utilizados. Ninguno de los pacientes había llevado anteriormente ningún tratamiento de los denominados biológicos. Todos los pacientes firmaron el consentimiento informado antes de la administración del tratamiento y antes de la realización de las biopsias.
Se determinó el índice de masa corporal (IMC) en todos los pacientes antes del comienzo del tratamiento.
El estudio fue aprobado por el comité ético de la institución.
Los pacientes recibieron etanercept (Enbrel®, Wyeth) en monoterapia a dosis de 25 mg dos veces a la semana durante 12 semanas.
La afectación clínica de la enfermedad fue determinada mediante el PASI. Este índice se cuantificó antes de la administración inicial de etanercept y tras doce semanas de tratamiento.
En cada paciente se realizó una biopsia de una placa representativa de su enfermedad mediante un punch de 4 mm antes del comienzo del tratamiento y tras 12 semanas de medicación.
Como anestesia se usó mepivacaína sin vasoconstrictor, y para el cierre de la zona se usó sutura con monofilamento no reabsorbible.
Las biopsias procedentes de las lesiones en placa fueron incluidas en formalina 10 % tamponada (WWR International). Tras la confirmación del diagnóstico de psoriasis mediante tinción con hematoxilina-eosina, se procedió a realizar tinción inmunohistoquímica mediante Bond Polymer Detection System (Vision BioSystems, Australia) para la identificación de los linfocitos T CD4+ (Novocastra Laboratories, Newcastle, Reino Unido) y CD8+ (Novocastra Laboratories, Newcastle, Reino Unido).
La cuantificación de las distintas poblaciones linfocitarias de CD4 y CD8 fue hecha a 400xde magnificación (aumento). Se cuantificaron todas las células marcadas por campo en la epidermis desde la membrana basal hasta el estrato córneo y en la dermis hasta una profundidad de 600 micras a lo largo de toda la pieza (4 mm). Posteriormente se hizo la media de células por campo. La cuantificación de células en cada biopsia se expresó en número de células positivas por campo de 400x.
Las poblaciones linfocitarias se determinaron mediante recuento automático y se expresaron en número de células por microlitro.
Análisis estadístico
La distribución de las variables continuas se hizo mediante la media ± DE, mientras que la distribución de las variables categóricas se expresó en frecuencias. Las comparaciones entre las variables continuas antes y después del tratamiento con etanercept se hicieron con la prueba de Wilcoxon para variables relacionadas. La correlación entre las poblaciones de linfocitos T y el PASI tras el tratamiento con etanercept, así como la correlación entre el IMC y el PASI tras el tratamiento con etanercept, fue establecida mediante el cálculo del coeficiente r de Spearman. Se utilizó un nivel bilateral de p < 0,05 para determinar la significación estadística. Todo el análisis estadístico se realizó con el SPSS para Windows, versión 11 (SPSS inc, Chicago, Illinois).
Resultados
Pacientes
Participaron en el estudio 10 pacientes con edades comprendidas entre 30 y 56 años (media 48,44 ± 12,02 años); seis (60 %) eran mujeres y cuatro (40 %) eran hombres. El IMC de los participantes en el estudio estuvo comprendido entre 20,96 y 36,52 kg/m2 (media 20,87 ± 5,39 kg/m2).
Dermatopatología
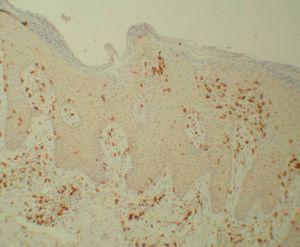
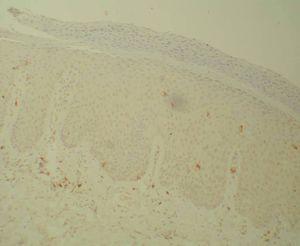
Se analizó un total de 20 biopsias procedentes de 10 pacientes. La cuantificación de las poblaciones linfocitarias totales, en el estrato dérmico y en el estrato epidérmico, se muestran en la tabla 1. Hubo un descenso significativo en las distintas poblaciones linfocitarias tras el tratamiento con etanercept. Los linfocitos CD4 totales basales y tras tratamiento con etanercept mostraron 16,93 ± 8,13 frente a 6,51 ± 3,46, p < 0,007; y los linfocitos CD8 totales basales y tras tratamiento (figs. 1 y 2) con etanercept: 17,73 ± 9,77 frente a 10,50 ± 9,46, p < 0,005. Los linfocitos CD4 basales en dermis y tras tratamiento con etanercept registraron 14,46 ± 6,42 frente a 6,11 ± 3,41, p < 0,007; y los linfocitos CD8 basales en dermis y tras tratamiento con etanercept: 17,29 ± 7,17 frente a 11,57 ± 6,50, p < 0,005. Los linfocitos CD4 basales en epidermis y tras tratamiento con etanercept registraron 2,47 ± 2,18 frente a 0,40 ± 0,29, p < 0,008; y los linfocitos CD8 basales en epidermis y tras tratamiento con etanercept: 17,73 ± 9,77 frente a 10,50 ± 9,46, p < 0,005.
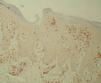
Figura 1. Linfocitos CD8 antes del tratamiento (Bond Polymer Detection System 200x).
Figura 2. Linfocitos CD8 tras tratamiento (Bond Polymer Detection System 200x).
Además encontramos una diferencia significativa en la ratio linfocitos CD4/CD8 en dermis: 0,94 ± 0,27 frente a 0,62 ± 0,36, p < 0,47.
Clínica
El PASI mejoró globalmente tras 12 semanas de tratamiento. El PASI basal mostró 33,30 ± 10,71 y tras el tratamiento 15,20 ± 13,28, p < 0,008. Nueve de los diez pacientes mejoraron y una paciente se mantuvo sin mejoría.
No hubo correlación significativa entre la variación de los linfocitos CD4 totales en la lesión y la mejoría en el PASI (rho = 0,49, p = 0,15) ni entre los valores de linfocitos CD8 totales en la lesión y la mejoría en el PASI (rho = 0,21, p = 0,55).
Tampoco hubo correlación entre el IMC y la variación del PASI (rho = 0,30, p = 0,93).
Sangre
Se analizó un total de 20 muestras de sangre procedentes de los 10 pacientes. No hubo diferencias significativas en las poblaciones linfocitarias sanguíneas antes y después del tratamiento. La media de linfocitos CD4 basales fue de 1.204,40 ± 869,59 y tras tratamiento con etanercept fue de 1.021,67 ± 409,63, p < 0,441. La media de linfocitos CD8 basales fue de 642,50 ± 351,52 frente a 583,11 ± 182,69 tras etanercept (p < 0,55).
Nueve (90 %) de los pacientes tuvieron una determinación de anticuerpos antinucleares (ANA) y ENA negativos antes y después del tratamiento con etanercept. Una (10 %) paciente presentó ANA positivos con un título de 1/640 y ENA negativos antes del tratamiento. Tras el tratamiento, el título de ANA aumentó a 1/1.280, se hicieron positivos los anticuerpos contra ribonucleoproteína y sufrió un brote de poliartritis en manos y muñecas. El cuadro clínico y la elevación de autoanticuerpos se resolvieron añadiendo metotrexate 25 mg/semana y prolongando la administración de etanercept.
Acontecimientos adversos
Uno de los pacientes experimentó un impétigo estafilocóccico en fosas nasales que tuvo que ser tratado con tratamiento sistémico sin complicaciones. Una paciente presentó reacción local en el sitio de inyección con fenómeno de recall que se controló con esteroides locales.
Discusión
La psoriasis es una enfermedad inflamatoria crónica de la piel que puede presentarse asociada a artropatía. En la etiología se han implicado distintos genes que interaccionan entre sí y con estímulos medioambientales, desencadenando el fenotipo de la enfermedad11,12. En las lesiones de psoriasis se produce una hiperproliferación y una maduración anormal del queratinocito acompañada de un infiltrado inflamatorio compuesto principalmente por linfocitos T con predominancia de células CD4+ en dermis y CD8+ en epidermis13. Se ha visto que la activación local de estas células es crucial en el desarrollo y mantenimiento de las lesiones de psoriasis4,14.
El etanercept es una proteína de fusión compuesta por dos subunidades del receptor p75 del TNF-α que actúa uniéndose de forma competitiva a esta molécula y previene la interacción con sus receptores en las membranas celulares. Etanercept ha mostrado eficacia en el tratamiento de la psoriasis y de la artropatía psoriásica mejorando la afectación clínica8,15 y el infiltrado inflamatorio de las lesiones. Nosotros consideramos que etanercept era el agente ideal para estudiar el efecto inmune del bloqueo del TNF de las placas de psoriasis porque su acción es debida a la neutralización del TNF y no a la depleción de las células que expresan TNF en su superficie.
En nuestro estudio encontramos un descenso precoz del número global de linfocitos T en las lesiones de psoriasis tras 12 semanas de tratamiento en monoterapia con etanercept, lo que concuerda con los resultados de Gottlieb et al16 tras 24 semanas de tratamiento. Este descenso se produjo tanto en los linfocitos CD4+ como en los linfocitos CD8+ en dermis y epidermis, pero no en sus respectivas poblaciones sanguíneas. El descenso de linfocitos T en las lesiones tras el uso de anti-TNF también se ha constatado en modelos animales y sugiere que la proliferación local de células T en la psoriasis es dependiente de la producción local de TNF-α4. El descenso de la ratio CD4+/ CD8+ en dermis tras el tratamiento está de acuerdo con los estudios que sugieren que los linfocitos CD4+, pero no los CD8+, son capaces de desencadenar la lesión de psoriasis, indicando una resolución de las mismas17.
Realizamos la detección de los autoanticuerpos en busca de posibles elevaciones de estos con el tratamiento y solamente se produjo elevación de los mismos en una paciente que ya tenía ANA positivos previamente, lo que hace pensar que su elevación se produce en individuos predispuestos.
La mejoría clínica experimentada en 9 de nuestros pacientes coincide con lo descrito en la literatura18. La ausencia de mejoría en uno de nuestros pacientes coincidió con la presencia previa de ANA que aumentó tras el tratamiento con etanercept. En este paciente no se desarrollaron clínica ni histología cutánea de lupus, como demostró la inmunofluorescencia directa negativa. Sí que presentó un episodio agudo de poliartritis que afectó a manos y muñecas, lo que ha sido descrito en algunos pacientes con artritis reumatoide que desarrollaron lupus tras el tratamiento con terapias anti-TNF19. Tras las 12 semanas iniciales de tratamiento del protocolo se le administró metotrexate 25 mg/semana junto con etanercept, lo que produjo una mejoría de sus lesiones junto con un descenso del título de anticuerpos. En nuestra opinión, el cuadro de esta paciente se correspondería con un brote de artropatía psoriásica acompañando a la refractariedad al tratamiento y no sería un episodio de lupus, ya que mejoró sin necesidad de la suspensión del tratamiento.
No encontramos correlación significativa entre el descenso de linfocitos y la mejoría en el PASI, lo que podría ser explicado por el relativamente corto periodo de tiempo transcurrido entre las biopsias y por el escaso tamaño muestral. También ha sido sugerido que esta escasa correlación es debida a que los linfocitos T actúan de forma local en la producción de las lesiones de psoriasis y que la célula que tiene mayor relevancia en su desarrollo sería la célula dendrítica, que los activaría4. Diversos estudios han mostrado que el mantenimiento de etanercept más allá de las 12 semanas iniciales de tratamiento produce una mejoría clínica en la psoriasis, incluso en aquellos pacientes que no han respondido durante ese periodo inicial18,20. Nosotros no podemos descartar que en un estudio a largo plazo haya una correlación significativa entre el descenso en el PASI y el descenso de linfocitos T en las lesiones.
La ausencia de disminución de poblaciones linfocitarias en sangre se explica por la ausencia de modificación de los niveles sanguíneos de TNF en las fases iniciales del tratamiento con anti-TNF21, la menor presencia de TNF en esta que en las lesiones22 y porque etanercept no produce lisis de las células que expresan TNF en su superficie9.
Los efectos secundarios durante el tratamiento fueron leves y bien tolerados.
Conclusión
Etanercept produce mejoría clínica y una disminución significativa de los linfocitos CD8 en epidermis y de los linfocitos CD4 en dermis en la placa de psoriasis de forma precoz tras 12 semanas de tratamiento sin producir afectación de las poblaciones linfocitarias en sangre periférica. Este estudio muestra eficacia y un buen perfil de seguridad de este fármaco en el tratamiento de la psoriasis, pero hacen falta estudios a largo plazo con él.
Conflicto de intereses
Los autores no presentan ningún conflicto de intereses. El estudio no ha sido financiado por ninguna entidad.
Correspondencia:
Laura Mahiques Santos.
Servicio de Dermatología.
Hospital General Universitario de Valencia.
Avda. Tres Cruces, s/n. 46014 Valencia. España.
laura_mahiques@aedv.es
Aceptado el 9 de mayo de 2007.