Los pénfigos son un grupo de enfermedades ampollosas autoinmunes que afectan a la piel y a las membranas mucosas. Sus características clínicas y epidemiológicas son variables en función de factores geográficos y étnicos.
ObjetivoSi hacemos una búsqueda bibliográfica exhaustiva encontramos escasos trabajos sobre epidemiología del pénfigo en nuestro medio. El objetivo de nuestro estudio es determinar las características clínicas y epidemiológicas del pénfigo en un hospital de segundo nivel de Málaga (España), de una manera retrospectiva.
Material y métodosEl estudio incluyó 20 pacientes diagnosticados de pénfigo en nuestro Servicio en un periodo de 13 años, comprendido entre enero de 1995 y enero de 2008.
ResultadosSe analizaron un extenso número de parámetros clínicos y epidemiológicos, incluyendo sexo, edad, tipo de pénfigo, tiempo de evolución de la enfermedad hasta el momento del diagnóstico, sintomatología asociada, tipo, morfología y localización de las lesiones en el momento del diagnóstico, afectación de piel y mucosas, tipo de tratamiento realizado, efectos adversos y complicaciones debidas a la terapia, número de ingresos hospitalarios y evolución final de los pacientes.
ConclusionesAunque con pequeñas diferencias, nuestros resultados están en buena consonancia con los ya existentes en la literatura en lo relativo al sexo, la edad y el perfil clínico de la enfermedad. Según nuestros datos ser varón es un factor de mal pronóstico, puesto que se asocia a una peor respuesta de la enfermedad al tratamiento y a mayor tasa de efectos secundarios y frecuencia de ingresos hospitalarios.
Pemphigus comprises a group of autoimmune blistering diseases that affect the skin and mucous membranes. Its clinical and epidemiologic features vary according to geographic location and ethnic background.
ObjectiveAn exhaustive search of the literature reveals very few reports of the epidemiology of pemphigus in setting. Our aim, thus, was to conduct a retrospective study of the clinical and epidemiologic features of pemphigus at a secondary care hospital in Málaga, Spain.
Material and methodsWe studied 20 patients diagnosed with pemphigus in our department over a period of 13 years (January 1995 to January 2008).
ResultsWe analyzed a large variety of clinical and epidemiologic parameters including sex; age; type of pemphigus; time since onset; associated symptoms; type, morphology, and location of lesions at the time of diagnosis; extent of skin and mucosal involvement; treatment received; treatment-related adverse effects and complications; number of hospital admissions; and patient outcome.
ConclusionsExcept for minor differences, our results are in agreement with published data on pemphigus regarding sex, age, and clinical presentation. According to our results, male sex is a predictor of poor prognosis as it is associated with poorer response to treatment and a higher rate of adverse effects and hospital admission.
El término pénfigo proviene del griego pemphix, que significa ampolla o burbuja, y describe un grupo de enfermedades ampollosas crónicas autoinmunes de la piel, en las que se producen autoanticuerpos que se dirigen contra la superficie celular de los queratinocitos, produciendo la pérdida de adherencia intercelular de éstos a través de un proceso llamado acantólisis. Desde el punto de vista clínico se caracteriza por la aparición de ampollas en la piel y erosiones y úlceras dolorosas en las mucosas. Clásicamente, el pénfigo se ha dividido en dos grandes grupos: el pénfigo vulgar (PV) y el pénfigo foliáceo (PF), según la localización de la ampolla1–4.
Los datos epidemiológicos del pénfigo son limitados. Es una enfermedad infrecuente (aunque en aumento, según un reciente estudio5) cuya incidencia, prevalencia y características clínicas y epidemiológicas son variables en función de factores geográficos y étnicos2. Existen muy pocas publicaciones sobre la epidemiología del pénfigo en nuestro medio. Las series más amplias proceden del Hospital 12 de Octubre de Madrid6 (52 casos) y del Hospital Virgen Macarena de Sevilla7,8 (34 y 23 pacientes en sendos trabajos publicados).
El objetivo de este trabajo es determinar las características clínicas y demográficas del pénfigo en el área de salud que corresponde al Hospital Universitario Virgen de la Victoria de Málaga (España), mediante el estudio retrospectivo de 20 casos diagnosticados en un periodo de 13 años, y comparar nuestros resultados con los ya publicados en otras zonas geográficas mediante una extensa revisión de la bibliografía existente.
Material y métodosEl estudio incluyó 20 pacientes diagnosticados de pénfigo en el Servicio de Dermatología del Hospital Clínico Universitario Virgen de la Victoria de Málaga durante un periodo de 13 años, comprendido entre enero de 1995 y enero de 2008. El número de personas adscritas al área de salud que corresponde al Hospital Universitario Virgen de la Victoria de Málaga (España) es de 460.000.
En todos los pacientes el diagnóstico se realizó basándose en las características clínicas típicas de la enfermedad, y confirmándose posteriormente mediante análisis histopatológico e inmunofluorescencia directa (IFD).
Se midieron y analizaron un extenso número de parámetros clínicos y epidemiológicos (tablas 1 y 2). Todos los datos se obtuvieron de forma retrospectiva mediante revisión de historias clínicas e informes de anatomía patológica.
Características clínicas de los pacientes
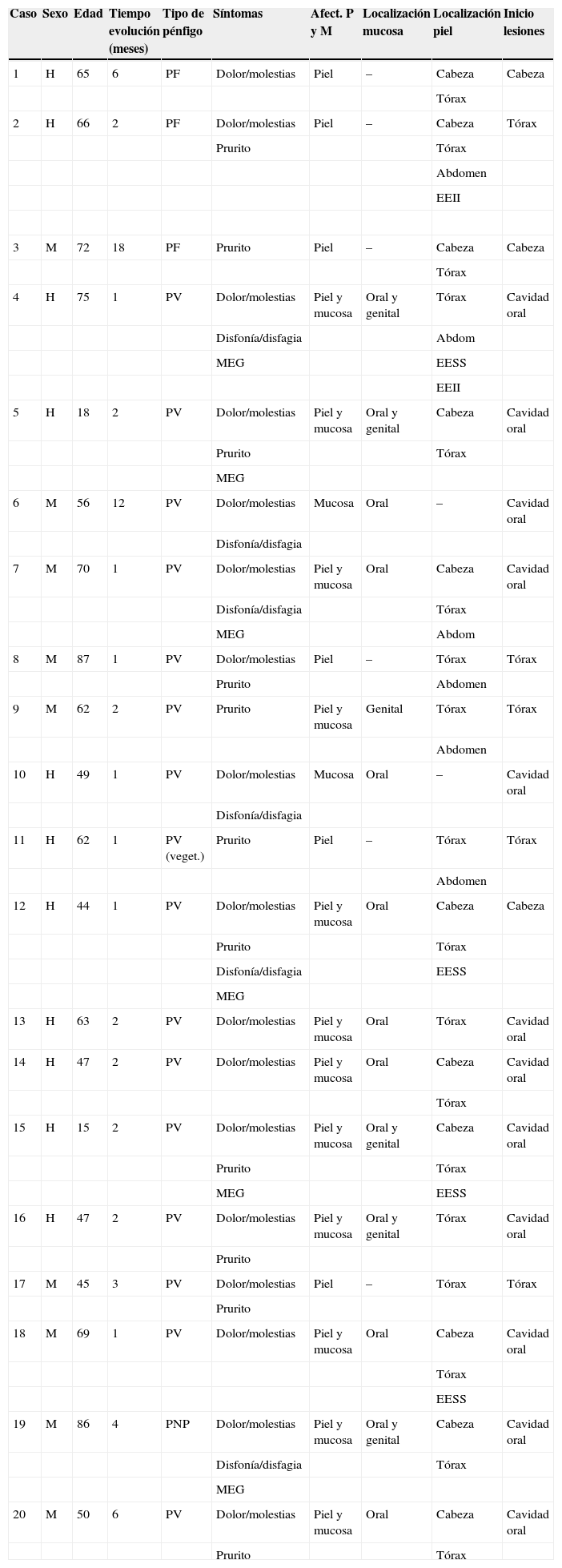
| Caso | Sexo | Edad | Tiempo evolución (meses) | Tipo de pénfigo | Síntomas | Afect. P y M | Localización mucosa | Localización piel | Inicio lesiones |
| 1 | H | 65 | 6 | PF | Dolor/molestias | Piel | – | Cabeza | Cabeza |
| Tórax | |||||||||
| 2 | H | 66 | 2 | PF | Dolor/molestias | Piel | – | Cabeza | Tórax |
| Prurito | Tórax | ||||||||
| Abdomen | |||||||||
| EEII | |||||||||
| 3 | M | 72 | 18 | PF | Prurito | Piel | – | Cabeza | Cabeza |
| Tórax | |||||||||
| 4 | H | 75 | 1 | PV | Dolor/molestias | Piel y mucosa | Oral y genital | Tórax | Cavidad oral |
| Disfonía/disfagia | Abdom | ||||||||
| MEG | EESS | ||||||||
| EEII | |||||||||
| 5 | H | 18 | 2 | PV | Dolor/molestias | Piel y mucosa | Oral y genital | Cabeza | Cavidad oral |
| Prurito | Tórax | ||||||||
| MEG | |||||||||
| 6 | M | 56 | 12 | PV | Dolor/molestias | Mucosa | Oral | – | Cavidad oral |
| Disfonía/disfagia | |||||||||
| 7 | M | 70 | 1 | PV | Dolor/molestias | Piel y mucosa | Oral | Cabeza | Cavidad oral |
| Disfonía/disfagia | Tórax | ||||||||
| MEG | Abdom | ||||||||
| 8 | M | 87 | 1 | PV | Dolor/molestias | Piel | – | Tórax | Tórax |
| Prurito | Abdomen | ||||||||
| 9 | M | 62 | 2 | PV | Prurito | Piel y mucosa | Genital | Tórax | Tórax |
| Abdomen | |||||||||
| 10 | H | 49 | 1 | PV | Dolor/molestias | Mucosa | Oral | – | Cavidad oral |
| Disfonía/disfagia | |||||||||
| 11 | H | 62 | 1 | PV (veget.) | Prurito | Piel | – | Tórax | Tórax |
| Abdomen | |||||||||
| 12 | H | 44 | 1 | PV | Dolor/molestias | Piel y mucosa | Oral | Cabeza | Cabeza |
| Prurito | Tórax | ||||||||
| Disfonía/disfagia | EESS | ||||||||
| MEG | |||||||||
| 13 | H | 63 | 2 | PV | Dolor/molestias | Piel y mucosa | Oral | Tórax | Cavidad oral |
| 14 | H | 47 | 2 | PV | Dolor/molestias | Piel y mucosa | Oral | Cabeza | Cavidad oral |
| Tórax | |||||||||
| 15 | H | 15 | 2 | PV | Dolor/molestias | Piel y mucosa | Oral y genital | Cabeza | Cavidad oral |
| Prurito | Tórax | ||||||||
| MEG | EESS | ||||||||
| 16 | H | 47 | 2 | PV | Dolor/molestias | Piel y mucosa | Oral y genital | Tórax | Cavidad oral |
| Prurito | |||||||||
| 17 | M | 45 | 3 | PV | Dolor/molestias | Piel | – | Tórax | Tórax |
| Prurito | |||||||||
| 18 | M | 69 | 1 | PV | Dolor/molestias | Piel y mucosa | Oral | Cabeza | Cavidad oral |
| Tórax | |||||||||
| EESS | |||||||||
| 19 | M | 86 | 4 | PNP | Dolor/molestias | Piel y mucosa | Oral y genital | Cabeza | Cavidad oral |
| Disfonía/disfagia | Tórax | ||||||||
| MEG | |||||||||
| 20 | M | 50 | 6 | PV | Dolor/molestias | Piel y mucosa | Oral | Cabeza | Cavidad oral |
| Prurito | Tórax | ||||||||
| Caso | Tipo de lesiones | N.° de lesiones | Tratamientos previos | Tratamiento final | Complicaciones del tratamiento | Remisión de la enfermedad | Ingresos hospital | Éxitus |
| 1 | Erosión/costra | <10 | – | Corticoides | Sí | Completa | No | No |
| 2 | Erosión/costra | >25 | Corticoides | Corticoides±IS | Sí | Parcial | Sí | Sí |
| Azatioprina | ||||||||
| 3 | Erosión/costra | <10 | – | Corticoides | No | Completa | No | No |
| 4 | Erosión/costra | >25 | Corticoides | Rituximab | Sí | Completa | Sí | No |
| Ampollas | Azatioprina | |||||||
| Aftas orales | ||||||||
| 5 | Erosión/costra | >25 | Corticoides | Rituximab | Sí | Completa | Sí | No |
| Ampollas | Azatioprina | |||||||
| Aftas orales | Ciclosporina | |||||||
| M. mofetilo | ||||||||
| Igs IV | ||||||||
| 6 | Aftas orales | 10–25 | Corticoides | Corticoides±IS | Sí | Parcial | No | No |
| Azatioprina | ||||||||
| 7 | Erosión/costra | 10–25 | Corticoides | Rituximab | Sí | Parcial | Sí | No |
| Ampollas | Azatioprina | |||||||
| Aftas orales | ||||||||
| 8 | Erosión/costra | <10 | – | Corticoides | Sí | Completa | No | No |
| 9 | Erosión/costra | 10–25 | – | Corticoides | No | Completa | No | No |
| Ampollas | ||||||||
| 10 | Aftas orales | 10–25 | Corticoides | Rituximab | Sí | Parcial | No | No |
| Azatioprina | ||||||||
| 11 | Erosión/costra | 10–25 | – | Corticoides | No | Completa | No | No |
| Ampollas | ||||||||
| 12 | Erosión/costra | >25 | Corticoides | Corticoides±IS | Sí | Parcial | Sí | No |
| Ampollas | Azatioprina | |||||||
| Aftas orales | Ciclosporina | |||||||
| 13 | Erosión/costra | 10–25 | Corticoides | Corticoides±IS | Sí | Completa | Sí | No |
| Aftas orales | Azatioprina | |||||||
| 14 | Erosión/costra | 10–25 | Corticoides | Corticoides±IS | Sí | Parcial | No | No |
| Aftas orales | Azatioprina | |||||||
| 15 | Erosión/costra | 10–25 | Corticoides | Rituximab | Sí | Parcial | Sí | No |
| Ampollas | Ciclosporina | |||||||
| Aftas orales | M. mofetilo | |||||||
| Igs IV | ||||||||
| 16 | Erosión/costra | <10 | Corticoides | Corticoides±IS | Sí | Parcial | Sí | No |
| Ampollas | Azatioprina | |||||||
| Aftas orales | M. mofetilo | |||||||
| 17 | Erosión/costra | <10 | – | Corticoides | No | Parcial | No | No |
| Ampollas | ||||||||
| 18 | Erosión/costra | 10–25 | – | Corticoides | No | Completa | No | No |
| Ampollas | ||||||||
| Aftas orales | ||||||||
| 19 | Erosión/costra | >25 | – | Corticoides | No | Parcial | No | No |
| Ampollas | ||||||||
| Aftas orales | ||||||||
| 20 | Erosión/costra | >25 | Corticoides | Corticoides±IS | No | Completa | No | No |
| Ampollas | Azatioprina | |||||||
| Aftas orales |
Afect. P y M: afectación de piel y mucosas; EEII: extremidades inferiores; EESS: extremidades superiores; H: hombre; Igs IV: inmunoglobulina intravenosa; IS: inmunosupresores; M: mujer; MEG: malestar general; M. mofetil: micofenolato mofetilo; PF: pénfigo foliáceo; PV: pénfigo vulgar; Veget: vegetante.
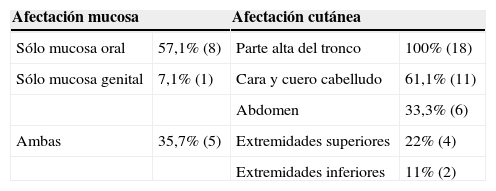
Localización más frecuente de las lesiones en mucosas y en piel
| Afectación mucosa | Afectación cutánea | ||
| Sólo mucosa oral | 57,1% (8) | Parte alta del tronco | 100% (18) |
| Sólo mucosa genital | 7,1% (1) | Cara y cuero cabelludo | 61,1% (11) |
| Abdomen | 33,3% (6) | ||
| Ambas | 35,7% (5) | Extremidades superiores | 22% (4) |
| Extremidades inferiores | 11% (2) | ||
Para el análisis de los resultados se empleó el programa estadístico SPSS 12.0, y se realizó una estadística descriptiva determinando frecuencias, porcentajes, medias y comparaciones entre los distintos grupos.
ResultadosLa frecuencia del pénfigo en la población estudiada es baja, ya que el número de pacientes con algún tipo de pénfigo atendidos a lo largo de 13 años (1995–2008) fue muy pequeño (n=20), lo cual supone una limitación muy importante a la hora de analizar los resultados obtenidos.
En la tabla 1 figuran las características clínicas de los pacientes incluidos en el estudio. De éstos 11 fueron hombres (55%) y 9 mujeres (45%), con una ratio hombre/mujer de 1,22/1. La edad media en el momento del diagnóstico de la enfermedad fue de 57,4±18,8 años, siendo el paciente más joven de 15 años y el mayor de 87 años. Si comparamos por sexos, la edad media en el momento de diagnóstico en hombres fue de 50,1±19,3 años (rango 15–75), mientras que en las mujeres fue sensiblemente mayor: 66,3±14,6 años (rango 45–87). En cuanto a los grupos de edad, la gran mayoría de los pacientes (18 casos, 90%) eran mayores de 40 años, existiendo solamente dos casos (10%) menores de 18 años.
La forma clínica más frecuente fue el PV (16 casos [80%] , siendo uno de ellos un pénfigo de tipo vegetante), seguido de PF (tres casos [15%]). En nuestra serie tuvimos también un caso de pénfigo paraneoplásico, que desarrolló una paciente diagnosticada previamente de linfoma no Hodgkin.
El diagnóstico de pénfigo se realizó en todos los sujetos del estudio en función de las características clínicas, siendo confirmado posteriormente mediante examen histopatológico y técnicas de IFD. La IFD mostró en todos los casos en que se realizó (90%, 18 pacientes) depósitos de IgG y, en algunos casos, de IgM entre los queratinocitos. Solamente en dos casos no se pudo realizar por motivos técnicos. La técnica de inmunofluorescencia indirecta (IFI) para detectar anticuerpos circulantes contra la superficie de los queratinocitos no se realiza en nuestro hospital en la actualidad.
El tiempo medio de evolución de la enfermedad hasta el momento del diagnóstico osciló entre 1 y 18 meses, con una media de 3,48±4,3 meses. Un hecho a destacar es que, en nuestra serie, los pacientes con lesiones en mucosas tardaron menos tiempo en consultar (2,75±3 meses) que aquellos que sólo tenían afectación cutánea (5,17±6,6 meses). En cuanto a los síntomas que llevaron a los pacientes a consultar, encontramos que el más frecuente fue el dolor y/o molestias locales causadas por las lesiones (85%, 17 casos), seguido del prurito (55%, 11 pacientes). En 6 enfermos (30%) hubo afectación importante del estado general. Otros 6 (30%) refirieron odinofagia y/o disfagia como consecuencia de las lesiones en la mucosa.
En relación con el perfil clínico de la enfermedad (tabla 2) el 60% de los enfermos (12 casos) presentó afectación de la piel y las mucosas, frente al 30% (6 pacientes) que tenía afectación exclusivamente cutánea y al 10% (dos pacientes) que tenía sólo afectación mucosa. La localización en las mucosas ocurrió en 14 enfermos, siendo la mucosa más frecuentemente afectada la oral (92,8%, 13 pacientes). La localización en la piel ocurrió en 18 pacientes. La zona cutánea que se vio afectada con más frecuencia fue la parte alta del tronco (100%, 18 casos), seguida de la cara y del cuero cabelludo (61,1%, 11 casos). La localización de inicio de la enfermedad más habitual fue la cavidad oral en un 60% de los casos (12 pacientes), seguida de la parte alta del tronco (25%, 5 enfermos), la cara y el cuero cabelludo (15%, tres sujetos).
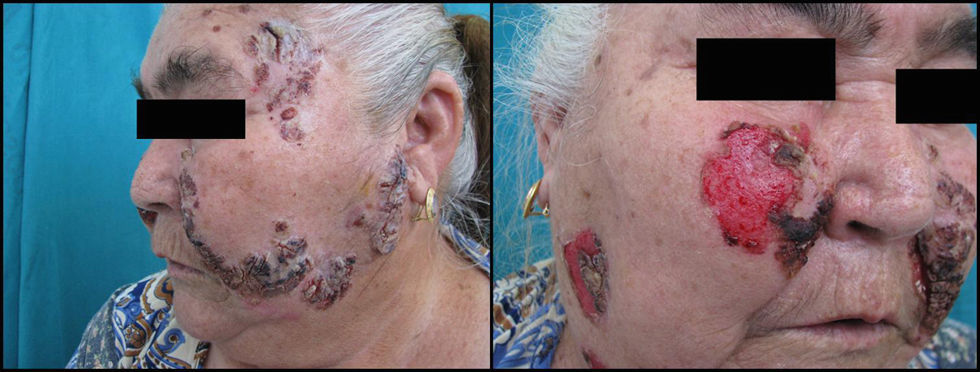
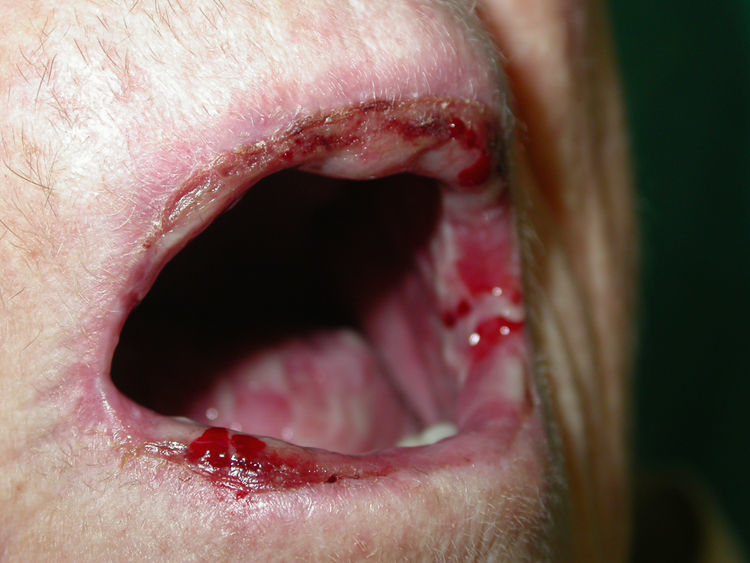
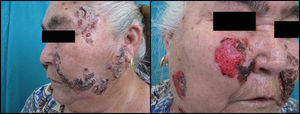
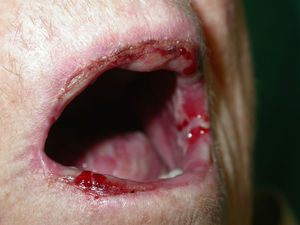
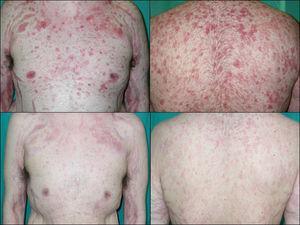
Si analizamos las características de las lesiones en el momento del diagnóstico de la enfermedad encontramos que el 90% de los pacientes (18 casos) presentaba lesiones en forma de erosiones cubiertas o no de costras y el 60% (12 casos) tenía verdaderas ampollas frágiles. Como hemos señalado anteriormente, 13 enfermos (65%) tenían afectación mucosa en forma de erosiones y aftas orales (figs. 1 y 2). El número de lesiones que presentaban los pacientes en el momento de la consulta fue de 10–25 en el 45% de los casos (9 sujetos), mientras que el 25% (5 casos) tenía menos de 10 lesiones y el 30% (6 casos) más de 25. El diámetro mayor medio de la lesión de más tamaño fue de 1,97±1,24cm (con un rango de 0,5–6cm).
El tratamiento de inicio en todos nuestros pacientes (100%) fue con corticoides tópicos y orales, a dosis de 0,5–1mg/kg/día, incrementando un 50% cada 7 días hasta controlar la actividad de la enfermedad (cese de la aparición de las lesiones). Tras el control de la actividad se mantuvo la misma dosis hasta que remitían la mayor parte de las lesiones, y después se reducía paulatinamente. En nuestra serie en el 40% de los pacientes (8 sujetos) se consiguió el control de la enfermedad exclusivamente con esteroides orales, mientras que en el 60% (12 enfermos) fue necesario el empleo de otras terapias adyuvantes en algún momento de la evolución de la enfermedad; de estos últimos, en 7 pacientes (35%) se controló la enfermedad con el uso concomitante de corticoides e inmunosupresores, y en los 5 restantes (25%) fue necesario recurrir al uso de terapias biológicas experimentales. Es interesante destacar, como dato de interés, la diferencia de respuesta al tratamiento en relación con el sexo del paciente, ya que en el 66,7% de las mujeres (6 casos) la enfermedad se controló sólo con el empleo de corticoides sistémicos, mientras que esto sólo se logró en el 18,2% de los hombres (dos casos).
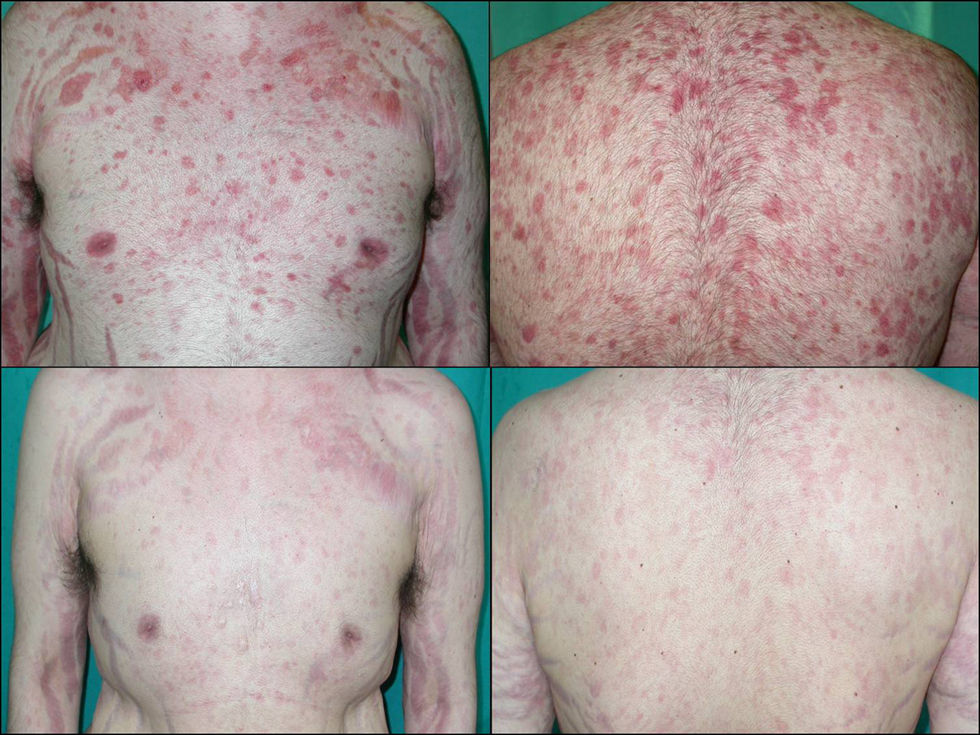
Dentro de los fármacos inmunosupresores el agente más empleado fue azatioprina en el 91,7% de los casos (11 pacientes), seguido de ciclosporina (25%, tres casos), micofenolato mofetilo (25%, tres casos) y la infusión intravenosa de inmunoglobulinas (16,7%, dos casos). No utilizamos metotrexato ni ciclofosfamida. El 91,6% de los pacientes recibió azatioprina como inmunosupresor inicial, pero al no obtenerse respuesta se sustituyó por alguno de los otros. Finalmente, en los 5 pacientes en los que no se consiguió el control de la enfermedad con ninguno de los tratamientos convencionales fue necesario recurrir a terapias biológicas; concretamente empleamos rituximab, un anticuerpo monoclonal quimérico anti-CD20 con un éxito importante, pues tras un periodo de seguimiento de 21,6±15,1 meses (rango 6–36 meses) en el 100% de los pacientes se logró controlar la enfermedad: dos de ellos están en remisión completa sin tratamiento y los otros tres están en remisión parcial, con dosis bajas de esteroides y/o inmunosupresores (fig. 3).
Se produjeron efectos adversos en el 65% de los pacientes (13 casos), la gran mayoría derivados del tratamiento. Los más frecuentes fueron las infecciones (61,5%), seguidas de hiperglucemia (38,5%), síndrome de Cushing (38,5%), molestias gastrointestinales (30,7%), hiperlipemias (23%), hepatotoxicidad (15,4%), hipertensión arterial (15,4%), cataratas (15,4%), osteoporosis (15,4%), miopatía (7,7%) y toxicidad renal (7,7%). Además, fue necesario el ingreso hospitalario de tres pacientes por complicaciones relacionadas con el tratamiento: una neumonía de la comunidad y una sepsis bacteriana en sendos pacientes en tratamiento con corticoides y azatioprina, y un cuadro febril en el contexto de una bacteriemia por gérmenes gram negativos en un paciente en tratamiento con rituximab. Es de destacar que, de nuevo, el grupo de pacientes masculinos tuvo mayor porcentaje de efectos adversos (90,9%, 10 enfermos) que el grupo femenino (33,3%, tres pacientes).
De nuestros pacientes el 40% (8 casos) requirió ingreso hospitalario en algún momento de la evolución para control de su enfermedad o de las complicaciones debidas al tratamiento. También los hombres tuvieron mayor porcentaje de ingresos, un 63,6% (7 casos) frente a un 11,1% (un caso) de mujeres.
Finalmente, tras un tiempo de seguimiento medio de 6,9±4,3 años (mínimo un año y máximo 13 años) la supervivencia de nuestros pacientes es del 95%. El control de la enfermedad con el tratamiento se consiguió en el 100% de los pacientes, estando en remisión completa (es decir, sin lesiones y sin tratamiento) el 50% de los sujetos (10 casos) y en remisión parcial (es decir, lesiones ausentes o escasas, pero con tratamiento esteroideo a bajas dosis y/o inmunosupresores) el otro 50% (10 pacientes). Sólo se produjo un caso de exitus en un paciente como consecuencia de la enfermedad o su tratamiento: un enfermo en tratamiento con corticoides orales y azatioprina que falleció debido a una sepsis bacteriana fatal a partir de una infección de una úlcera localizada en el pie, presumiblemente facilitada por el efecto inmunosupresor del tratamiento.
DiscusiónLa forma clínica de pénfigo más frecuente en nuestra serie, como en la literatura médica1–3, fue el PV (incluyendo la variante vegetante) en el 80% de los casos (16 pacientes), seguido del PF (15%, tres casos). Estos resultados son comparables a los de la mayoría de trabajos, excepto en Finlandia9, donde predomina el pénfigo eritematoso; en Túnez10, Mali11 y Sudáfrica12 el PF y en Brasil13 el fogo selvagem (o PF endémico).
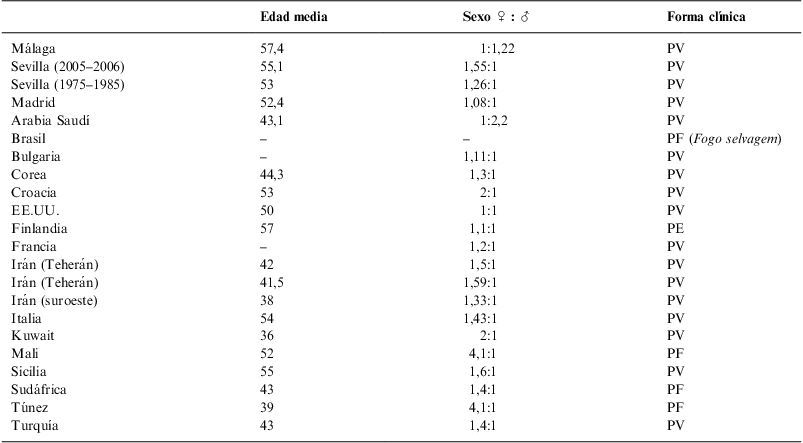
Clásicamente se dice que el pénfigo afecta por igual a hombres y mujeres1–3. En nuestro trabajo la relación o ratio hombre/mujer es de 1,22:1 a favor del hombre. Sin embargo, una preponderancia variable a favor de las mujeres se ha observado en la mayoría de las series publicadas hasta la fecha9–12,14–24. Una afectación por igual en ambos sexos se vio en un estudio publicado en Estados Unidos25, mientras que solamente en Arabia Saudí26 se ha objetivado un predominio del sexo masculino sobre el femenino 2,2:1, coincidiendo con nuestro trabajo. Si comparamos nuestros datos con las publicaciones previas españolas también encontramos una frecuencia mayor en mujeres que en hombres, siendo la ratio de 1,08:1 en Madrid6 y de 1,26:1 y 1,55:1 en Sevilla7,8.
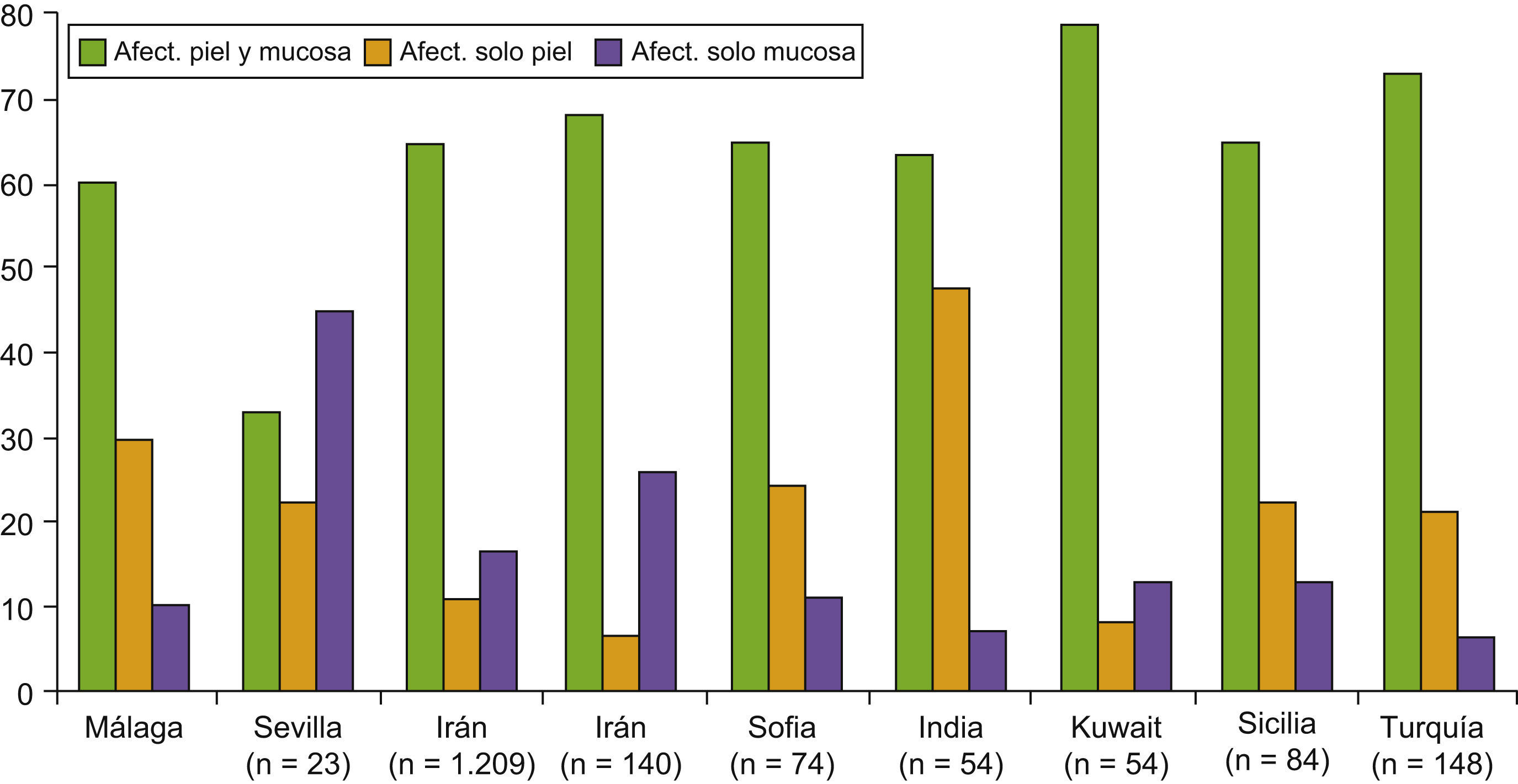
El pénfigo suele iniciarse en la cuarta-sexta década de la vida1–3. Efectivamente, la edad media de inicio de la enfermedad en nuestro estudio fue de 57,4±18,8 años, similar a la publicada en otros trabajos9,11,17,18,24 y concordante con los datos reportados en las series españolas6–8. La tabla 3 muestra los datos demográficos y clínicos en las diferentes series publicadas nacionales e internacionales.
Datos demográficos y clínicos en las diferentes series publicadas nacionales e internacionales
| Edad media | Sexo ♀ : ♂ | Forma clínica | |
| Málaga | 57,4 | 1:1,22 | PV |
| Sevilla (2005–2006) | 55,1 | 1,55:1 | PV |
| Sevilla (1975–1985) | 53 | 1,26:1 | PV |
| Madrid | 52,4 | 1,08:1 | PV |
| Arabia Saudí | 43,1 | 1:2,2 | PV |
| Brasil | – | – | PF (Fogo selvagem) |
| Bulgaria | – | 1,11:1 | PV |
| Corea | 44,3 | 1,3:1 | PV |
| Croacia | 53 | 2:1 | PV |
| EE.UU. | 50 | 1:1 | PV |
| Finlandia | 57 | 1,1:1 | PE |
| Francia | – | 1,2:1 | PV |
| Irán (Teherán) | 42 | 1,5:1 | PV |
| Irán (Teherán) | 41,5 | 1,59:1 | PV |
| Irán (suroeste) | 38 | 1,33:1 | PV |
| Italia | 54 | 1,43:1 | PV |
| Kuwait | 36 | 2:1 | PV |
| Mali | 52 | 4,1:1 | PF |
| Sicilia | 55 | 1,6:1 | PV |
| Sudáfrica | 43 | 1,4:1 | PF |
| Túnez | 39 | 4,1:1 | PF |
| Turquía | 43 | 1,4:1 | PV |
PE: pénfigo eritematoso; PF: pénfigo foliáceo; PV: pénfigo vulgar.
Si la edad se correlaciona con el sexo encontramos que la edad media de inicio de la enfermedad en mujeres fue netamente superior (66,3±14,6 años) que en los hombres (50,1±19,3 años). Tal diferencia se explica porque los casos de edades extremas se dieron en uno y otro sexo, es decir, los casos de presentación juvenil (15 y 18 años) en nuestro trabajo aparecieron en hombres, mientras que los más longevos se dieron en mujeres (87 y 86 años). Sin embargo, como hemos señalado anteriormente, debido al pequeño número de casos, no es posible sacar conclusiones sobre esta diferencia. Acorde con estos resultados aparecen las series de Irán22 y Arabia Saudí26, en las que la edad de presentación es mayor en mujeres que en hombres, aunque no con una diferencia tan marcada. Otros estudios publicados14,18,25, por el contrario, muestran una edad de inicio superior en hombres.
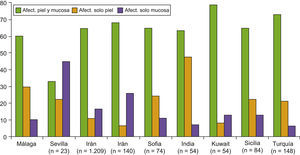
En cuanto al perfil clínico de la enfermedad, las ampollas del pénfigo pueden dar lugar a manifestaciones cutáneas y/o mucosas según la variante clínica. En nuestro trabajo el 60% de los pacientes (12 casos) presentó afectación de piel y mucosas, el 10% (2 casos) afectación exclusiva de mucosas y el 30% (6 casos) afectación exclusivamente cutánea. En el resto de series y trabajos publicados los resultados son variables según la zona geográfica donde nos encontremos, aunque en la gran mayoría aparece la afectación conjunta de la piel y las mucosas como la forma de afectación más frecuente, como podemos ver en la figura 4. Ninguno de nuestros pacientes afectos de PF tuvo afectación de mucosas, al igual que se describe en la literatura mundial1–3.
En nuestra serie, dentro de los sujetos con lesiones mucosas (70%, 14 pacientes), encontramos que la mucosa más frecuentemente afectada fue la oral (92,86%, 13 casos). Resultados similares encontramos en las series de Irán21,22 y la española de Sevilla8, donde hasta el 91,4, 81 y 80%, respectivamente, presentaban lesiones en la mucosa oral.
En cuanto a las lesiones en la piel (18 pacientes) la localización más frecuente fue en la parte alta del tronco (100%, 18 casos), seguida de la cara y el cuero cabelludo (61,1%, 11 casos). Estos resultados también se ajustan a los encontrados en los trabajos procedentes de Irán21,22. En la serie española procedente de Sevilla8 también aparecen el tórax (31%) y el cuero cabelludo (32%) como las localizaciones cutáneas más habituales, aunque con una frecuencia inferior a la de nuestro estudio.
Clásicamente se dice que el PV normalmente se inicia con lesiones en la mucosa oral, las cuales preceden a las lesiones cutáneas en meses. Efectivamente, preguntando a nuestros pacientes sobre el lugar de inicio de las mismas, la localización más frecuente fue la cavidad oral en un 60% de los casos (12 pacientes), seguida de la parte alta del tronco (25%, 5 pacientes). Estos datos son similares a los publicados en la literatura21–23, donde señalan que la localización inicial más frecuente suele ser la mucosa oral en el 60–90% de los casos. Por último, cabe resaltar que el 83,33% de nuestros enfermos (10 casos) que presentaban afectación inicial oral desarrollaron lesiones cutáneas posteriormente. Inversamente, solamente el 25% (dos pacientes con PV, ningún caso de PF) de los enfermos que presentaban enfermedad cutánea de inicio progresaron a lesiones en las mucosas.
El tiempo medio transcurrido desde la aparición de los síntomas hasta el momento del diagnóstico fue de 3,48±4,3 meses (rango 1–18 meses). Este parámetro varía en los diferentes trabajos, puesto que se ve influido por multitud de factores, entre ellos el grado de acceso a la asistencia sanitaria en el país en cuestión, o el grado de familiaridad de los médicos con la enfermedad y sus diferentes formas de presentación. De hecho, muchos de los pacientes son diagnosticados de inicio erróneamente de gingivoestamotatitis. Si comparamos nuestros resultados con la serie del Hospital 12 de Octubre (Madrid)6, por tratarse de un medio sanitario similar, encontramos que el tiempo medio de diagnóstico fue de 8 meses (rango 15 días–36 meses), superior al de nuestro estudio.
En nuestra serie los pacientes con lesiones en las mucosas tardaron menos tiempo en consultar (2,75±3 meses) que los pacientes que sólo tenían afectación cutánea (5,17±6,6 meses). Este hallazgo coincide con el del trabajo de Esmaili et al (Irán)22, donde señalan que los pacientes con afectación cutánea exclusiva o con lesiones cutáneas de inicio tardan más tiempo en consultar (41,9% de los pacientes con lesiones en las mucosas de inicio tenían un tiempo de desarrollo de la enfermedad de al menos 6 meses hasta la consulta al especialista, frente a un 63% de enfermos con lesiones cutáneas de inicio). Una explicación al diagnóstico más precoz en los pacientes con lesiones en las mucosas podría ser que las erosiones orales producen sintomatología florida en forma de dolor, molestias locales y odinofagia, que harían que los pacientes consultasen de forma más temprana que aquellos que sólo tienen lesiones cutáneas.
En cuanto al tratamiento del pénfigo es bien sabido que antes de la llegada de los corticoides sistémicos esta entidad solía ser mortal (mortalidad del 75%), ya que la mayoría de los pacientes fallecían en los 5 años siguientes a la aparición de la enfermedad. La introducción de corticoides sistémicos y de agentes inmunosupresores ha mejorado mucho el pronóstico del pénfigo, aunque la morbilidad y la mortalidad todavía son significativas (inferior al 10%), pues a veces se produce la muerte como resultado de las complicaciones del tratamiento. Aunque no existe un consenso universalmente aceptado los corticoides sistémicos son el pilar terapéutico fundamental, y los agentes inmunosupresores suelen usarse por su efecto de ahorro de corticoides, para reducir los efectos adversos de éstos o en caso de mal control de la enfermedad1,2.
Todos nuestros pacientes (100%) fueron tratados inicialmente con corticoides orales y tópicos, consiguiendo el control de la enfermedad en el 40% (8 sujetos). El resto (60%, 12 pacientes) requirió el empleo de otras terapias adyuvantes en algún momento de la evolución de la enfermedad. No se encontraron diferencias en cuanto a la respuesta al tratamiento entre los diferentes subtipos de pénfigo.
En 7 pacientes (35%) se controló la enfermedad con el uso concomitante de corticoides e inmunosupresores. Dentro de los fármacos inmunosupresores el agente más empleado fue azatioprina en el 91,7% de los casos (11 pacientes), seguido de ciclosporina (25%, tres casos), micofenolato mofetilo (25%, tres casos) y la infusión intravenosa de inmunoglobulinas (16,7%, dos casos). No tenemos experiencia con metotrexato ni ciclofosfamida en el tratamiento del pénfigo. Según nuestra experiencia uno de los tratamientos más eficaces y seguros del pénfigo es el empleo de corticoides orales combinados con azatioprina (conseguimos el control de la enfermedad en 7 de los 11 pacientes). Con el resto de agentes inmunosupresores no obtuvimos tan buenos resultados.
En los 5 pacientes (25%) en los que no se consiguió el control de la enfermedad con ninguno de los tratamientos convencionales fue necesario recurrir al empleo de terapia biológica con rituximab, anticuerpo monoclonal quimérico anti-CD20. La dosis de rituximab empleada en todos nuestros pacientes fue de 375mg/m2, administrado por vía intravenosa semanalmente durante 4 semanas. En nuestra serie rituximab se mostró como una alternativa de tratamiento válida, puesto que en el 100% de los pacientes se logró controlar la enfermedad. Excelentes resultados también han sido publicados en otros trabajos27–30. En cuanto a los efectos adversos debidos a rituximab, la mayoría de ellos son leves, transitorios y relacionados con la infusión. Sin embargo, se han descrito reacciones graves como hipotensión, broncoespasmo, síndrome de Stevens-Johnson, infecciones bacterianas graves, reactivación de herpes zoster, meningoencefalitis virales, reactivación de hepatitis B, anemia hemolítica autoinmune, fallo hepático, neutropenia, etc.27. En nuestro caso sólo uno de nuestros pacientes presentó un síndrome febril en el contexto de una bacteriemia por gérmenes gram negativos, que se resolvió satisfactoriamente con el ingreso del paciente y el tratamiento con antibióticos intravenosos.
En cuanto al resto de complicaciones se produjeron en gran parte de los enfermos (65%, 13 casos) y fueron consecuencia, en su mayoría, del tratamiento. Las más frecuentes fueron las infecciones (61,5%) seguidas de hiperglucemia (38,5%) y síndrome de Cushing (38,5%). En general, nuestros datos son similares a los descritos por otros autores, aunque con porcentajes variables6–8,15,16,21,23,24. En nuestra serie hubo un paciente que falleció como consecuencia de una sepsis bacteriana (una de las principales causas de muerte en estos pacientes), probablemente favorecida por el tratamiento inmunosupresor.
Finalmente, en relación con el tratamiento y sus complicaciones nuestro estudio arroja algunos datos interesantes al respecto, y es que el sexo masculino parece asociarse a una peor respuesta a tratamiento, lo que conlleva la necesidad de un mayor número y/o dosis de fármacos y, por ende, más tasa de efectos adversos y mayor frecuencia de ingresos hospitalarios: a) Un 81,1% de los hombres (10 pacientes) no se controlaron con el tratamiento esteroideo oral y requirieron otras terapias, frente a un 66,7% de las mujeres (6 casos) que sí lo hicieron; b) Un 90,9% de los pacientes varones (10 casos) sufrió efectos adversos por la terapia, frente a un 33,3% (tres casos) de las mujeres; c) hasta un 63,6% de los pacientes masculinos (7 casos), requirió ingreso en algún momento de la evolución para el control de su enfermedad o de las complicaciones debidas al tratamiento, frente a un 11,1% (un caso) de las mujeres. Este interesante hecho no ha sido descrito anteriormente en la literatura, aunque, por supuesto, requeriría de estudios con un número de pacientes mucho más amplio para ser confirmado de forma definitiva.
ConclusionesAunque con pequeñas diferencias, los datos demográficos y epidemiológicos de nuestro estudio están en buena consonancia con los ya existentes en la literatura nacional e internacional. Cabe destacar únicamente la mayor frecuencia de pénfigo en pacientes varones en nuestra serie, mientras que en el resto de trabajos no existen diferencias en cuanto a sexos o esta es favorable al sexo femenino.
Según nuestros resultados el hecho de ser varón parece comportarse como factor de mal pronóstico, puesto que se asocia a una peor respuesta de la enfermedad al tratamiento, a una mayor tasa de efectos secundarios y a mayor frecuencia de ingresos hospitalarios, aunque serían necesarios estudios con un número de casos mucho más amplio para apoyar esta conclusión de forma definitiva. Este hallazgo no ha sido referido con anterioridad en ninguna de las series publicadas de pénfigo.
En cuanto al tratamiento, según nuestra experiencia, rituximab se muestra como una alternativa terapéutica válida para los casos de pénfigo refractarios a las terapias estándares debido a su efectividad, buena tolerancia y perfil de seguridad.
Finalmente, esperamos que nuestros datos sirvan para conocer un poco más las características clínico-epidemiológicas del pénfigo en nuestro medio, tema sobre el que existen escasas publicaciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.