INTRODUCCIÓN
Las respuestas inmunes pueden agruparse en dos grandes categorías: respuesta inmune innata y respuesta inmune adaptativa. La respuesta indeltamune innata es inespecífica, constituye la primera barrera de defensa frente a las infecciones, y la llevan a cabo los granulocitos y los macrófagos que reconocen ciertas moléculas que se encuentran en la superficie de muchas bacterias, y a partir de ahí proceden a fagocitarlas, a la vez que inducen la secreción de citocinas1-3. La respuesta inmune adaptativa es aquella generada por los linfocitos T y B, que tras el encuentro con el antígeno para el que están específicamente predeterminados se multiplican y producen citocinas e inmunoglobulinas. Las citocinas son proteínas solubles de bajo peso molecular liberadas por las células que afectan la función o propiedades de otras células. Las citocinas son producidas por otras muchas células, además de las del sistema inmune, pero es en estas últimas en donde desempeñan un papel más relevante, especialmente entre los linfocitos T, que dependen de ellas para llevar a cabo sus efectos, actuando sobre una amplia gama celular: células B, células T, macrófagos, células tisulares y células hematopoyéticas. Para ejercer su función las citocinas se unen a receptores específicos presentes en las células sobre las que actúan.
A finales de la década de los ochenta se describieron tanto en ratones como en seres humanos dos subgrupos de linfocitos T helper (colaboradores) atendiendo al patrón de citocinas que producían, y se les denominó T helper 1 (Th1) y T helper 2(Th2)4,5. En respuesta a la estimulación antigénica, los linfocitos Th1 producen interleucina (IL)2 e interferón γ (IFN-γ) y estimulan la inmunidad mediada por las células. Los linfocitos Th2 segregan IL-4, IL-5 e IL-10, favorecen la inmunidad humoral, e inducen la producción de anticuerpos. Las respuestas extremas de este espectro son capaces de inhibir el desarrollo de la contraria, y así el IFN- producido por las células Th1 puede inhibir la proliferación de las células Th2. Contrariamente, la IL-4 y la IL-10 producidas por las células Th2 pueden inhibir la proliferación de las células Th16-8.
¿Qué es lo que determina que la respuesta inmune se decante hacia la producción de linfocitos T con fenotipo Th1 o Th2? Aunque actualmente no existe una respuesta clara a esta pregunta, la teoría más aceptada implica a ciertas citocinas. La IL-12 y el factor de necrosis tumoral α (TNF-α) producido por los macrófagos presentadores de antígenos son fuertes promotores de las respuestas Th19,108,10.
Actualmente sabemos que varias enfermedades cutáneas están caracterizadas por una respuesta Th2: el síndrome hipereosinofílico idiopático11, el penfigoide ampolloso12, la dermatitis atópica13,14, la lepra lepromatosa multibacilar15,16, e incluso una enfermedad neoplásica como el síndrome de Sézary17-20. A diferencia de esto, en la lepra tuberculoide15,16, en la psoriasis21 y en el herpes gestationis22 existe un predominio de la respuesta Th1.
Centrándonos en las neoplasias cutáneas, los estudios realizados en los linfomas cutáneos de células T (micosis fungoide [MF] y enfermedad de Sézary) han llevado a generar una atractiva hipótesis sobre el papel de la respuesta Th1/Th2 en su etiopatogenia. En un interesante trabajo, Saed et al estudiaron el perfil de las citocinas de los linfocitos T en la epidermis, dermis y sangre periférica de pacientes con linfomas cutáneos de células T17. Previamente, Vowels et al habían demostrado la existencia de un patrón de producción de citocinas Th2 en las células neoplásicas procedentes de sangre periférica de pacientes con síndrome de Sézary18,19. El propósito del trabajo de Saed et al era determinar si existía una diferencia en el patrón de citocinas y por tanto el tipo de linfocitos T asociados con la MF con respecto al del síndrome de Sézary. Después de extraer el ARN total por separado de la epidermis, dermis y leucocitos de sangre periférica, sintetizaron un ADN complementario y realizaron una amplificación con reacción en cadena de la polimerasa (PCR) usando cebadores para las citocinas asociadas con un patrón Th1 (IL-2, IFN-γ) y para las asociadas con un patrón Th2 (IL-4, IL-5 IL-10). Sus resultados mostraron que todas las muestras de MF contenían ARN mensajero de IL-2 e IFN-γ sólo en la epidermis, mientras que en la variante leucémica, el síndrome de Sézary, se encontró un patrón dominado por la IL-4, IL-5 e IL-10 tanto en la epidermis como en sangre periférica. Los pacientes con MF mostraban en sangre periférica un patrón superponible al encontrado en sangre periférica de sujetos normales, con una mezcla de citocinas de los dos patrones. Una hipótesis interesante para explicar este cambio en el patrón de citocinas hallado en la MF (Th1) con respecto al síndrome de Sézary (Th2) sería que todas las células neoplásicas son del tipo Th2, de tal forma que inicialmente el infiltrado inflamatorio reactivo (Th1) que intenta controlar a las células malignas es masivo, y así sucede que la MF puede permanecer indolente durante un largo período de tiempo hasta que finalmente esta respuesta de control de los Th1 es superada por el mayoritario fenotipo Th2 del clon maligno existente en sangre periférica y en la piel del síndrome de Sézary20.
En el presente estudio hemos trasladado nuestro interés a la respuesta inmune existente en el melanoma, comparando pacientes que se encontraban en diferentes estadios evolutivos. Esto nos pareció importante, en primer lugar por la relevancia conocida que la respuesta inmunológica tiene frente a este tumor, y en segundo porque puede aportar claves para abordar la terapia de estos pacientes. Nuestro propósito era averiguar si existía un patrón predominante Th1 o Th2 en los pacientes con melanoma en diferentes estadios y compararlos con sujetos controles sanos. A priori, una respuesta Th1, en donde se favorezca la inmunidad celular (linfocitos T), sería la más adecuada para la lucha antitumoral, mientras que la respuesta Th2 sería menos efectiva en pacientes con tumores diseminados. Con esta premisa nos planteamos las siguientes hipótesis: a) en los controles existiría un predominio de la respuesta Th1 frente a los pacientes con melanoma, considerados como un grupo; b) en los pacientes con melanoma localizado existiría una respuesta Th1, mientras que en los melanomas metastásicos existiría una respuesta Th2, y c) por último, nos planteamos una comparación en el patrón de citocinas de los pacientes con melanoma localizado y con más de 2 años de evolución, esto es, aquellos en los que la enfermedad parece estar más controlada, con el de pacientes con melanoma metastásico.
Para verificar o rechazar estas hipótesis estudiamos mediante citometría de flujo el patrón de citocinas producido por los linfocitos T circulantes en pacientes con melanoma en diferentes estadios.
En una segunda parte del trabajo nos propusimos estudiar esas diferencias en el patrón Th1/Th2 entre la piel sana de un sujeto control y las lesiones de melanoma tanto localizado como metastásico. Para ello utilizamos una técnica de transcriptasa inversa seguida de reacción en cadena de la polimerasa (RT-PCR) cuantitativa.
MATERIAL Y MÉTODOS
Pacientes
Hemos incluido en la primera parte de este trabajo a 19 pacientes y 6 controles. Los 19 pacientes tenían melanomas invasivos. De los 6 controles, 5 eran personal sanitario de nuestro hospital que acudieron a realizarse controles hematológicos como parte de un examen de salud rutinario, y en los que se obtuvo consentimiento antes de incluirlos en el presente estudio, y 1 era un paciente que acudió a revisión 2 años después de que se le hubiese extirpado un carcinoma basocelular y sin que hubiese presentado ninguna recidiva. En todos ellos se realizó una única determinación.
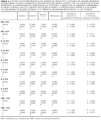
En la tabla 1 están recogidas las principales características clínicas e histológicas de los melanomas incluidos en la primera parte del estudio. La clasificación utilizada es la de la American Joint Commitee on Cancer (AJCC) de 1992. De forma resumida, de los 19 pacientes que componían el grupo de estudio, 6 pertenecían al estadio I de la AJCC (melanoma localizado con un Breslow inferior a 1,5 mm), 5 al estadio II (melanoma localizado con un Breslow superior o igual a 1,5 mm) y 8 tenían un melanoma metastásico diseminado (estadio IV).
Para la segunda parte del trabajo se obtuvieron biopsias de 3 milímetros de diámetro mediante un punch de una zona de piel sana de un sujeto control, de un nevus melanocítico intradérmico de larga evolución, de tres melanomas localizados y de tres pacientes con melanomas con metástasis cutáneas. Las muestras fueron congeladas inmediatamente sumergiéndolas en nitrógeno líquido. En el caso de los melanomas localizados, la toma de esta pequeña biopsia nunca afectó al diagnóstico histológico definitivo de la lesión, ya que se eligieron lesiones de gran tamaño y que llegaron a nuestro centro con biopsias parciales que confirmaban el diagnóstico de melanoma.
Métodos
Citometría de flujo
La sangre de controles y pacientes fue recogida en tubos que utilizaban como anticoagulante la heparina y procesada antes de 4 horas tras la extracción.
Para inducir la síntesis de citocinas se diluyó la sangre entera en medio RPMI 1640 (1:1 v/v) y se añadió un bloqueador del transporte de proteínas a la membrana (GolgiStop). Las células se estimularon con 25 ng/ml de forbol miristato acetato (PMA) y 1 µg/ml de ionomicina, codiciones experimentales que conducen a la activación de las células. Todas las muestras se incubaron en estufa durante 4 horas a 37º C con 5%-7% de CO2.
En el estudio se utilizaron tres controles de la activación celular:
1) El control de la activación basal se realizó diluyendo la sangre entera con RPMI-1640 sin añadir GolgiStop ni estímulo con PMA ni ionomicina.
2) El control de la expresión de marcadores de activación celular en la membrana plasmática se obtuvo diluyendo la sangre entera en RPMI sin GolgiStop y estimulando con PMA e ionomicina a las concentraciones antes mencionadas.
3) El control de la expresión intracelular de marcadores de activación se preparó de la misma manera que el estudio de producción de citocinas, es decir, diluyendo la sangre entera con RPMI y GolgiStop y estimulando las células con PMA e ionomicina.
Para la determinación de la síntesis de citocinas en tubos de 12 x 75 mm se alicuotaron 100 µl de muestra de sangre entera activada. Las células se marcaron en superficie con 20 µl de anticuerpo CD8-FITC y 20 µl de CD3-Cy5. Mediante el kit CytoFix-CytoPerm se fijaron y se permeabilizaron las células. En estas condiciones se realizó el marcaje intracelular con 15 µl del anticuerpo monoclonal específico para cada una de las siguientes citocinas: IL-2, IL-4, IL-10, TNF-alfa e IFN-gamma, así como el control de marcaje inespecífico, IgG1 o IgG2. Todos estos anticuerpos monoclonales para el marcaje intracelular estaban conjugados con ficoeritrina (PE).
Los tubos de control de la activación basal y de superficie se prepararon con 100 µl de la dilución de sangre entera correspondiente y 10 µl de anticuerpo CD69-Cy5, que detecta la expresión en superficie de un marcador de activación celular. Las muestras se lisaron y fijaron mediante el sistema TQ-Prep. El control de la expresión intracelular de marcadores de activación se realizó con una alícuota de 100 µl de la muestra de sangre correspondiente y 10 µl de CD69-Cy5. La permeabilización y fijación de las células se realizó con el kit CytoFix-CytoPerm.
Todas las muestras fueron analizadas inmediatamente con un citómetro de flujo EPICS XL-MCL. Los resultados fueron cuantificados con el programa de análisis SYSTEM II instalado en el ordenador del citómetro.
RT-PCR cuantitativa a tiempo real
Para cuantificar los transcritos (mARN) de las diferentes citocinas se utilizó la técnica de la RT-PCR cuantitativa a tiempo real. El método empleado para la obtención de los datos cuantitativos de la expresión génica relativa es el método de comparación de las Ct (método ΔΔCt) tal y como se describe en el boletín del usuario n.º 2 de la empresa Applied Biosystems. La fórmula utilizada para el cálculo de la expresión génica relativa es: nivel de inducción = 2 (ΔΔCt), donde ΔΔCt = (CtGI [muestra] Ct rRNA 18S [muestra]) (CtGI [calibrador] Ct rARN 18S [calibrador]), Ct es el ciclo umbral, a partir del cual se observa un aumento de fluorescencia con respecto a la fluorescencia basal del sistema (los valores de Ct son inversamente proporcionales a los niveles de mARN diana presentes en la muestra a estudiar), GI es el gen de interés (cada uno de los genes de las citocinas en este trabajo), rARN 18S es el ARN de la subunidad 18 S ribosomal que se utiliza como control endógeno, el calibrador es una muestra de piel sana, y las muestras cuya expresión queremos determinar corresponden a un nevus, tres melanomas localizados y tres melanomas metastásicos.
En estos experimentos, el ARN total se extrajo de cada una de las muestras con el reactivo TRIzol (GIBCO-Life Technologies) siguiendo las instrucciones recomendadas por el fabricante. La transcripción inversa para generar el cADN se realizó por el sistema TaqMan Reverse Transcription Reagents (Applied Biosystems, P/N N808-0234) siguiendo las recomendaciones del fabricante. La reacción de RT contenía, en un volu-men final de 100 µl, 1X tampón RT, 5,5 mm MgCl2, 500 µm de cada desoxinucleótido trifosfato, 2,5 µm de random hexamers, 0,4 U/µl de inhibidor de RNasas, 1,25 U/µl de transcriptasa inversa MultiScribe y 2 µg de ARN total. Las muestras se incubaron a 95° C durante 10 minutos y 48° C durante 30 minutos, seguido de 95° C durante 5 minutos para inactivar la transcriptasa. Las reacciones de PCR se analizaron con la TaqMan Cytokine Gene Expresion Plate I (Applied Biosystems P/N 4304671). La placa tiene 96 pocillos ordenados en 12 columnas, una para cada citocina. En los pocillos de cada columna se encuentran los primers y la sonda TaqMan para cada una de las citocinas y el rARN 18S utilizado como control endógeno. La amplificación simultánea de un control endógeno con el gen diana se utiliza para normalizar la cantidad de ARN añadido a cada reacción. Cada PCR se realizó en un volumen de 50 µl conteniendo 5 µl de la reacción de transcripció n inversa y 1X TaqMan Universal PCR Master Mix (Applied Biosystems P/N 4304437). Las condiciones de PCR comprendían un paso inicial de 95° C durante 10 minutos seguido de 40 ciclos a 95° C durante 15 segundos y 60° C 1 minuto. La cuantificación se realizó con el ABI Prism 7700 Sequence Detection System (Applied Biosystems).
Metodología estadística
Los datos experimentales de la primera parte del estudio se procesaron con los programas estadísticos GW-BASIC y SPSS-PC de acuerdo a:
1) Metodología estadística descriptiva: estadísticas básicas, reduciendo los datos a sus parámetros de centraje, dispersión y tamaño (x = media aritmética, s = desviación típica; n = número de casos) para todos los datos cuantitativos.
2) Metodología estadística analítica: cruce de variables cuantitativas utilizando las siguientes pruebas para el análisis de la varianza; F de Fisher y «t» de Student para diferencias de medias.
RESULTADOS
Analizaremos los resultados del estudio de cito-metría de flujo en sangre periférica, atendiendo en primer lugar al porcentaje de células productoras de cada citocina. Desglosaremos los datos, analizando cada citocina y para cada una de ellas comentaremos los resultados obtenidos al comparar:
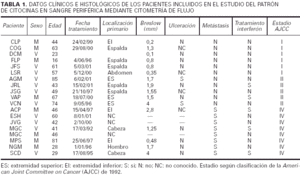
1) Grupo de estudio y grupo control (tabla 2).
2) Los tres subgrupos de estudio (estadio I, II y IV de melanoma) y grupo control (tabla 3).
3) Melanoma localizado (estadios I y II) frente a melanoma mestastásico (tabla 3).
4) Pacientes a los que se les había extirpado un melanoma cutáneo y se encontraban libres de enfermedad durante un período de más de 2 años, con pacientes con melanoma metastásico.
En segundo lugar hemos analizado la intensidad de expresión de cada citocina por parte de aquellos linfocitos que las producen (unidades arbitrarias de fluorescencia). Para ello hemos cuantificado la intesidad de fluorescencia de los anticuerpos unidos específicamente a las células productoras de citocinas (tabla 4).
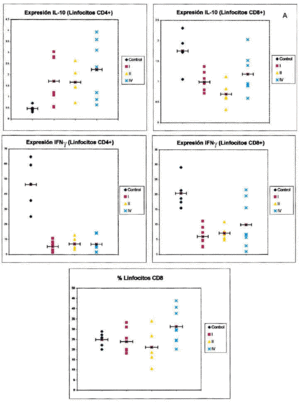
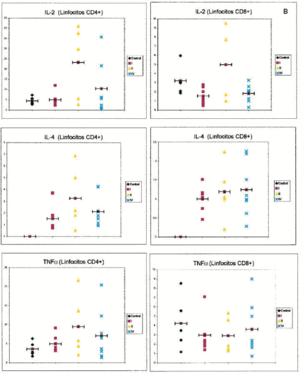
En la figura 1 puede observarse un ejemplo de la estrategia citométrica seguida para determinar la producción de citocinas por los linfocitos T. Se muestran los histogramas utilizados para seleccionar la población de linfocitos, por sus características morfológicas, y las subpoblaciones de linfocitos CD4 y CD8, por marcaje con anticuerpos CD3 y CD8. Por último se muestran los histogramas utilizados para la cuantificación de niveles intracelulares de citocinas. La figura 2 recoge los porcentajes de expresión de citocinas agrupando a los pacientes según su estadio clínico.
Fig. 1.--Ejemplos ilustrativos de la estrategia citométrica seguida para la determinación de citocinas intracelulares en linfocitos sangre entera. A: histograma biparamétrico de tamaño (FS) frente a complejidad (SS) donde se acota la población de linfocitos. B: control de activación celular; superposición de histogramas de distribución en linfocitos de la expresión del marcador de activación CD69, mostrando la expresión positiva (trazo rojo) de las células activadas con PMA + ionomicina en las mismas condiciones experimentales de inducción de síntesis de citocinas frente a una población control, no estimulada (trazo verde). C: histograma de complejidad (SS) frente a la fluorescencia roja del anticuerpo CD3-Cy5, identificando la población de linfocitos T (CD3+) seleccionada para el análisis citométrico. D: histograma biparamétrico de fluorescencia roja de CD3-Cy5 frente a fluorescencia verde de CD8-FITC que identifica las subpoblaciones CD4 y CD8 de los linfocitos T, acotados como en la gráfica C, los linfocitos CD4 corresponden a la población CD3+CD8 (cuadrante superior izquierdo). E: histograma biparamétrico de fluorescencia verde del anticuerpo CD8-FITC frente a la fluorescencia naranja del anticuerpo irrelevante IgG2b, mostrando el ajuste de los cursores para determinar la población negativa (cuadrantes izquierdos) en el análisis de la síntesis de citocinas en linfocitos T, acotados como se muestra en la gráfica C. F y G: histogramas biparamétricos de fluorescencia verde de CD8-FITC frente a la fluorescencia naranja del anticuerpo, marcado con PE, específico frente a interferón gamma (IFNγ-PE), mostrando simultáneamente la expresión de dicha citocina en linfocitos T CD4+ y CD8+. Este tipo de histograma se utiliza para cuantificar, a partir de los cuadrantes derechos, el porcentaje de células que sintetizan cada una de las citocinas estudiadas y la intensidad relativa de expresión de las mismas. F: muestra un ejemplo de un paciente en estadio I. G: muestra un ejemplo de un paciente en estadio IV.
Fig. 2.-- Expresión de citocinas intracelulares en linfocitos T CD4+ y CD8+ de sangre entera de controles sanos y pacientes con melanoma, en función del estadio clínico de la enfermedad. Los gráficos muestran el porcentaje de células positivas para cada una de las citocinas en cada sujeto analizado (eje de ordenadas) dependiendo del estadio clínico de la enfermedad (control, estadios I, II y IV, eje de abscisas). Cada punto representa un sujeto de estudio. La barra horizontal indica la media de los valores obtenidos.
Detallaremos los resultados obtenidos para cada citocina:
Respecto al IFN-γ existe una diferencia estadísticamente sigificativa entre el porcentaje de células, tanto CD4 como CD8, que producen IFN-γ entre los controles y los pacientes con melanoma, siendo siempre mayor el número de células productoras de esta citocina en los primeros. Cuando desglosamos el grupo de estudio en tres subgrupos, según la clasificación de la AJCC y realizamos un análisis de la varianza con la prueba de Fisher considerando estos tres grupos y el grupo control, observamos que existen diferencias estadísticamente significativas entre todos ellos. Sin embargo, no existen diferencias entre el porcentaje de células productoras de IFN-γ al comparar pacientes con melanoma localizado (estadio I + estadio II) con pacientes con melanoma metastásico (estadio IV). Tampoco hallamos ninguna diferencia cuando comparamos los pacientes con melanoma localizado de más de 2 años de evolución con los pacientes con melanoma metastásico.
Al considerar la intesidad de expresión del IFN-γ por los linfocitos CD4 y CD8 observamos que existen diferencias estadísticamente significativas en el análisis de la variaza con la F de Fisher entre los tres grupos de estudio (estadio I, II y IV) en lo referente a los linfocitos CD4, mientras que en los linfocitos CD8 las diferencias se encuentran muy cerca de la significación. No existe, sin embargo, ninguna diferencia al considerar a los estadios localizados del melanoma (I + II) y al metastásico diseminado, y tampoco los localizados con un intervalo de superviviencia superior a los 2 años frente a los metastásicos.
Respecto a la IL-10 existe una diferencia estadísticamente significativa entre el porcentaje de células CD4 que producen IL-10 al comparar los controles con los pacientes con melanoma, de forma que en los pacientes con melanoma es mayor el número de lifocitos que producen esta citocina. Sin embargo, ocurre lo contrario cuando consideramos el número de células CD8 productoras de IL-10, ya que aquí también existe una diferencia con significación estadística, pero los valores mayores los encontramos en los controles. Al igual que mencionamos para el IFN-γ, existe una diferencia significativa al comparar tanto el porcentaje de células CD4 como el de CD8 que producen IL-10 en los estadios I, II, IV y en el grupo control. Sin embargo, cuando comparamos los pacientes con melanoma localizado (estadios I y II) con los pacientes con melanoma metastásico, las diferencias no alcanzan significación estadística. Sin embargo, es interesante observar que parece existir un espectro en el porcentaje de células CD4 que producen IL-10, en el que los controles son los que tienen menos células productoras de IL-10, los pacientes con melanoma metastásico tienen el porcentaje mayor, y los pacientes con melanoma localizado se encuentran en un punto intermedio. Respecto al número de linfocitos CD8 productores de IL-10, se observan resultados discordantes, ya que el mayor número de células productoras se encuentra en los controles y el menor en los localizados. No hemos encontrado diferencias al comparar los pacientes con melanoma localizado de más de 2 años de evolución con los pacientes con melanoma metastásico.
Cuando consideramos la intesidad de expresión de esta citocina por parte de las células CD4 y CD8, no existen diferencias significativas entre los tres grupos de estudio. Tampoco hay diferencias al agrupar los estadios I y II y compararlos con el grupo metastásico, ni entre los localizados que llevan más años libres de enfermedad y los metastásicos.
Respecto a la IL-2 como se aprecia en la tabla 2, no existe una diferencia significativa al comparar el grupo control con el grupo de los melanomas. Sin embargo, al desglosar el grupo de estudio y agrupar a los pacientes según los diferentes estadios de la AJCC, nos encontramos que al realizar un análisis de la varianza con la F de Fisher, las diferencias son significativas. Observamos en la tabla 3 un aumento progresivo en la proporción de células CD4 productoras de IL-2 al comparar al grupo control con el estadio I y al estadio I con el estadio II. Sin embargo, en los pacientes con metástasis el porcentaje desciende y se sitúa entre el estadio I y II. No existe significación estadística cuando restringimos la comparación a los pacientes con melanoma localizado (estadio I + estadio II) y los que tienen melanoma mestastásico. Tampoco encontramos diferencias a considerar al introducir el factor tiempo, es decir, comparando a los pacientes con melanoma localizado con un período libre de enfermedad superior a 2 años con los pacientes con metástasis de melanoma.
Al valorar la intesidad de expresión de la IL-2 no existen diferencias significativas en lo referente a los linfocitos CD4. Sin embargo, la intensidad de expresión por parte de los linfocitos CD8 está en los límites de la significación (p = 0,054). No existes melanomas localizados con el período libre de enfermedad mayor de 2 años con los metastásicos.
Respecto a la IL-4, no hemos encontrado diferencias estadísticamente significativas, ni siquiera una tendencia reseñable, al analizar los resultados obtenidos para esta citocina y realizar las comparaciones entre los grupos establecidos.
En cuanto a la intensidad de expresión de la IL-4, no existen diferencias en ninguna de las comparaciones realizadas.
Respecto al TNF-α tampoco se observan diferencias entre los grupos estudiados. En lo referente a la intensidad de expresión del TNF-alfa, no existen diferencias en ninguna de las comparaciones establecidas.
Respecto a los linfocitos CD8, no existen diferencias significativas entre el grupo control y el grupo de los melanomas considerados en conjunto. No existe una significación estadística al realizar un análisis de la varianza y comparar a los tres grupos de estudio y el grupo control. Sin embargo, sí existe un número mayor de células CD8 en los pacientes de melanoma metastásico en relación con los melanomas localizados, es decir, cuando se agrupan los estadios I y II, y esta diferencia es estadísticamente significativa. No observamos diferencias entre los melanomas localizados con período libre de enfermedad superior a 2 años y los metastásicos.
Expresión de citocinas en el tumor
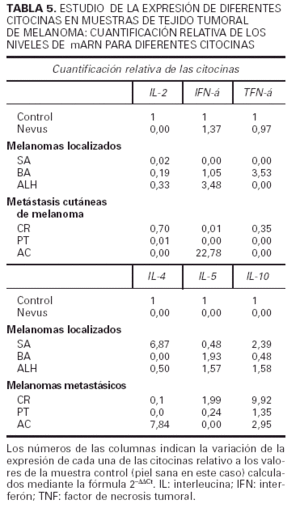
Respecto a la segunda parte de nuestro trabajo hemos estudiado en la propia lesión de melanoma la presencia de ARN mensajero de distintas citocinas y la hemos cuantificado frente a un control de piel normal. Los resultados se resumen en la tabla 5. Podemos observar que el nevus expresa niveles similares a los de la piel normal de IFN-γ y TNF-α, y el resto de transcritos se encuentran en niveles indetectables. Los pacientes SA y CR muestran un patrón Th2, mientras que ALH y AC muestran un patrón Th0. No se observa ninguna correlación entre el patrón Th2 o Th0 y el hecho de que el melanoma sea primario o metastásico. El paciente PT presenta una discreta elevación de la IL-10 (1,35) y el paciente BA presenta un aumento en el TNF-α (3,53) y en la IL-5 (1,93), por lo que es difícil adscribirlo a ningún patrón específico.
DI SCUSIÓN
Desde la descripción en 1986 por Mosmann et al de la existencia en ratones de dos subgrupos de linfocitos T helper, Th1 y Th2, según su patrón de producción de citocinas, se han producido multitud de avances en este tema, muchos de los cuales han servido no sólo para explicarnos mejor la patogenia de diversas enfermedades, sino para abrir camino a nuevos tratamientos. Como ya hemos mencionado, los linfocitos Th1 producen IL-2 e interferón-gamma IFN-γ, mientras que los linfocitos Th2 producen IL-4, IL-5, IL-6, IL-9, IL-10 e IL-13. En seres humanos se ha comprobado que existen unos patrones Th1 y Th2 similares, aunque la producción de IL-2, IL-6, IL-10 e IL-13 no está completamente restringida a un solo subgrupo de células T como ocurre en los ratones8. Los linfocitos T CD8 también producen citocinas, y aunque se caracterizan por la expresión de un patrón de tipo Th18, existen evidencias claras de la existencia de células T CD8+ con un patrón de tipo Th2, tanto en ratones como en humanos23,24.
En la actualidad conocemos que existe una mayor complejidad entre estos patrones extremos que se identificaron inicialmente. Se han identificado células T que producen las citocinas correspondientes a ambos patrones (Th0) y a las que se considera precursoras indiferenciadas de las Th1 o Th225. Un ejemplo del patrón Th0 se ha encontrado en los pacientes infectados por el virus de la inmunodeficiencia humana (VIH), en los que se ha detectado la expresión de grandes cantidades tanto de IFN-γ como de IL-10, sin que estos niveles se vean alterados en el curso de la infección. Además, las células que expresan estas citocinas son mayoritariamente CD8+26. La expresión de IL-2 e IL-4 era prácticamente indetectable independientemente del estado de la infección por el VIH. Por otra parte, existen células T helper con propiedades reguladoras (Th3) que producen cantidades elevadas del factor de crecimiento transformante β (TGF-β) e IL-10 y pueden suprimir las respuestas antígeno-específicas in vivo e in vitro27,28. Además se han observado grandes diferencias cuantitativas en la producción de citocinas entre distintos clones pertenecientes al patrón Th1 y entre los pertenecientes al Th28. Las interpretaciones de esta complejidad oscilan entre aquellas que consideran que existe un modelo con dos (Th1/Th2) o más (Th0/Th3) fenotipos, con diferencias cuantitativas según el momento de desarrollo de los linfocitos, hasta aquellas que proponen un modelo sin subgrupos definidos, en el que existiría un continuo con diferentes combinaciones en la secreción de citocinas29.
La explicación de los resultados del presente trabajo es compleja y puede estar sujeta a distintas interpretaciones. La más sencilla de ellas nos llevaría a considerar que en los sujetos controles existe un predominio de la respuesta Th1, caracterizada aquí por un porcentaje elevado de linfocitos T que producen IFN-γ y una menor abundancia de los linfocitos CD4 que producen IL-10, en contraposición a lo que ocurre en los pacientes con melanoma, que presentan un número inferior de linfocitos T productores de IFN-γ y un porcentaje mayor de células CD4 productoras de IL-10.
Los porcentajes de lifocitos productores de IFN-γ son similares en los pacientes con melanoma en diferentes estadios. Sin embargo, aunque no existen diferencias estadísticamente significativas, se observa un gradiente de células CD4 productoras de IL-10 en la sangre de los pacientes con melanoma con arreglo al estadio en que se encuentran, de manera que los pacientes con un melanoma más avanzado tienen un mayor número de células que producen esta citocina.
La IL-10 está implicada en diferentes procesos del sistema inmunitario para conseguir un efecto antiinflamatorio e inmunosupresor30. La IL-10 posee una acción inhibidora sobre las células presentadoras de antígenos y sobre la respuesta inmune mediada por células T. En modelos murinos se ha demostrado que la IL-10 inhibe la presentación de los antígenos tumorales por las células presentadoras de antígenos de la epidermis31. Se ha demostrado, incluso, que cuando se tratan las células de Langerhans con IL-10 se induce un estado de tolerancia antigénica específica en los linfocitos TH1, mientras que esto no ocurre con los clones de linfocitos TH232. Sin embargo, a diferencia de lo que ocurre en los modelos murinos en los que la IL-10 es producida sólo por los linfocitos TH2 y suprime la respuesta TH1, en los s eres humanos la IL-10 es producida por las células TH1 y TH2 y suprime la función de ambos tipos celulares33. Este efecto parece estar mediado, como acabamos de mencionar, a través de la inhibición de las células presentadoras de antígenos33,34.
Se ha demostrado que la IL-10 inhibe la producción de múltiples citocinas, entre las que se encuentran la IL-2, IFN-gamma, TNF-alfa y la propia IL-1035-37. En contraste, la IL-10 posee propiedades estimuladoras sobre las células CD8 y actúa atrayéndolas, activándolas y favoreciendo su proliferación38-41. Lo que resulta muy interesante es que la activación de las células T en presencia de IL-10 puede inducir un estado de no respuesta o anergia que no puede ser revertido en presencia de IL-2 o estimulación con anti-CD3 o anti-CD2842. El papel de la IL-10 en la inducción y mantenimiento de la anergia vino sugerido por estudios en diferentes campos, entre ellos la respuesta inmune antitumoral43. La anergia mediada por la IL-10 puede estar asociada con la inducción de una población de células T reguladoras que producen niveles elevados de IL-10 y pueden suprimir las respuestas antígeno-específicas in vivo e in vitro27,28,44,45.
Refiriéndonos en concreto a la asociación entre la IL-10 y el cáncer, varios trabajos han apuntado la relación existente entre niveles elevados de expresión de IL-10 con varios tumores, entre ellos el melanoma46-49. Los mecanismos por los que esto puede ocurrir son básicamente dos, bien porque la IL-10 actúe como un factor de crecimiento para las células tumorales50 o porque la IL-10 producida por, o en la vecindad del tumor, puede dificultar la inducción o la función efectora de la respuesta inmune antitumoral51,52.
Todo lo expuesto hasta aquí explicaría gran parte de nuestros resultados, ya que hemos encontrado que existe una diferencia estadísticamente significativa en la población de células CD4 productoras de IL-10 al comparar a los pacientes con melanoma (en los que es mayor) con el grupo control. Esto explicaría la disminución existente no sólo en el porcentaje de linfocitos CD4 y CD8 productores de IFN-γ, sino también el menor número de linfocitos CD8 productores de IL-10, ya que como hemos mencionado la IL-10 es capaz en los seres humanos de inhibir tanto las respuestas Th1 como las respuestas Th233.
Centrándonos en el análisis del grupo de estudio, observamos que los pacientes con melanoma metastásico poseen una población de células CD4 productoras de IL-10 sustancialmente más elevada (aunque no se alcancen diferencias con significación estadística) que los pacientes con melanoma localizado. De esta forma existe un gradiente en el porcentaje de células CD4+ productoras de IL-10, con niveles menores en los sujetos controles, intermedios en los pacientes con melanoma localizado y los mayores en los pacientes con metástasis. Esto explicaría el único dato estadísticamente significativo que hemos obtenido al comparar el grupo de pacientes con melanoma localizado y los metastásicos, que es el aumento en el número de linfocitos CD8 en estos últimos, y a la vez ayudaría a comprender este dato que, en principio, puede parecer contradictorio, esto es, que aumenten los linfocitos CD8 y, sin embargo, los pacientes evolucionen hacia un estado de peor respuesta frente a su tumor. Como hemos comentado, la activación y proliferación de los linfocitos T en presencia de IL-10 puede conducir a un estado de anergia frente al tumor. La mayor población de células CD4 productoras de IL-10 en los pacientes con melanoma metastásico respecto al estadio II también ayuda a entender la menor cantidad de linfocitos CD4 y CD8 productores de IL-2 en el melanoma metastásico, indicando que se produce una inhibición en la producción de IL-2.
A la luz de los resultados encontrados nos parece importante señalar una serie de vías para proseguir estas investigaciones. En primer lugar, es evidente que existen importantes diferencias personales en la respuesta inmune que complican especialmente la interpretación de los datos, y estas diferencias pueden apreciarse observando la producción de citocinas en los controles. Esto hay que atribuirlo a que cualquier individuo se encuentra sujeto a múltiples situaciones (infecciones intercurrentes, enfermedades autoinmunes propias de cada sujeto, etc.) que pueden modificar su respuesta inmunitaria, con independencia de que padezcan o hayan tenido alguna vez un tumor. La inclusión de un número mayor de pacientes y controles sería la mejor solución para este problema.
En segundo lugar sería interesante realizar estudios longitudinales, determinando el patrón de citocinas producido por un mismo paciente en diferentes momentos. Esto permitiría analizar mejor los cambios en patrones Th1/Th2 durante el curso de la enfermedad.
Por último, es importante estudiar si existe alguna modificación en el patrón de citocinas producido por un paciente cuando se encuentra en tratamiento con inmunoterapia, quimioterapia o con un régimen combinado.
Los resultados realizados en la piel tumoral mediante la ténica de RT-PCR cuantitativa apoyan los datos obtenidos con la citometría de flujo. Nos parece especialmente reseñable la diferencia que hemos hallado en la expresión de los transcritos de citocinas entre el nevus y los melanomas. Es además muy interesante el hallazgo de dos pacientes que mostraron un patrón Th0, pero todos los casos presentaron alguna de las citocinas características del patrón Th2 (IL-4, IL-5 o IL-10). Además cinco de los seis melanomas tenían niveles de IL-10 superiores a los del control, reafirmando los datos encontrados en linfocitos T activados en sangre circulante. Nuestros planes son proseguir esta línea de investigación, profundizando en el estudio de la expresión de citocinas en el propio tejido tumoral, correlacionándolo con parámetros histológicos e inmunohistoquímicos que nos ayuden a comprender mejor la respuesta inmune frente a este tumor in situ.
CONCLUSIONES
1) En sangre circulante existe un aumento en la producción de IL-10, citocina, con notable efecto inmunosupresor, en los pacientes con melanoma frente a los controles.
2) Observamos una tendencia en el porcentaje de células CD4 que producen IL-10, de manera que los controles son los que tienen menos células productoras de IL-10, los pacientes con melanoma metastásico tienen el porcentaje mayor y los pacientes con melanoma localizado se encuentran en un punto intermedio.
3) Esto explicaría el único dato estadísticamente significativo que hemos obtenido al comparar el grupo de pacientes con melanoma localizado y los metastásicos, que es el aumento en el número de lifocitos CD8 en estos últimos. Sin embargo, a pesar del aumento de los linfocitos CD8, los pacientes evolucionan hacia un estado de peor respuesta frente a su tumor, puesto que hemos comentado que la activación y proliferación de los linfocitos T en presencia de IL-10 puede conducir a un estado de anergia frente al tumor.
4) En tejido tumoral se encuentra un patrón de expresión de citocinas Th2 o Th0 sin que exista correlación con el hecho de que el melanoma sea primario o metastásico.