Sr. Director:
Aportamos un caso típico de reacción acneiforme de evolución súbita en una paciente que inició tratamiento con cetuximab debido a una enfermedad sistémica derivada de un adenocarcinoma de colon. Nuestra contribución, aparte de recordar este efecto secundario frecuente, consiste en el uso de metronidazol con éxito como primera alternativa. Cetuximab (C225) es un anticuerpo monoclonal dirigido contra el receptor del factor de crecimiento epidérmico (EGFR), que actualmente se utiliza en el tratamiento de tumores malignos sólidos en estadios avanzados. Existe una toxicidad cutánea característica del fármaco, siendo el efecto secundario más frecuente el desarrollo de una erupción acneiforme folicular más pronunciada en regiones seborreicas (cara, pecho y zona superior de la espalda) y que se manifiesta generalmente entre la primera y la cuarta semanas después de iniciar el tratamiento.
Se trata de una mujer de 51 años que fue derivada por el Servicio de Digestivo a la consulta dermatológica con carácter urgente por presentar una erupción acneiforme de rápida instauración tras el inicio de un tratamiento inmunosupresor. Entre sus antecedentes personales destacaba una intervención por carcinoma de colon hacía 3 años, con posterior afectación sistémica pulmonar y sospecha de hipertensión intracraneal por la aparición de cefalea continua (en estudio). La paciente notó la aparición brusca de múltiples lesiones que le recordaban al acné juvenil tras el inicio del tratamiento quimioterápico citotóxico con C225 e iridotecan (CPT-11). Las lesiones se iniciaron a las 2 semanas de la primera sesión, primero en la región central de la cara con posterior extensión a las mejillas y cuero cabelludo.
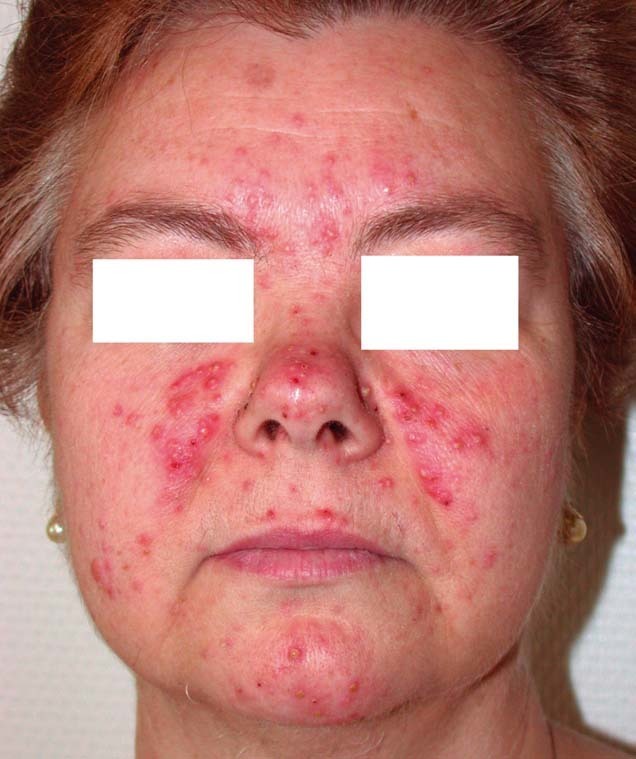
En la exploración clínica se apreciaban numerosas lesiones acneiformes en forma de pápulas y pústulas sobre un eritema intenso de la cara, con menor afectación del cuero cabelludo (fig. 1).
Figura 1. Lesiones acneiformes en forma de pápulas y pústulas sobre un eritema intenso de la cara.
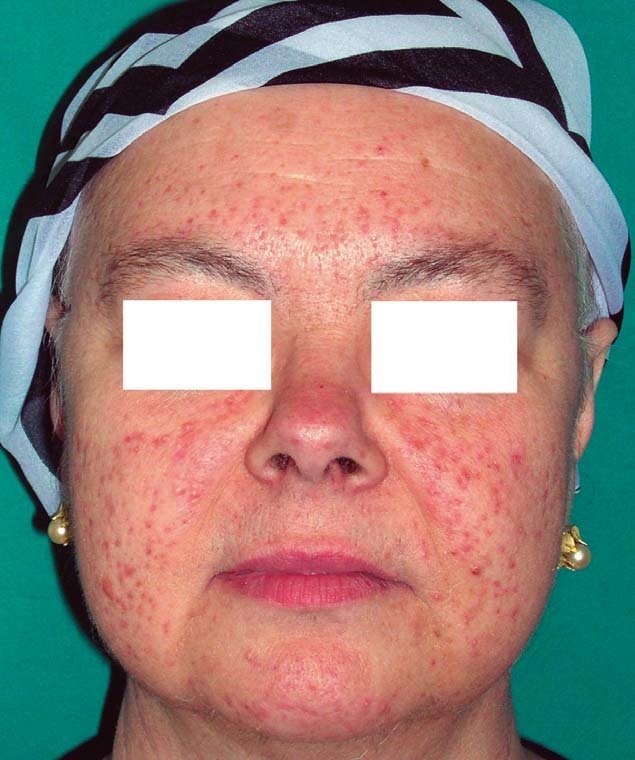
Dada la sospecha clínica inicial y la evolución natural de la enfermedad, se realizaron cultivos para bacterias y hongos (que resultaron negativos), y se instauró tratamiento con metronidazol a 1 g diario durante 1 mes, con una respuesta favorable que llevó a la desaparición de la mayoría de las lesiones (fig. 2). Inicialmente se descartó el tratamiento con tetraciclina o doxiciclina dado el estudio de afectación intracraneal al que la paciente estaba siendo sometida para así evitar la posibilidad de hipertensión intracraneal secundaria.
Figura 2. Resolución de las lesiones tras un mes de tratamiento. Cicatrices posinflamatorias.
Como comentamos anteriormente en forma de breve introducción, C225 es un anticuerpo monoclonal dirigido contra el EGFR, que inhibe el crecimiento celular de varios tumores. Actualmente se utiliza en el tratamiento de tumores malignos sólidos en estadios avanzados1. Respecto a la toxicidad cutánea del fármaco, existen series de pocos casos que muestran que el efecto secundario más frecuente (hasta en un 80 % de los casos) es el desarrollo de una erupción acneiforme folicular2-4, más pronunciada en la cara, pecho y zona superior de la espalda3, 5 y que se manifiesta típicamente entre la primera y la cuarta semana tras el inicio del tratamiento6-8. Generalmente el prurito es leve o está ausente, al igual que la formación de comedones, que es nula3,9. Otros efectos secundarios descritos que se asocian frecuentemente con los inhibidores del EGFR son el desarrollo de eccema xerodérmico10, paroniquia11 y aftas en la mucosa oral6,11. Respecto al origen de los efectos secundarios cutáneos, en concreto sobre el folículo, parece estar cada vez más aclarado el mecanismo de acción. Tomando como base algunos estudios inmunohistoquímicos y de técnicas de hibridación in situ se demuestra un incremento de la expresión de la proteína p27Kip1 (inhibidora de la cinasa-2 ciclino-dependiente, reguladora del ciclo celular de la fase G1 a la S, y de la migración celular) en los queratinocitos epidérmicos tras el tratamiento con C225. Este hecho está relacionado con una alteración de la regulación in vivo de la homeostasis folicular y epidérmica mediada por el EGFR, que provoca la aparición de la erupción acneiforme5,12,13.
Los cultivos no muestran un agente infeccioso causante, siendo este un criterio que apoya en el diagnóstico3,4,5,8,9. El estudio histopatológico de las lesiones muestra un patrón de reacción folicular que consiste en un intenso infiltrado inflamatorio neutrofílico que rodea los infundíbulos5,12, los cuales se muestran en ocasiones hiperqueratósicos6. El diagnóstico diferencial debe establecerse con erupciones foliculares de inicio brusco, ya sean entidades establecidas o reacciones farmacológicas; entre estas últimas las más frecuentes son las producidas por vitamina B12, corticosteroides, andrógenos, litio, tuberculostáticos, halógenos, algunos antidepresivos tricíclicos, anticonvulsivantes e inmunosupresores. La erupción responde habitualmente a tetraciclinas como la minociclina a la dosis 100 mg diarios, o la doxiciclina también a la dosis de 100 mg diarios, aunque actualmente no existe un consenso sobre la duración del tratamiento3,9,10,14. Las recurrencias son relativamente frecuentes, aunque menos intensas que el episodio inicial. Dado el incremento de los tratamientos biológicos en diversas especialidades, esta es una entidad que veremos aparecer cada vez más en la consulta dermatológica diaria y por ello, el dermatólogo debe sospecharla desde el inicio de la anamnesis, evitando en muchos de los casos la realización de pruebas agresivas como la biopsia. Respecto al tratamiento, las tetraciclinas son en la actualidad el de elección y existen pocas referencias sobre el éxito terapéutico con alternativas como metronidazol, empleado en nuestro caso, y otros antibióticos de acción sistémica.