La hidradenitis supurativa (HS) es una enfermedad inflamatoria crónica de la piel que puede requerir el uso de fármacos biológicos como los anti-TNFα y los anti-interleucina 17 (anti-IL17). El objetivo de nuestra revisión es evaluar la eficacia y la seguridad de los fármacos anti-IL17 en los pacientes con HS.
Material y métodosSe realizó una revisión sistemática con posterior, metaanálisis siguiendo el método de población, intervención, comparación, resultado y tipo de estudio (PICOS). Se incluyeron únicamente ensayos clínicos aleatorizados con placebo (S) que incluyeran individuos con HS≥18 años de edad (P), que hubieran recibido placebo (C) o un fármaco biológico anti-IL17 (I) para medir los resultados de eficacia y seguridad (O). La búsqueda se realizó en: PubMed®, Scopus® y el Registro Cochrane Central de Ensayos Controlados (Cochrane Central Register of Controlled Trials). Se determinó el riesgo de sesgo de cada estudio, el sesgo de publicación, el análisis de sensibilidad y la certeza de la evidencia.
ResultadosSe obtuvo un total de 320 referencias bibliográficas, 4 cumplieron los criterios de inclusión. El metaanálisis mostró de forma significativa un mayor, porcentaje de pacientes que alcanzaban el Hidradenitis Suppurativa Clinical Response (HiSCR) OR: 1,96 [1,79-2,15], una mayor, disminución del DLQI, Diferencia media de −1,92 [−2,68, −1,16] y un aumento de los efectos adversos (OR: 1,21 [1,09-1,34]), especialmente por, infecciones por Candida, OR: 5,61 [2,66-11,83].
ConclusionesEl tratamiento con fármacos biológicos anti-IL17 es eficaz en el manejo de los pacientes con HS moderada-grave. Aunque estos fármacos son seguros, deben ser monitorizados debido al riesgo de infecciones, principalmente candidiasis.
Hidradenitis suppurativa (HS) is a chronic inflammatory skin disease that is difficult to manage, requiring the use of biologic drugs such as anti-TNFα and anti-interleukin 17 (anti-IL17). The aim of our review is to evaluate the safety and efficacy profile of anti-IL17 drugs in patients with HS.
Materials and methodsWe conducted a systematic review with subsequent meta-analysis following the population, intervention, comparison, outcome and type of study (PICOS) method. We included only randomized clinical trials with placebo (S) that included individuals with HS≥18 years old (P), and who had been on placebo (C) OR, an anti-IL17 biologic drug (I) to measure safety and efficacy outcomes (O). Search was conducted across multiple databases: PubMed, Scopus, and the Cochrane Central Register of Controlled Trials. The risk of bias of each study, publication bias, sensitivity analysis, and certainty of evidence were determined.
ResultsA total of 320 bibliographic references were obtained, 4 of which met the inclusion criteria. Compared to placebo, the meta-analysis showed a significantly higher percentage of patients achieving Hidradenitis Suppurativa Clinical Response (HiSCR) OR, of 1.96 [1.79-2.15], a greater decrease in DLQI, MD −1.92 [−2.68, −1.16] and an increase in adverse effects; OR: 1.21 [1.09-1.34], particularly due to Candida infections; OR, 5.61 [2.66-11.83].
ConclusionsTreatment with anti-IL17 biologic drugs is effective in patients with moderate-to-severe HS. Although these drugs are safe, they should be monitored due to the risk of infections, mainly candidiasis.
La hidradenitis supurativa (HS) es una enfermedad inflamatoria crónica de la unidad pilosebáceo-apocrina. Se presenta en brotes de nódulos eritematosos, abscesos y túneles principalmente en las zonas axilar, submamaria, inguinal y anogenital. Esta enfermedad se acompaña de dolor y una afectación muy intensa de la calidad de vida1,2.
Aunque la prevalencia exacta aún se desconoce, se estima que ronda el 0,4% en todo el mundo2, con una tasa de incidencia anual de 6 casos por cada 100.000 habitantes3, se considera una entidad infradiagnosticada4.
Entre las herramientas terapéuticas5 se encuentran las terapias tópicas e intralesionales6, los tratamientos antibióticos sistémicos, los procedimientos quirúrgicos y, más recientemente, se han incluido los tratamientos biológicos, siendo el adalimumab el primer fármaco biológico con indicación para el tratamiento de la HS, habiendo demostrado ser superior, al placebo en la HS moderada/grave5,7.
Aunque la fisiopatología de la HS no está totalmente dilucidada, se supone que existe una interacción entre la inmunidad innata, a través de la vía del inflamasoma, y la inmunidad adaptativa a través de las vías Th1 y Th17, con un aumento de la interleucina-17 (IL17) y del TNF-α. Curiosamente, se han encontrado niveles más altos de IL17 en el suero de los pacientes con HS más grave8.
Una revisión sistemática previa, realizada en el 2022, sobre los tratamientos anti-interleucina 17 (anti-IL17) en el tratamiento de la HS respaldó su perfil de eficacia y su uso como alternativa terapéutica en los pacientes refractarios a otros tratamientos9.
Secukinumab y bimekizumab son 2 fármacos biológicos anti-IL17 comercializados que actualmente cuentan con ensayos clínicos aleatorizados (ECA) en la HS que demuestran su perfil de eficacia10–12. Sin embargo, hacen falta metaanálisis que incluyan los ensayos clínicos más recientes, en particular los de bimekizumab12.
Por lo tanto, debido al impacto que esta enfermedad tiene en la calidad de vida de los pacientes y a la necesidad de herramientas terapéuticas eficaces, se justifica esta revisión sistemática y metaanálisis para medir el perfil de seguridad y eficacia del tratamiento con anti-IL17 en la HS.
MétodosCriterios de elegibilidadEste metaanálisis se registró en PROSPERO (CRD42024538548). Este estudio se adhirió a las directrices PRISMA13 (material suplementario 1).
La pregunta de investigación se formuló según la estrategia PICOS:
- –
P (Población): Pacientes adultos de 18 años o más que habían sido diagnosticados de HS.
- –
I (Intervención): Tratamientos anti-interleucina 17.
- –
C (Comparador): Tratamiento con placebo.
- –
(Resultado): El resultado primario de interés fue el perfil de seguridad y eficacia de los tratamientos anti-IL17 en los pacientes con HS. Esto incluyó las métricas de Respuesta Clínica a la Hidradenitis Supurativa (HiSCR), incluyendo HIiSCR75 y HiSCR90, Índice de Calidad de Vida Dermatológica (DLQI) como Medida de Resultado Informada por el Paciente (PROM), la tasa de incidencia de pacientes con eventos adversos, eventos adversos graves, cefalea, infecciones y contaminación de cualquier órgano, infecciones por cándida, enfermedad inflamatoria intestinal y retirada del tratamiento.
- –
S (Diseño del estudio): Solo se incluyeron ensayos clínicos aleatorizados controlados con placebo.
Se aplicaron criterios de exclusión para garantizar la calidad y comparabilidad de los estudios incluidos. Se excluyeron los estudios observacionales, tanto de casos y controles como de cohortes. También se excluyeron las revisiones sistemáticas y las revisiones bibliográficas. Duplicados: Se excluyeron múltiples informes sobre el mismo estudio para evitar la duplicación de datos.
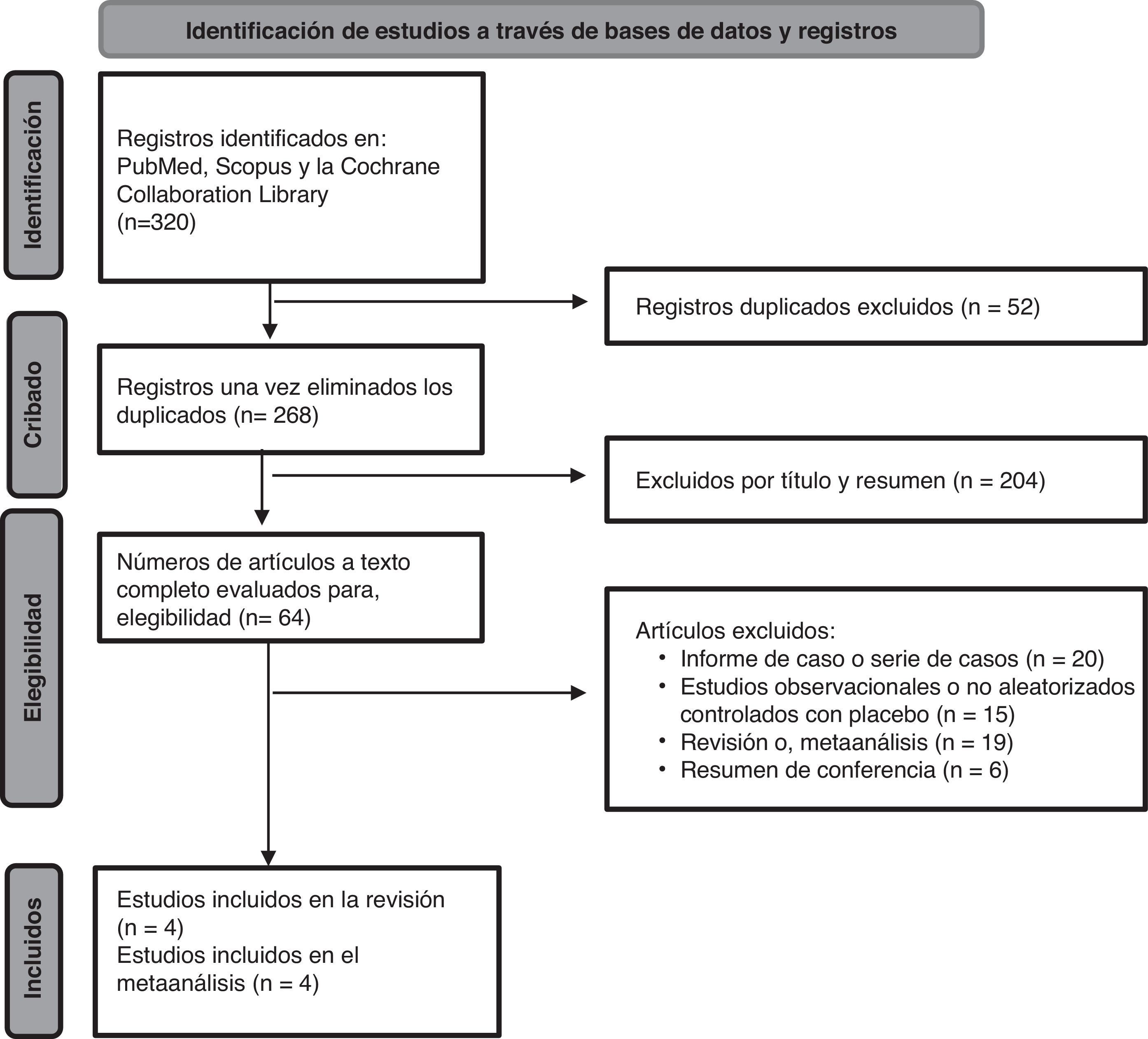
Fuentes de informaciónSe realizó una extensa revisión bibliográfica utilizando múltiples bases de datos, incluyendo PubMed®, Scopus® y el Registro Cochrane Central de Ensayos Controlados desde su inicio hasta el 9 de junio de 2024 (fig. 1). Se utilizó una metodología sistemática y rigurosa para la búsqueda de estudios relevantes, sin establecer un tiempo específico O, límite de idioma. Se realizó una revisión exhaustiva de las referencias bibliográficas de los estudios seleccionados en la primera fase de la búsqueda para identificar cualquier estudio adicional que pudiera haberse omitido en la búsqueda inicial.
Métodos de búsqueda para la identificación de estudiosSe utilizaron los siguientes términos de búsqueda para buscar en todos los registros de ensayos y bases de datos: (hidradenitis supurativa OR, acné inversa) AND (IL17 OR, IL17A OR, bimekizumab OR, secukinumab) (material suplementario 2). Dos revisores (AO/ML) acordaron de forma independiente la selección de los estudios elegibles y llegaron a un consenso sobre los estudios que debían incluirse.
Extracción de datos y elementos de los datosDos autores (AO/ML) revisaron de forma independiente los datos extraídos de los estudios. Si no se alcanzaba un consenso, se consultaba a un tercer autor (CM) para completar el formulario de extracción de datos. Se recogieron los siguientes datos: características basales de los artículos, autor y año de publicación, tipo de estudio, identificador del ensayo clínico, diseño del estudio, variable principal de valoración en semanas, gravedad, tamaño de la muestra, edad, número de mujeres, resultados y conflictos de intereses relacionados con la industria farmacéutica.
En los ECA que incluían más de un brazo con un anti-IL17, cada uno de ellos se analizó por separado.
Una de las variables comparadas fue el HiSCR, a las 2, 4, 12 y 16 semanas. La HiSCR es un criterio de valoración independientemente del tamaño de la lesión, el dolor o el impacto en la calidad de vida. Se define como, al menos, una reducción del 50% en el recuento total de abscesos y nódulos inflamatorios sin aumento en el recuento de abscesos ni en el recuento de túneles de drenaje en relación con el valor basal14. Los datos de eficacia se extrajeron en las semanas 2 y 4 para evaluar la velocidad, y los datos de eficacia se extrajeron en las semanas 12 y 16, ya que eran los criterios de valoración de los estudios. También se extrajeron los valores HiSCR75 y HiSCR90 si se habían notificado. Como PROM, se extrajo el cambio medio y la desviación estándar del DLQI si lo informaban los estudios. Para los resultados de seguridad, se pudieron establecer comparaciones mediante la tasa de incidencia de pacientes con acontecimientos adversos, acontecimientos adversos graves, cefalea, infecciones y contaminación de cualquier órgano, infecciones por cándida, enfermedad inflamatoria intestinal y retirada del tratamiento.
Riesgo de sesgoLa calidad metodológica y el riesgo de sesgo (RoB) de los ECA incluidos fueron evaluados de forma independiente por 2 revisores mediante la herramienta de riesgo de sesgo de la Colaboración Cochrane (Cochrane Collaboration) (software Review Manager®). Esta herramienta evalúa sistemáticamente 6 dominios clave relacionados con el sesgo: generación de la secuencia aleatoria, ocultación de la asignación, cegamiento de los participantes y del personal, cegamiento de la evaluación de resultados, datos de resultados incompletos e información selectiva. Para cada dominio, se utilizaron criterios explícitos preespecificados para asignar calificaciones de RoB bajo, alto o poco claro. Los resultados de la RoB se muestran en la figura 2 y la justificación de cada criterio puede consultarse en el material suplementario 3.
Evaluación de los resultadosSe estimaron las diferencias de medias (DM) y los intervalos de confianza (IC) del 95% para las variables continuas medidas en la misma escala. Se calcularon las odds ratio (OR) para las variables dicotómicas. La heterogeneidad se evaluó mediante el estadístico I2, con valores <25%, 25-50% y >50% que indican una heterogeneidad baja, moderada y alta, respectivamente. Se utilizó un modelo de efectos fijos cuando no se observó heterogeneidad significativa. El informe de datos incompletos entre los estudios se abordó siguiendo las orientaciones metodológicas del Manual Cochrane15. Para todos los análisis se utilizó el software estadístico Review Manager® 5.4. Se utilizó Web-PlotDigitizer versión 4.7 para obtener información de las figuras de los artículos. Se consideró un nivel de umbral de significación estadística si p<0,05.
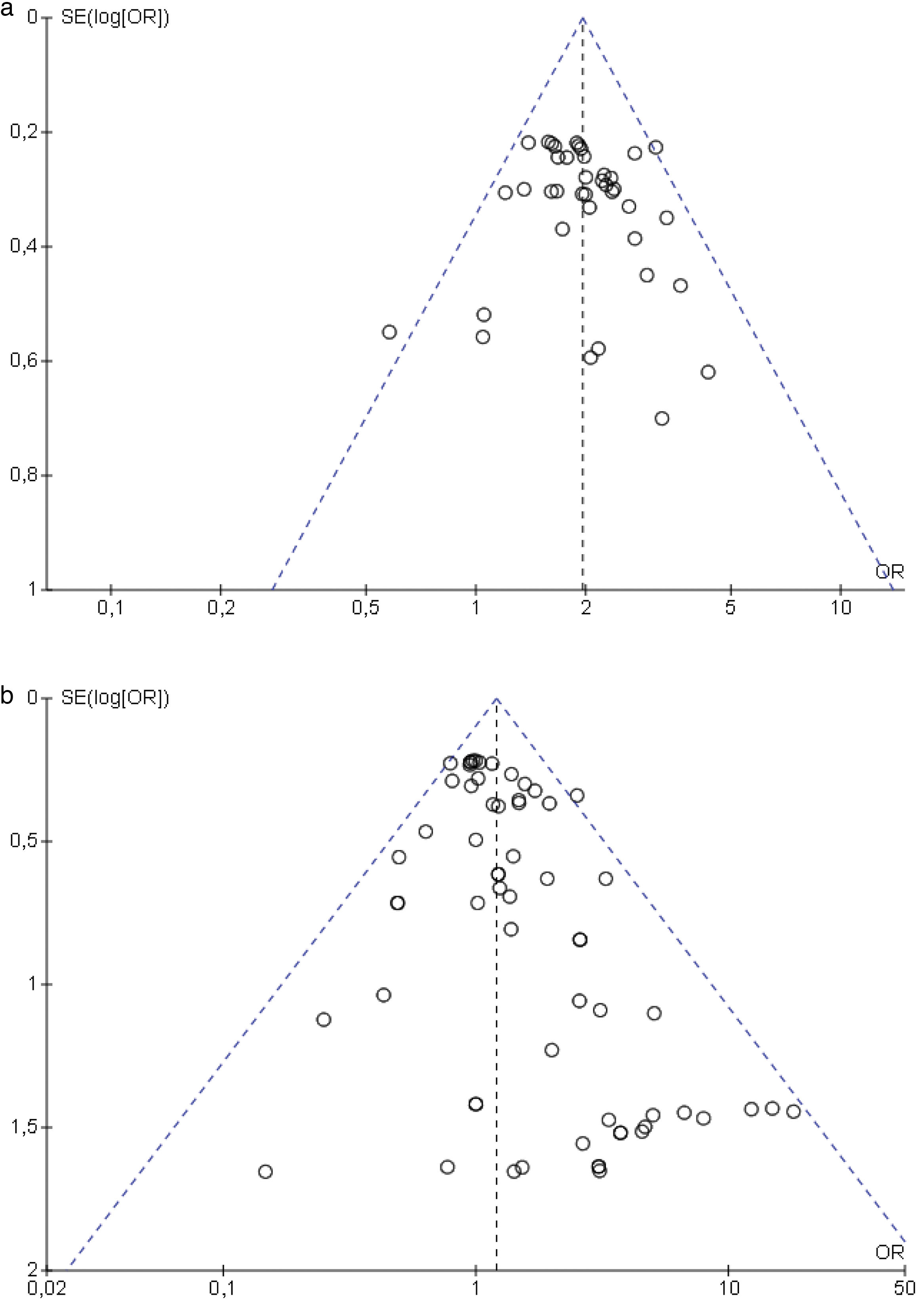
Sesgo de publicaciónEl análisis del gráfico en embudo (funnel plot) se realizó con el programa informático Review Manager® 5.4 para evaluar el posible sesgo de publicación. La asimetría del gráfico en embudo puede mostrar un sesgo de publicación derivado de la no publicación de estudios más pequeños con resultados nulos o no concluyentes.
Análisis adicionalesSe realizaron análisis de subgrupos basados en el tiempo de seguimiento en el caso de HiSCR, específicamente a las 2, 4, 12 y 16 semanas, y basados en diferentes variables de eventos adversos en los resultados de seguridad.
Debido al interés en la práctica clínica real, los datos de seguridad y eficacia de bimekizumab y secukinumab se han analizado por separado.
Se realizó un análisis de sensibilidad eliminando los estudios de fármacos no comercializados para cada resultado y reanalizando los datos utilizando Review Manager® 5.4 para evaluar la solidez de los resultados y evaluar el impacto de la exclusión de estudios individuales en las interpretaciones globales.
Gradación de la certeza de la evidenciaPara evaluar la certeza de los resultados se utilizó el enfoque Grading of Recommendations Assessment, Development, and Evaluation (GRADE), utilizando GRADEpro16. GRADE evalúa la calidad de la evidencia basándose en factores como el diseño del estudio, la RoB, la inconsistencia, la indirectidad, la imprecisión y el sesgo de publicación. Los datos utilizados fueron los introducidos en Review Manager® 5.4.
ResultadosSelección de estudiosLa búsqueda inicial arrojó un total de 320 artículos procedentes de bases de datos. Tras eliminar los duplicados y las revisiones basadas en títulos y resúmenes, se excluyó un total de 256 artículos, lo que dio como resultado 64 artículos. Tras revisar los textos completos, se excluyeron 60 estudios por no cumplir los criterios de inclusión. Finalmente, se incluyeron 4 estudios en la revisión sistemática y el metaanálisis10–12,17 (fig. 1).
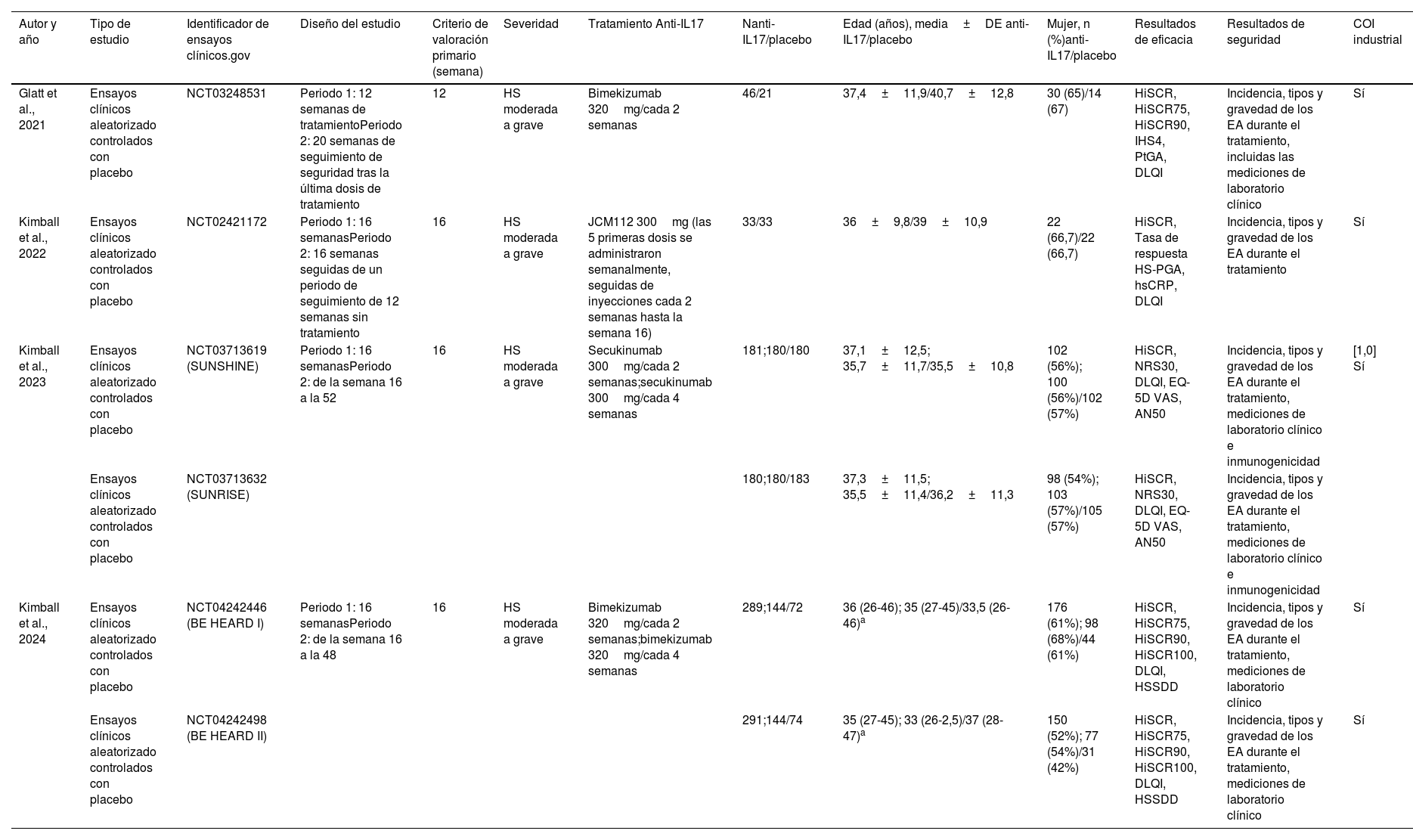
Características de los estudiosLa tabla 1 ilustra las principales características de los estudios incluidos. Dos artículos informaron sobre 2 ensayos clínicos diferentes cada uno. Se incluyeron 4 artículos con 2.231 pacientes (1.668 del grupo anti-IL17 y 563 del grupo placebo). Todos los estudios incluidos eran ensayos clínicos aleatorizados controlados con placebo. En general, el número de mujeres era mayor que el de hombres en los estudios. La edad media de los pacientes en los estudios se muestra en la tabla 1. La gravedad de la HS en todos los estudios fue de moderada a grave. Solo se exportaron los datos del primer periodo de los ensayos clínicos para evitar el sesgo global y el efecto de periodo.
Características basales de los estudios incluidos
| Autor y año | Tipo de estudio | Identificador de ensayos clínicos.gov | Diseño del estudio | Criterio de valoración primario (semana) | Severidad | Tratamiento Anti-IL17 | Nanti-IL17/placebo | Edad (años), media±DE anti-IL17/placebo | Mujer, n (%)anti-IL17/placebo | Resultados de eficacia | Resultados de seguridad | COI industrial |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Glatt et al., 2021 | Ensayos clínicos aleatorizado controlados con placebo | NCT03248531 | Periodo 1: 12 semanas de tratamientoPeriodo 2: 20 semanas de seguimiento de seguridad tras la última dosis de tratamiento | 12 | HS moderada a grave | Bimekizumab 320mg/cada 2 semanas | 46/21 | 37,4±11,9/40,7±12,8 | 30 (65)/14 (67) | HiSCR, HiSCR75, HiSCR90, IHS4, PtGA, DLQI | Incidencia, tipos y gravedad de los EA durante el tratamiento, incluidas las mediciones de laboratorio clínico | Sí |
| Kimball et al., 2022 | Ensayos clínicos aleatorizado controlados con placebo | NCT02421172 | Periodo 1: 16 semanasPeriodo 2: 16 semanas seguidas de un periodo de seguimiento de 12 semanas sin tratamiento | 16 | HS moderada a grave | JCM112 300mg (las 5 primeras dosis se administraron semanalmente, seguidas de inyecciones cada 2 semanas hasta la semana 16) | 33/33 | 36±9,8/39±10,9 | 22 (66,7)/22 (66,7) | HiSCR, Tasa de respuesta HS-PGA, hsCRP, DLQI | Incidencia, tipos y gravedad de los EA durante el tratamiento | Sí |
| Kimball et al., 2023 | Ensayos clínicos aleatorizado controlados con placebo | NCT03713619 (SUNSHINE) | Periodo 1: 16 semanasPeriodo 2: de la semana 16 a la 52 | 16 | HS moderada a grave | Secukinumab 300mg/cada 2 semanas;secukinumab 300mg/cada 4 semanas | 181;180/180 | 37,1±12,5; 35,7±11,7/35,5±10,8 | 102 (56%); 100 (56%)/102 (57%) | HiSCR, NRS30, DLQI, EQ-5D VAS, AN50 | Incidencia, tipos y gravedad de los EA durante el tratamiento, mediciones de laboratorio clínico e inmunogenicidad | [1,0] Sí |
| Ensayos clínicos aleatorizado controlados con placebo | NCT03713632 (SUNRISE) | 180;180/183 | 37,3±11,5; 35,5±11,4/36,2±11,3 | 98 (54%); 103 (57%)/105 (57%) | HiSCR, NRS30, DLQI, EQ-5D VAS, AN50 | Incidencia, tipos y gravedad de los EA durante el tratamiento, mediciones de laboratorio clínico e inmunogenicidad | ||||||
| Kimball et al., 2024 | Ensayos clínicos aleatorizado controlados con placebo | NCT04242446 (BE HEARD I) | Periodo 1: 16 semanasPeriodo 2: de la semana 16 a la 48 | 16 | HS moderada a grave | Bimekizumab 320mg/cada 2 semanas;bimekizumab 320mg/cada 4 semanas | 289;144/72 | 36 (26-46); 35 (27-45)/33,5 (26-46)a | 176 (61%); 98 (68%)/44 (61%) | HiSCR, HiSCR75, HiSCR90, HiSCR100, DLQI, HSSDD | Incidencia, tipos y gravedad de los EA durante el tratamiento, mediciones de laboratorio clínico | Sí |
| Ensayos clínicos aleatorizado controlados con placebo | NCT04242498 (BE HEARD II) | 291;144/74 | 35 (27-45); 33 (26-2,5)/37 (28-47)a | 150 (52%); 77 (54%)/31 (42%) | HiSCR, HiSCR75, HiSCR90, HiSCR100, DLQI, HSSDD | Incidencia, tipos y gravedad de los EA durante el tratamiento, mediciones de laboratorio clínico | Sí |
AN50: proporción de pacientes con una reducción de al menos el 50% en el recuento de abscesos (A) y nódulos inflamatorios (N) en comparación con el valor inicial; COI: conflicto de intereses; DLQI: Dermatology Life Quality Index; EA: eventos adversos; EQ-5D VAS: EuroQol-5D visual analog scale; HiSCR: respuesta clínica a la hidradenitis supurativa, definida como una reducción del recuento total de abscesos y nódulos inflamatorios de al menos el 50% con respecto al valor basal, sin aumento con respecto al valor basal del recuento de abscesos y nódulos inflamatorios o túneles de drenaje; HiSCR75: reducción del recuento total de abscesos y nódulos inflamatorios de al menos el 75% con respecto al valor basal, sin aumento con respecto al valor basal del recuento de abscesos o túneles de drenaje; HiSCR90: reducción del recuento total de abscesos y nódulos inflamatorios de al menos el 90% con respecto al valor inicial sin aumento del recuento de abscesos o túneles de drenaje con respecto al valor inicial; HS: hidradenitis supurativa; HS-PGA: hidradenitis supurativa Physician's Global Assessment; hsCRP: proteína C reactiva de alta sensibilidad; HSSDD: diario de síntomas de hidradenitis supurativa; IHS4: International Hidradenitis Suppurativa Severity Score; NRS30: reducción del 30% o más y reducción de 2 unidades o más respecto al valor basal en la Evaluación Global del Dolor Cutáneo por el Paciente en una escala de valoración numérica continua; PtGA: Patient's Global Assessment.
Se analizó el RoB del primer periodo de cada ensayo clínico. Los resultados del RoB se muestran en la figura 2. En el ensayo clínico NCT02421172, la generación de la secuencia aleatoria y la ocultación de la asignación se puntuaron con «riesgo de sesgo no claro», ya que no se detallaron. Se puntuó con «alto riesgo de sesgo» el cegamiento de la evaluación de resultados porque no se informó. Para el resto de los estudios se consideró un riesgo de sesgo bajo.
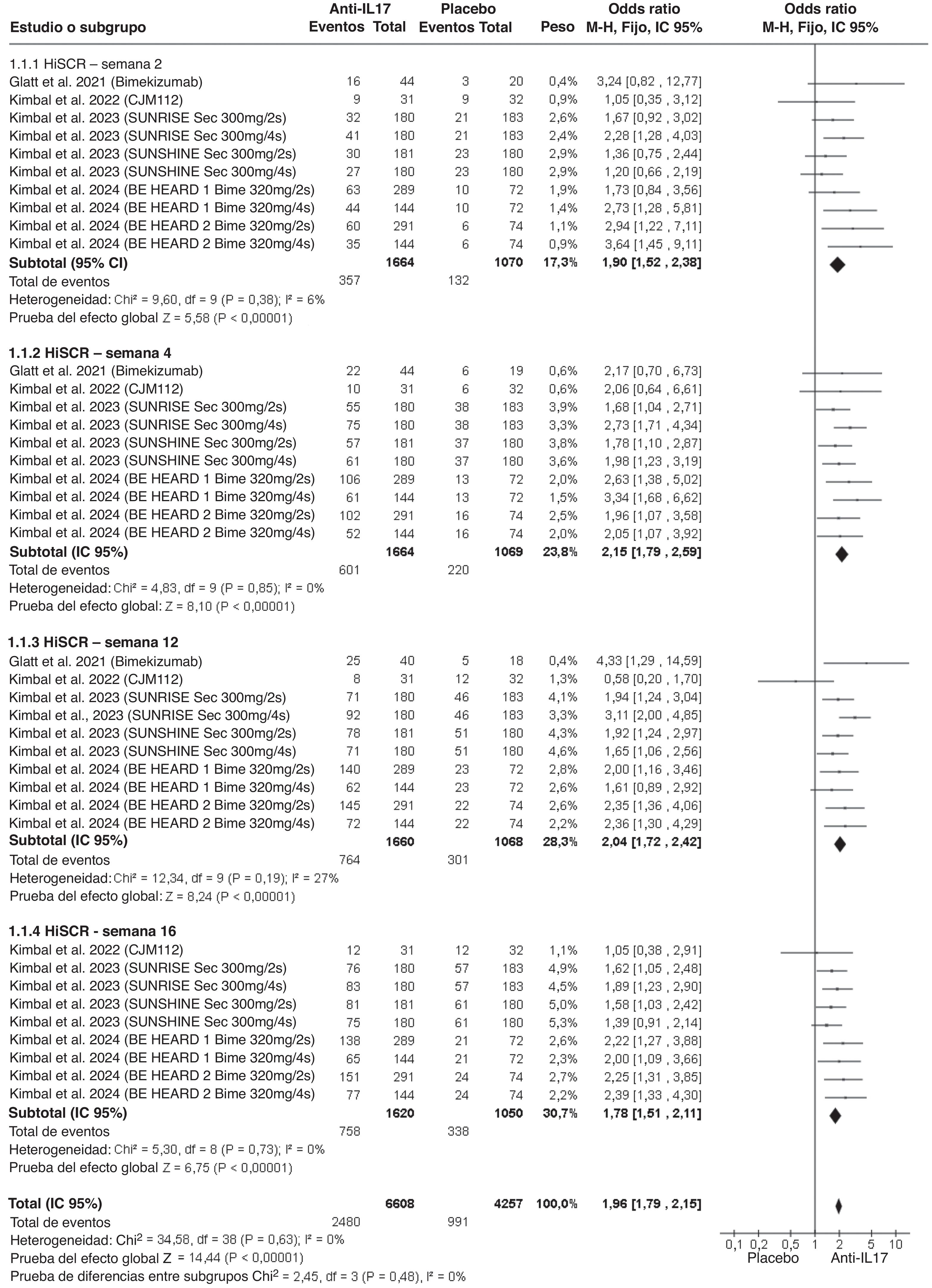
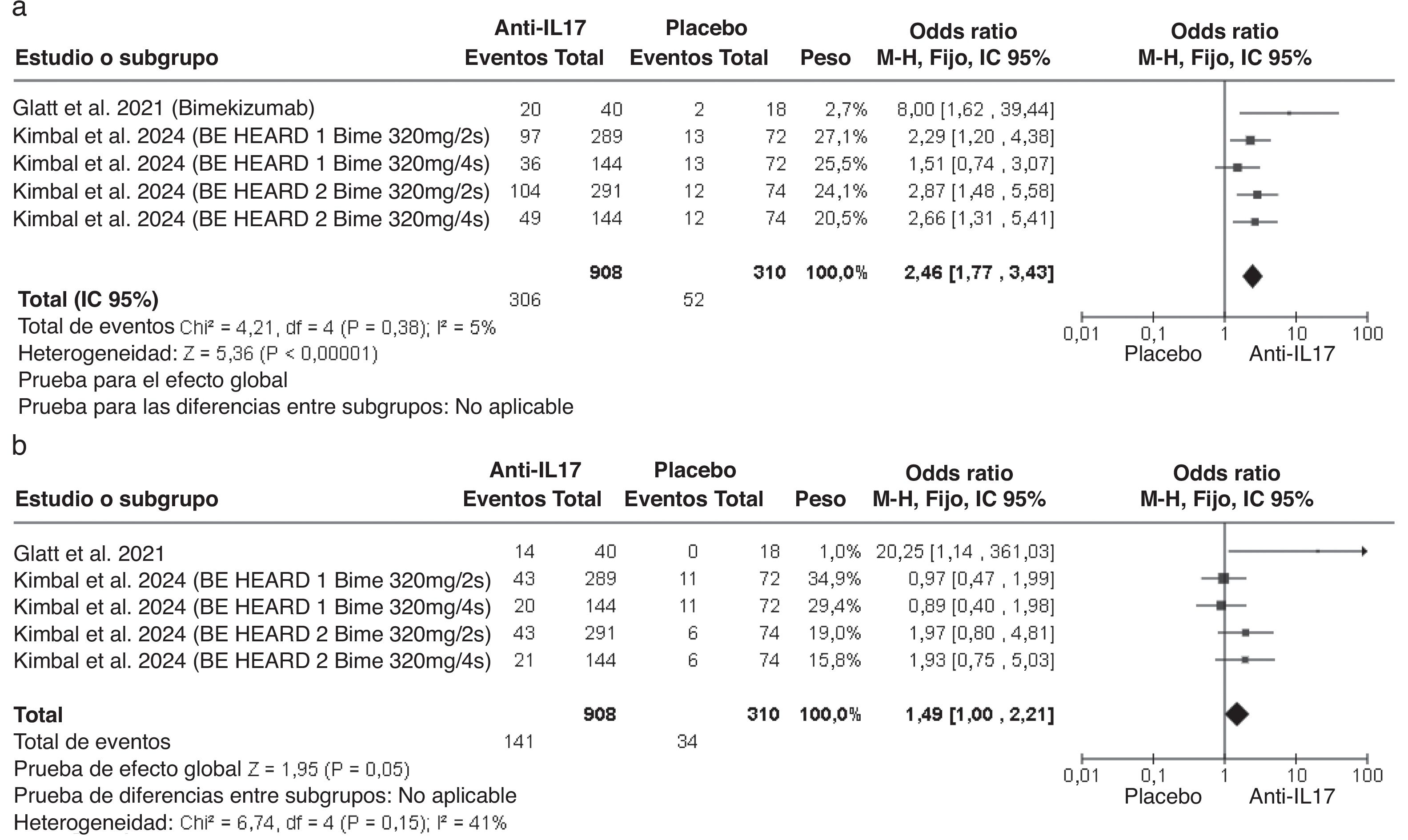
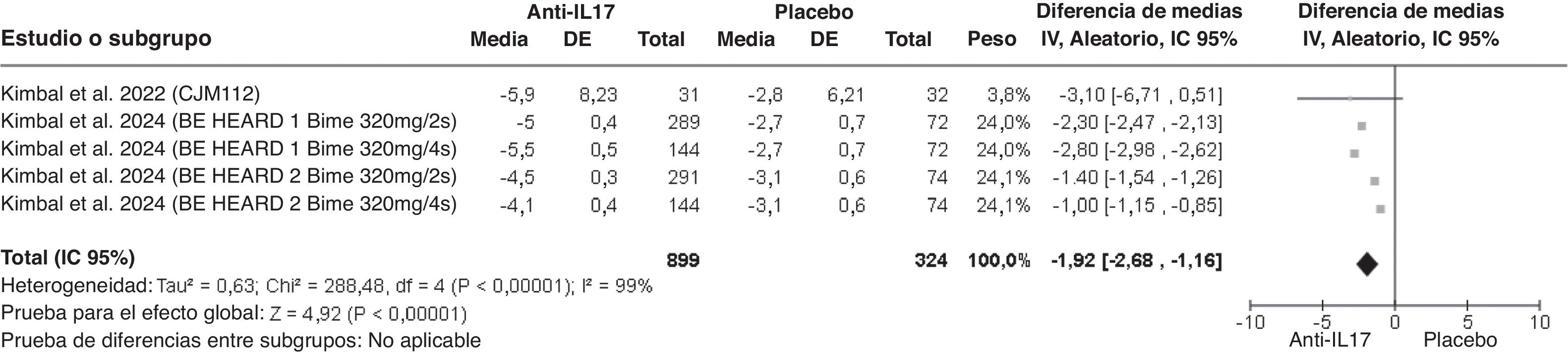
ResultadosEl tratamiento con anti-IL17 en HS mostró un mayor porcentaje de pacientes que alcanzaron HiSCR de forma significativa frente a placebo (OR: 1,96 [1,79-2,15]). Analizado por semanas, un mayor porcentaje de pacientes alcanzó HiSCR desde la semana 2 (OR: 1,90 [1,52-2,38]) hasta la semana 4 (OR: 2,15 [1,79-2,59]), semana 12 (OR: 2,04 [1,72-2,42]) y semana 16 (OR: 1,78 [1,51-2,11]) (fig. 3). En cuanto a la variable HiSCR75, el tratamiento con anti-IL17 mostró un porcentaje significativamente mayor (OR: 2,46 [1,77-3,43]) de pacientes que alcanzaron esta respuesta frente a placebo, pero no tanto para la variable HiSCR90 (OR: 1,49 [1,00-2,21]) (fig. 4). En cuanto a la PROM, el tratamiento con anti-IL17 mostró una disminución significativamente mayor del DLQI (DM −1,92 [−2,68-1,16]) (fig. 5).
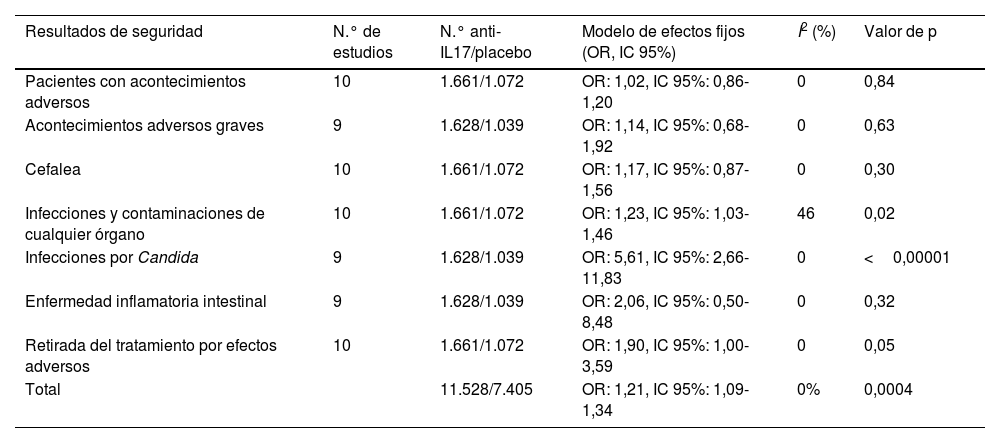
El tratamiento con anti-IL17 mostró un aumento significativo de los efectos adversos frente a placebo; OR: 1,21 [1,09-1,34]. No se encontraron diferencias en cuanto al número de pacientes que experimentaron efectos adversos; OR: 1,02 [0,86-1,20]. No hubo diferencias significativas en cuanto a acontecimientos adversos graves (OR: 1,14 [0,68-1,92]), cefalea (OR: 1,17 [0,87-1,56]), desarrollo de enfermedad inflamatoria intestinal (OR: 2,06 [0,50-8,48]) o en la tasa de retirada del tratamiento relacionada con acontecimientos adversos (OR: 1,90 [1,00-3,59]). Se encontraron diferencias significativas en cuanto a una mayor tasa de infecciones y contaminaciones de cualquier órgano (OR: 1,23 [1,03-1,46]) y de infecciones por Candida (OR: 5,61 [2,66-11,83]) con el uso de anti-IL17 frente a placebo (tabla 2 y material suplementario 4).
Resultados del metaanálisis en relación con el perfil de seguridad de las variables analizadas. Los diagramas de bosque se muestran en el material suplementario 5
| Resultados de seguridad | N.° de estudios | N.° anti-IL17/placebo | Modelo de efectos fijos (OR, IC 95%) | I2 (%) | Valor de p |
|---|---|---|---|---|---|
| Pacientes con acontecimientos adversos | 10 | 1.661/1.072 | OR: 1,02, IC 95%: 0,86-1,20 | 0 | 0,84 |
| Acontecimientos adversos graves | 9 | 1.628/1.039 | OR: 1,14, IC 95%: 0,68-1,92 | 0 | 0,63 |
| Cefalea | 10 | 1.661/1.072 | OR: 1,17, IC 95%: 0,87-1,56 | 0 | 0,30 |
| Infecciones y contaminaciones de cualquier órgano | 10 | 1.661/1.072 | OR: 1,23, IC 95%: 1,03-1,46 | 46 | 0,02 |
| Infecciones por Candida | 9 | 1.628/1.039 | OR: 5,61, IC 95%: 2,66-11,83 | 0 | <0,00001 |
| Enfermedad inflamatoria intestinal | 9 | 1.628/1.039 | OR: 2,06, IC 95%: 0,50-8,48 | 0 | 0,32 |
| Retirada del tratamiento por efectos adversos | 10 | 1.661/1.072 | OR: 1,90, IC 95%: 1,00-3,59 | 0 | 0,05 |
| Total | 11.528/7.405 | OR: 1,21, IC 95%: 1,09-1,34 | 0% | 0,0004 |
IC: intervalo de confianza; OR: odds ratio.
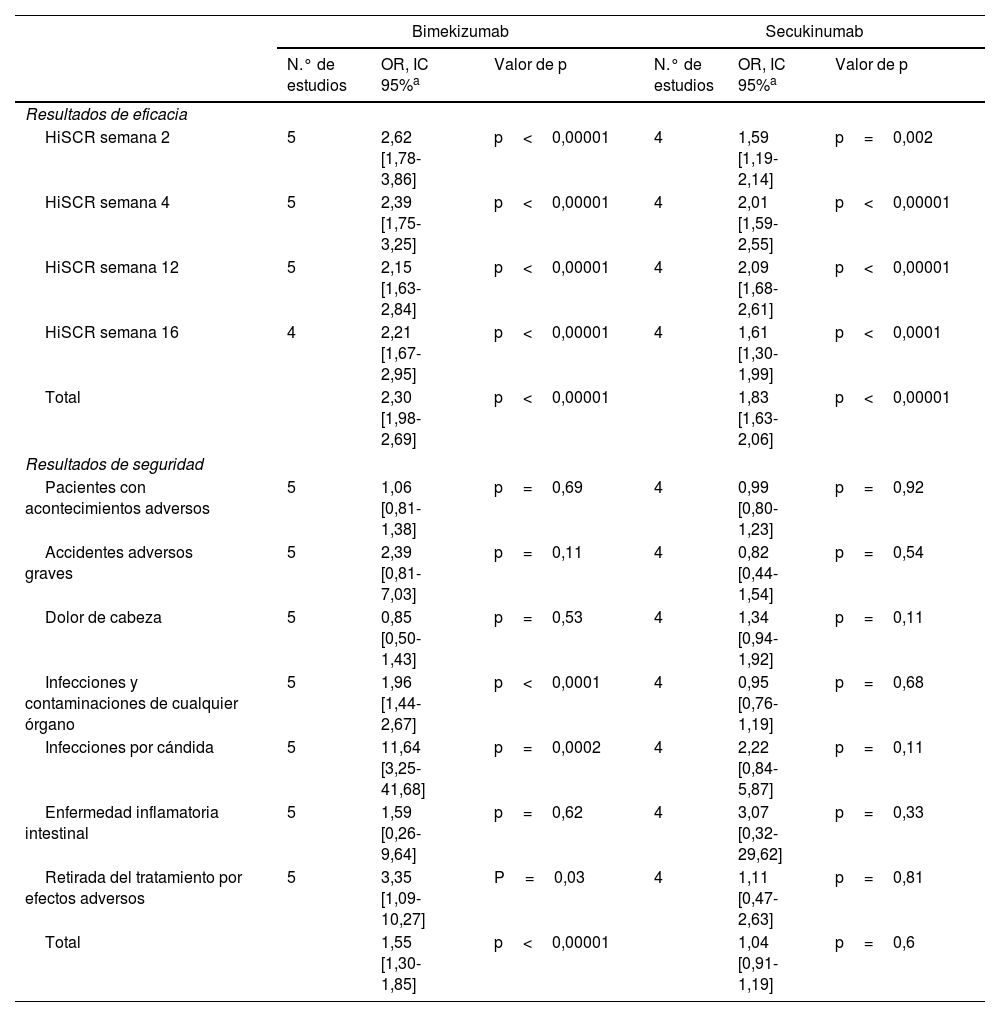
Un análisis separado de los resultados de seguridad y eficacia para bimekizumab y secukinumab se muestra en la tabla 3 y material suplementario 5. En cuanto a la eficacia, los resultados de bimekizumab respecto a la obtención de HiSCR muestran una OR>2 a las 2 semanas de tratamiento, con una OR total de 2,30 [1,98-2,69], respecto a la OR total de secukinumab (1,83 [1,63-2,06]), cuyos resultados son inferiores en los subanálisis realizados en las semanas 2, 4, 12 y 16. Sin embargo, en cuanto a las variables de seguridad, secukinumab no muestra diferencias con respecto a placebo en cuanto a la tasa de efectos adversos (OR: 1,04 [0,91-1,19]), incluyendo candidiasis (2,22 [0,84-5,87]) frente a un aumento de los efectos adversos frente a placebo con el uso de bimekizumab (OR: 1. 55 [1,30-1,85]), siendo las diferencias significativas debidas a un mayor aumento de infecciones y contaminaciones de cualquier órgano (OR: 1,96 [1,44-2,67]), principalmente candidiasis (OR: 11,64 [3,25-41,68]), y a la retirada del tratamiento debido a efectos adversos (OR: 3,35 [1,09-10,27]).
Resultados de eficacia y seguridad de bimekizumab y secukinumab analizados por separado
| Bimekizumab | Secukinumab | |||||
|---|---|---|---|---|---|---|
| N.° de estudios | OR, IC 95%a | Valor de p | N.° de estudios | OR, IC 95%a | Valor de p | |
| Resultados de eficacia | ||||||
| HiSCR semana 2 | 5 | 2,62 [1,78-3,86] | p<0,00001 | 4 | 1,59 [1,19-2,14] | p=0,002 |
| HiSCR semana 4 | 5 | 2,39 [1,75-3,25] | p<0,00001 | 4 | 2,01 [1,59-2,55] | p<0,00001 |
| HiSCR semana 12 | 5 | 2,15 [1,63-2,84] | p<0,00001 | 4 | 2,09 [1,68-2,61] | p<0,00001 |
| HiSCR semana 16 | 4 | 2,21 [1,67-2,95] | p<0,00001 | 4 | 1,61 [1,30-1,99] | p<0,0001 |
| Total | 2,30 [1,98-2,69] | p<0,00001 | 1,83 [1,63-2,06] | p<0,00001 | ||
| Resultados de seguridad | ||||||
| Pacientes con acontecimientos adversos | 5 | 1,06 [0,81-1,38] | p=0,69 | 4 | 0,99 [0,80-1,23] | p=0,92 |
| Accidentes adversos graves | 5 | 2,39 [0,81-7,03] | p=0,11 | 4 | 0,82 [0,44-1,54] | p=0,54 |
| Dolor de cabeza | 5 | 0,85 [0,50-1,43] | p=0,53 | 4 | 1,34 [0,94-1,92] | p=0,11 |
| Infecciones y contaminaciones de cualquier órgano | 5 | 1,96 [1,44-2,67] | p<0,0001 | 4 | 0,95 [0,76-1,19] | p=0,68 |
| Infecciones por cándida | 5 | 11,64 [3,25-41,68] | p=0,0002 | 4 | 2,22 [0,84-5,87] | p=0,11 |
| Enfermedad inflamatoria intestinal | 5 | 1,59 [0,26-9,64] | p=0,62 | 4 | 3,07 [0,32-29,62] | p=0,33 |
| Retirada del tratamiento por efectos adversos | 5 | 3,35 [1,09-10,27] | P=0,03 | 4 | 1,11 [0,47-2,63] | p=0,81 |
| Total | 1,55 [1,30-1,85] | p<0,00001 | 1,04 [0,91-1,19] | p=0,6 | ||
HiSCR: respuesta clínica a la hidradenitis supurativa, definida como una reducción del recuento total de abscesos y nódulos inflamatorios de al menos el 50% con respecto al valor basal, sin aumento con respecto al valor basal del recuento de abscesos y nódulos inflamatorios o túneles de drenaje; IC: intervalo de confianza; OR: odds ratio.
Se realizaron análisis de sensibilidad para HiSCR, DLQI y resultados de seguridad, excluyendo los estudios que incluían tratamientos anti-IL17 que no estaban disponibles comercialmente. Estos análisis mantuvieron los resultados comunicados anteriormente. Un mayor porcentaje de pacientes alcanzó el HiSCR de forma significativa con respecto al placebo; OR: 2,00 [1,82-2,20]. Se mantuvo la significación con respecto al PROM DLQI (DM −1,87 [−2,65, −1,09]) y al perfil de seguridad de las variables analizadas; OR: 1,15 [1,03-1,29] (material suplementario 6).
Sesgo de publicaciónEl sesgo de publicación se evaluó mediante gráficos en embudo (funnel plots), que revelaron una simetría consistente con un sesgo de publicación bajo con respecto a los resultados de eficacia (HiSCR) y seguridad (fig. 6).
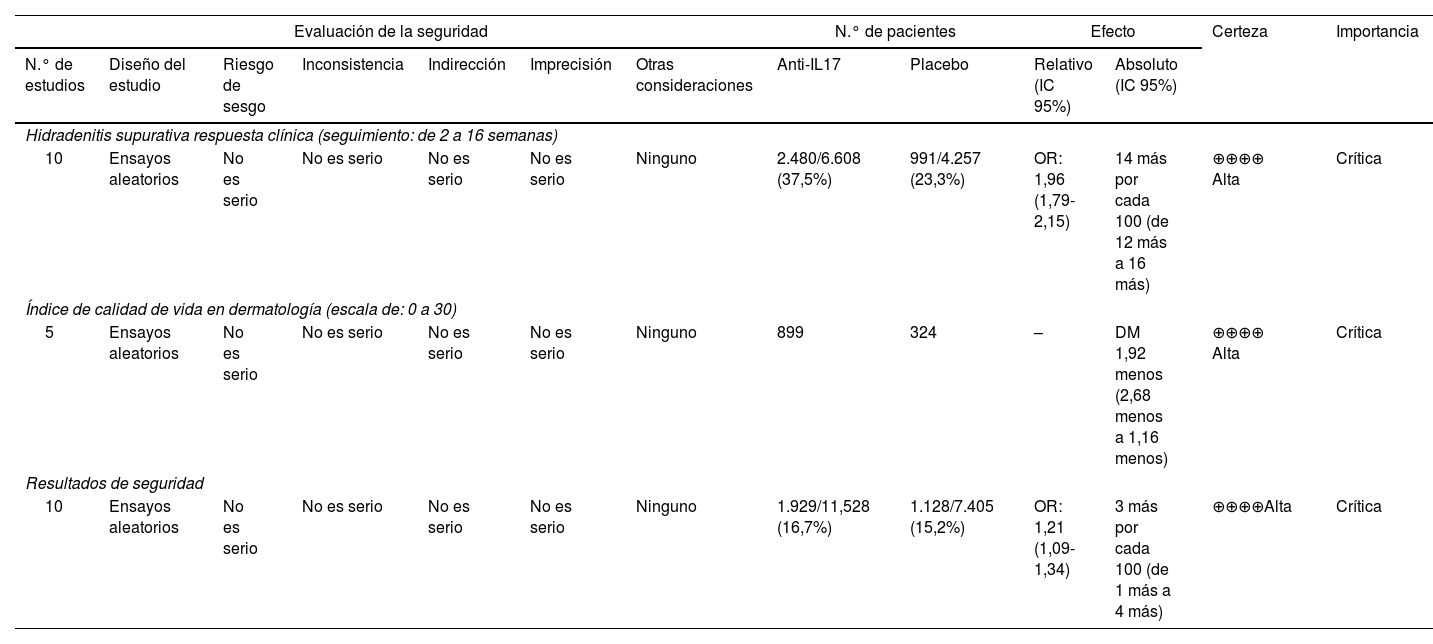
GRADELos datos incluidos en el metaanálisis se utilizaron para realizar el GRADE. La escala GRADE mostró una alta certeza con respecto a los resultados del HiSCR, el DLQI y los resultados de seguridad (tabla 4).
Certeza de la evidencia por GRADE
| Evaluación de la seguridad | N.° de pacientes | Efecto | Certeza | Importancia | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| N.° de estudios | Diseño del estudio | Riesgo de sesgo | Inconsistencia | Indirección | Imprecisión | Otras consideraciones | Anti-IL17 | Placebo | Relativo (IC 95%) | Absoluto (IC 95%) | ||
| Hidradenitis supurativa respuesta clínica (seguimiento: de 2 a 16 semanas) | ||||||||||||
| 10 | Ensayos aleatorios | No es serio | No es serio | No es serio | No es serio | Ninguno | 2.480/6.608 (37,5%) | 991/4.257 (23,3%) | OR: 1,96 (1,79-2,15) | 14 más por cada 100 (de 12 más a 16 más) | ⊕⊕⊕⊕ Alta | Crítica |
| Índice de calidad de vida en dermatología (escala de: 0 a 30) | ||||||||||||
| 5 | Ensayos aleatorios | No es serio | No es serio | No es serio | No es serio | Ninguno | 899 | 324 | – | DM 1,92 menos (2,68 menos a 1,16 menos) | ⊕⊕⊕⊕ Alta | Crítica |
| Resultados de seguridad | ||||||||||||
| 10 | Ensayos aleatorios | No es serio | No es serio | No es serio | No es serio | Ninguno | 1.929/11,528 (16,7%) | 1.128/7.405 (15,2%) | OR: 1,21 (1,09-1,34) | 3 más por cada 100 (de 1 más a 4 más) | ⊕⊕⊕⊕Alta | Crítica |
DM: diferencia de medias; IC: intervalo de confianza; OR: odds ratio.
La HS es una enfermedad inflamatoria crónica de la piel difícil de tratar, lo que ha llevado al uso de muchas herramientas terapéuticas diferentes1. Se han aprobado pocos fármacos con una indicación específica para la HS, y se han realizado pocos ensayos clínicos aleatorizados4. Dado que los ECA con anti-IL17 para el tratamiento de la HS son recientes, no existen comparaciones sobre los resultados de todos los ensayos clínicos más recientes con anti-IL1710–12,17. Presentamos este metaanálisis actualizado de ensayos clínicos aleatorizados controlados con placebo sobre el tratamiento con anti-IL17 en la HS de moderada a grave.
Demostramos que los fármacos biológicos anti-IL17 son tratamientos eficaces con un perfil de seguridad tolerable en la HS moderada-grave, lo que se apoya en un mayor porcentaje de pacientes que alcanzan HiSCR (incluso HiSCR75, pero no HiSCR90), una reducción del DLQI y un aumento de los acontecimientos adversos solo a expensas de infecciones y contaminaciones, en particular candidiasis, sin diferencias significativas con placebo en cuanto al número de pacientes que experimentan efectos adversos, acontecimientos adversos graves, cefalea, desarrollo de enfermedad inflamatoria intestinal o interrupción del tratamiento. El análisis del HiSCR a lo largo de diferentes semanas muestra el perfil de eficacia y la rapidez del anti-IL17, ya que esta eficacia es significativa a partir de la semana 2, lo que permite una mejoría precoz de esta enfermedad.
La IL17 es una de las citocinas proinflamatorias clave en algunas enfermedades inflamatorias de la piel, como la psoriasis y la HS18. Existen 6 miembros de la familia de la IL17, de la A a la F, siendo la IL17A, la IL17C y la IL17F las más asociadas con las enfermedades autoinflamatorias9,18.
Secukinumab es un anticuerpo monoclonal neutralizante de la IL17A. Sus ensayos clínicos idénticos SUNSHINE y SUNRISE han demostrado eficacia en la HS de moderada a grave, aunque en el ensayo SUNSHINE el grupo que recibió secukinumab cada 4 semanas no alcanzó el criterio de valoración11.
El anticuerpo monoclonal CJM112 tiene una diana terapéutica similar a secukinumab17. Un metaanálisis en red19 sitúa a secukinumab como tratamiento de segunda línea solo después de adalimumab, y a CJM112 como la 4.a mejor opción, según la superficie bajo la curva de clasificación acumulativa (SUCRA).
El bimekizumab es un anticuerpo monoclonal de doble acción que bloquea la IL17A y la IL17F. Sus ensayos clínicos BE HEARD I y BE HEARD II12 muestran su perfil de eficacia para el tratamiento de la HS de moderada a grave. Esta eficacia ya se había observado en un ensayo clínico previo10.
Los principales ensayos clínicos, SUNSHINE y SUNRISE para secukinumab11 y BE HEARD I y BE HEARD II para bimekizumab12 incluyeron a los pacientes con HS de moderada a grave definida por ≥5 lesiones inflamatorias en lugares anatómicos de ≥2 durante, al menos, un año en los ensayos con secukinumab y 6 meses en los ensayos con bimekizumab. No obstante, en los ensayos con bimekizumab era obligatorio que los pacientes hubieran estado en tratamiento previo con antibióticos sistémicos o tuvieran una contraindicación para ello. En estos ensayos, tener 20 o más tractos sinusales fue un criterio de exclusión.
En los ensayos BE HEARD I y BE HEARD II12, la aleatorización se estratificó según Hurley (II o III, ya que Hurley I no se incluyó en los ensayos) y el uso o no de antibióticos en ese momento (estratos con antibióticos frente a estratos sin antibióticos).
Durante los ensayos SUNSHINE y SUNRISE11 se permitió el uso de antibióticos sistémicos, corticosteroides intralesionales o drenaje en caso de reagudización, mientras que en los ensayos con bimekizumab estaba prohibido, lo que significa que los ensayos clínicos BE HEARD I y BE HEARD II12 aislaron mejor el efecto del fármaco.
Estos 4 ensayos clínicos comparten el criterio principal de valoración de la eficacia de HiSCR en la semana 16. La HiSCR se calculó a partir del número de abscesos (masa fluctuante y purulenta con un diámetro >10mm), nódulos inflamatorios y fístulas drenantes.
Sin embargo, otros criterios de valoración de interés relacionados con HiSCR, como HiSCR75, HiSCR90 y HiSCR100, solo se notificaron en BE HEARD I y BE HEARD II12, mientras que los de secukinumab no se notificaron.
Nuestro metaanálisis muestra que el doble de pacientes tratados con anti-IL17 alcanzan HiSCR frente a placebo, un resultado significativo desde la semana 2, lo que demuestra su rapidez. Más del doble de pacientes alcanzan HiSCR75 cuando reciben bimekizumab frente a placebo, sin diferencias significativas para alcanzar una respuesta HiSCR90, lo que muestra el perfil de eficacia de estos fármacos, pero lo lejos que estamos aún de las respuestas observadas con fármacos biológicos en psoriasis20. Sería de gran interés clínico la investigación de biomarcadores para predecir la respuesta terapéutica de los pacientes, con el objetivo de alcanzar la respuesta HiSCR90 que los anti-IL17 no han demostrado conseguir en este estudio.
En cuanto al DLQI, se observa un descenso de 2 puntos de media con anti-IL17 frente a placebo, lo que indica que mejora la calidad de vida de los pacientes con HS, aunque solo se ha podido comparar con bimekizumab12 y CJM11217.
Se observaron más efectos adversos al utilizar estos tratamientos biológicos, principalmente debido a un aumento de las infecciones y contaminaciones, sobre todo por Candida; sin embargo, no provocó un aumento significativo de la retirada del tratamiento. Dado que la vía Th17 es importante como mecanismo inmunitario antifúngico,21 se trata de un efecto adverso ya conocido en pacientes con psoriasis22, especialmente con bimekizumab23, también en pacientes con HS24.
El RoB fue bajo, excepto para el ensayo clínico con CJM112. Los análisis de sensibilidad de todas las variables comentadas (material suplementario 5) excluyeron el estudio CJM112 y mantuvieron las diferencias significativas y sus tamaños con respecto a HiSCR y DLQI. El principal cambio fue la ausencia de diferencias significativas respecto a la tasa de infecciones en general y contaminaciones, pero sí para candidiasis.
El análisis de certeza mediante el sistema GRADE fue de certeza alta para HiSCR, DLQI y resultados de seguridad.
En un metaanálisis de ensayos clínicos sobre adalimumab en la HS7, solo su administración semanal demostró ser eficaz frente a placebo, con una respuesta clínica a HiSCR similar a la del anti-IL17, pero sin datos sobre HiSCR75 O, HiSCR90. La mejoría en el DLQI, significativa para adalimumab solo en administración semanal, fue menor en ese metaanálisis que con anti-IL17 en el nuestro. En cuanto al perfil de seguridad, no informaron de un aumento significativo de los acontecimientos adversos con adalimumab, incluidas las infecciones frente a placebo. Sin embargo, la mayoría de los desenlaces comparados en ese metaanálisis fueron los notificados en la semana 127.
LimitacionesEntre las limitaciones, destacamos principalmente que solo se han incluido 6 ensayos clínicos. También encontramos como limitación la falta de más estudios que incluyeran variables como el IHS4 o el DLQI, bien porque estas variables no se mostraron en más de 1 estudio o porque se detallaron de forma no comparable. Las variables HiSCR75 o HiSCR90 solo incluyeron ensayos clínicos con bimekizumab porque fueron los únicos ensayos que lo informaron. Los resultados de seguridad se homogeneizaron, siendo hasta la semana 12 para el estudio de Glatt et al.10 y hasta la semana 16 en el otro11,12,17. Además, creemos que deberían realizarse estudios de práctica clínica real bien diseñados para obtener datos de seguridad y eficacia a largo plazo y el impacto en la calidad de vida de los pacientes.
ConclusionesEn nuestra revisión sistemática y metaanálisis, el tratamiento con fármacos biológicos anti-IL17 en los pacientes con HS es eficaz para conseguir una mejoría de la enfermedad a partir de la semana 2, y de la calidad de vida frente a placebo. En base a los resultados de un análisis separado, parece que bimekizumab podría ser un tratamiento más eficaz, pero con un peor perfil de seguridad, con una mayor tasa de candidiasis, lo que significa que los pacientes en este tratamiento deben ser monitorizados por el riesgo de infecciones por cándida. Además, creemos que deberían realizarse estudios de práctica clínica real bien diseñados para obtener datos de seguridad y eficacia a largo plazo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.