La dermatitis atópica (DA) es una frecuente enfermedad crónica e inflamatoria de la piel que acarrea una fuerte carga física y emocional. La DA suele comenzar a edades tempranas y tiene un curso heterogéneo. Las últimas evidencias a este respecto sugieren que las interleucinas IL-4 e IL-3 son citoquinas claves en la inmunopatogénesis de la DA. El dupilumab es un anticuerpo monoclonal dirigido contra la subunidad del receptor alfa de la IL-4 que bloquea la señalización tanto de la IL-4 como de la IL-3. Datos extraídos de estudios fase i-iii revelan que administrado como monotratamiento o acompañado de corticosteroides tópicos, el dupilumab se tolera bien y resulta efectivo en el tratamiento de pacientes adultos con DA de carácter entre moderado y grave. Un gran número de pacientes que recibieron dupilumab experimentaron mejorías notables en varios índices de eficacia, incluidos el Índice de gravedad y área de eccema, la Escala de evaluación global del investigador y la Escala de dermatitis atópica. Estos resultados abren una nueva era a tratamientos dirigidos en el manejo de la DA.
Atopic dermatitis (AD) is a common, chronic, inflammatory skin disorder with high physical and emotional burden. AD usually starts in early childhood and has a heterogeneous course. Emerging evidence suggests that IL-4 and IL-13 are key cytokines in the immunopathogenesis of AD. Dupilumab is a monoclonal antibody directed against IL-4 receptor α subunit, that blocks both IL-4 and IL-13 signaling. Data from Phase I-III studies revealed that dupilumab, administered as monotherapy or with topical corticosteroids, is effective and well tolerated in the treatment of adult patients with moderate-to-severe AD. A large proportion of patients receiving dupilumab had significant improvements in multiple efficacy indexes, including Eczema Area and Severity Index, Investigator's Global Assessment and SCORing Atopic Dermatitis scores. These results introduce a new era of targeted therapies in the management of AD.
La dermatitis atópica (DA) es una frecuente enfermedad crónica, inflamatoria e incurable de la piel cuya prevalencia mundial es de hasta el 25% en niños y del 5% en adultos1–5. La DA suele comenzar a edades tempranas, si bien hasta el 10% de los casos se da en adultos4,6,7. Casi el 20% de los pacientes padece la enfermedad en grado entre moderado y grave2. El curso de la DA es heterogéneo y suele presentarse con brotes intermitentes, algunos pacientes llegan, incluso, a desarrollar recaídas persistentes o crónicas de la enfermedad, mientras en otros grupos de pacientes todos los síntomas no se resuelven del todo hasta llegada la adolescencia8,9. La DA se asocia a otras comorbilidades alérgicas tales como el asma, la rinosinusitis, las alergias alimentarias10,11 y un mayor riesgo de desarrollar enfermedades psicológicas como, por ejemplo, depresión, ansiedad e ideas suicidas8,12–15 debido a los problemas de sueño que genera la intensa comezón que ocasiona. Recientemente, la DA se ha asociado a otras comorbilidades tales como la obesidad y la enfermedad cardiovascular, lo cual pone de manifiesto la posibilidad de que la DA sea un trastorno sistémico16. Además, la DA se asocia a un alto coste socioeconómico y en asistencia sanitaria debido a la pérdida de trabajo y resultados negativos que ocasiona al empresario, tanto a nivel de productividad como de rentabilidad17.
Patogénesis de la dermatitis atópicaLa DA es un trastorno multifactorial que incluye factores genéticos y medioambientales. La mutación de la proteína epidérmica filagrina es un riesgo genético de desarrollar DA, si bien dicha mutación no se da en todos los pacientes con DA18. La DA se caracteriza por una disrupción de la barrera epidérmica que acarrea inflamación crónica acompañada de hiperplasia epidérmica e infiltrados celulares, incluidas linfocitos T, células dendríticas, eosinófilos y linfocitos T colaboradores tipo 2 (Th2)19–21. Las vías de respuesta inmunológica que se observan en una epidermis con DA son Th2 dominantes y secretan interleucinas (IL)-4, IL-5, IL-13, IL-25 e IL-31, con algunas células colaboradoras Th1, Th17 y Th2219,22–24.
Las interleucinas IL-4 y IL-13 son citoquinas claves que conducen la actividad de los linfocitos Th2 y algunas de sus acciones son: 1) una mayor producción de inmunoglobulina E; 2) una mayor expresión de quimioquinas como, por ejemplo, quimioquinas reguladas por el timo y por activación y eotaxina-3; 3) la atracción de células inflamatorias tales como eosinófilos y células Th2; y 4) la inhibición de la diferenciación de queratinocitos, la expresión de proteínas barrera como las filagrinas y la síntesis de lípidos y péptidos antimicrobianos que resulta, todo ello, en una disfunción de la barrera epidérmica25–33. El defecto de la barrera epidérmica de pacientes con DA ocasiona sequedad cutánea y una mayor cantidad de Staphylococcus aureus en piel lesional, así como un mayor riesgo de infecciones34,35.
Necesidades no cubiertas en el tratamiento de la dermatitis atópicaEl tratamiento de la DA sigue siendo un desafío y es limitado36. La mayoría de pacientes presentan esta enfermedad de carácter leve, si bien la quinta parte la sufre de forma entre moderada y grave2,37,38. En las formas leves de la enfermedad los emolientes y los agentes tópicos (glucocorticoides tópicos [GCT]) e inhibidores tópicos de la calcineurina suelen bastar para controlar los síntomas de la enfermedad, si bien el tratamiento de la enfermedad de carácter moderado y grave plantea más retos. El tratamiento tópico no suele ser satisfactorio y el uso de agentes inmunosupresores sistémicos, tales como ciclosporinas (el único agente sistémico aprobado para el tratamiento de la DA), metotrexato, azatioprina y micofenolato de mofetilo se ve limitado por sus posibles toxicidades y efectos secundarios39–44. Por eso necesitamos nuevas opciones terapéuticas sistémicas seguras y efectivas que nos ayuden a tratar la DA de carácter entre moderado y grave.
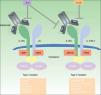
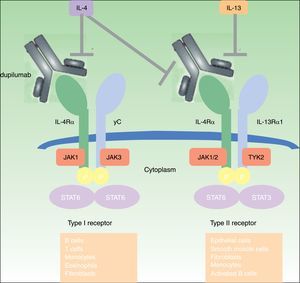
DupilumabEl dupilumab es un anticuerpo monoclonal completamente humano (mAb) dirigido contra la subunidad del receptor α de la interleucina 4 (IL-4Rα) que bloquea la señalización tanto de la IL-4 como de la IL-1345. Las interleucinas IL-4 e IL-13 están altamente expresadas en lesiones epidérmicas agudas y crónicas de pacientes con DA19,46, y su inhibición ha resultado enormemente efectiva en pacientes adultos con DA de carácter moderado y grave45–50 (fig. 1). El dupilumab es el único fármaco biológico que ha pasado a la fase iii de un ensayo clínico para el tratamiento de la DA de carácter entre moderado y grave, y está también en fase de investigación para el tratamiento del asma, la sinusitis crónica, la poliposis nasal y la esofagitis esosinofílica49.
Mecanismo de acción de dupilumab: Dupilumab actúa sobre la subunidad α del receptor de la interleucina 4 (IL-4Rα). El IL-4Rα es parte tanto de los receptores de la IL-4 tipos I y II como del receptor de la IL-13, de ahí que dupilumab inhiba la señalización en cascada de las interleucinas IL-4 and IL-13.
Se llevaron a cabo los estudios M4A y M4B fase i, doble ciegos, aleatorizados y controlados por placebo, con aumento de dosis, de 4 semanas de duración, con monotratamiento con dupilumab en pacientes adultos con DA de carácter entre moderado y grave, a fin de evaluar los perfiles de seguridad y eficacia51. En el estudio M4A 30 pacientes fueron aleatorizados en 4 grupos que recibieron placebo (n=6) o dupilumab en dosis de 75mg (n=8), 150mg (n=8) o 300mg (n=8) una vez por semana. En el M4B 37 pacientes fueron aleatorizados en 3 grupos que recibieron placebo (n=10) o dupilumab 150mg una vez por semana (n=14) o 300mg una vez por semana (n=13). En ambos estudios el tratamiento con dupilumab generó una rápida eficacia dependiente de la dosis en todos los resultados clínicos51. El hecho de alcanzar un descenso del 50% en el Índice de gravedad y área de eccema (EASI-50) el día 29 fue mucho más significativo con todas la dosis de dupilumab que cuando los pacientes recibieron placebo (del 59% vs 19%, respectivamente; p<0,05). El día 29 se observaron, también, mejoras notables en otros puntos finales clínicos en grupos de tratamiento combinado frente al placebo, incluidas la Escala de evaluación global del investigador (IGA), el porcentaje de Área de superficie corporal (ASC) y la Escala de gradación numérica (NRS) de prurito.
También se observaron importantes y rápidos cambios dependientes de la dosis en el perfil de expresión del ARN en la piel lesional tras 4 semanas de tratamiento con dupilumab, alcanzándose perfiles de expresión no lesional y mejoras en el índice EASI. Se observaron mejorías del 24% y 49% en el transcriptoma lesional de pacientes tratados con 150 y 300mg de dupilumab, respectivamente, comparado con un cambio del 21% a fenotipo molecular lesional en el grupo que recibió placebo (p<0,0001 para todos los grupos)49. También se observó la supresión de la expresión de K16, marcador de la proliferación de queratinocitos y regulador de la inmunidad innata, sugestivo de que el dupilumab reduce la hiperplasia epidérmica47.
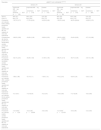
Fase IIbEl ensayo fase IIb fue un estudio doble ciego, aleatorizado, controlado por placebo, con aumento de dosis, de 16 semanas de duración, de individuos adultos con AD de carácter entre moderado y grave que fueron aleatorizados a recibir placebo (n=61) o dupilumab en dosis de 100mg cada 4 semanas (n=65), 200mg cada 2 semanas (n=61) o 300mg/una vez por semana (n=63), cada 2 semanas (n=64) o cada 4 semanas (n=65)52,53. En líneas generales el dupilumab demostró una mayor eficacia que el placebo en todos los niveles de dosis. En la semana 16 las puntuaciones obtenidas en el índice EASI mejoraron notablemente en los grupos en tratamiento con dupilumab, comparado con los grupos que recibieron placebo. El cambio porcentual medio ajustado por mínimos cuadrados en las puntuaciones obtenidas en el índice EASI fue del –74% (300mg/una vez por semana), –68% (300mg/cada 2 semanas), –65% (200mg/cada 2 semanas), –64% (300mg/cada 4 semanas) y –45% (100mg/cada 4 semanas) frente a un –18% para el placebo (p<0,0001 para todas las comparativas). Además, muchos más pacientes de los grupos en tratamiento con dupilumab alcanzaron puntuaciones de 0/1 en la escala IGA. También se observaron mejorías notables, tanto en las puntuaciones obtenidas en la Escala de dermatitis atópica (SCORAD) (de hasta el –56,9% con dosis de dupilumab de 300mg/una vez por semana vs un –13,8% para el placebo; p<0,0001 vs placebo) como en las puntuaciones obtenidas en las escala ASC (de hasta el –65,6% para dosis de dupilumab de 300mg/una vez por semana, vs un –7,7% para el placebo; p<0,0001 vs placebo)49,52. Además, dupilumab se asoció a una mejora del prurito en la primera semana. Salvo por la dosis de 100mg/cada 4 semanas, todas las dosis de dupilumab redujeron el cambio porcentual medio ajustado por mínimos cuadrados entre un 32,63% y un 46,9% a la semana 16 (p<0,0001 para cada comparativa)52. Dupilumab también mejoró la calidad de vida de los pacientes con DA, observándose mejoras dependientes de la dosis en el Índice de calidad de vida en dermatología (DLQI), desde que se inició el tratamiento hasta transcurridas 16 semanas, para todos los regímenes de dosis (p<0,0001), incluida la dosis de 100mg/cada 4 semanas52 (tabla 1).
Resultados de eficacia en estudios fase IIb y iii (SOLO-1 y -2) del dupilumab para el tratamiento de la dermatitis atópica en la semana 16
| Resultado | Estudio fase IIba,(sem 52) | |||||
|---|---|---|---|---|---|---|
| Dupilumab 300mg 1 vez/semana (n=63) | Dupilumab 300mg cada 2 semanas (n=64) | Dupilumab 200mg cada 2 semanas (n=61) | Dupilumab 300mg cada 4 semanas (n=65) | Dupilumab 100mg cada 4 semanas (n=65) | Placebo 1 vez/semana (n=61) | |
| IGA 0/1 | 21 (33%) | 19 (30%) | 17 (28%) | 14 (22%) | 8 (12%)* | 1 (2%) |
| Puntuación en la escala EASI, cambio porcentual medio ajustado por MC con respecto al inicio del tratamiento | –73,7% (5,2) | –68,2% (5,1) | –65,4% (5,2) | –63,5% (4,9) | –44,8% (5,0) | –18,1% (5,2) |
| Puntuaciones de máximo prurito en la escala NRS, cambio porcentual medio ajustado por MC con respecto al inicio del tratamiento | –46,90% (4,61) | –40,06% (4,54) | –34,12% (4,72) | –32,63% (4,52) | –15,67% (4,49) | 5,15% (4,77) |
| Puntuación en la escala SCORAD, cambio porcentual medio ajustado por MC con respecto al inicio del tratamiento | –56,9% (4,1) | –51,2% (4,1) | –46,0% (4,1) | –48,8% (4,0) | –26,6% (4,0)* | –13,8% (4,1) |
| Puntuación en la escala ASC, cambio porcentual medio ajustado por MC con respecto al inicio del tratamiento | –65,6% (6,7) | –52,1% (6,6) | –54,5% (6,7) | –48,8% (6,4) | –26,2% (6,4)* | –7,7% (6,7) |
| Puntuación en la escala DLQI, cambio porcentual medio ajustado por MC con respecto al inicio del tratamiento | –59,0% (7,14) | –39,6% (7,01) | –43,3% (7,18) | –37,4% (6,88) | –11,9% (6,88)** | 2,6% (7,34) |
| Resultado | SOLO 1a,(sem 54) | SOLO 2a,(sem 54) | ||||
|---|---|---|---|---|---|---|
| Dupilumab 300mg 1 vez cada 2 semanas (n=224) | Dupilumab 300mg todas las semanas (n=223) | Placebo (n=224) | Dupilumab 300mg 1 vez cada 2 semanas (n=233) | Dupilumab 300mg todas las semanas (n=239) | Placebo (n=236) | |
| IGA 0/1 | 85 (38%) | 83 (38%) | 23 (10%) | 84 (36%) | 87 (36%) | 20 (8%) |
| Puntuación en la escala EASI, cambio porcentual medio ajustado por MC con respecto al inicio del tratamiento | –72,3% (2,6) | –72,0% (2,6) | –37,6% (3,3) | –67,1% (2,5) | –69,1% (2,5) | –30,9% (3,0) |
| Puntuaciones de máximo prurito en la escala NRS, cambio porcentual medio ajustado por MC con respecto al inicio del tratamiento | –51,0% (2,5) | –48,9% (2,6) | –26.1% (3,0) | –44,3% (2,3) | –48,3% (2,4) | –15,4% (3.0) |
| Puntuación en la escala SCORAD, cambio porcentual medio ajustado por MC con respecto al inicio del tratamiento | –57,7% (2,1) | –57,0% (2,1) | –29,0% (3,2) | –51,1% (2,0) | –53,5% (2,0) | –19,7% (2,5) |
| Puntuación en la escala ASC, cambio porcentual medio ajustado por MC con respecto al inicio del tratamiento | –33,4 (1,4) | –34,3 (1,4) | –15,4 (1,9) | –30,6 (1,3) | –32,1 (1,3) | –12,6 (1,6) |
| Puntuación en la escala DLQI, cambio porcentual medio ajustado por MC con respecto al inicio del tratamiento | –9,3 (0,4) | –9,0 (0,4) | –5,3 (0,5) | –9,3 (0,4) | –9,5 (0,4) | –3,6 (0,5) |
| Puntuación en la escala HADS, cambio porcentual medio ajustado por MC con respecto al inicio del tratamiento | –5,2 (0,5) | –5,2 (0,5) | –3,0 (0,7) | –5,1 (0,4) | –5,8 (0,4) | –0,8 (0,4) |
Los datos se presentan en porcentajes (n), cambio porcentual medio ajustado por MC con respecto al inicio del tratamiento (EE) o cambio medio ajustado por MC con respecto al inicio del tratamiento (EE).
ASC: Área de superficie corporal; DLQI: Índice de calidad de vida en dermatología; EASI: Índice de severidad y área de eccema; EE: error estándar; HADS: Escala de ansiedad y depresión hospitalaria; IGA: Escala de evaluación global del investigador; MC: mínimos cuadrados; NRS: Escala de gradación numérica; SCORAD: Escala de dermatitis atópica.
Dos estudios fase iii, doble ciegos, aleatorizados, controlados por placebo, de idéntico diseño y de 16 semanas de duración evaluaron los perfiles de seguridad y eficacia del dupilumab.
En el estudio SOLO 1 671 individuos fueron aleatorizados para recibir placebo (n=224), una dosis de dupilumab de 300mg/una vez por semana (n=224) o la misma dosis de dupilumab cada 2 semanas alternando con placebo (n=223)54. Las puntuaciones de 0/1 en la escala IGA en la semana 16 se alcanzaron en el 38% y 37% de los pacientes que recibieron dupilumab cada 2 semanas y una vez por semana, respectivamente, frente al 10% de los pacientes que recibieron placebo (p<0,001). Las mejoras medias observadas en la escala EASI fueron de, aproximadamente, el 70% en ambos grupos en tratamiento con dupilumab, alcanzando el 51% y 52% de los pacientes en tratamiento con dupilumab cada 2 semanas y una vez por semana, respectivamente (p<0,001 vs placebo), un EASI-75 en la semana 1654. Asimismo, en la semana 16 el cambio porcentual medio ajustado por mínimos cuadrados con respecto al inicio del tratamiento fue del –51,0% y –48,9% en la escala NRS de máximo prurito y del –57,7% y –57,0% en la escala SCORAD, también en la semana 16, en los grupos que recibieron dupilumab cada 2 semanas y una vez por semana, respectivamente (p<0,001 vs placebo)54.
En el estudio SOLO 2 un total de 708 pacientes fueron aleatorizados en 3 grupos que recibieron placebo (n=236), una dosis de dupilumab de 300mg/una vez por semana (n=239), o la misma dosis de dupilumab cada 2 semanas alterando con placebo (n=233)54. En la semana 16 el punto final de obtener una puntuación de 0/1 en la escala IGA lo alcanzaron el 36% de los pacientes en ambos regímenes de dosis de dupilumab, frente al 20% de los pacientes del grupo que recibió placebo (p<0,001). En la semana 16 pudo confirmarse un EASI-75 en el 44% y 48% de los pacientes que recibieron dupilumab cada 2 semanas y una vez por semana, respectivamente (p<0,001 vs placebo). El cambio porcentual medio por mínimos cuadrados con respecto al inicio del tratamiento fue del –44,3% y –48,3% en la escala NRS de máximo prurito y del –51,1% y –53,5% en la escala SCORAD, en la semana 16, en los grupos que recibieron dupilumab cada 2 semanas y una vez por semana, respectivamente (p<0,001 vs placebo). Además, en ambos estudios, las puntuaciones obtenidas en las escalas ASC y DLQI experimentaron, también, mejoras importantes en la semana 16 con todos los regímenes de dosis de dupilumab.
En ambos ensayos SOLO se observó un impacto importante en la calidad de vida de los pacientes, confirmándose remisiones importantes de los síntomas de ansiedad y depresión en la Escala de ansiedad y depresión hospitalaria54 (tabla 1).
Ensayo clínico LIBERTY AD CHRONOSSe llevó a cabo un estudio fase iii, doble ciego, aleatorizado, controlado por placebo, en pacientes adultos con DA de carácter moderado-grave a fin de evaluar los perfiles de seguridad y eficacia del dupilumab más GCT. Setecientos cuarenta pacientes fueron aleatorizados en 3 grupos que recibieron placebo (n=315) o dupilumab 300mg/una vez por semana (n=319) o una vez cada 2 semanas (n=106), más GCT. Se obtuvo una puntuación de 0/1 en la escala IGA en la semana 16 en el 39% de los pacientes de ambos grupos en tratamiento con dupilumab, frente al 12% de los pacientes del grupo que recibió placebo (p<0,0001 vs placebo); el 64% de los pacientes que recibieron dupilumab una vez por semana y el 69% de los que lo recibió una vez cada 2 semanas alcanzó un EASI-75 en la semana 16, frente al 23% de los pacientes del grupo de control (p<0,0001 vs placebo)55; más de la mitad de los pacientes en tratamiento, en ambos grupos, con dupilumab alcanzó una mejoría en la escala NRS de máximo prurito de 4 o más puntos en la semana 16, frente al 20% de los pacientes que recibió placebo (p<0,0001 vs placebo). Se observó una eficacia idéntica en la semana 52 para estos 3 puntos finales clínicos. Dupilumab también mejoró todos los demás índices en las semanas 16 y 52, incluidas las escalas SCORAD, ASC y DLQI (tabla 2). Comparado con el placebo, el dupilumab también se asoció con más días sin GCT, con índices más bajos de uso de fármacos de rescate y a un descenso de los brotes de DA en un período de tratamiento de 52 semanas de duración55.
Resultados de eficacia en un estudio fase iii de dupilumab para el tratamiento de la dermatitis atópica, LIBERTY AD CHRONOS, en las semanas 16 y 52
| Resultado | LIBERTY AD CHRONOSa,(sem 55) | |||||
|---|---|---|---|---|---|---|
| Semana 16 | Semana 52 | |||||
| Dupilumab 300mg cada 2 semanas+GCT (n=106) | Dupilumab 300mg 1 vez/semana+GCT (n=319) | Placebo 1 vez/semana+GCT (n=315) | Dupilumab 300mg cada 2 semanas+GCT (n=89) | Dupilumab 300mg 1 vez/semana+GCT (n=270) | Placebo 1 vez/semana+GCT (n=264) | |
| IGA 0/1 | 39% (41) | 39% (125) | 12% (39) | 36% (32) | 40% (108) | 13% (33) |
| EASI-75 | 69% (73) | 64% (204) | 23% (73) | 65% (58) | 64% (173) | 22% (57) |
| Puntuación en la escala EASI, cambio porcentual medio ajustado por MC con respecto al inicio del tratamiento | –76,7% (3,77) | –77,3% (2,22) | –43,2% (2,26) | –78,3% (4,44) | –80,3% (82,64) | –45,8% (2,70) |
| Puntuaciones de máximo prurito en la escala NRS, cambio porcentual medio ajustado por MC con respecto al inicio del tratamiento | –56,2% (3,38) | –54,8% (1,99) | –28,6% (2,03) | –56,2% (4,38)* p=0,0001 | –54,4% (2,60) | –27,1% (2,66) |
| Puntuación en la escala SCORAD, cambio porcentual medio ajustado por MC con respecto al inicio del tratamiento | –62,1% (2,61) | –63,35 (1,53) | –31,8% (1,55) | –66,2% (3,14) | –66,1% (1,85) | –34,1% (1,88) |
| Puntuación en la escala ASC, cambio porcentual medio ajustado por MC con respecto al inicio del tratamiento | –38,6 (1,88) | –37,4 (1,11) | –18,6 (1,13) | –41,5 (2,19) | –39,9 (1,30) | –20,3 (1,33) |
| Puntuación en la escala DLQI, cambio porcentual medio ajustado por MC con respecto al inicio del tratamiento | –9,7 (0,51) | –10,5 (0,30) | –5,3 (0,31) | –10,9 (0,59) | –10,7 (0,36) | –5,6 (0,36) |
| Puntuación en la escala HADS, cambio porcentual medio ajustado por MC con respecto al inicio del tratamiento | –4,9 (0,56)** p=0,03 | –5,2 (0,33)* p=0,0004 | –3,6 (0,34) | –5,3 (0,65)* p=0,0109 | –5,5 (0,39) | –3,4 (0,40) |
Los datos se presentan en tantos pòrcentajes (n), cambio porcentual medio ajustado por MC con respecto al inicio del tratamiento (EE) o cambio medio ajustado por MC con respecto al inicio del tratamiento (EE).
ASC: área de superficie corporal; DLQI: Índice de calidad de vida en dermatología; EASI: Índice de severidad y área de eccema; EE: error estándar; HADS: Escala de ansiedad y depresión hospitalaria; IGA: Escala de evaluación global del investigador; MC: mínimos cuadrados; NRS: Escala de gradación numérica; SCORAD: Escala de dermatitis atópica.
El dupilumab se toleró bien y presenta un perfil favorable de seguridad en todos los estudios, clasificándose la mayoría de episodios adversos (EA) como episodios de carácter leve o moderado y transitorios en su duración. Los EA de carácter grave fueron, por regla general, poco comunes en todos los estudios51,52,54 (tablas 3 y 4).
Episodios adversos en las fases i (M4A y M4B) y IIa (M12 y C4) de los estudios de dupilumab para el tratamiento de la dermatitis atópica
| EA | Ambos estudios M4 A y M4B(sem 49) (sem 51) | M12(sem 49) (sem 51) | C4(sem 49) (sem 51) | |||
|---|---|---|---|---|---|---|
| Dupilumab (n=51) | Placebo (n=16) | Dupilumab (n=55) | Placebo (n=54) | Dupilumab+GCT (n=21) | Placebo+GCT (n=10) | |
| Cualquier EA | 44 (86%) | 14 (88%) | 42 (76%) | 43 (80%) | 12 (57%) | 7 (70%) |
| EA graves | 1 (2%) | 1 (6%) | 1 (2%) | 7 (13%) | 0 | 1 (10%) |
| EA que obligaron a interrumpir el estudio | 0 | 1 (6%) | 1 (2%) | 3 (6%) | 0 | 1 (10%) |
| Infecciones de la piel | 2 (4%) | 2 (13%) | 3 (5%) | 13 (24%) | 1 (5%) | 1 (10%) |
Estos resultados se expresan en número de pacientes (porcentaje).
EA: episodios adversos.
(sem 49) Datos recopilados en la semana 49.
(sem 51) Datos recopilados en la semana 51.
Episodios adversos en las fases IIb y III (SOLO 1 y 2 y LIBERTY AD CHRONOS) de los estudios de dupilumab para el tratamiento de la dermatitis atópica
| EA | Fase IIb (sem 52) | SOLO 1 y SOLO 2 (sem 54) | LIBERTY AD CHRONOS (sem 55) | |||
|---|---|---|---|---|---|---|
| Dupilumab (todos los grupos de dosis incluidos) (n=318) | Placebo (n=61) | Dupilumab (todos los grupos de dosis incluidos) (n=920) | Placebo (n=460) | Dupilumab (todos los grupos de dosis incluidos) (n=415) | Placebo (n=315) | |
| Al menos un EA | 258 (81%) | 49 (80%) | 628 (68%) | 313 (69%) | 358 (86%) | 266 (84%) |
| Al menos un EA grave | 12 (4%) | 4 (7%) | 21 (2%) | 24 (5%) | 13 (3%) | 16 (5%) |
| EA que obligaron a interrumpir el estudio | 21 (7%) | 3 (5%) | 13 (1%) | 7 (2%) | 11 (3%) | 24 (8%) |
| Reacciones en el punto de inyección | 22 (7%) | 2 (3%) | 123 (13%) | 28 (6%) | 66 (16%) | 24 (8%) |
| Nasofaringitis | 89 (28%) | 16 (26%) | 87 (9%) | 39 (9%) | 85 (20%) | 61 (19%) |
| Infección de vías respiratorias altas | 23 (7%) | 11 (18%) | 33 (4%) | 10 (2%) | 54 (13%) | 32 (10%) |
| Infecciones herpéticas | 26 (8%) | 1 (2%) | 46 (5%) | 17 (4%) | 30 (7%) | 25 (8%) |
| Infecciones de la piel | 21 (7%) | 5 (8%) | 55 (6%) | 44 (10%) | 38 (9%) | 56 (18%) |
| Conjuntivitisa | 21 (7%) | 2 (3%) | 60 (7%) | 7 (2%) | 76 (18%) | 25 (8%) |
| Exacerbación de la DA | 54 (17%) | 11 (18%) | 121 (13%) | 148 (32%) | 72 (17%) | 144 (46%) |
| Cefalea | 34 (11%) | 2 (3%) | 73 (8%) | 24 (5%) | 29 (7%) | 19 (6%) |
DA: dermatitis atópica; EA: episodios adversos.
Estos resultados se expresan en número de pacientes (porcentaje). Los EA descritos aquí sobrevinieron en el 5% de los pacientes de cualquier grupo de estudio.
En los estudios fase i-iii los EA más frecuentes fueron nasofaringitis, reacciones en el punto de inyección, cefalea, exacerbación de la DA e infecciones de la piel. En todos estos ensayos la incidencia de la nasofaringitis estuvo equilibrada entre el grupo que recibió dupilumab y el que recibió placebo, mientras que las exacerbaciones de la DA y las infecciones de la piel fueron más comunes en los pacientes que recibieron placebo54.
Los efectos adversos de carácter grave fueron más habituales con el placebo que con el dupilumab en todos los estudios, así como los efectos adversos de carácter grave de infecciones de la piel, arrojando una incidencia, en todos los estudios fase i y IIa, 4 veces más alta que la incidencia descrita en los grupos a tratamiento con dupilumab (0,20 vs 0,05, respectivamente)51. En un estudio fase IIb tanto las exacerbaciones de la DA de carácter grave (del 2% en ambos grupos) como las infecciones serias (<1% con dupilumab vs 0% con placebo) fueron similares y raras en los 2 grupos52. En los ensayos SOLO-1 y -2 las infecciones de la piel sobrevinieron en, aproximadamente, el 6% de los pacientes que recibieron dupilumab, y en el 8-11% de los pacientes que recibieron placebo, si bien el dupilumab no se asoció a un mayor riesgo total de infecciones en el ensayo CHRONOS54,55.
Las infecciones herpéticas fueron más habituales en los sujetos que recibieron dupilumab que en los que recibieron placebo en un estudio fase IIb (del 8% vs 2%, respectivamente), en los estudios SOLO-1 y -2 (del 5% en ambos estudios vs 4% y 3%, respectivamente), así como en el estudio CHRONOS (del 7% vs 8%, respectivamente). Hallazgo que no se reportó en ensayos fase i y IIa.
Se observó una mayor incidencia de conjuntivitis en los grupos a tratamiento que en los que recibieron placebo en un estudio fase IIb (del 7% vs 3%, respectivamente) en los estudios SOLO-1 y -2 (del 8% y 5% vs 2% y 1%, respectivamente), así como en el CHRONOS (del 18% vs 8%, respectivamente), siendo la mayoría de los casos de carácter entre leve y moderado52,55. Solo 2 pacientes en tratamiento con dupilumab interrumpieron el tratamiento del estudio por presentar cuadros de conjuntivitis56.
No sobrevino ninguna muerte en los estudios fase i y ii, pero sí 3 muertes en los estudios fase iii, aunque parece que ninguna asociada al tratamiento con dupilumab.
Los episodios adversos de carácter grave que hicieron que se abandonara el fármaco y el estudio fueron pocos en todos los estudios, sobreviniendo la mayoría de ellos con el placebo, salvo en un estudio fase IIb (del 7% con dupilumab vs 5% con placebo). En el estudio CHRONOS la mitad de los pacientes abandonó el estudio por presentar brotes de DA en el grupo en tratamiento con placebo, por uno que presentó conjuntivitis en el grupo que recibió dupilumab una vez por semana.
DiscusiónLos datos de los ensayos sobre el dupilumab de más de 2.000 pacientes vienen a confirmar su eficacia clínica en pacientes adultos con DA de carácter entre moderado y grave. La solidez de estos hallazgos viene avalada por importantes mejoras en varios índices de eficacia, incluidos las escalas EASI, IGA, ASC, la escala de gradación numérica NRS de máximo prurito y la escala DLQI52. Se obtuvo una respuesta EASI-75 en más de la mitad de los pacientes inscritos en todos los ensayos, alcanzándose una puntuación de 0/1 en la escala IGA con mayor frecuencia en todos los grupos del estudio en tratamiento con dupilumab. También se observó un importante y significativo descenso del cuadro de prurito con el tratamiento con dupilumab y marcados descensos en los síntomas de ansiedad y depresión. Como el prurito es un importante factor que contribuye al impacto negativo que tiene la DA en la calidad de vida de los pacientes, el dupilumab podría tener beneficios que cambiarían tanto la calidad de vida como la salud mental de muchos de estos pacientes.
En líneas generales, el dupilumab se toleró bien y tuvo un perfil de seguridad favorable en todos los estudios, clasificándose la mayoría de EA como episodios de carácter entre leve o moderado, con un índice similar en los pacientes que recibieron placebo y sin efectos tóxicos limitados por la dosis. Las infecciones herpéticas sobrevinieron con mayor frecuencia en los pacientes tratados con dupilumab, si bien, hasta la fecha, el bloqueo de la señalización de las interleucinas IL-4 y IL-13 no se ha considerado como un posible factor de riesgo para estas infecciones52,54. Además, los pacientes con DA corren un mayor riesgo de desarrollar infecciones cutáneas que la población general, presumiblemente debido a una disrupción de la barrera epidérmica. Resulta interesante que se observaran infecciones cutáneas con mayor frecuencia en los grupos en tratamiento con placebo, porque las perturbaciones cutáneas no se trataron26. Dupilumab podría no ser inmunosupresor ni asociarse a un mayor riesgo de infecciones, aunque sí que sería capaz de restaurar tanto la barrera epidérmica como la función inmunológica55. Se observó una mayor incidencia de conjuntivitis alérgica y no alérgica en todos los estudios, aunque la causa no termina de estar clara. La conjuntivitis sobrevino con mayor frecuencia en pacientes con enfermedad grave o conjuntivitis alérgica coexistente, siendo la inmensa mayoría de carácter entre leve y moderado, y resolviéndose durante el tratamiento del estudio55,56; se trata de un EA que no aumentó con el dupilumab en estudios con pacientes asmáticos ni con poliposis nasal, lo cual sugiere que existe un mecanismo específico asociado a la DA y no un efecto inherente al dupilumab54–57. Parece existir una relación inversa entre las concentraciones en suero de dupilumab y la conjuntivitis, sugestivo de que un tratamiento insuficiente local podría desempeñar un papel en todo esto56.
Resulta difícil extrapolar los datos del dupilumab a niños, la población más vulnerable, si bien ahora mismo hay en marcha sendos estudios fase IIa y iii con niños (los estudios NCT02407756 y NCT02612454) cuyos resultados ayudarán a determinar cuál es la eficacia del dupilumab en este grupo de edad. Además, se necesitan datos de seguimiento a largo plazo procedentes de estudios y registros de extensión para excluir la presencia de EA raros y poder evaluar los perfiles de eficacia, tolerabilidad y seguridad de un tratamiento a largo plazo con dupilumab.
Otros fármacos en fase de prueba en pacientes con DA son: 1) nemolizumab (anti-IL-31), con resultados de un estudio fase ii que revelan un importante descenso de los indicadores de prurito frente al placebo, con ciertos descensos en otros parámetros clínicos asociados a la DA58; 2) tralokinumab y lebrikizumab (anti-IL-13), que hasta la fecha han demostrado buenos perfiles de seguridad; 3) tezepelumab (anti-TSLP), un antagonista del ligando OX40, ILV-094 (anti-IL-22), secukinumab (anti-IL-17), omalizumab (receptor de la inmunoglobulina E anti-Fc), apremilast (anti-PDE4) e inhibidores de la JAK tofacitinib y baricitinib, en estudios en curso de los que todavía no hay resultados; y 4) tocilizumab (receptor de la IL-6/antagonista de la IL-6R). Todos estos fármacos vienen a confirmar mejoras notables en los índices clínicos de la DA, aunque se han descrito índices de infección más altos59. Estos agentes son prometedores para el tratamiento de la DA, aunque necesitamos estudios más extensos que nos ayuden a evaluar qué papel pueden desempeñar en el tratamiento de esta enfermedad cutánea.
El dupilumab puede llegar a revolucionar el manejo de la DA durante los próximos años, posibilitando un abordaje terapéutico dirigido en la práctica clínica, algo parecido a lo ocurrido con la psoriasis hace varios años. Dupilumab podría llegar a ser para la DA lo que los inhibidores del TNF-α fueron para la psoriasis: tratamientos seguros y efectivos que podrían ser un salto cualitativo en la capacidad de los médicos de mejorar las vidas de sus pacientes60. Los próximos años puede que la carga económica de los sistemas sanitarios se vea aliviada con el uso del dupilumab como fármaco sistémico para el manejo de la DA, si bien este probablemente se reserve para casos graves de DA que no responden a los tratamientos tradicionales, aunque se muestre superior en los ensayos clínicos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.