En la actualidad, las infecciones de transmisión sexual ulcerativas, que incluyen la sífilis, el virus del herpes simple (VHS), el linfogranuloma venéreo (LGV), el chancroide, la donovanosis y, más recientemente, el monkeypox (MPOX), representan un desafío creciente para los profesionales sanitarios.
La incidencia de sífilis y LGV ha aumentado en los últimos años en España. Además VHS, sífilis y chancroide son infecciones que pueden incrementar el riesgo de la adquisición y transmisión de VIH. Los grupos poblacionales con mayor vulnerabilidad ante estas infecciones son jóvenes, hombres que tienen sexo con hombres (HSH) y trabajadores del sexo comercial.
Es importante realizar un diagnóstico diferencial oportuno, ya que las lesiones ulcerativas genitales, anales, perianales y orales pueden plantear diagnóstico diferencial con otras condiciones infecciosas y no infecciosas, como vulvovaginitis candidiásica, lesiones traumáticas, carcinoma, aftas, enfermedad de Behçet, eritema fijo medicamentoso o psoriasis. Por este motivo, el dermatólogo tiene un papel crucial en el diagnóstico y el tratamiento de las infecciones de transmisión sexual.
En el presente capítulo se exponen las principales características epidemiológicas, clínicas y terapéuticas de dichas infecciones.
Currently, ulcerative sexually transmitted infections, including syphilis, herpes simplex virus (HSV), lymphogranuloma venereum (LGV), chancroid, donovanosis and, more recently, monkeypox (MPOX), represent a growing challenge for health care professionals.
The incidence of syphilis and LGV has increased in recent years in Spain. Additionally, HSV, syphilis and chancroid can also increase the risk of HIV acquisition and transmission. The population groups most vulnerable to these infections are young people, men who have sex with men (MSM) and commercial sex workers.
It is important to make a timely differential diagnosis since genital, anal, perianal, and oral ulcerative lesions may pose differential diagnosis with other infectious and non-infectious conditions such as candidiasis vulvovaginitis, traumatic lesions, carcinoma, aphthous ulcers, Behçet's disease, fixed drug eruption, or psoriasis. For this reason, the dermatologist plays a crucial role in the diagnosis and management of sexually transmitted infections.
This chapter presents the main epidemiological, clinical and therapeutic features associated with these infections.
El desarrollo de estas guías se justifica por el aumento creciente de las infecciones de transmisión sexual (ITS), particularmente entre adolescentes, hombres que tienen sexo con hombres (HSH) y trabajadores del sexo comercial.
Es importante realizar un diagnóstico diferencial adecuado en cada caso, aplicar las técnicas microbiológicas oportunas en función de la exposición sexual, así como el tratamiento eficaz para cada una de ellas1.
Sífilis / LúesDada su relevancia tanto clínica como epidemiológica, la etiopatogenia y las manifestaciones clínicas de la sífilis se abordarán en el capítulo «Guías de manejo de sífilis» (que estará disponible en próximas publicaciones de esta revista), incluyendo en este apartado solo su diagnóstico y tratamiento.
DiagnósticoEl método definitivo para el diagnóstico tanto de la sífilis primaria como la congénita es la identificación del Treponema pallidum en campo oscuro o por la aplicación de test moleculares (PCR) en una lesión exudativa o tejido; sin embargo, estas técnicas no tienen una distribución universal y solo se cuenta con ellas en centros específicos, por lo cual el diagnóstico de la sífilis en cualquiera de sus estadios se sigue basando en la realización de las pruebas serológicas treponémicas y no treponémicas2.
Las pruebas treponémicas (T.pallidum passive particle agglutination [TP-PA] assay o FTA-ABS, etc.) son las más específicas y son las primeras en positivizarse; sin embargo, una vez positivas no vuelven a negativizarse (en la mayoría de los casos), por lo cual sus fluctuaciones no sirven ni para seguimiento ni para nuevos diagnósticos3. En cuanto a las pruebas no treponémicas (Venereal Disease Research Laboratory [VDRL] o Rapid Plasma Reagin [RPR] test), son las más sensibles, por lo que pueden tener falsos positivos con más frecuencia y pueden tardar unos días más en positivizarse que las treponémicas; sin embargo, con el tratamiento adecuado pueden negativizarse, por lo que sus fluctuaciones y nuevas positividades sirven tanto para el seguimiento como el diagnóstico de nuevas infecciones4.
Para el diagnóstico correcto se requiere la realización de ambas pruebas.
Para considerar bien tratada una infección se requiere una disminución en mínimo 2 diluciones (por ejemplo, 1:16 a 1:4, 1:32 a 1:8) a los 6 meses del tratamiento. Se recomienda que se utilice la misma prueba tanto en el diagnóstico como en el seguimiento y a poder ser en el mismo laboratorio3 (2,C).
Si ambas pruebas son positivas, se procede a realizar el tratamiento según en el estadio clínico que se encuentre el paciente; si la prueba treponémica es positiva y la no treponémica es negativa, se aconseja realizar otra prueba treponémica por un método diferente; si continua siendo positiva y hay antecedente previo de sífilis, no se recomienda ampliar estudio; si no hay antecedente previo y/o la sospecha clínica o epidemiológica es alta, se recomienda volver a testar a las 2-4 semanas, remarcando la importancia de la abstinencia sexual hasta la resolución del caso2.
TratamientoEl tratamiento de la sífilis se realiza según el estadificación (tabla 1). En todos los casos el antibiótico de elección es la penicilina parenteral, cuya eficacia es avalada por la amplia experiencia clínica y por estudios clínicos. Existen algunas situaciones en las cuales se admite la administración de otro antibiótico, siendo más estrictos en el seguimiento posterior.
Tratamiento de la sífilis según estadio y su grado de evidencia
| Sífilis temprana (primaria, secundaria y latente temprana) |
| 1.a línea: penicilina benzatínica 2.400.000 UI IM DU (1, B) |
| 2.a línea: penicilina procaínica 600.000 UI IM/ D 10-14 D cuando no hay disponibilidad de Penicilina Benzatínica) (1, C) |
| Trastorno coagulación: Ceftriaxona 1 g/D IV 10 D (1, C) o doxiciclina 200 mg D VO 14 D (1, C) |
| Embarazo: penicilina benzatínica 2.400.000 UI IM DU |
| Alergia penicilina: Doxiciclina 200 mg día 14 D VO (1, C) |
| Sífilis tardía (latente tardía, sífilis terciaria, gomas sifilíticos) |
| 1.a línea: penicilina benzatínica 2.400.000 UI IM / semana, 3 semanas (1, C) |
| 2.a línea: penicilina procaínica 600.000 UI IM/ D 17-21 D (cuando no hay disponibilidad de penicilina benzatínica (1, C) |
| Alergia penicilina: desensibilización (1, C) o doxiciclina 200 mg D VO 21-28 D (2, D) |
| Neurosífilis, sífilis ocular o sífilis auricular |
| 1.a línea: penicilina bencílica 18-24 millones UI D (3-4 millones cada 4h) IV 10-14 D |
| 2.a línea: ceftriaxona 1-2 g IV D 10-14 D |
| 3.a línea: penicilina procaínica 1,2-2,4 millones UI IM D +probenecid 500 mg 4 veces D por 10-14 D |
| Alergia penicilina: desensibilización (1, C) |
| Embarazo |
| 1.a línea: penicilina benzatínica 2.400.000 UI IM DU (1, B) |
| 2.a línea: penicilina procaínica 600.000 UI IM D 10-14 días (cuando no hay disponibilidad de penicilina benzatínica) (1, C) |
| Alergia: desensibilización +penicilina benzatínica 2.400.000 UI IM DU (1, C) |
| PWH igual que el resto de la población |
D día o días; DU: dosis única; IM intramuscular; IV: intravenosa; VO: vía oral.
Para la formulación de las recomendaciones hemos empleado la metodología GRADE.
- •
Contacto de paciente con sífilis temprana <90 días del contacto: tratar como sífilis temprana, aunque las pruebas serológicas sean negativas.
- •
Contacto de paciente con sífilis temprana >90 días del contacto: si pruebas negativas, no tratar; si pruebas positivas, tratar según su estadificación; si es un paciente con riesgo de pérdida de seguimiento, tratar como sífilis temprana.
- •
Contacto de paciente con sífilis tardía: si pruebas positivas, tratar según su estadificación particular.
Tabla 2.Seguimiento de la sífilis según sus estadios y su grado de evidencia
Sífilis temprana: VDRL/RPR 3, 6, 12 meses mínimo disminución 2 diluciones (4 veces). Si no disminución, valorar la posibilidad de neurosífilis (2, D) Sífilis tardía: VDRL/RPR pueden no negativizarse. No se recomienda seguimiento a menos que sea de alto riesgo de reinfección
La infección por herpes se caracteriza porque, tras la primoinfección, el virus permanece latente y puede reactivarse a lo largo de toda la vida2. Tanto el virus del herpes simple tipo1 (VHS1) como el tipo2 (VHS2) pueden afectar la zona genital, siendo el VHS2 el más frecuente. Muchos pacientes permanecen sin el diagnóstico debido a la baja sospecha en el caso de herpes pauci o asintomático, y son estos pacientes lo que están en alto riesgo de ser trasmisores de la infección.
El riesgo de transmisión parece ser más alto en los pródromos y las recurrencias, por lo que debe aconsejarse a los pacientes de abstenerse de tener contacto sexual durante estos periodos. La eficacia del preservativo en la prevención de la transmisión no está comprobada; sin embargo, datos indirectos apoyan su uso tanto en mujeres como en hombres5 (IIb,B).
ClínicaClínicamente se caracteriza por vesículas y úlceras dolorosas, recurrentes y auto-resolutivas. Se aconseja hacer el diagnóstico de confirmación con PCR siempre que sea posible, teniendo en cuenta que la mayoría de los pacientes se presentan en la consulta cuando ya han resuelto el brote6 (IIIb). Las recurrencias y las formas subclínicas en zona genital están descritas con mayor frecuencia con el VHS2 que con el VHS17.
DiagnósticoLa prueba diagnóstica recomendada es la PCR por su alta sensibilidad5 (Ib,A); dada la baja sensibilidad del cultivo, solo se aconseja utilizarlo como técnica diagnóstica cuando no se tenga disponibilidad de la PCR o para estudio de resistencias antivirales en casos refractarios. La muestra debe tomarse de la lesión activa8 (Ib,A); no se recomienda hacer tomas en zonas aleatorias dada su baja sensibilidad, y porque un resultado negativo no descarta la posibilidad de infección latente (Ib,A).
En cuanto a las serologías de VHS, solo se recomienda su utilización en los siguientes escenarios5:
- 1.
Pacientes con lesiones recurrentes o clínica atípica y que la PCR o el cultivo den repetitivamente negativos o no hayan podido realizarse (III,B).
- 2.
Para diferenciar entre un primer episodio o una recidiva con fines del asesoramiento y manejo (III,B).
- 3.
Pareja de pacientes con diagnóstico de VHS y que desconozcan si previamente han tenido las lesiones con fines de asesoramiento (Ib,A).
- 4.
Personas gestantes asintomáticas con pareja con historia de herpes (IIb,B).
El objetivo del tratamiento en la primoinfección es mejorar los síntomas y prevenir o disminuir la frecuencia de los brotes; y en las recurrencias, además, disminuir la posibilidad de transmisión. Hay que tener en cuenta que el tratamiento no tiene la capacidad de erradicar el virus. y no se ha demostrado que afecte la frecuencia ni la gravedad de los brotes sucesivos2.
Tratamiento en la primoinfecciónSe recomienda tratar a todos los pacientes que se diagnostiquen con una primoinfección herpética en los primeros 5días de la infección o mientras tenga lesiones activas5, por lo sintomáticas que suelen ser y, además, porque pueden presentar cursos larvados (tabla 3).
Tratamiento de la primoinfección por VHS
| Tratamiento primoinfección VHS (Ib, A) |
| Aciclovir 400 mgVO 3 vd 7-10 D (preferencia en embarazadas) |
| Famciclovir 250 mg VO 3 vd 7-10 D |
| Valaciclovir 1g VO 2vd 7-10 D |
| Aciclovir 200 mg VO 5 vd 7-10 D (no recomendado por bajo cumplimiento) |
D: día o días; VO: vía oral; vd: veces día.
No se recomienda el uso de tratamientos tópicos, ya que son menos efectivos que los orales y pueden generar resistencias9,10 (IV,C). La vía intravenosa se reserva solo para aquellos pacientes que no puedan realizar las tomas orales por trastornos funcionales o por vómito, y en pacientes inmunosuprimidos.
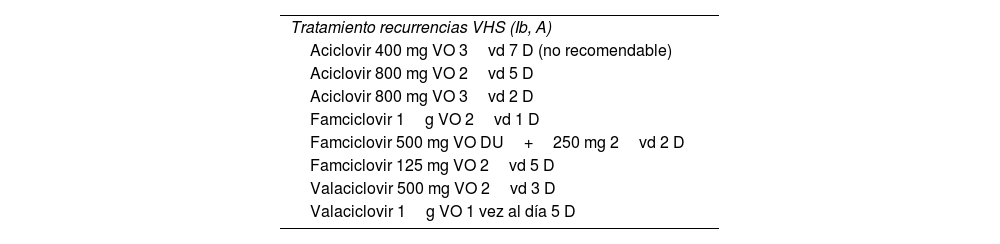
Tratamiento en las recurrenciasSuelen ser menos frecuentes las recidivas del VHS1 que el VHS2, de ahí la importancia del genotipado a la hora del consejo postinfección (tabla 4).
Tratamiento en las recurrencias VHS 2
| Tratamiento recurrencias VHS (Ib, A) |
| Aciclovir 400 mg VO 3vd 7 D (no recomendable) |
| Aciclovir 800 mg VO 2vd 5 D |
| Aciclovir 800 mg VO 3vd 2 D |
| Famciclovir 1g VO 2vd 1 D |
| Famciclovir 500 mg VO DU+250 mg 2vd 2 D |
| Famciclovir 125 mg VO 2vd 5 D |
| Valaciclovir 500 mg VO 2vd 3 D |
| Valaciclovir 1g VO 1 vez al día 5 D |
D: día o días; DU: dosis única; vd: veces día; VO: vía oral.
El momento ideal para iniciar el tratamiento es en el pródromo de la infección o en el primer día de la aparición de la lesión. El tratamiento de las recurrencias reduce la duración del brote en 1-2 días5 (Ib,A).
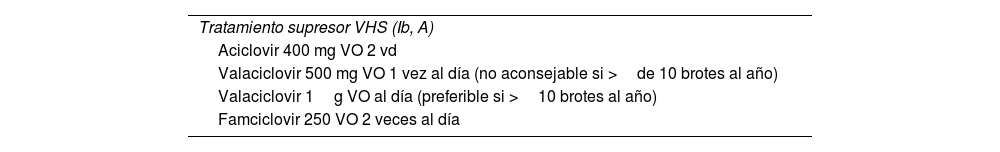
Tratamiento supresorSe debe consensuar con el paciente y realizarse en los casos en los que se confirme infección por VHS2 o VHS1 y se produzcan brotes frecuentes que impacten en la calidad de vida de este. El tratamiento puede disminuir la posibilidad de recidiva en un 70-80%5. Además, disminuye la excreción asintomática del virus2. Se han demostrado su seguridad y su eficacia a largo plazo2. Se recomienda el uso de terapia supresora en parejas serodiscordantes sintomáticas o con múltiples parejas5. No hay datos de efectividad en pacientes con VHS2 asintomáticos (tabla 5).
Consideraciones especialesManejo VHS en pacientes inmunodeprimidos y personas que viven con el VIH (people living with HIV [PWH]) (tabla 6). Otras situaciones especiales se consideran en la tabla 7.
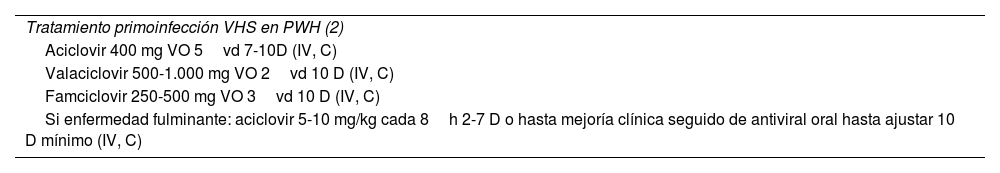
Consideraciones especiales, tratamiento primoinfección HSV en PWH
| Tratamiento primoinfección VHS en PWH (2) |
| Aciclovir 400 mg VO 5vd 7-10D (IV, C) |
| Valaciclovir 500-1.000 mg VO 2vd 10 D (IV, C) |
| Famciclovir 250-500 mg VO 3vd 10 D (IV, C) |
| Si enfermedad fulminante: aciclovir 5-10 mg/kg cada 8h 2-7 D o hasta mejoría clínica seguido de antiviral oral hasta ajustar 10 D mínimo (IV, C) |
vd: veces día; VO: vía oral.
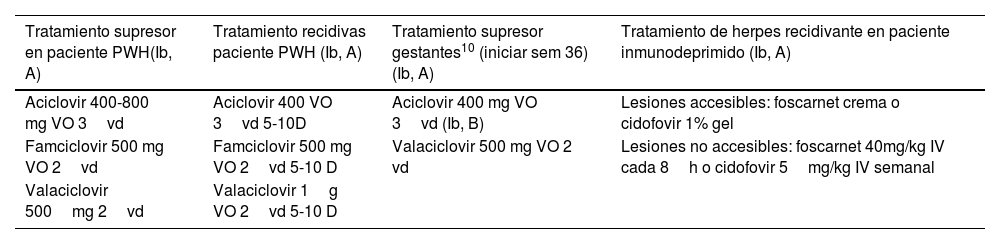
Otras consideraciones especiales
| Tratamiento supresor en paciente PWH(Ib, A) | Tratamiento recidivas paciente PWH (Ib, A) | Tratamiento supresor gestantes10 (iniciar sem 36) (Ib, A) | Tratamiento de herpes recidivante en paciente inmunodeprimido (Ib, A) |
|---|---|---|---|
| Aciclovir 400-800 mg VO 3vd | Aciclovir 400 VO 3vd 5-10D | Aciclovir 400 mg VO 3vd (Ib, B) | Lesiones accesibles: foscarnet crema o cidofovir 1% gel |
| Famciclovir 500 mg VO 2vd | Famciclovir 500 mg VO 2vd 5-10 D | Valaciclovir 500 mg VO 2 vd | Lesiones no accesibles: foscarnet 40mg/kg IV cada 8h o cidofovir 5mg/kg IV semanal |
| Valaciclovir 500mg 2vd | Valaciclovir 1g VO 2vd 5-10 D |
D: día o días; IV: intravenoso; vd: veces día; VO: vía oral.
El factor de riesgo más importante para la reactivación del VHS es el grado de inmunosupresión. Los esquemas de tratamiento con antivirales sistémicos han demostrado ser igual de eficaces en pacientes inmunosuprimidos; sin embargo, son mucho más frecuentes las resistencias a los antivirales en los pacientes PWH, lo que puede llevar a fracasos terapéuticos más frecuentes5.
Linfogranuloma venéreoEl linfogranuloma venéreo (LGV) es una infección de transmisión sexual causada por la bacteria Chlamydia trachomatis serotipos L1-L3, siendo el L2 y L2b el más común en Europa11,12. Desde 2003 es endémico en Europa entre hombres que tienen sexo con hombres (HSH)13, sobre todo en PWH14 (1,A), y desde 2015 se trata de una EDO en España.
ClínicaEl 25% de las infecciones por LGV en HSH son asintomáticas15. En sintomáticos, el período de incubación puede variar entre 1-4 semanas, describiéndose clásicamente tres etapas:
- •
Primera etapa. Pequeña pápula o pústula indolora que puede ulcerarse, auto-resolución en una semana. Puede haber secreción mucopurulenta, sobre todo si hay afectación rectal.
- •
Segunda etapa («etapa inguinal»). Linfadenopatía inguino-femoral dolorosa que aparece 2-6 semanas después de la lesión primaria, predominio unilateral (2/3 casos). Puede complicarse con inflamación, supuración y abscesos; algunos de estos pueden drenar espontáneamente. El signo del surco (patognomónico) se debe a la inflamación de ganglios inguinales y femorales separados por el ligamento inguinal.
- •
Tercera etapa («etapa ano-genito-rectal»). Inicialmente presentan proctocolitis, caracterizada por síntomas severos de dolor anorrectal, secreción hemopurulenta y rectorragia, junto con tenesmo y estreñimiento, seguidas de abscesos perirrectales, fístulas o estenosis rectal. Puede simular enfermedades inflamatorias intestinales crónicas, como la enfermedad de Crohn, tanto a nivel clínico como histopatológico, por lo que debe ser considerado en el diagnóstico diferencial. Sin tratamiento, puede complicarse con megacolon, y la linfangitis crónica progresiva con elefantiasis, estiómeno (enfermedad ulcerativa crónica de la vulva) o síndrome de la pelvis congelada. Actualmente, la forma de presentación más frecuente del LGV es en forma de proctitis sintomática en HSH, siendo infrecuente que se manifieste con úlceras genitales o adenopatías inflamatorias inguinales
Menos frecuentemente puede acompañarse de clínica sistémica, como febrícula, escalofríos, malestar, artromialgias, artritis reactiva, neumonitis y perihepatitis.
DiagnósticoEl diagnóstico inicial está basado en la sospecha clínica, pero debe confirmarse mediante la detección de ADN específico de la variedad LGV (L1, L2 y L3), a través de un procedimiento de dos pasos (1,B)16-18.
- •
Se utilizan pruebas de amplificación de ácidos nucleicos (NAAT) en muestras clínicas sospechosas.
- •
Si se detecta ADN/ARN de C.trachomatis, se debe detectar ADN específico de genovar de LGV.
Se recomienda iniciar precozmente el tratamiento, disminuyendo así las posibles complicaciones, como el megacolon y la linfangitis crónica progresiva (2,C) (tabla 8).
Tratamiento del linfogranuloma venéreo
| Tratamiento de primera elección | |
| Doxiciclina | Sintomáticos: 100 mg cada 12horas por 21 días, VO (1, B)19 |
| Asintomáticos: 100 mg cada 12 horas por 21 días, vía oral (1, C) o pauta cortaa 100 mg cada 12 horas por 7 días, VO (2, D)20 | |
| Tratamiento alternativob | |
| Azitromicina | 1 g monodosis o 1 g semanal durante 3 semanas, VO (2, D)21 |
| Eritromicina (elección en gestantes) | 400mg cada 6 horas por 21 días, VO (2, D) |
| Tratamiento quirúrgico | |
| Los bubones fluctuantes deben drenarse mediante aspiración con aguja a través de la piel (2, D). No se recomienda la incisión quirúrgica por el riesgo de complicaciones como formación crónica de cavidades (2, D) | |
D: día o días; VO vía oral.
En algunos casos se precisa tratamiento más prolongado si hay complicaciones como fístulas o bubones22.
El chancroide, o chancro blando, es una infección de transmisión sexual causada por la bacteria gramnegativa Haemophylus ducreyi23. Es más frecuente en países tropicales, aunque su incidencia ha ido disminuyendo incluso en la mayoría de los países donde previamente era endémica, exceptuando el norte de India y Malawi24,25.
ClínicaTras un período de incubación de 3-7 días, aparecen pequeñas pápulas eritematosas dolorosas que rápidamente progresan a pústulas y úlceras. Estas últimas se caracterizan por ser superficiales con bordes irregulares y socavados, con base granulomatosa y exudado purulento, que pueden permanecer durante meses si no se tratan. Hasta en un 50% se acompañan de adenopatías inguinales unilaterales dolorosas que pueden confluir hasta formar bubones.
DiagnósticoEl diagnóstico suele ser clínico (tabla 9), ya que el aislamiento de la bacteria en cultivo es difícil (sensibilidad <80%) (III,B)26. Las técnicas de amplificación de ácido nucleico, como la PCR, son las más empleadas, pudiendo realizarse el diagnóstico diferencial entre los diferentes agentes microbiológicos, como T.pallidum y VHS27,28 (III,B). El tratamiento se recoge en la tabla 10.
Diagnóstico probable de chancroide (según CDC)18
| Si se cumplen todos los siguientes criterios1) El paciente tiene una o más úlceras genitales dolorosas2) La presentación clínica, la aparición de úlceras genitales y, si están presentes, la linfadenopatía regional son típicas del chancroide3) El paciente no tiene evidencia de infección por T.pallidum por el examen de campo oscuro del exudado de la úlcera o por una prueba serológica para sífilis realizada al menos 7 días después del inicio de las úlceras4) Una prueba de PCR VHS1 o 2 o cultivo de VHS realizado en el exudado de la úlcera es negativo |
Tratamiento del chancroide
| Tratamiento de elección |
| Azitromicina 1 g vía oral monodosis (Ib, A) |
| Ceftriaxona 250 mg IM monodosis (Ib, A) |
| Tratamiento alternativo |
| Ciprofloxacino 500 mg cada 12horas VO por 3 días (Ib, B) |
| Eritromicina 500 mg cada 6horas VO por 7 días (Ib, B) |
IM: intramuscular; VO: vía oral.
Los pacientes deben ser reevaluados a los 3-7 días del tratamiento. El tiempo de curación dependerá del tamaño de la úlcera y de las adenopatías, y la evolución es más lenta en PWH y no circuncidados29.
Se aconseja realizar un estudio de contactos, incluyendo las parejas sexuales de los 10 días anteriores al inicio de los síntomas.
MPOXLa viruela del mono, o monkeypox (MPOX), es una enfermedad zoonótica emergente causada por un ortopoxvirus (virus ADN de doble cadena; género Orthopoxvirus, familia Poxviridae)30.
Se considera endémica en África central y occidental, donde se identificaron dos variantes: la de África central/valle del Congo (mortalidad alrededor del 10%) y la de África occidental (mortalidad del 3-4%)31-33.
En mayo de 2022 se identificaron varios casos de MPOX sin antecedentes de viajes recientes a áreas endémicas o de contacto con casos confirmados, lo que llevó a la OMS, el 23 de julio del mismo año, a declarar este último brote como una emergencia de salud pública internacional34. Al momento de la redacción de este artículo se habían reportado un total de 91.123 casos a nivel mundial, con 157 defunciones35. En Europa se han registrado 26.229 casos36, siendo España el país con más casos notificados, con un total de 7.611 casos35,36.
En áreas endémicas existen cuatro formas de transmisión de MPOX: mordedura o arañazos con animales infectados (ardillas, roedores, monos), contacto con sus fluidos, consumo de carne no suficientemente cocinada o humanos infectados. En este último caso la infección puede adquirirse por vía aérea (microgotas), contacto directo (heridas, costras, fluidos corporales) y contacto indirecto (fómites), aunque también se han descripto la vía vertical y la nosocomial37.
En el brote actual se considera que el mecanismo de transmisión principal es el contacto sexual38, siendo las personas más afectadas HSH, jóvenes (media edad de 34 años) y PWH (52,5%)35,36,38-42.
ClínicaEl período de incubación oscila entre 5-21 días43. El síntoma más frecuente es la fiebre35,36,38-42. Las manifestaciones clínicas se relacionan con el mecanismo de transmisión44:
- -
Vía respiratoria/clásica (forma endémica principalmente): inicialmente fiebre, cefalea, adenopatías, mialgias; posteriormente múltiples pápulas y pseudopústulas.
- -
Inoculación subcutánea: pseudopústulas bien circunscritas, profundas, a menudo umbilicadas, dolorosas, que tardan semanas en resolverse y que pueden acompañarse de edema local y linfadenopatía regional. También pueden presentar lesiones periorales/linguales o panadizos.
Se han registrado complicaciones en el 8,3% de los casos38-42, siendo las más frecuentes sobreinfección bacteriana, úlceras orales y proctitis/proctocolitis/proctalgia45-51.
DiagnósticoEl diagnóstico es clínico-epidemiológico y se confirma por PCR y/o secuenciación52.
En el análisis histopatológico pueden encontrarse cuerpos de inclusión citoplasmáticos acidófilos («cuerpos de Guarnieri»), que corresponden a agregados de partículas virales.
Dentro del diagnóstico diferencial se deben considerar: varicela, infección por herpes zoster, sarampión, zika, dengue, chikingunya, herpes simple, impétigo, MARSA, gonorrea diseminada o localizada, sífilis primaria o secundaria, chancroide, linfogranuloma venéreo, molusco contagioso.
TratamientoAl día de la fecha no existen tratamientos específicos aprobados por la FDA/EMA por los pacientes con MPOX, por lo que el tratamiento sintomático es el pilar de la terapia (tabla 11).
Tratamiento sintomático, medicamentos antivirales, vacunas y medidas preventivas recomendadas para MPOX
| Tratamiento sintomático |
| Antitérmicos |
| Antiinflamatorios no esteroideos (AINE) |
| Corticoides tópicos o sistémicos en caso de inflamación importante/mucositis |
| Analgésicos para atenuar el dolor |
| Un microambiente limpio y húmedo cubriendo las úlceras infecciosas puede mitigar el potencial de transmisión y promover la reepitelización del exantema |
| Antibioticoterapia si hay sobreinfección bacteriana |
| Medicamentos antivirales aprobados |
| Tecovirimat (único fármaco con indicación para el tratamiento de infecciones por ortopoxvirus, autorizado por la EMA) |
| Brincidofovir no está autorizado por la UE, pero sí por la FDA para el tratamiento de MPOX |
| Cidofovir: activo in vitro para la viruela; asociado a nefrotoxicidad. El uso tópico off-label parece tener efecto, reduciendo el tiempo de resolución de las lesiones y mejorando su resultado cosmético53 |
| Vacunas recomendadas |
| Vacuna contra la viruela: protección cruzada de hasta 85%54. El efecto protector disminuye con el tiempo |
| (>20 años). La profilaxis postexposición dentro de los 4 días iniciales puede prevenir la infección o reducir su gravedad55. Vacuna no replicante de tercera generación aprobada: Imvanex™ - Vaccinia Ankara modificada56,57 |
| Posología: inyección subcutánea 0,5ml dos dosis o régimen alternativo intradérmico de 0,1ml (con 28 días de diferencia entre ambas dosis)58 |
| Medidas de prevención/aislamiento59a |
| Aislamiento de contacto y respiratorioa |
| Permanecer en su propia habitación, no compartir artículos personales |
| Evitar contacto con personas inmunodeprimidas, gestantes, niños, mascotas o mamíferos |
| Utilizar mascarilla y cubrir lesiones en caso de tener que abandonar el domicilio |
| Realizar lavado e higiene de manos de forma frecuente |
| Abstinencia sexuala |
EMA: Agencia Europea Medicamento; FDA: Food And Drug Administration; UE: Unión Europea.
Infección genital infrecuente causada por la bacteria intracelular aerobia gramnegativa Klebsiella granulomatis. Actualmente los focos principales se encuentran en Papúa Nueva Guinea, Sudáfrica, parte de India y Brasil18,60.
Con un periodo de incubación de 50 días, se caracteriza por una o varias lesiones papulares firmes que inicialmente aumentan en tamaño y número, y posteriormente progresan a úlceras indoloras de predominio en la región genital/perianal (90%). Generalmente cursa sin linfadenopatía, y ocasionalmente se asocia a granulomas subcutáneos (pseudobubones)61. Las lesiones son altamente vascularizadas y con tendencia al sangrado/friables (por esta causa el riesgo de coinfección con VIH es alto)62.
ClínicaLas formas clínicas más frecuentes son la úlcero-granulomatosa, seguida de la hipertrófica/verrucosa, necrótica y esclerótica. La infección extragenital (6%) puede ocurrir a nivel pélvico, en órganos intraabdominales, en huesos o en la cavidad oral61.
DiagnósticoEl diagnóstico se puede realizar a través de la visualización de la bacteria en campo oscuro o microscopia directa con tinción Giemsa/Leishman/Wright (células grandes mononucleares con quistes intracitoplasmáticos llenos de cuerpos de Donovan), en biopsia de lesiones o por PCR con detección del ADN. Se trata de una bacteria difícil de cultivar61.
El estudio de contactos debería realizarse desde los 60 días60 a 6 meses18,61 previos al inicio de los síntomas.
El principal diagnóstico diferencial es el carcinoma escamoso de pene, que puede imitar o complicar la infección. Por esta razón, se recomienda biopsiar las lesiones persistentes.
TratamientoSu objetivo es frenar la progresión de las lesiones; la curación típicamente se inicia en los márgenes de la úlcera, requiriendo terapia prolongada para permitir granulación y re-epitelización. La duración en todos los casos será de 3 semanas como mínimo, debiendo mantenerse el tratamiento hasta la resolución de las lesiones61 (tabla 12).
Tratamiento del granuloma inguinal / donovanosis
| Tratamiento de primera línea |
| Azitromicina 1g VO una vez a la semana o 500mg/día (1B, en gestantes 1D) |
| Tratamientos alternativos |
| Doxiciclina 100 mg cada/12horas VO (1C)a |
| o |
| Eritromicina base 500mg cada/6horas VO (1C) |
| o |
| TMP-SMX 160/800 mg cada/12horas (2B)a |
| Gentamicina 1 mg/kg cada/8horas parenteral puede añadirse si hay una respuesta lenta de las lesiones (1C)a BASHH |
| Niños: azitromicina 20 mg/kg cada/24horas VO |
| Tratamiento profiláctico en neonatos (madres con lesiones) a igual dosis por 3 días (grado C, nivel IV) |
BASHH: British Association for Sexual Health and HIV; VO: vía oral.
Duración mínima de 3 semanas y hasta la curación total de las lesiones.
En el presente capítulo hemos expuesto las principales características epidemiológicas, clínicas y terapéuticas de las ITS ulcerativas de un modo didáctico, práctico y sencillo para el rápido acceso de los médicos dedicados a la atención de las ITS. El diagnóstico adecuado de las mismas facilitará el tratamiento precoz de las mismas, redundando en una disminución de los contagios.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.