La patología cutánea vulvar constituye un motivo frecuente de consulta en el momento actual. La vulva, al igual que el resto de la piel, puede verse afectada por múltiples enfermedades de diferentes etiologías, pero sus especiales condiciones anatómicas y fisiológicas hacen que tenga algunas peculiaridades que pueden suponer una dificultad añadida en su manejo. El estudio de la patología vulvar está emergiendo como una nueva área en la Dermatología. En este artículo, tras valorar la características de la vulva normal, sistematizaremos y realizaremos una breve revisión de las dermatosis inflamatorias vulvares, grupo heterogéneo de enfermedades en las que es clave un abordaje amplio y multidisciplinar.
Vulvar skin disease is a common reason for consultation. The vulva, like the rest of the skin, can be affected by numerous diseases of various etiologies, but its particular anatomic and physiologic characteristics create additional diagnostic and therapeutic difficulties. The study of vulvar disease is emerging as a new branch of dermatology. In this article, we examine the characteristics of the normal vulva, and perform a brief, structured review of vulvar inflammatory dermatoses, which comprise a heterogeneous group of diseases in which a broad, multidisciplinary approach is essential.
Los genitales externos de la mujer reciben el nombre de vulva. La palabra deriva de la palabra latina vulva, que significa envoltura, y se utilizaba para denominar al útero1. Se trata de un área topográfica cutánea específica, compleja, variable de una mujer a otra y que comprende varias estructuras anatómicas diferentes. Su complejidad, junto a las características morfológicas y funcionales de la misma (conjunción de sistemas urinario, genital y gastrointestinal en un área mucocutánea), condicionan una múltiple y variada patología que precisa un enfoque multidisciplinar con la colaboración de varias especialidades como Ginecología, Urología, Patología y Dermatología2.
Aunque las enfermedades vulvares son un motivo frecuente de consulta en el momento actual, por una parte los miedos y tabúes socioculturales de algunas mujeres, que tienden a ocultar o no consultar por sus síntomas, y por otro la falta de experiencia en la identificación de esta patología por algunos profesionales, y la «incomodidad» de la zona a explorar, ha conducido a la demora diagnóstica y terapéutica en muchas ocasiones.
Desde el punto de vista dermatológico, la vulva, al igual que el resto de la piel, puede verse afectada por múltiples enfermedades de diferentes etiologías, tanto específicas o predominantes de esta localización, como formando parte de un cuadro generalizado. Sin embargo, la patología vulvar reúne algunas peculiaridades: las condiciones de humedad, fricción y oclusión hacen que las características clínicas típicas se modifiquen. La sintomatología es a veces imprecisa (quemazón, escozor, prurito) y común a múltiples procesos diferentes. Pueden aparecer complicaciones secundarias (infecciones o lesiones por rascado) que dificulten la evaluación. La anamnesis debe ser cuidadosa. Las connotaciones sociales, los miedos a las patologías malignas o a las enfermedades de transmisión sexual y la afectación en la vida de pareja hacen que algunas mujeres se sientan solas, les sea difícil explicar su cuadro y suponga una demora en la consulta con la consiguiente aparición de procesos crónicos o avanzados. Es vital una buena relación médico-paciente, en la que la persona sea capaz de expresarse libremente, explicarles de manera sencilla la naturaleza de los síntomas3 e intentar evitar la frustración y la depresión, que son frecuentes en estos cuadros4. Por último, se recomienda tener en la consulta un esquema de la anatomía vulvar5 para que la paciente señale y se familiarice con la misma, documentación fotográfica o un espejo que la ayude en su autoexploración3.
Durante tiempo esta patología ha sido considerada «huérfana». Sin embargo, actualmente la vulvología está emergiendo como un área reconocida y cada vez más estudiada, con un enfoque amplio y multidisciplinar, en la que los dermatólogos somos un pilar fundamental en el diagnóstico y manejo terapéutico6.
Anatomía de la vulva normal y sus variaciones anatómicasLa vulva es el conjunto de los órganos genitales externos de la mujer. Se define como el área localizada en el triángulo perineal anterior y se encuentra delimitada por el monte de Venus anteriormente, el periné posteriormente, los pliegues inguinales lateralmente y el anillo himeneal medialmente7. Comprende varias estructuras anatómicas, siendo las principales el monte de Venus, los labios mayores, los menores, el surco interlabial, el clítoris, el capuchón o prepucio del clítoris, el vestíbulo o introito vaginal (desde la línea de Hart hasta el anillo himeneal), el meato uretral, las glándulas vestibulares mayores (o de Bartholino) en el tercio posterior del vestíbulo y las menores (o de Skene) a ambos lados del meato uretral8. La línea de Hart se encuentra en la cara medial de los labios menores y es la demarcación que separa la mucosa modificada de los labios menores (epitelio queratinizado) de la mucosa (epitelio transicional no queratinizado) del vestíbulo vaginal. El vestíbulo, la porción más interna de la vulva, se extiende desde esta línea hasta el himen. La vascularización de la vulva proviene de las arterias pudendas internas y externas. Las regiones anterior y superior están inervadas por el nervio ilioinguinal y genitofemoral (ramas del plexo lumbar) y el resto por el nervio pudendo. El aspecto de la vulva es muy variable, dependiendo de la edad, raza y factores hormonales. Se pueden observar diferentes grados de pigmentación, así como asimetría o hipertrofia de los labios menores5.
Podemos destacar dos variaciones anatómicas fisiológicas:
- 1.
Hiperplasias sebáceas (manchas de Fordyce): es la más frecuente de las variaciones9. Se encuentra entre el 75 y el 95% de las mujeres5, aunque raramente se han publicado casos10. Son pequeñas pápulas amarillentas (1-2mm) en la cara interna de los labios menores que corresponden a glándulas sebáceas ectópicas. Pueden ser prominentes y coalescer. Son asintomáticas y no precisan tratamiento.
- 2.
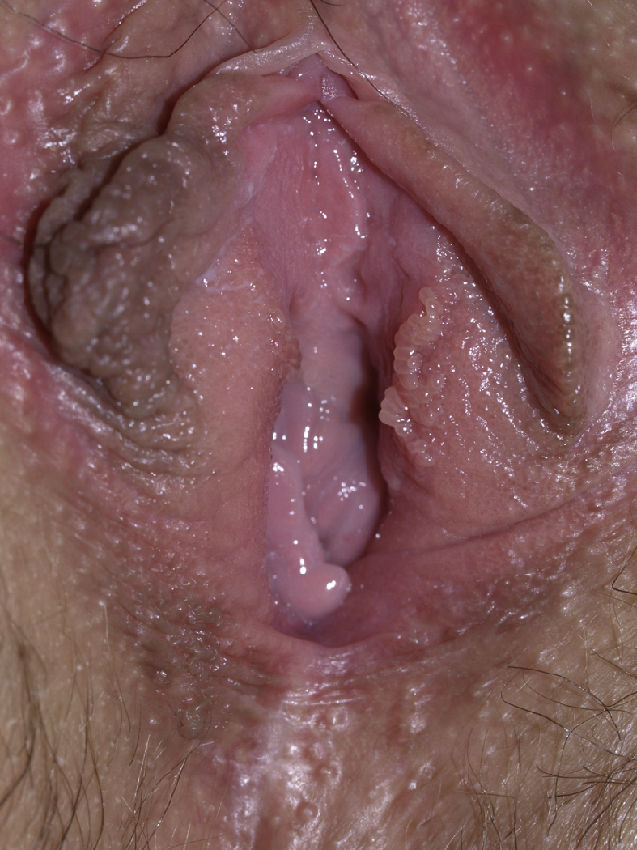
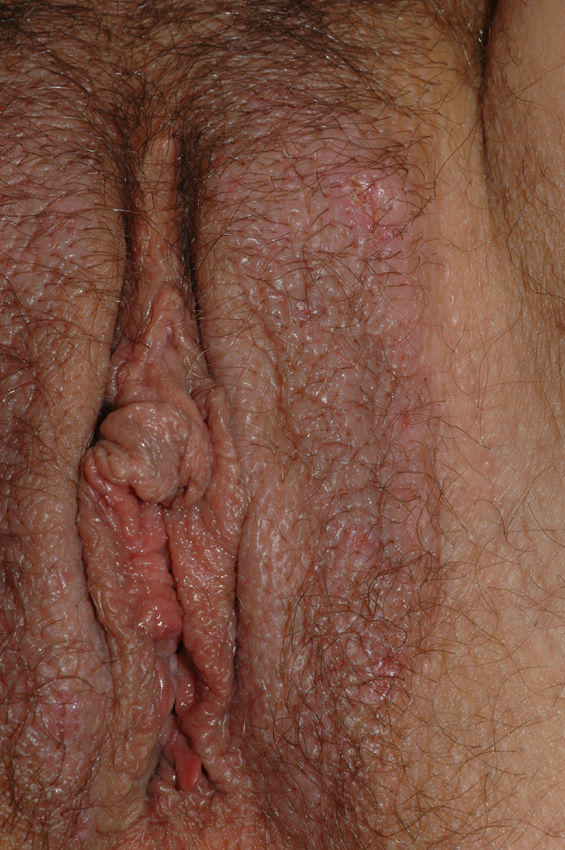
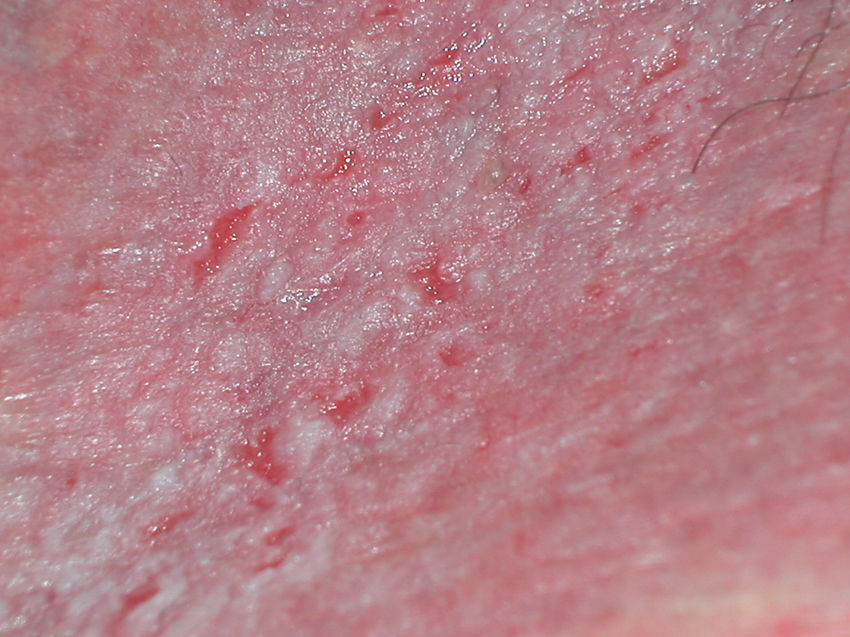
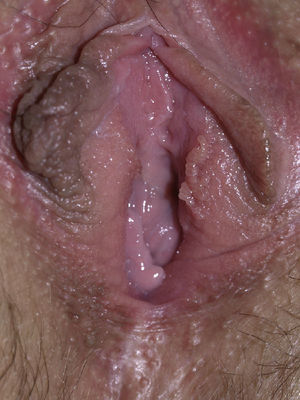
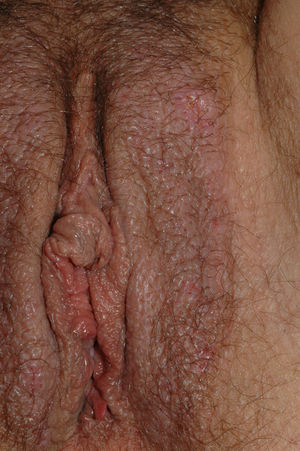
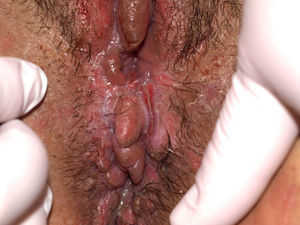
Papilomatosis vulvar o vestibular: su prevalencia es controvertida. Algunos estudios señalan que puede encontrarse en el 1%11, mientras que en otros las tasas oscilan entre el 8 y el 48% de las mujeres5. Las papilas vulvares fueron descritas en 1981 como pseucondilomas de la vulva12 y han recibido varios nombres hasta la actualidad, como micropapilomatosis, papilomatosis escamosa benigna, papilomatosis hirsutoide de la vulva y micropapilomatosis labial2. Son proyecciones pequeñas (1-2mm) filiformes, monomorfas, blandas, de color similar a la mucosa adyacente y simétricas localizadas sobre todo en la zona posterior del vestíbulo (fig. 1). En número variable, cuando cubren casi totalmente el vestíbulo, reciben el nombre de papilomatosis vulvar11. Aunque inicialmente existieron dudas sobre su etiología se ha descartado su relación con la infección por el virus del papiloma humano13 (VPH), representando una variante normal del epitelio genital y considerándose análogas a las pápulas perladas del pene14. Debe realizarse el diagnóstico diferencial con los condilomas para evitar tratamientos inadecuados15,16. Se han propuesto para ello 5 parámetros clínicos13 y la exploración dermatoscópica17. Así, clínicamente y a diferencia de los condilomas, las papilas tienen un color rosado similar a la mucosa adyacente, son blandas, tienen una distribución simétrica o lineal en vez de irregular, de la base de cada lesión se origina una sola proyección en vez de varias proyecciones filiformes y no blanquean al utilizar ácido acético. Dermatoscópicamente se observan vasos sanguíneos abundantes e irregulares en el centro casi transparente de papilas de tamaño uniforme, redondeadas y de bases separadas17. Suelen ser asintomáticas, aunque en algunos casos se puede asociar prurito, dolor o quemazón llegando a interferir con la vida normal y sexual11,18,19. No requieren tratamiento.
Es difícil clasificar de forma sistemática las patologías que pueden afectar a la región vulvar, ya que son múltiples y variadas y comprenden desde las dermatosis inflamatorias a las infecciones, las lesiones tumorales, las alteraciones de la pigmentación e incluso a los síndromes de dolor crónico como la vulvodinia. La International Society for the Study of Vulvovaginal Diseases (ISSVD) ha tenido como uno de sus objetivos el desarrollo de clasificaciones y la unificación de las nomenclaturas de las enfermedades vulvares, y ha realizado actualizaciones de la neoplasia intraepitelial de vulva20, las dermatosis21 y la vulvodinia22.
En este artículo sistematizaremos y realizaremos una breve revisión de las dermatosis inflamatorias vulvares, patología frecuente en la práctica clínica, cuya clasificación más reciente se basa en el patrón histológico de cada uno de los cuadros, y en la que es vital una buena correlación clínico-histológica para su diagnóstico23 (tabla 1). Esta clasificación podría considerarse poco útil en el manejo y práctica diaria, ya que en muchas ocasiones pueden coexistir o superponerse varios cuadros y no ser excluyentes unos patrones de otros, pero supone una herramienta útil en el estudio, comparación y discusión de estas enfermedades entre diferentes profesionales y grupos de trabajo.
Clasificación de las dermatosis inflamatorias vulvares
| Patrón liquenoide |
| Liquen escleroso |
| Liquen plano |
| Patrón de esclerosis dérmica |
| Liquen escleroso |
| Patrón espongiótico |
| Eczema atópico |
| Eczema de contacto (irritativo y alérgico) |
| Patrón vesículo-ampolloso |
| Penfigoide ampolloso |
| Penfigoide de mucosas |
| Penfigoide gestacional |
| Pénfigo vulgar |
| Enfermedad IgA lineal |
| Formas ampollosas de eritema multiforme, síndrome de Stevens-Johnson y necrólisis epidérmica tóxica |
| Patrón acantótico |
| Liquen simple crónico |
| Psoriasis |
| Síndrome de Reiter |
| Patrón acantolítico |
| Enfermedad de Hailey-Hailey |
| Enfermedad de Darier |
| Dermatosis acantolítica del área vulvocrural |
| Patrón granulomatoso |
| Enfermedad de Crohn |
| Síndrome de Melkersson-Rosenthal |
| Patrón vasculopático |
| Aftas |
| Enfermedad de Behçet |
| Vulvitis de células plasmáticas |
Modificado de la clasificación de las dermatosis vulvares de la ISSVD (2006)21
Basándonos en la clasificación de las dermatosis según el patrón histológico que presentan podemos encontrar varios cuadros23.
Patrón liquenoideLiquen esclerosoEl liquen escleroso (LE) es una dermatosis inflamatoria crónica y autoinmune que afecta predominantemente a la región anogenital. Fue descrita en el siglo xix por Hallopeau24 y Darier25, quienes lo describieron como una variante de liquen plano. Ha recibido varios nombres como craurosis vulvar, liquen escleroso y atrófico o distrofia hipoplásica. Actualmente la ISSVD recomienda que se denomine liquen escleroso26.
Aunque es frecuente se cree que puede estar infraestimado dado su seguimiento por diferentes especialidades, la falta de experiencia en reconocer el cuadro en algunos sectores, las consultas tardías y el inicio asintomático en el 9% de los casos27–29. Se ha estimado una prevalencia de 1/300-1/1.000 en mujeres que acuden a clínicas de patología vulvar30, representando hasta el 39% de las pacientes tratadas en una de ellas31. Otros estudios lo observan hasta en un 1,7% de las mujeres que acuden a una consulta ginecológica32 y casi en el 3% de las mujeres en una residencia de ancianos33. Aunque se ha descrito en todos los grupos de edad y ambos sexos, es más frecuente en mujeres postmenopáusicas26. Puede aparecer en la infancia (15%). En niñas habitualmente mejora, pero puede persistir hasta la edad adulta34,35.
Su etiología exacta es desconocida y probablemente sea multifactorial36,37. Se han implicado factores genéticos, autoinmunitarios, hormonales e infecciosos en su patogénesis38,39. La contribución genética es compleja. Se estima que al menos el 11% de las pacientes con LE tienen familiares afectos28, aunque el patrón de herencia no está definido34. Se han estudiado diferentes asociaciones con los genes que regulan el sistema mayor de histocompatibilidad40,41 encontrándose asociaciones con HLA DQ7, y en menor medida con HLA DQ8 y DQ9, sobre todo si se inicia en la infancia40,42–44. Recientemente se ha encontrado asociación con el HLA–DRB1*12/DQB1*0301/04/09 /010. Sin embargo, los haplotipos HLA DRB1*0301 /04 y DRB1*0301/04/DQB1*0201 /02 /03 parecen proteger del riesgo de LE45. Por otra parte, se ha considerado una enfermedad autoinmune dada la existencia de una incidencia elevada de autoanticuerpos, la asociación a otras enfermedades autoinmunes como la tiroiditis46, la alopecia areata, la anemia perniciosa o el vitíligo47–49 y la historia familiar de enfermedades autoinmunes en estas pacientes. Dado que la inflamación inicial en el LE se observa en la membrana basal, se ha propuesto que el antígeno diana se debe encontrar en esta región. Así, existe evidencia de la existencia de autoanticuerpos circulantes contra la proteína 1 de la matriz extracelular (ECM-1) en un 67% de los casos50 y de anticuerpos contra regiones de la membrana basal (principalmente BP180 y BP230) en un 30% de los mismos50–52. Un último estudio ha demostrado que en más del 40% de los pacientes con LE vulvar y liquen plano el dominio NC16A de la proteína BP180 es la diana de las células T circulantes y que existen autoanticuerpos contra BP18053. Por otra parte, continúa el debate respecto al papel etiopatogénico de Borrelia burgdorferi, ya que mientras que en Europa hay alguna evidencia de su implicación, en estudios realizados en EE.UU. no se ha demostrado54. Finalmente, parece tener una posible influencia hormonal, dado que aparece más en periodos de la vida donde la influencia estrogénica es más baja42.
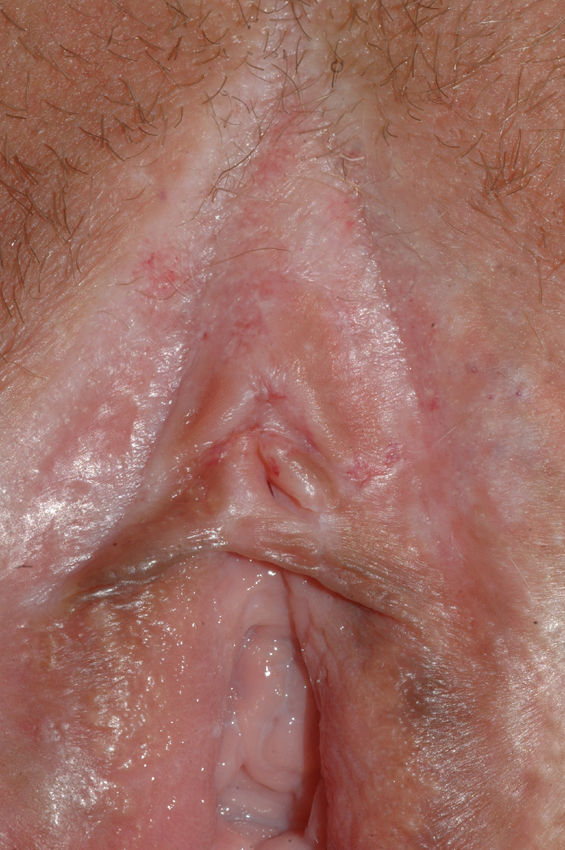
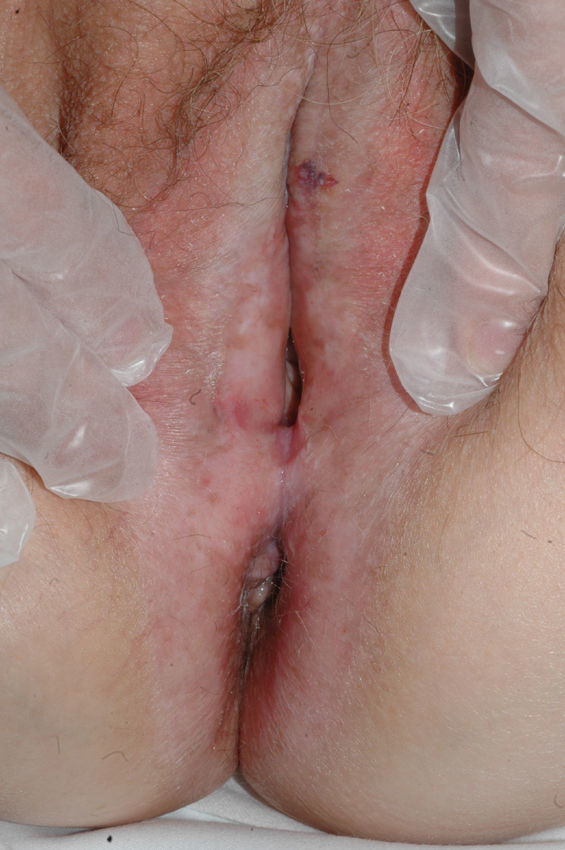
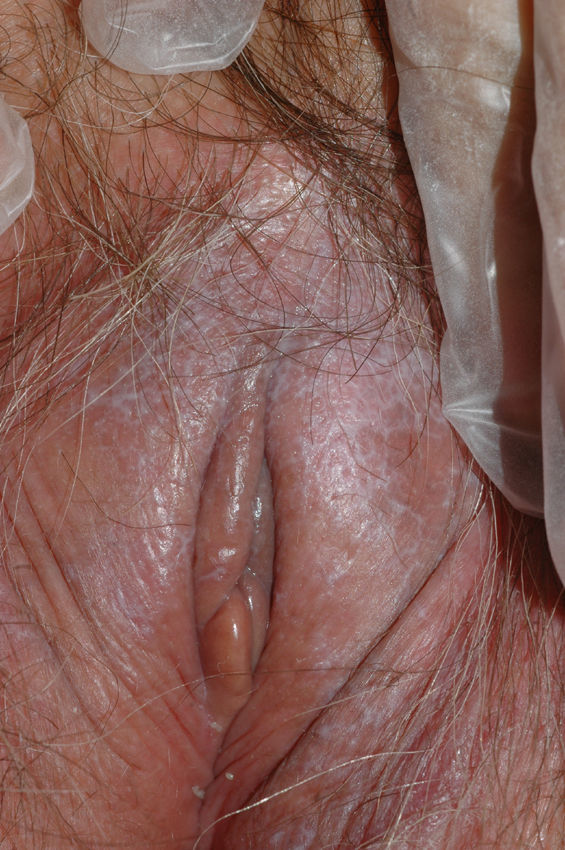
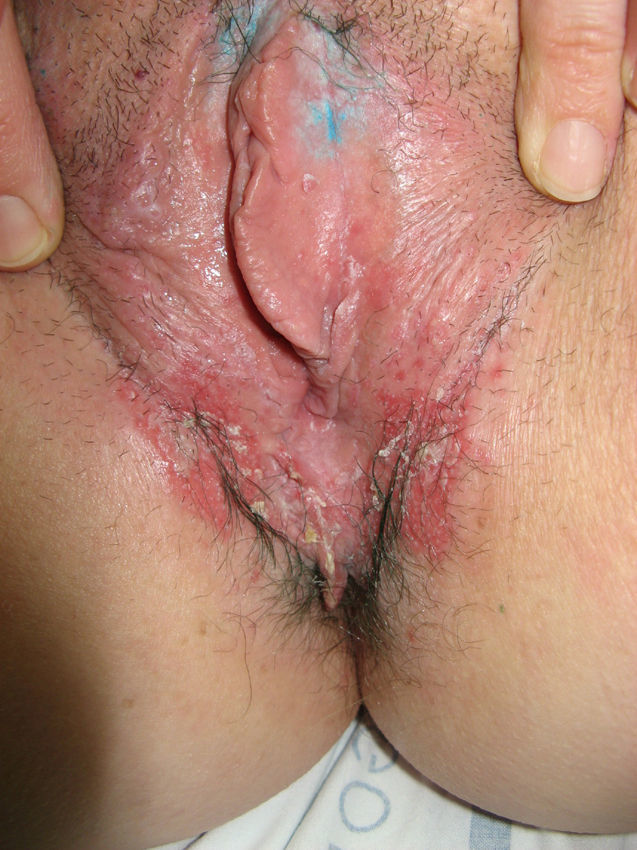
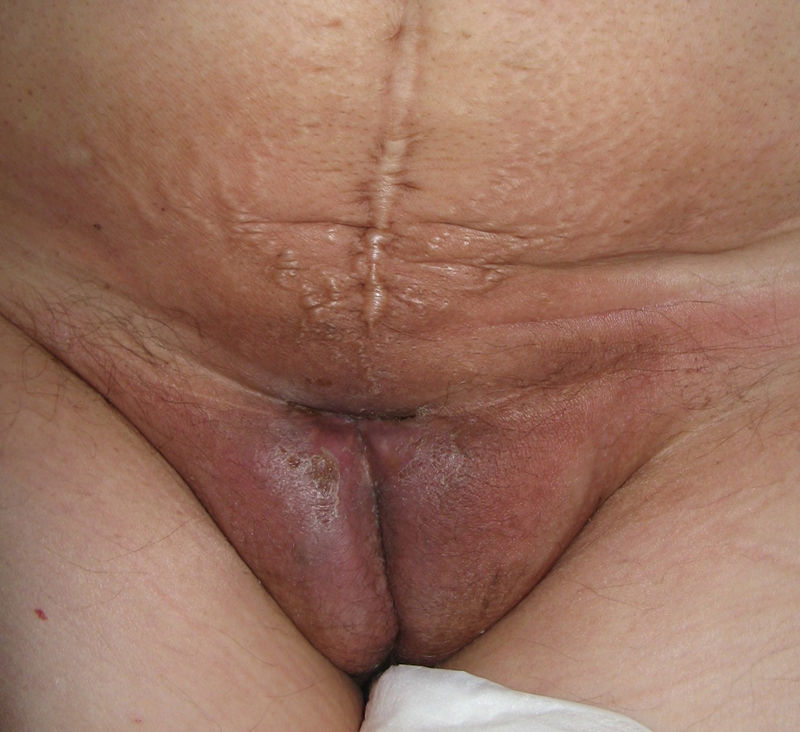
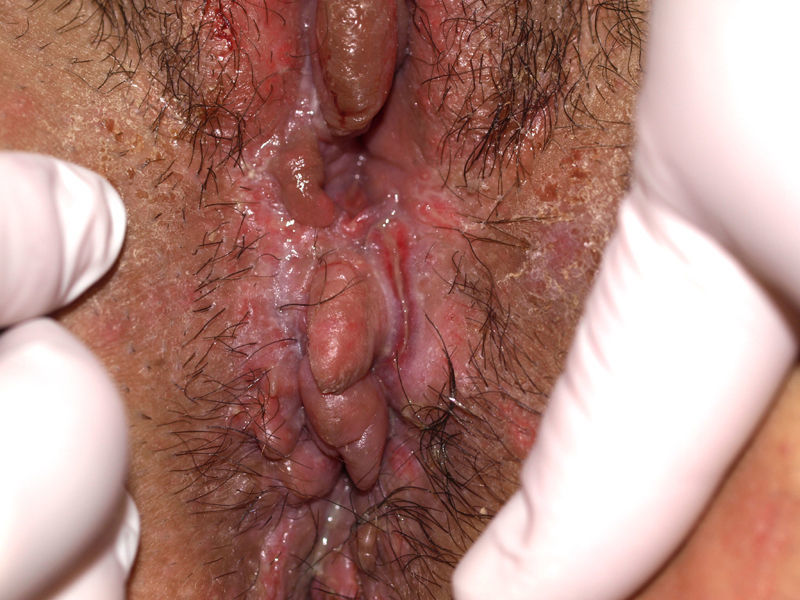
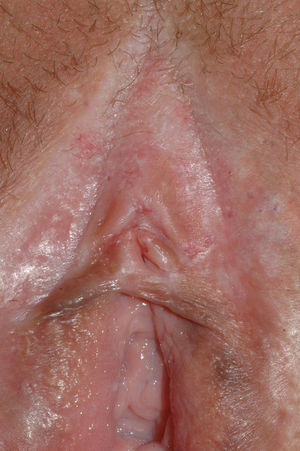
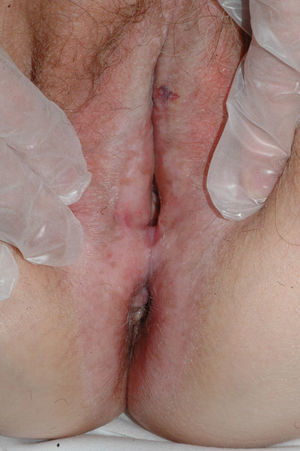
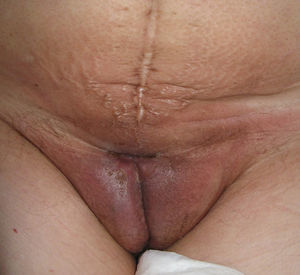
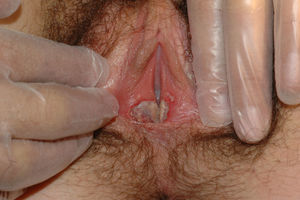
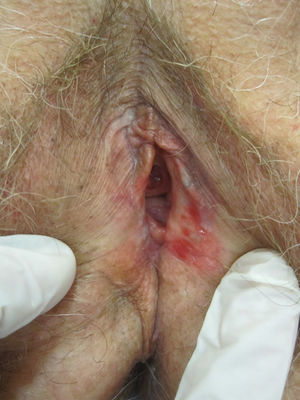
El síntoma más frecuente es el prurito, aunque en algunos casos puede aparecer dolor, dispareunia, disuria, estreñimiento o infecciones secundarias. En un 1% de los casos puede ser asintomático41. Existe una gran variabilidad clínica según la localización afectada y el tiempo de evolución. Suele iniciarse en la zona alrededor del clítoris (fig. 2) y en casos avanzados puede llegar a disponerse en un patrón típico en forma de «8», rodeando la zona vulvar y perianal, que se afecta en el 60% de los casos41 (fig. 3). Pueden aparecer manifestaciones extragenitales en un 6%47, pero no suele afectarse ni la mucosa genital ni la oral. Solo se ha descrito un caso de LE vaginal55.
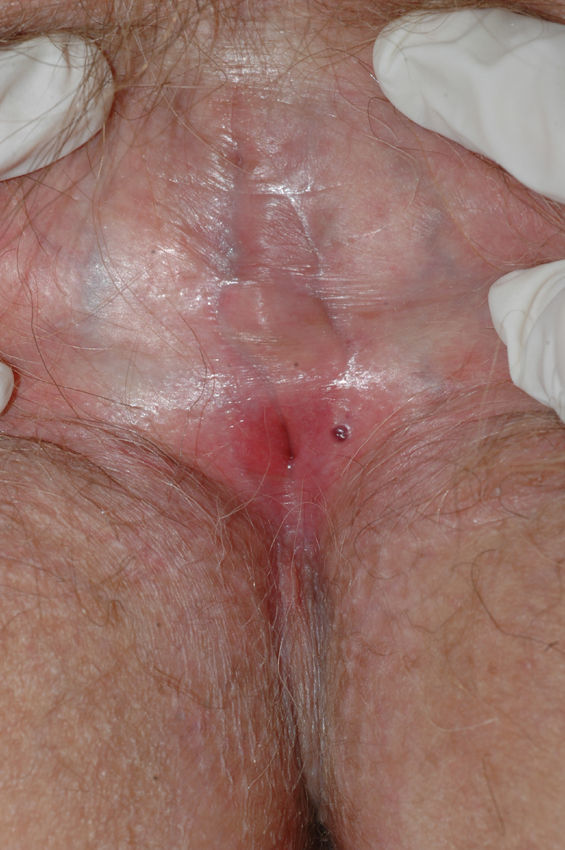
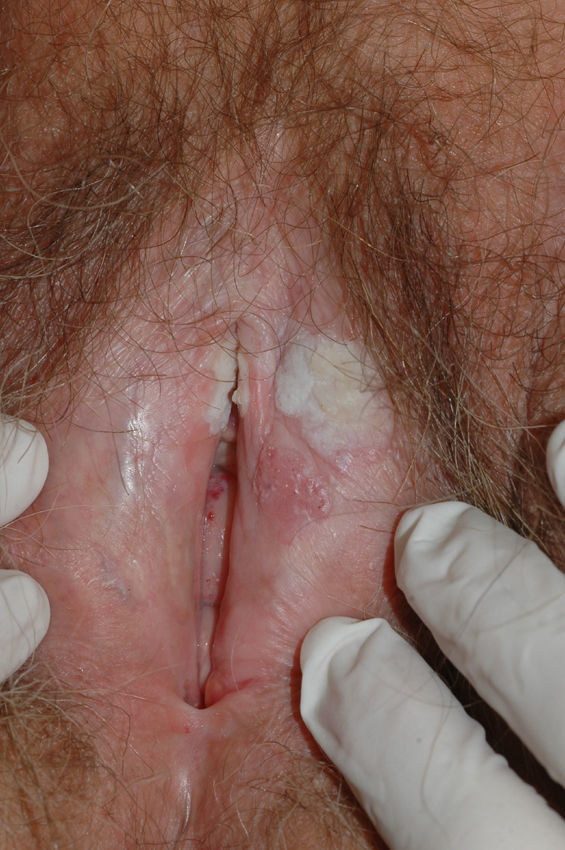
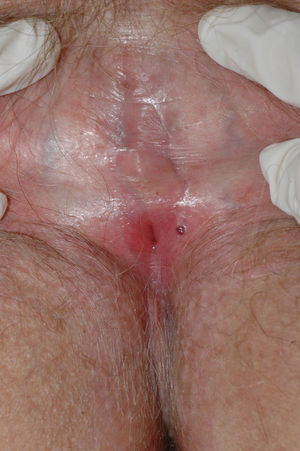
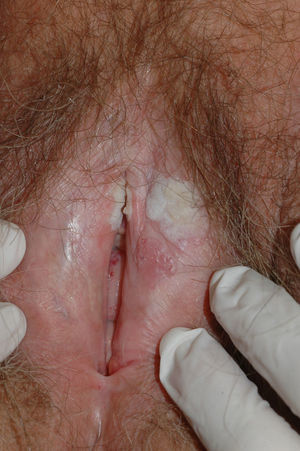
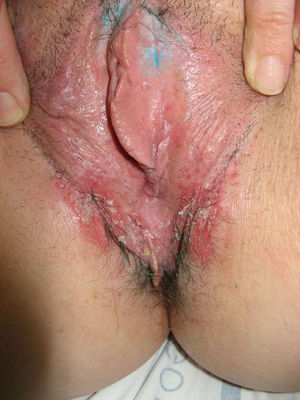
Se caracteriza por la presencia de pápulas y placas de color blanco nacaradas bien definidas junto con un característico cambio de textura cutánea que hace que la piel se torne muy fina, con una mayor fragilidad que puede manifestarse en forma de púrpura, erosiones y fisuras. El prurito puede conducir a la aparición de lesiones por rascado y liquenificación que dificulten el diagnóstico. En casos evolucionados podemos encontrar diferentes grados de esclerosis y cambios estructurales cicatriciales con reabsorción de las estructuras anatómicas: obliteración o sinequia de labios menores y clítoris, pérdida completa de labios menores e incluso en casos graves no tratados estenosis del introito vaginal (fig. 4). Puede asociar hiperpigmentación parcheada de la mucosa y vestíbulo. Existe asociación entre el LE y el carcinoma epidermoide vulvar25, y más raramente el carcinoma verrugoso56 (fig. 5). Se estima un riesgo del 2-5% 41,57–59. Se cree que los pacientes mal controlados tienen mayor riesgo58. El diagnóstico de LE suele ser clínico, siendo los diagnósticos diferenciales fundamentales la psoriasis (con la que a veces se asocia60), el liquen plano, el liquen simple crónico y el penfigoide de mucosas. Aunque no siempre es precisa, se aconseja la realización de una biopsia de confirmación, sobre todo cuando se observen lesiones cicatriciales con pérdida de estructuras vulvares5,38. Esta es esencial en los casos dudosos o atípicos, siempre que se sospeche malignización (áreas de hiperqueratosis o erosión persistentes), si no responde a los tratamientos habituales, si existen áreas pigmentadas o si existen lesiones extragenitales que puedan sugerir una morfea27. En ocasiones puede ser útil solicitar un estudio de autoinmunidad27, aunque existe cierta controversia y en general no se recomienda.
Los hallazgos histológicos dependen del tiempo de evolución y de la localización de la muestra. Los cambios precoces incluyen vacuolización de la capa basal de la epidermis y ocasional necrosis de queratinocitos, o un infiltrado linfohistiocitario en banda en la dermis superficial. Las lesiones más estables muestran una epidermis atrófica y edema de dermis papilar junto con esclerosis e hialinización de los haces de colágeno, que dan un aspecto homogéneo a toda la dermis superficial. A veces puede observarse paraqueratosis e hiperplasia epidérmica en relación con un liquen simple asociado23.
El objetivo del tratamiento es la reducción del prurito y otros síntomas, la mejoría de la calidad de vida y de las lesiones cutáneas, evitando su progresión y la posible degeneración a carcinoma epidermoide39. Es importante explicar la naturaleza del cuadro, su cronicidad y las opciones de tratamiento. Deben recomendarse unas medidas generales higiénicas como evitar los agentes irritantes, utilizar jabones y emolientes sin fragancias, prendas de algodón y lubricante y emolientes si es necesario26. Aunque se han propuesto múltiples tratamientos ninguno ha demostrado ser más eficaz que los corticoides tópicos de muy alta potencia (propionato de clobetasol 0,05%), por lo que constituyen la primera línea terapéutica27. No existen ensayos controlados aleatorizados y podemos encontrar varias pautas de uso27,41. Se recomienda basar la frecuencia de aplicación en el aspecto de la piel y no en la sintomatología37. El 60% presenta remisión completa41,61, aunque en otros estudios se ha descrito una remisión parcial o completa hasta en el 95% de las mujeres que lo usan diariamente durante tres meses62. Los labios menores y la región alrededor del clítoris son resistentes a los efectos adversos de los corticoides tópicos (atrofia, telangiectasia) y las terapias largas de mantenimiento son seguras63. En pacientes no respondedores, o para evitar posibles efectos adversos, también se ha demostrado la utilidad de los inhibidores de la calcineurina tópicos (pimecrolimus y tacrolimus)27,64, con beneficio en casi el 50% de los pacientes. Sin embargo, la falta de estudios a largo plazo, la posible irritación que produce y la controversia de su uso en una enfermedad con potencial de malignización, hace que se mantenga como terapia de segunda línea. La testosterona y otros tratamientos hormonales se usaron en el pasado, pero actualmente no existen evidencias demostradas del beneficio de su uso27. En pacientes resistentes al tratamiento se ha descrito una posible utilidad de los tratamientos sistémicos (ciclosporina, metotrexato y otros inmunosupresores). En cuanto a los tratamientos físicos no hay indicación de cirugía, salvo casos de malignización o secuelas cicatriciales como la de estenosis vaginal. Está indicada tras la resolución de la inflamación, siendo necesario tratamiento posterior para evitar la reestenosis54.
Liquen planoEl liquen plano (LP) es una dermatosis inflamatoria que puede afectar a la piel, las mucosas o a ambas y que adopta diferentes morfologías según su tiempo de evolución, localización y gravedad65. Su etiología es desconocida, aunque es considerada una enfermedad autoinmune mediada por células T, dada su asociación a otras enfermedades autoinmunes y su respuesta a fármacos inmunosupresores49,53,66,67.
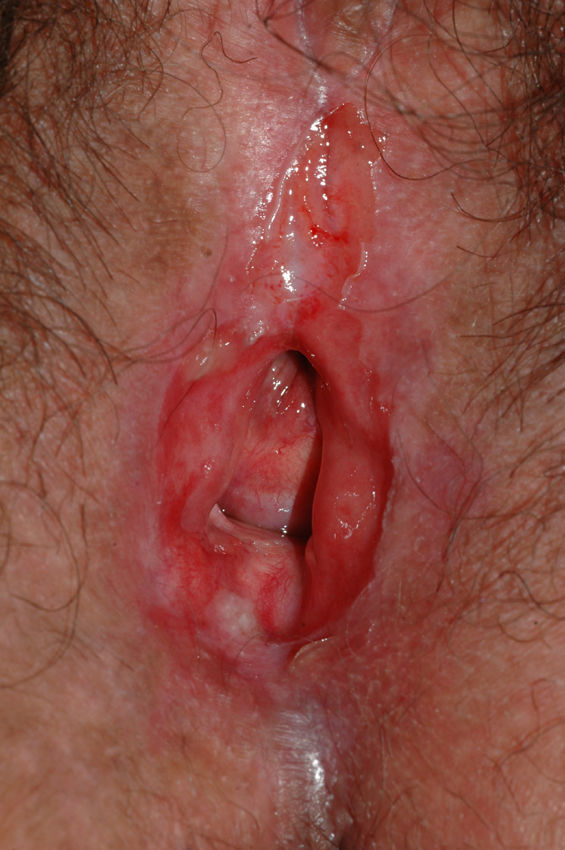
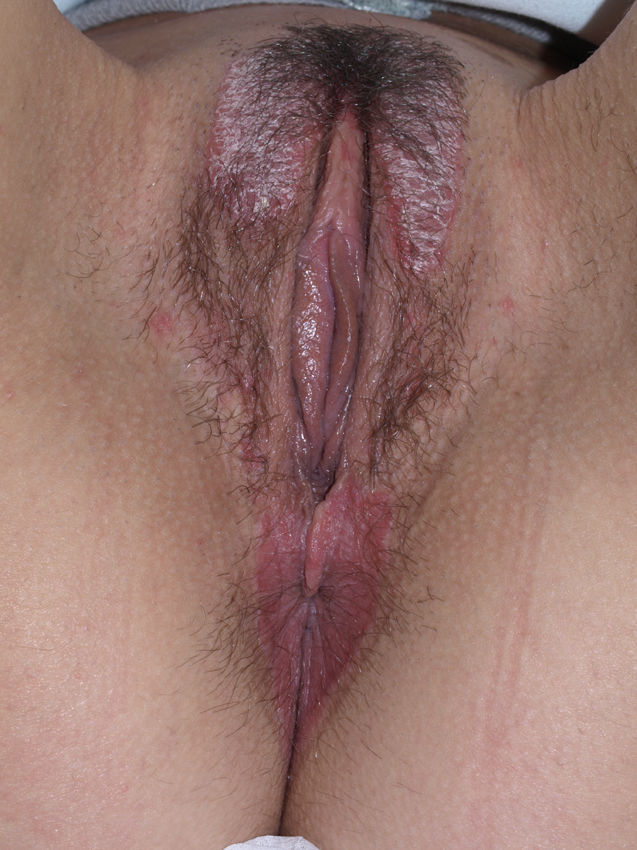
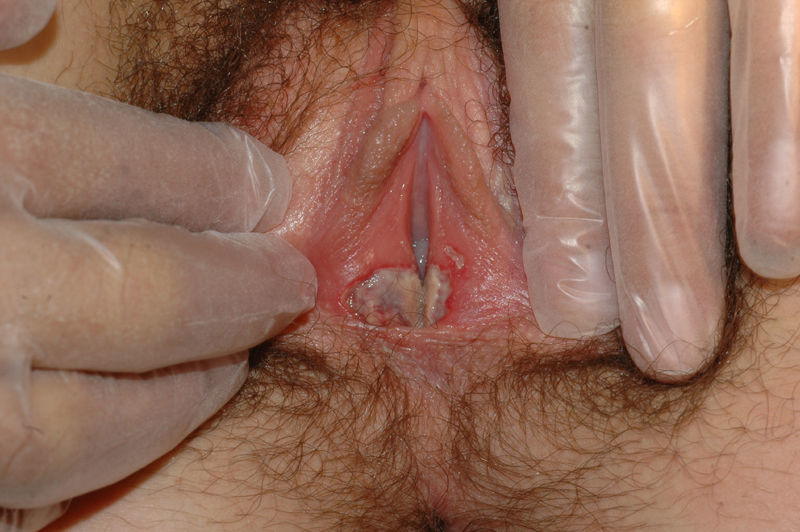
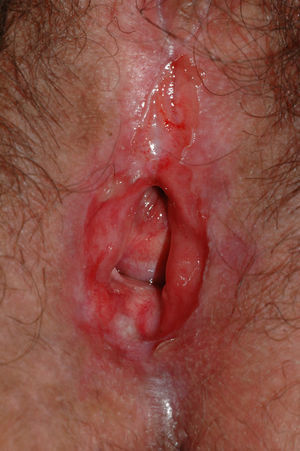
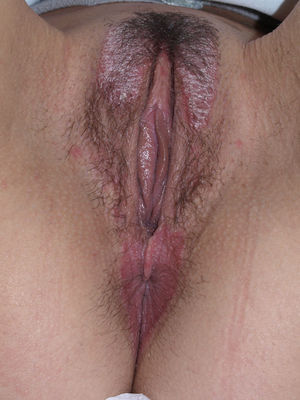
A nivel vulvovaginal el LP puede aparecer de forma aislada o asociado a otras localizaciones. Se estima que aproximadamente el 50% de las mujeres con liquen plano oral tienen afectación vulvar54,65,68, aunque se cree que ha podido estar infradiagnosticado69 y que la afectación es más frecuente70,71. Por otra parte, dos tercios de las pacientes con afectación vulvar padecen también afectación vaginal y gingival en lo que se conoce como síndrome vulvo-vaginal-gingival72–75. El LP vulvovaginal (LPVV) puede tener diferentes formas clínicas, pero dada la naturaleza de la mucosa anogenital los hallazgos más frecuentes son el eritema intenso, que afecta al introito y a la vagina, las estrías blanquecinas (fig. 6), el epitelio blanquecino o la aparición de úlceras o erosiones eritematosas intensas bien definidas, en lo que se conoce como LP erosivo, que es el más frecuente a este nivel, con datos que oscilan entre el 7476 y el 95%5 de los casos (fig. 7). Suele ser sintomático, caracterizándose por dolor, quemazón o picor asociados a disuria, dispareunia y sangrado poscoital65,69,75–77. Otros datos especiales son la posibilidad de aparición de áreas cicatriciales y sinequias, con enterramiento del clítoris y posible estrechamiento del introito, la afectación vaginal (50-60%) con o sin vaginitis descamativa asociada y la posible afectación de otras mucosas como la rectal o la esofágica5. Como otros cuadros con erosiones crónicas, existe un riesgo de malignización a carcinoma epidermoide entre el 2-3%63,75,78,79. El diagnóstico clínico es complejo y debe sospecharse ante todo cuadro de erosiones rojas, intensas, dolorosas en la vulva. Es básica la exploración de otras regiones. Puede ser necesaria la realización de una biopsia, aunque solo en el 70% se obtiene un diagnóstico de certeza68. Esta debe tomarse de algún área blanquecina o del borde de una erosión. Lo característico es la presencia de un intenso infiltrado inflamatorio linfocitario en banda en la dermis superficial con degeneración de la capa basal y formación de cuerpos de Civatte23. El diagnóstico diferencial, además de con el liquen escleroso, las reacciones liquenoides por fármacos y la vulvitis plasmocelular de Zoon, debe realizarse con enfermedades ampollosas como el penfigoide de mucosas, el pénfigo vulgar, el exantema fijo o el eritema multiforme. En cuanto al tratamiento, a diferencia del LE, se trata de un cuadro resistente y de difícil control69. La primera línea de tratamiento está constituida por los corticoides tópicos75, que deben pautarse de forma individualizada según la sintomatología. No existe ningún estudio controlado, por lo que las recomendaciones se basan en series de casos. Existen datos de buena respuesta a los inhibidores de la calcineurina tópicos80,81. En casos resistentes se han utilizado diferentes tratamientos sistémicos (corticoides orales, hidroxicloroquina, metotrexato, ciclosporina, retinoides, micofenolato, ciclofosfamida, azatioprina, etanercept e infliximab) sin una respuesta uniforme. En casos de afectación vaginal son útiles los corticoides intravaginales en supositorios unidos a fluconazol oral (150mg/semana) para minimizar el riesgo de candidosis82. La cirugía se reserva para casos de estenosis u obliteración. Se recomienda seguimiento a largo plazo78.
Patrón de esclerosis dérmicaRepresentado por el LE ya descrito.
Patrón espongióticoEl eczema es una dermatosis que afecta frecuentemente a la región vulvar, caracterizándose por la presencia de prurito, lesiones eritematosas difusas, disrupción epitelial y liquenificación83. El diagnóstico puede dificultarse por la maceración del área y las lesiones secundarias al rascado. Existen dos tipos de eczema: el endógeno, representado por la dermatitis atópica y el liquen simple y el exógeno o de contacto. Puesto que la histología y la clínica pueden ser superponibles e incluso coexistir, son vitales una buena anamnesis y una adecuada correlación clínico-patológica. Histopatológicamente se caracteriza por la presencia de espongiosis en la epidermis e infiltrado linfocitario dérmico con eosinófilos ocasionales. Además, y según la evolución, puede observarse: en la fase aguda vesículas intraepidérmicas, en la subaguda hiperqueratosis y en la crónica hiperplasia epidérmica23.
Eczema endógenoDermatitis atópicaEs la forma más frecuente de eczema endógeno. Suele afectar a personas con antecedentes familiares o personales de atopia y comenzar en la edad infantil (fig. 8). A veces los únicos signos son xerosis, descamación y liquenificación. Los cambios histológicos no son específicos23.
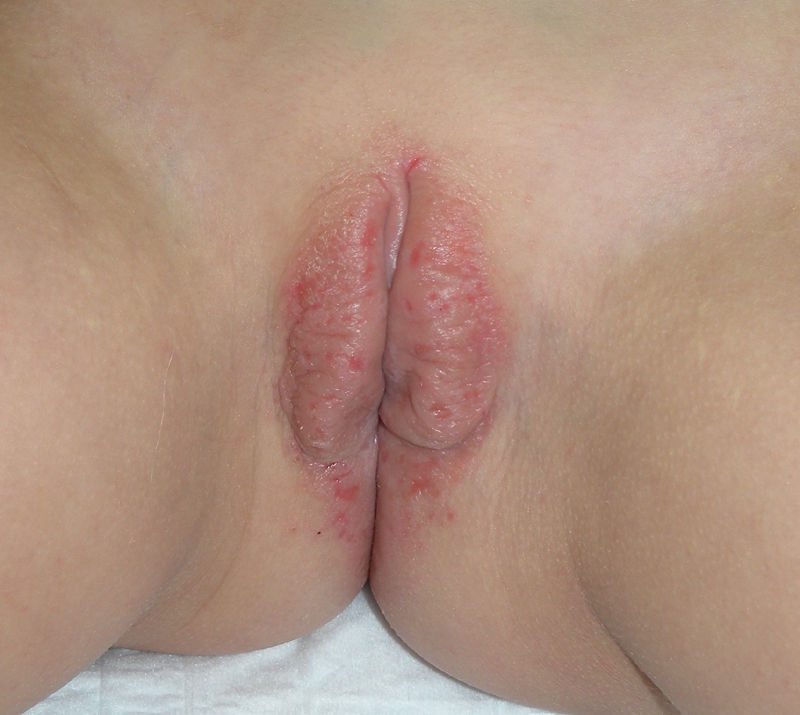
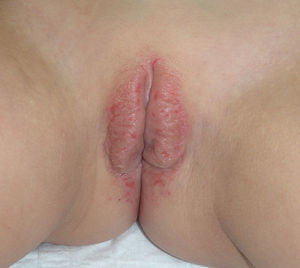
Liquen simple crónicoEs una de las causas más frecuentes de prurito vulvar primario, aunque también puede ser secundario a otras dermatosis pruriginosas. El liquen simple crónico primario puede considerarse una variante localizada y crónica de dermatitis atópica84. El prurito y el rascado continuados producen engrosamiento de la piel y daño de la barrera protectora, con irritación, mayor sensibilidad a sustancias exógenas, sobreinfecciones y perpetuación del ciclo85. Clínicamente aparecen placas engrosadas y liquenificadas con aumento de los pliegues cutáneos, unilateral o bilateralmente (fig. 9). Pueden observarse erosiones, excoriaciones e hiperpigmentación residual, sobre todo en los labios mayores. El pelo púbico puede afectarse. Pueden observarse otras lesiones eczematosas u otros estigmas de atopia. El diagnóstico es clínico. Si existen dudas puede realizarse una biopsia en la que se observa hiperqueratosis, hipergranulosis, acantosis, espongiosis e infiltrado inflamatorio crónico23.
El tratamiento consiste en disminuir la inflamación (corticoides tópicos potentes), detener el ciclo de prurito-rascado (antihistamínicos nocturnos), mejorar la función de barrera cutánea (lubricantes), evitar los irritantes y tratar las posibles sobreinfecciones85,86.
Eczema de contactoEl eczema de contacto vulvar es muy frecuente y puede complicar otras dermatosis como consecuencia de los síntomas o tratamientos aplicados5,83. Puede ser irritativo o alérgico y se considera que la vulva es particularmente susceptible, dado que la superficie cutánea es más débil que en otras localizaciones87,88.
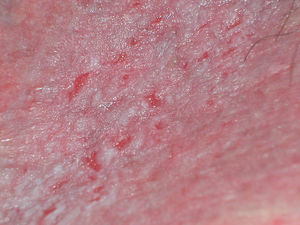
Eczema de contacto irritativoEs el más frecuente, aunque su prevalencia es desconocida. Puede manifestarse en forma de picor, escozor o dolor. Es resultado del contacto con sustancias que causan citotoxicidad a los queratinocitos sin necesidad de sensibilización previa. Los posibles irritantes vulvares son múltiples, pero conviene resaltar los fluidos corporales que pueden contactar en esta zona (orina, heces, semen, sudor), los medicamentos tópicos (fig. 10) y los productos de higiene íntima87. Nos podemos encontrar dos tipos de cuadros irritativos frecuentes en la práctica clínica, uno homólogo a la dermatitis del pañal (sobre todo en mujeres mayores con incontinencia urinaria) y otro en mujeres con una higiene excesiva (fig. 11).
Es menos común, pero debe considerarse en el diagnóstico diferencial de otras dermatosis que no responden al tratamiento89. Representa una reacción de hipersensibilidad retardada tipo IV que precisa previa sensibilización. Los alérgenos más frecuentemente identificados son fragancias, antibióticos tópicos, níquel, preservantes y anestésicos tópicos5. Para el diagnóstico es esencial la realización de pruebas alérgicas de contacto. El diagnóstico diferencial depende de la fase del eczema. En la fase aguda hay que descartar otros procesos vesículo-erosivos como herpes simple, candidiasis, eritema multiforme, exantema fijo, enfermedades ampollosas autoinmunes y liquen plano erosivo. En la fase crónica debe diferenciarse de otros eczemas (atópico y seborreico), psoriasis inversa, liquen simple crónico y enfermedad de Paget87.
En ambos casos es esencial evitar el agente irritativo o alérgico y no seguir unas conductas de higiene excesivamente irritantes. Estos agentes pueden ser múltiples (tabla 2). Según la severidad se recomienda usar corticoides tópicos u orales, antihistamínicos orales y descartar infecciones secundarias87.
Agentes irritantes y alérgenos más frecuentes en el eczema de contacto vulvar
| Contactantes causales de eczemas vulvares |
| Agentes irritantes |
| Agua: excesivo lavadoFluidos corporales: orina, sudor, heces, semen, flujo vaginalProductos de higiene: lubricantes, compresas, toallitas, pañalesTérmicos: secadores y bolsas de agua calienteFármacos: geles con alcohol, imiquimod, fluorouracilo (5-FU), podofilino, cantaridina, propilenglicol, podofilotoxinaDetergentes y jabones |
| Alérgenos |
| Anestésicos locales: lidocaína, benzocaína, tetracaínaAntibióticos: neomicina, bacitracina, polimixina, sulfamidasAntifúngicos: imidazoles, nistatinaAntisépticos: clorhexidina, violeta de genciana, tiomersal, povidona yodadaFragancias: bálsamo de Perú, alcohol cinámico, eugenol, isoeugenol, citronela, corticoides tópicosEmolientes: lanolina, glicerina, aceite de jojoba, propilenglicolPreservantes: kathon, quaternium 15, formaldehído, bronopol, diazolidinil urea, imidazolidinil ureaGomas (condones, diafragmas, guantes, pesarios): látex, tiuramCompresas femeninas: formaldehído, fragancias, metacrilatos, acetil acetonaOtros: níquel, toluensulfonamida de la laca de uñas, espermicidas |
Cuadro ya comentado dentro de las dermatosis inflamatorias de patrón espongiótico. También se incluye en esta sección, ya que histológicamente también puede observarse acantosis importante en la biopsia23.
PsoriasisDermatosis crónica y multifactorial que afecta al 5% de las mujeres con síntomas vulvares23. Puede manifestarse con intenso prurito, dolor, fisuras o ser asintomática. Las formas clínicas en vulva son variables (vulgar, inversa y pustulosa) y suelen acompañarse de lesiones en otras áreas. Las lesiones tienen un límite neto característico90. Tiene predilección por las zonas pilosas (labios mayores y monte de Venus), aunque también se afectan los pliegues inguinales y la cara interna de los muslos en la forma inversa (fig. 12). Es frecuente el fenómeno de Koebner por la fricción continua y la exposición a irritantes. El diagnóstico es clínico y solo en formas atípicas es precisa la biopsia. Debe diferenciarse de la dermatitis seborreica (rara en vulva), el liquen simple, el eczema de contacto, la candidiasis y la tiña cruris. Los síntomas vulvares (prurito o quemazón) en mujeres con psoriasis se han correlacionado con síntomas depresivos, por lo que es importante la valoración y tratamiento de estas lesiones91. Suele controlarse con tratamiento tópico y evitando irritantes externos.
Síndrome de ReiterEnfermedad multisistémica caracterizada por uretritis, conjuntivitis y artritis. Puede acompañarse de manifestaciones cutáneas, fiebre y malestar. Las lesiones suelen aparecer en manos, pies y genitales y son clínica e histológicamente indistinguibles de la psoriasis pustulosa90. Casi exclusivo de varones, la afectación vulvar es rara y se da sobre todo en mujeres con VIH92.
Patrón vesículo-ampollosoLa vulva puede afectarse en múltiples dermatosis ampollosas. Se ha descrito afectación por pénfigo vulgar, penfigoide ampolloso, gestacional y de mucosas, dermatitis herpetiforme, epidermólisis ampollosa, eritema multiforme, síndrome de Stevens-Johnson e incluso lupus eritematoso sistémico ampolloso2,93. La lesión inicial puede ser una ampolla, pero la fricción presente en esta localización hace que habitualmente se observen erosiones94. Destacamos:
Penfigoide ampollosoEl penfigoide ampolloso es una enfermedad ampollosa autoinmune caracterizada por la aparición de ampollas tensas en la piel, precedidas o no de lesiones eczematosas o urticariformes. En la vulva pueden observarse ampollas claras o hemorrágicas, con formación posterior de erosiones que curan sin dejar cicatrices. Suele ser pruriginoso y aparecer en pacientes de edad avanzada. Sin embargo, aunque rara, la afectación vulvar es más frecuente en niñas, bien como variante única localizada95-100 o en asociación a un cuadro generalizado93. Es importante su identificación, ya que es básico diferenciarlo del abuso sexual2,101,102. Se confirma mediante biopsia. Histológicamente aparecen ampollas subepidérmicas con infiltrado inflamatorio dérmico que suele incluir eosinófilos. La inmunofluorescencia directa (IFD) de la piel perilesional muestra depósito de IgG y C3 en la membrana basal. El tratamiento depende de la gravedad e incluye: corticoides tópicos y orales, minociclina, niacinamida, dapsona, azatioprina y ciclofosfamida.
Penfigoide de mucosasEl penfigoide de mucosas, antes llamado cicatricial103, es un grupo de enfermedades ampollosas autoinmunes mediadas por autoanticuerpos dirigidos contra diferentes proteínas de la unión dermo-epidérmica, que afecta principalmente a mucosas, y en menor medida a la piel104. Las mucosas más comúnmente afectadas son la oral y la conjuntival. La vagina y la vulva también pueden afectarse en un 17-54% de los casos94,105. Suele aparecer entre los 60-80 años, aunque se han descrito casos en niñas con afectación exclusiva genital99,106,107. Clínicamente es difícil apreciar vesículas intactas. Se observan eritema y erosiones inespecíficas, con eventual aparición posterior de cicatrices, reabsorción de clítoris y estrechamiento gradual del introito. Las pacientes refieren irritación, quemazón, prurito, dolor y sequedad. Puede acompañarse de afectación cutánea y oral105. Es importante descartar la afectación conjuntival por el riesgo de ceguera que conlleva. Histológicamente se aprecian ampollas subepidérmicas con infiltrado mixto con eosinófilos. En la mucosa vaginal pueden aparecer células plasmáticas y fibrosis asociada a cambios cicatriciales. La IFD muestra un depósito lineal de IgG y C3 en la membrana basal. IgA e IgM pueden estar o no presentes23. El diagnóstico diferencial se realiza con el pénfigo vulgar, el liquen plano erosivo108, el eritema multiforme y el liquen escleroso109. El objetivo del tratamiento es disminuir la inflamación y prevenir las secuelas, y depende de la gravedad y la localización. La afectación genital se considera de alto riesgo, ya que puede producir cicatrización, adhesiones vaginales o estenosis y requiere un tratamiento agresivo y multidisciplinar110. Se han utilizado varios fármacos sistémicos como prednisona oral con ciclofosfamida, azatioprina, micofenolato, ciclosporina, metrotrexato, dapsona, inmunoglobulinas intravenosas111, etanercept112 o infliximab con resultados variables.
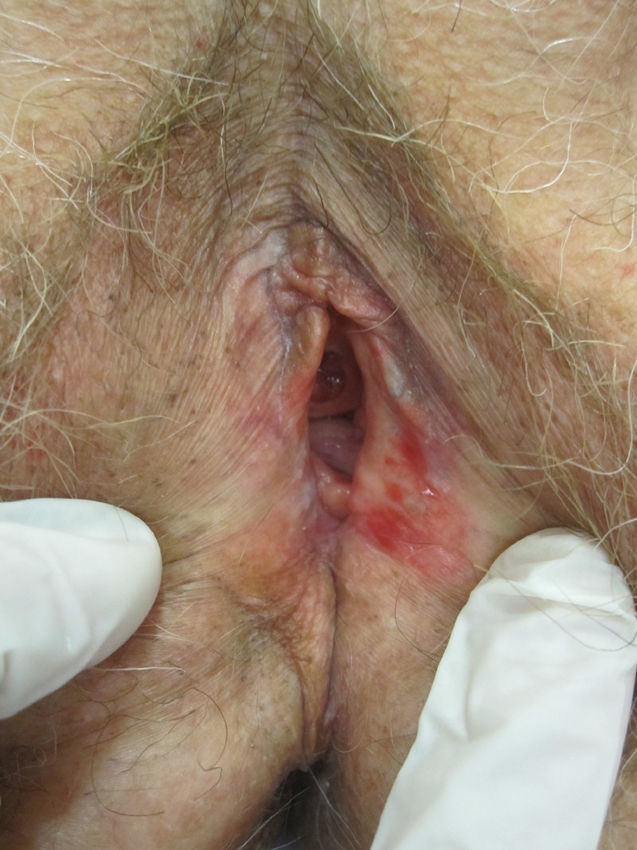
Pénfigo vulgarEnfermedad ampollosa autoinmune de piel y mucosas caracterizada histológicamente por la presencia de acantólisis suprabasal e inmunológicamente por la presencia de autoanticuerpos IgG contra la superficie de los queratinocitos (antidesmogleína 3). En la vulva la afectación tiene una prevalencia desconocida, aunque en un trabajo reciente se estima que aparece en un 51% de las pacientes con pénfigo vulgar (PV)113. Se manifiesta en forma de erosiones dolorosas de tamaño variable y borde irregular (fig. 13), localizadas en su mayoría en los labios menores, pero que también pueden afectar a la vagina (36%) y el cérvix (15%), incluso de forma aislada y que, a diferencia de otras localizaciones, pueden resolverse dejando cicatriz114. Se debe diferenciar del LP, eritema multiforme ampolloso y penfigoide de mucosas. El diagnóstico se realiza mediante biopsia. Histológicamente se caracteriza por acantólisis y ampollas intraepidérmicas con las células basales en empalizada alineadas en el suelo de la ampolla. Mediante IFD se observan depósitos de IgG y C3 intercelulares23. En algunos casos se recomienda exploración ginecológica completa e incluso realización de una citología cervical113, aunque la observación de células acantolíticas suprabasales disqueratósicas puede ser indistinguible de una neoplasia cervical intraepitelial, requieriendo un diagnóstico diferencial más completo entre ambas entidades114. Si la afectación es localizada se recomiendan los corticoides tópicos. En casos extensos deben considerarse otros tratamientos como corticoides sistémicos o inmunosupresores como dapsona, azatioprina, metotrexato, ciclofosfamida, micofenolato, inmunoglobulinas intravenosas y rituximab93,115.
Dermatitis ampollosa IgA linealEnfermedad vesículo-ampollosa caracterizada clínicamente por la presencia de placas eritematosas policíclicas o anulares con vesículas en la periferia que adoptan un patrón en «collar de perlas». Las mucosas, y en concreto la genital, pueden afectarse de forma casi indistinguible al penfigoide de mucosas. La histología no es específica y requiere la IFD de piel perilesional, donde se observan depósitos lineales de IgA en la membrana basal23.
Patrón acantolíticoEnfermedad de Hailey-Hailey (pénfigo benigno familiar)Genodermatosis acantolítica autosómica dominante debida a una mutación en el gen ATP2C1. Suele aparecer en la adolescencia y tiene predilección por flexuras y regiones intertriginosas. Se ha descrito afectación vulvar aislada116,117. Se manifiesta con erosiones lineales y angulares, pruriginosas, con maceración blanquecina y mal olor. La sobreinfección es frecuente. Histológicamente se observa acantólisis intraepidérmica con apariencia en «pared de ladrillos desmoronada». La IFD es negativa23.
Enfermedad de DarierGenodermatosis autosómica dominante con expresividad variable debida a una mutación en el cromosoma 12. Se manifiesta en forma de pápulas hiperqueratósicas en regiones seborreicas, pudiendo afectar a la vulva. Es frecuente la sobreinfección83. Histológicamente se observan columnas de paraqueratosis, acantosis epidérmica y acantólisis suprabasal. Suelen aparecer cuerpos redondos y granos y células disqueratósicas en la epidermis23.
Dermatosis acantolítica vulvocruralEnfermedad poco frecuente dentro del espectro de las disqueratosis focales acantolíticas. Fue descrita como entidad independiente por Chorzelski en 1984118. Clínicamente se presenta como pápulas o placas, solitarias o múltiples, del color de la piel, blanquecinas o levemente eritematosas que se localizan preferentemente en los labios mayores, aunque también pueden afectar al periné, ingles o cara supero-medial de ambos muslos119. Pueden ser dolorosas o pruriginosas. Su etiopatogenia es desconocida. Histológicamente tiene características tanto de la enfermedad de Hailey-Hailey como de la enfermedad de Darier y se observan acantólisis prominente que puede afectar a todo el espesor de la epidermis, y disqueratosis con granos y cuerpos redondos. Puede haber hiperqueratosis y paraqueratosis focal. El diagnóstico diferencial debe realizarse con la enfermedad de Darier, la enfermedad de Hailey-Hailey, el pénfigo vegetante y el disqueratoma verrugoso119. El tratamiento es complicado. Las lesiones solitarias pueden ser tratadas mediante extirpación quirúrgica120, pero las lesiones múltiples tienden a persistir y son recalcitrantes a múltiples terapias resultando solamente útil la tretinoína tópica en un caso119.
Patrón granulomatosoEnfermedad de CrohnEnfermedad inflamatoria intestinal caracterizada por la presencia de granulomas no caseificantes. La afectación mucocutánea es frecuente, en un 20-40%121 de los casos, aunque los últimos estudios muestran tasas de un 15%122. La afectación genital (70% de las pacientes con afectación cutánea)123 es más frecuente en niños y suele producirse por extensión directa de la enfermedad perineal. Más raramente puede ser parte de una enfermedad de Crohn (EC) metastásica23. Las lesiones vulvares aparecen en el 2% de las mujeres con EC124, siendo lo más frecuente el eritema y edema labial asimétrico. También pueden aparecer edema bilateral, erosiones, ulceraciones lineales en los surcos interlabiales o inguinales, abscesos, fístulas vulvares e incluso cicatrices125-127 (fig. 14). Excepcionalmente se han descrito casos de pioderma gangrenoso o carcinoma epidermoide sobre estas lesiones124. Histológicamente se observa la presencia de granulomas no caseificantes en dermis y debe ser diferenciado de la hidradenitis supurativa. Se deben realizar diferentes tinciones específicas para descartar infecciones23. Dado que las alteraciones cutáneas pueden preceder a la sintomatología intestinal en un 20% de los casos, es importante la sospecha clínica, sobre todo en niños con lesiones genitales y en pacientes con ulceraciones lineales en forma de «corte de cuchillo» en pliegues, que son casi patognomónicas de esta enfermedad126. El tratamiento de primera línea de la forma vulvar puede diferir del de las formas intestinales, y está constituido por el metronidazol oral. También puede usarse ciprofloxacino, solo o añadido al anterior. En casos resistentes o de fístulas se utilizan fármacos anti-TNF como infliximab, etanercept o adalimumab122.
Vulvitis granulomatosaLa vulvitis granulomatosa es una entidad poco frecuente y de etiología desconocida caracterizada por la presencia de un infiltrado inflamatorio granulomatoso crónico, similar e indistinguible del observado en la EC y la sarcoidosis128. Existe cierta controversia en su nomenclatura y ha recibido otros nombres como vulvitis hipertrófica, vulvitis granulomatosa idiopática, edema crónico de vulva o vulvitis de Melkersson-Rosenthal. Actualmente se considera un subtipo de granulomatosis anogenital, término homólogo al de granulomatosis oro-facial, surgido para aunar el espectro de alteraciones caracterizadas por edema labial persistente y la presencia en la biopsia de granulomas de células epitelioides no necrotizantes en la dermis profunda, edema e infiltrado linfocitario129,130.
Es importante un estudio completo de estas pacientes para descartar otras entidades que puedan cursar con edema y granulomatosis, en especial la EC y la sarcoidosis (tabla 3). Para ello se recomienda biopsia de la lesión y estudios microbiológicos de las muestras, así como radiografía de tórax y colonoscopia.
Causas de edema vulvar
| Edema vulvar |
| Infecciosas |
| Vulvovaginitis candidósica |
| Celulitis |
| Infecciones víricas: herpes simple, VEB, parvovirus |
| Chancroide |
| Linfogranuloma venéreo |
| Granuloma inguinal |
| Tuberculosis |
| Sífilis |
| Actinomicosis |
| Filariasis |
| No infecciosas |
| Inflamatorias |
| Eczema de contacto |
| Hidradenitis supurativa |
| Enfermedad de Crohn |
| Sarcoidosis |
| Vulvitis granulomatosa idiopática |
| Tumores subcutáneos simuladores de edema |
| Lipomas |
| Quiste de Bartholino |
| Linfangioma circunscrito |
| Angiomixoma |
| Linfoma |
| Otras |
| Yatrogénica: postcirugía vulvar o postradioterapia |
| Relacionado con el embarazo |
| Linfedema congénito |
| Traumático/hematoma |
| Condiciones médicas: insuficiencia cardíaca, hipoalbuminemia, preeclampsia, angioedema |
A pesar de todo esto, la distinción entre EC y granulomatosis vulvar idiopática puede ser difícil e incluso se ha descrito su asociación128. Algunos autores han postulado la hipótesis de que en realidad este cuadro pueda ser un precursor o parte del espectro de la enfermedad, pero sin embargo la mayoría de las pacientes no la desarrollan tras largo tiempo de seguimiento. También puede asociarse a queilitis granulomatosa130.
En el tratamiento inicial del brote agudo se han utilizado la admisnistración intralesional de corticoides o los corticoides sistémicos con mejoría. En la terapia de mantenimiento se ha propuesto el uso de metronidazol, danazol, clofazimina y antimaláricos con resultados variables. Su pronóstico es desconocido, pero puede producir fibrosis y linfedema crónico128.
Patrón vasculopáticoÚlceras aftosasLas úlceras aftosas vulvares tienen caracteríticas similares a las orales. Actualmente se cree que estaban infraestimadas en frecuencia123. La localización más frecuente es la cara interna de los labios menores. Típicamente tienen un borde bien delimitado, irregular, miden entre 1-2mm de profundidad y presentan eritema perilesional. Al igual que en la variante oral la causa es desconocida. Su diagnóstico suele ser de exclusión (tabla 4).
Causas de úlceras o erosiones vulvares
| Infecciosas |
| Bacterianas |
| Sífilis, chancroide, linfogranuloma venéreo, granuloma inguinal, impétigo |
| Víricas |
| Herpes simple, VIH, virus de Epstein Barr, citomegalovirus, Influenza A |
| Fúngicas |
| Cándida |
| Otras |
| Leishmaniasis y amebiasis |
| No infecciosas |
| Inflamatorias |
| Ampollosas |
| Pénfigo vulgarPenfigoide ampollosoPenfigoide de mucosasEnfermedad de Hailey-HaileyLupus eritematoso sistémico ampollosoEnfermedad IgA lineal |
| No ampollosas |
| Liquen plano erosivoLiquen esclerosoEnfermedad de CrohnAftosis idiopáticaAftosis secundariasEnfermedad de BehçetPioderma gangrenosoVulvitis de ZoonDeficiencia de vitamina B12Déficit de hierro o de folatoDermatitis de contacto agudaExantema fijoEritema multiformeNecrolisis epidérmica tóxicaDermatitis autoinmune por progesteronaHidradenitis supurativaAcrodermatitis enteropática |
| Malignas |
| Carcinoma basocelular, carcinoma epidermoide, neoplasia intraepitelial vulvar (VIN), enfermedad de Paget extramamaria, linfomas, histiocitosis X |
| Traumáticas |
| Físicas (excoriaciones, traumatismos, facticia)Químicas (antisépticos, 5-FU, podofilotoxina) |
Un tipo especial son las úlceras de Lipschütz, descritas por este autor en 1913131. Este cuadro se caracteriza por la aparición de una o más úlceras dolorosas en mujeres generalmente vírgenes y sin antecedentes previos, en el contexto de un síndrome febril y malestar general. Las úlceras suelen aparecer en la cara interna de los labios menores y pueden adoptar una disposición «en beso» o «en espejo». Suelen tener un borde sobreelevado y bien definido, con eritema y edema asociados y un exudado pseudomembranoso o una escara marronácea adherente132 (fig. 15). Su etiología es desconocida, pero se ha asociado a diferentes primoinfecciones por agentes infecciosos. Actualmente el virus de Epstein-Barr133,134 es el más implicado, aunque se ha relacionado con otros virus, incluso influenza A135. El diagnóstico diferencial debe incluir a todas las patologías que cursan con úlceras vulvares agudas. El proceso es autolimitado y se resuelve espontáneamente133, aunque se recomiendan medidas sintomáticas, siendo útiles los corticoides tópicos u orales132.
Enfermedad de BehçetEnfermedad inflamatoria crónica multisistémica, de etiología desconocida, caracterizada por úlceras aftosas orales y genitales recidivantes, lesiones oculares y lesiones cutáneas como eritema nodoso, acompañadas en ocasiones de artritis, trastornos gastrointestinales y del sistema nervioso central. Entre los criterios diagnósticos de este cuadro se encuentra la aparición de úlceras genitales recurrentes, que ocurren entre el 57-93% de los pacientes123, y que junto a las úlceras orales son lo más característico de la enfermedad. Pueden curar con cicatriz, por lo cual deben buscarse en ausencia de lesiones activas123. En mujeres con úlceras genitales se considera como primera opción de tratamiento la colchicina sola o asociada a penicilina G benzatina. Otros tratamientos son la talidomida, dapsona, ciclosporina, azatioprina y agentes anti-TNF136.
Vulvitis de células plasmáticasEntidad descrita en 1957 por Garnier137. Aunque más rara que su variante masculina, puede aparecer en las mucosas del vestíbulo, epitelio periuretral o labios menores. Su causa es desconocida, aunque se sugiere un origen inmune. Ha recibido otros nombres como vulvitis plasmocelular, vulvitis de Zoon o vulvitis circunscrita plasmocelular. Puede ser asintomática o producir prurito, quemazón, irritación o dispareunia. Se presenta como una o más placas eritematosas, brillantes, bien definidas, con un tono característico anaranjado-marronáceo y ocasional moteado puntiforme purpúrico2 (fig. 16). Suelen ser bilaterales y simétricas. Clínicamente se debe diferenciar del liquen plano, el exantema fijo y la neoplasia intraepitelial vulvar. Debe realizarse biopsia, ya que el diagnóstico definitivo es histológico. Se observa un denso infiltrado inflamatorio en banda de células plasmáticas asociado a epidermis atrófica con moderada espongiosis y queratinocitos en forma de diamante23. Dada la presencia habitual las células plasmáticas en la mucosa vulvar su porcentaje debe sobrepasar el 50% para ser diagnóstico. Si se encuentran ente un 25-50% deben reunirse otros criterios como el depósito de hemosiderina y la atrofia epitelial138. No es necesario tratamiento en mujeres asintomáticas. Los corticoides tópicos potentes son la primera línea terapéutica139. Otros tratamientos son el acetónido de triamcinolona intralesional, el imiquimod140,141 y la ciclosporina tópica142. El tacrolimus tópico no presenta la misma eficacia que en los casos de balanitis143.
ConclusiónLa patología cutánea vulvar constituye un motivo frecuente de consulta para el dermatólogo en el momento actual. Supone un gran impacto en las pacientes, ya que asocia una importante morbilidad, ansiedad, connotación social, miedo a las patologías malignas o a las enfermedades de transmisión sexual y afectación en la vida de pareja.
La vulva, al igual que el resto de la piel, puede verse afectada por múltiples enfermedades de diferentes etiologías, pero sus especiales condiciones anatómicas y fisiológicas hacen que tenga algunas peculiaridades que pueden suponer una dificultad en su manejo. El patrón clínico de cada una de las dermatosis vulvares es variado y, por otra parte, muchas de ellas pueden manifestarse clínicamente casi de forma idéntica. Por lo tanto, en el estudio de este grupo de dermatosis son básicas una cuidada anamnesis basada en una buena relación médico-paciente, una exploración física completa, así como una correcta correlación clínico-histológica, con un enfoque amplio y multidisciplinar, en el que los dermatólogos son el pilar fundamental.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.