El objetivo de la medicina basada en la evidencia es entregar herramientas que permiten localizar, evaluar y aplicar la mejor evidencia científica, permitiendo de esta forma apoyar la toma de decisiones clínicas y mejorar el cuidado de nuestros pacientes. Este artículo resume los pasos básicos para la práctica de la medicina basada en evidencia en dermatología, con énfasis en las cuatro etapas fundamentales de este proceso: la formulación de una correcta pregunta clínica, la búsqueda de la información, la evaluación crítica de la información encontrada y la integración de esta información en la experiencia y juicio clínico, con el fin de ayudar a tomar la mejor decisión según cada escenario.
The aim of evidence-based medicine is to support clinical decision making by providing tools for systematically locating, appraising, and applying the best information currently available to improve patient outcomes. This article summarizes the basic steps for practicing evidence-based medicine in the management of cutaneous diseases. Special emphasis is placed on the following 4 major steps in the process: asking a clinical question taking into consideration 4 elements; finding the evidence; critically appraising the evidence; and integrating the new information into clinical expertise and judgment, in order to make the best decision in each clinical setting.
En medicina, la toma de decisiones clínicas, basada únicamente en deducciones derivadas del conocimiento de la fisiopatología y la experiencia clínica personal, plantea varias dificultades y limitaciones a nuestra práctica diaria1,2.
Por un lado, el conocimiento de la fisiopatología de las enfermedades cutáneas, producto a su vez del explosivo crecimiento de las ciencias básicas en dermatología, se encuentra en un proceso de renovación constante, lo cual implica que las decisiones basadas en este«pensamiento fisiopatológico»variarán también dramáticamente de un día para otro3,4. Asimismo, son varios los casos en los que la plausibilidad biológica de varias intervenciones ampliamente utilizadas en dermatología y en medicina general ha sido finalmente rechazada o, peor aun, considerada peligrosa, después de su evaluación en ensayos clínicos o metaanálisis5-7.
Por otro lado, sin desestimar la gran fuente de conocimiento que constituye la experiencia personal, la toma de decisiones únicamente basadas en ésta implica muchas veces una sobreestimación de las experiencias anecdóticas, con una tendencia a recordar la evidencia científica aprendida en forma previa, y una incorrecta incorporación de evidencia reciente más significativa, sobre todo cuando ésta va en desacuerdo con las creencias y experiencias previas1-4.
La variable correlación que existe entre las deducciones derivadas de la fisiopatología y la experiencia personal, y la efectividad y seguridad clínica real de muchas intervenciones en medicina, hace necesario integrar el conocimiento derivado de la investigación clínica a la toma de decisiones en medicina, así como también mantener una constante actualización de los conocimientos.
Diariamente nos vemos sometidos a incertidumbres en relación a cómo diagnosticar, entregar un pronóstico o tratar a nuestros pacientes. Por otra parte, el volumen de la literatura médica crece de forma exponencial8, no existiendo, lamentablemente, una relación directa entre el volumen de la información publicada y la calidad de ésta9-11. Existe en la dermatología, como en otras especialidades, un exceso de información de calidad muy heterogénea, situación que hace muy difícil lograr una actualización completa, basada en la mejor información científica disponible.
La medicina basada en la evidencia (MBE) propone una serie de herramientas para encontrar información de forma eficiente, analizarla críticamente y usarla de forma correcta4.
¿Qué es la medicina basada en la evidencia?La definición de MBE es«el empleo concienzudo, explícito y juicioso de la mejor evidencia disponible, en la toma de decisiones clínicas para el cuidado de pacientes individuales». La dermatología basada en la evidencia (DBE) es la aplicación de los principios de la MBE en el cuidado de nuestros pacientes con enfermedades cutáneas3,4. El concepto fundamental tras la práctica de la MBE es la integración de la mejor evidencia científica disponible, derivada fundamentalmente de la investigación clínica, la experiencia clínica y la consideración de las circunstancias y preferencias del paciente.
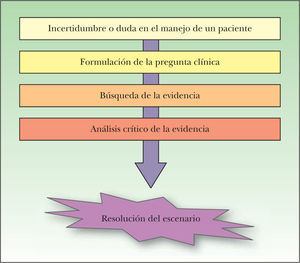
Conceptos generales sobre medicina basada en la evidenciaLa práctica de la MBE se realiza en cuatro etapas (fig. 1), cuyo proceso parte de la incertidumbre en el manejo de un paciente y termina en la aplicación de la evidencia encontrada en la toma de decisiones con este paciente.
El proceso de la medicina basada en la evidencia nace ante la incertidumbre generada en la toma de decisiones frente a un paciente particular. Una vez identificada esta incertidumbre, el siguiente paso es la transformación de ésta en una pregunta clínica estructurada, la posterior búsqueda y el análisis crítico de la información encontrada, para finalizar resolviendo el escenario, aplicando esta evidencia a la toma de decisiones, como una herramienta más, junto con el correcto juicio, la experiencia clínica, y los valores y las preferencias del paciente.
La identificación de una incertidumbre y la traducción de ésta en una pregunta clínica contestable es la primera etapa en la práctica de la MBE4.
En general, las preguntas que se generan pueden ser clasificadas en dos categorías:
- 1.
Preguntas básicas: que tienen relación con características generales de una enfermedad, siendo respondidas recurriendo a libros de texto, apuntes de clases o artículos de revisión.
- 2.
Preguntas de acción (o preguntas clínicas): tienen relación directa con la toma de decisiones en un paciente particular, ya sea en el diagnóstico, la terapia o el pronóstico de una condición determinada.
Este último tipo de preguntas, en general, no pueden ser respondidas de forma actualizada a través de los medios tradicionales, como los libros de texto; para responderlas es necesario el uso de otras fuentes de información, como los estudios publicados en revistas biomédicas y el uso de bases de datos vía Internet.
Etapas para la formulación de preguntas clínicas- 1.
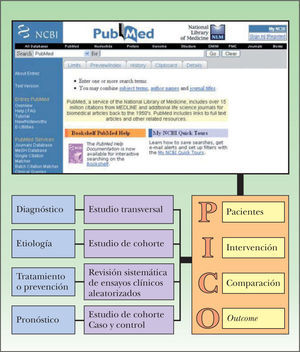
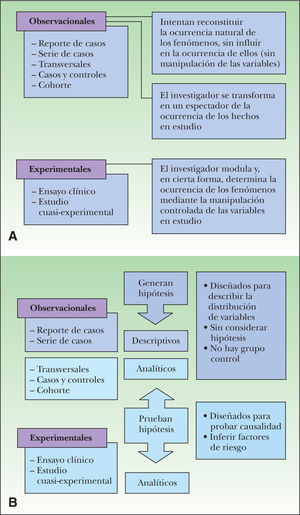
El primer paso para formular una pregunta de acción es establecer claramente qué tipo de aspecto aborda el interrogante, es decir, si éste tiene relación con el diagnóstico, el tratamiento, la prevención o el pronóstico de una determinada situación clínica. Distintos tipos de estudios epidemiológicos responderán a diferentes preguntas clínicas (fig. 2). En la figura 3 y en la tabla 1 se presenta un resumen de los tipos de estudios epidemiológicos y su clasificación.
Figura 2.La formulación de una pregunta clínica adecuada parte por incluir este interrogante en alguna categoría, ya sea en el diagnóstico, la etiología, el tratamiento o el pronóstico de una condición clínica, lo que determina el tipo de estudio epidemiológico que debemos buscar. Posteriormente, nuestra pregunta debe dividirse en 4 partes, lo que nos ayudará a encontrar el estudio que responda a nuestra pregunta de forma más eficiente, introduciendo los 2 ó 3 primeros elementos de esta pregunta en una base de datos como PubMed.
Figura 3.A. Los estudios epidemiológicos se dividen en experimentales y observacionales. En los primeros se produce una manipulación de una exposición determinada en un grupo de individuos. Si ha existido manipulación pero no aleatorización se habla de estudios cuasi-experimentales. Cuando el experimento no es posible se diseñan estudios observacionales que simulan el experimento que no se ha podido realizar. B. Los estudios observacionales se pueden clasificar, a su vez, en analíticos o no analíticos. Todos los estudios experimentales son analíticos.
Tabla 1.Características principales de los estudios epidemiológicos
Estudios observacionales no analíticos - –
Describen a un paciente o a un grupo de pacientes con un diagnóstico similar
- –
Sirven para generar nuevas hipótesis, pero para evaluar la presencia de asociación estadística
- –
La gran limitación es la ausencia de un grupo control
Estudios observacionales analíticosPrevalencia o corte - –
Estudian simultáneamente la exposición y la enfermedad en un momento determinado
- –
Esta medición simultánea no permite conocer la secuencia temporal de los acontecimientos
- –
Cuando se estudia una prueba diagnóstica y se compara con un estándar de oro se denomina estudio de corte diagnóstico
- –
Estudia un grupo de sujetos enfermos y los compara con un grupo control que no tenga la enfermedad
- –
La relación entre uno o varios factores relacionados con la enfermedad se examina comparando la frecuencia de exposición a éste u otros factores entre los casos y los controles
- –
La medida de asociación que permite cuantificar esta asociación se llama odds ratio. Este diseño no permite calcular la incidencia
- –
En este tipo de estudio los individuos son identificados en función de la presencia o ausencia de exposición a un determinado factor
- –
Al inicio del estudio todos están libres de la enfermedad de interés y son seguidos durante un período de tiempo para observar la frecuencia de aparición del fenómeno en estudio
- –
Permite estimar la incidencia
Estudios experimentales: ensayo clínico - –
Es el que permite acercarse a la noción de causalidad de manera más directa
- –
Las características que un ensayo clínico idealmente debería tener son:
- 1.
Un diseño que considere uno o más grupos experimentales y uno o más grupos controles, comparables entre sí
- 2.
La asignación de los individuos debe ser aleatoria
- 1.
Síntesis de la información: revisiones sistemáticas - –
Distintas de las revisiones narrativas o«puestas al día»
- –
Síntesis estructuradas, protocolizadas y sistemáticas de la evidencia científica actual, relacionada con un determinado problema
- –
La búsqueda de información en varias fuentes, incluyendo bases de datos, búsqueda manual de artículos en revistas, contacto por expertos, entre otros
- –
Existe una evaluación de calidad de los estudios incluidos
- –
Dan la visión más completa y menos sesgada sobre el estado del arte acerca de un tema en particular
- –
Cuando se cumplen ciertos requisitos, toda la información recopilada puede resumirse en una medida de efecto única, conocida como metaanálisis
- –
- 2.
El segundo paso es dividir la pregunta en cuatro elementos: pacientes, intervención, comparación y outcome (fig. 2). En la tabla 2 se presenta un ejemplo de una pregunta clínica bien diseñada y otra mal diseñada.
Tabla 2.Resumen de las definiciones usadas para formular preguntas clínicas contestables, junto con un ejemplo de una pregunta sobre terapia bien diseñada y otra mal diseñada
Paciente Intervención Comparación Outcome Definiciones Establecer las características del paciente que hace nacer la incertidumbre Especificar cuál es la intervención (tratamiento, factor pronóstico o estudio diagnóstico) que queremos analizar Especificar cuál es la comparación que queremos hacer (placebo, otro tratamiento, otro procedimiento diagnóstico) Cuál es el efecto (outcome) que estamos buscando Pregunta clínica bien diseñada En un hombre de 70 años con carcinoma basocelular nodular en el dorso nasal… … el uso de la terapia fotodinámica con ácido metil-aminolevulínico es más efectivo que… .... la extirpación quirúrgica… … en disminuir las recurrencias a los 5 años? Pregunta clínica mal diseñada ¿Cuál es el tratamiento del carcinoma basocelular?
La elaboración de la pregunta clínica según este formato es un paso fundamental en el proceso de la MBE, ya que, además de focalizar y clarificar nuestra incertidumbre, permite, eligiendo las palabras desde los dos o tres primeros componentes de la pregunta, encontrar artículos relevantes al introducirlos en una base de datos como PubMed, en la mayoría de los casos12.
Búsqueda eficiente de informaciónEn los últimos años hemos presenciado cambios revolucionarios en el modo en que la información médica se genera, divulga y utiliza13-15. Desde la introducción de Internet en el campo de la información en medicina, los formatos electrónicos han reemplazado las versiones impresas de libros, revistas e índices, siendo Internet la forma actual en la que los médicos buscamos información para sustentar nuestras decisiones.
Existe actualmente una«explosión»de fuentes de información disponible vía Internet que si bien ha aumentado el acceso a la información, también ha hecho más difícil la búsqueda, convirtiendo este proceso muchas veces en una experiencia frustrante y agotadora16,17.
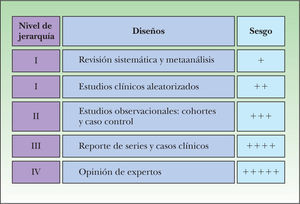
Dado que no toda la información publicada es de igual valor, la MBE propone una clasificación jerárquica de la información, basada fundamentalmente en el diseño de los estudios, lo que está directamente en relación con la calidad y probabilidad de sesgo de éstos. De esta manera, aquellos estudios cuyo diseño ofrezca la información con menos riesgo de sesgo ocupan el primer lugar dentro de este orden jerárquico, conocido como los niveles de evidencia. Para el caso de los estudios sobre terapia, este primer lugar lo ocupan las revisiones sistemáticas de ensayos clínicos, seguidas por los ensayos clínicos individuales (fig. 4).
En esta figura se explican los niveles de evidencia para estudios sobre terapia. El primer escalón de la evidencia está constituido por las revisiones sistemáticas, siendo el último escalón las recomendaciones basadas en la opinión de expertos. Esta jerarquía se establece según qué tipo de diseño ofrece la menor posibilidad de sesgo.
Una búsqueda de información con mayor posibilidad de encontrar aquélla de mejor calidad en el menor tiempo posible, es la que parte buscando en las fuentes de información preevaluada existentes en Internet. En estas fuentes preevaluadas la información contenida ha sido previamente sometida a un análisis crítico, basado en los principios de la MBE, ofreciendo altos niveles de evidencia, permitiendo una toma de decisiones sin tener que analizar nosotros mismos la validez metodológica de la información.
Muchos de estos recursos son gratuitos y generalmente están actualizados. En las siguientes líneas se describen en general aquéllos más relevantes para el dermatólogo debido a su metodología, formato simple de búsqueda y los altos estándares de información que entregan. En la tabla 3 se resumen los sitios web de acceso a estos recursos:
Resumen de los sitios web de acceso a los recursos presentados en el artículo
| Fuentes preevaluadas de información | |
| Bases de datos de revisiones sistemáticas y agencias evaluadoras de tecnologías en salud | |
| http://www.cochrane.orghttp://cochrane.bireme.brhttp://www.update-software.com/Clibplus/ClibPlus.asphttp://www.nottingham.ac.uk/~muzdhttp://www.york.ac.uk/inst/crd/crddatabases.htm |
| Revistas secundarias | |
| http://www.acpjc.orghttp://ebm.bmjjournals.comhttp://www.jr2.ox.ac.uk/bandolierhttp://www.archderm.com |
| Libros según la metodología MBE | |
| http://www.blackwellpublishing.com/medicine/bmj/dermatologyhttp://www.clinicalevidence.comhttp://www.uptodate.com |
| Guías de práctica clínica | |
| http://rms.nelh.nhs.uk/guidelinesfinderhttp://www.guideline.govhttp://www.g-i-n.nethttp://www.bad.org.uk/healthcare/guidelineshttp://www.aad.org/professionals/guidelines |
| Temas valorados críticamente | |
| http://www.bestbets.orghttp://www.minervation.comhttp://www.dermatoscopio.clhttp://ebderm.orghttp://www.bii.a-star.edu.sg |
| Metabuscadores | |
| http://www.tripdatabase.comhttp://sumsearch.uthscsa.edu |
| Fuentes de información primaria | |
| - PubMed | http://www.pubmed.com |
MBE: medicina basada en la evidencia.
Destaca en esta área la Colaboración Cochrane, organización sin fines de lucro que elabora y disemina revisiones sistemáticas de alta calidad metodológica sobre tratamiento, prevención y rehabilitación de patologías, de todas las especialidades. El Grupo Piel Cochrane es uno de los 50 grupos colaboradores actualmente existentes, aloja en su sitio actualmente alrededor de 30 revisiones sistemáticas publicadas, con un número de protocolos y títulos de futuras revisiones en continuo aumento18,19. DARE es un sitio que analiza críticamente las revisiones sistemáticas que aparecen en las principales bases de datos biomédicas. Se publican aquellas revisiones sistemáticas metodológicamente válidas en forma de un resumen estructurado, junto con un comentario crítico.
Revistas secundariasSe trata de publicaciones donde un grupo de expertos revisa estudios relevantes y bien diseñados, y en las que se adjunta un resumen estructurado junto a un análisis crítico del estudio en cuestión.
Libros desarrollados según la metodología de la medicina basada en la evidencia: BMJ Clinical Evidence, UpToDate y Evidence Based DermatologyEl primero se actualiza cada 6 meses y está orientado al tratamiento de problemas de salud frecuentes (actualmen te cubre alrededor de 200 patologías). Tiene un capítulo de enfermedades cutáneas que contiene información sobre el manejo de distintas entidades: acné, tiña pedis, onicomicosis, dermatitis atópica, celulitis, erisipela, psoriasis, escabiosis, pediculosis, herpes labial, cáncer de piel, arrugas, vitíligo, verrugas y dermatitis seborreica20.
UpToDate contiene un amplio listado de enfermedades de todas las áreas actualizado constantemente; si bien el proceso de búsqueda y el análisis de la información es menos riguroso que el desarrollado en Clinical Evidence, desde febrero de 2006 se ha incorporado un sistema de graduación de la evidencia entregada en cada tema.
Finalmente, Evidence Based Dermatology contiene información sobre el manejo de un amplio espectro de enfermedades cutáneas, elaborando recomendaciones basadas en revisiones sistemáticas y en ensayos clínicos en cada tema.
Guías de práctica clínica desarrolladas según la metodología de la medicina basada en la evidenciaRecomendaciones en cuanto al manejo de un problema de salud que abarca áreas como el diagnóstico, el tratamiento y el pronóstico de éste.
ríticamenteResúmenes de artículos evaluados críticamente, elaborados a partir de un escenario clínico específico.
Metabuscadores: Tripdatabase y SUMsearchSon herramientas de búsqueda que entregan información alojada en múltiples bases de datos, tanto preevaluadas como primarias, como PubMed, Biblioteca Cochrane, DARE, guías de práctica clínica, entre otras. Por este motivo, estos buscadores entregan tanto información previamente analizada críticamente como otra que no lo está.
Si bien la información contenida en estos recursos preevaluados ha aumentado considerablemente, su número, especialmente en dermatología, es todavía insuficiente para responder a toda la diversidad de preguntas clínicas que nos pueden surgir ante nuestros pacientes, por lo que el uso de bases de datos no filtradas como PubMed es frecuentemente necesario. Dado que la información en estas fuentes primarias no es sometida a un análisis crítico previo a su publicación, la evaluación de la calidad metodológica debe ser realizada por el lector, previa a su incorporación a la toma de decisiones, eligiendo para ello el diseño epidemiológico que ocupe el mejor lugar según los niveles de evidencia.
Búsqueda de información en fuentes primarias: PubMedA diferencia de las bases de datos preevaluadas, la cantidad de información disponible en las fuentes primarias, como PubMed, es muchas veces inabordable. Por esta razón, la correcta formulación de la pregunta clínica en el esquema PICO (pacientes, intervención, comparación, outcome) resulta aún más importante. Por otro lado, durante los últimos años varias herramientas han sido desarrolladas con el objetivo de ayudar a los clínicos a encontrar información de alta calidad de una forma más eficiente21.
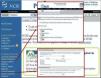
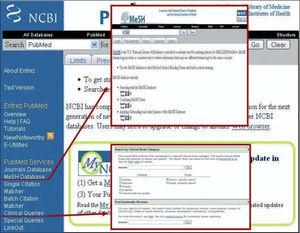
Un método muy útil para optimizar las búsquedas en PubMed es incorporar los MeSH (Medical Subject Headings), que corresponden a términos estandarizados que describen el contenido del artículo indizado en PubMed y lo relacionan con otros de contenido similar. Todos los artículos indizados en PubMed son catalogados mediante el uso de MeSH, por lo que incluirlos en la búsqueda supondrá un proceso más rápido y efectivo (fig. 5).
Otra herramienta útil en PubMed es clinical queries22,23 (fig. 5). Este recurso permite focalizar las búsquedas de acuerdo al tipo de pregunta clínica, ya sea sobre etiología, terapia, diagnóstico o pronóstico. Asimismo, estas búsquedas pueden ser hechas de forma sensible o específica, siendo esta última usualmente la más útil para obtener datos pertinentes en el menor tiempo. Las búsquedas ejecutadas usando esta herramienta tienden a ser clínicamente más relevantes que las realizadas en la interfase principal de PubMed.
Analizando críticamente la informaciónEvaluación de la calidad del estudioSi la información que resuelve nuestra incertidumbre se encuentra en una base de información preevaluada, el análisis crítico de la información generalmente ya fue realizada previo a su publicación, quedando únicamente por evaluar la magnitud de los resultados antes de la aplicación de la nueva información a la toma de decisiones. En cambio, cuando la información proviene de una base de datos primaria, como PubMed, es necesario realizar este análisis crítico previo a considerar la implementación de esta información en la clínica diaria. En la tabla 4 se resumen los puntos fundamentales, al analizar críticamente los estudios sobre terapia y diagnóstico24-29.
Características fundamentales para evaluar críticamente los estudios sobre terapia y diagnóstico. Las fallas metodológicas en el diseño de estos estudios están directamente relacionadas con la probabilidad de obtener resultados sesgados, lo que afecta tanto a la calidad del estudio como a su aplicación en la práctica diaria
Características fundamentales de un ensayo clínico bien diseñado
|
Características fundamentales de un estudio de diagnóstico bien diseñado
|
Características fundamentales de una revisión sistemática bien diseñada
|
Estudios de terapia. En los estudios sobre terapia, los resultados pueden presentarse de distintas formas, siendo la percepción de los médicos sobre la magnitud del efecto diferente, dependiendo de la forma en que éste se exprese30. Así, según la medida de efecto que se utilice, el impacto de una intervención podrá parecer de mayor o menor magnitud, cuando en realidad expresan lo mismo30.
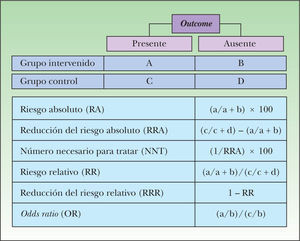
Para estudios de terapia las distintas medidas de efecto pueden presentarse tanto en términos absolutos (riesgo absoluto, reducción absoluta del riesgo y número necesario para tratar) como relativos (riesgo relativo y reducción relativa del riesgo), existiendo en Internet varias herramientas que calculan estos valores. Las medidas absolutas derivan de la diferencia entre la tasa de eventos observados en los grupos estudiados, mientras que las relativas resultan del cociente entre estas tasas.
Es importante recalcar que las medidas absolutas son dependientes del riesgo basal (riesgo de los sujetos sin intervención: grupo control o placebo), por lo cual su magnitud es extrapolable a un escenario clínico concreto, sólo en la medida en que el riesgo basal del sujeto tratado sea similar al de los sujetos del estudio analizado. Por el contrario, las medidas relativas se mantienen constantes en distintos escenarios clínicos, independientemente del riesgo basal30,31.
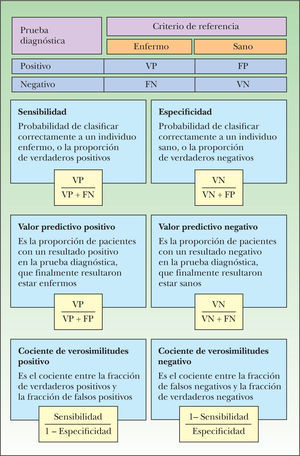
Estudios de pruebas diagnósticas. El correcto diagnóstico es la etapa inicial en el adecuado manejo de nuestros pacientes. La historia clínica y el examen físico nos dan una idea intuitiva de la probabilidad de que un paciente tenga un determinado diagnóstico. Esta idea intuitiva (que llamamos probabilidad pre-prueba), en algunos escenarios, no será suficiente ni para descartar una determinada enfermedad ni para confirmarla, siendo necesario solicitar pruebas diagnósticas para mover nuestra probabilidad pre-prueba hacia una nueva probabilidad, que llamaremos probabilidad post-prueba y que nos permitirá una toma de decisiones adecuada.
La sensibilidad y la especificidad son características intrínsecas de una prueba diagnóstica, independientes de la prevalencia de la enfermedad en la población en que se estudian. Sin embargo, no nos son de utilidad para la toma de decisiones en la clínica diaria, dado que su valor informa acerca de la probabilidad de obtener un resultado positivo o negativo, en función de la verdadera condición del sujeto con respecto a la enfermedad. Sin embargo, cuando solicitamos exámenes carecemos de información acerca de su verdadero diagnóstico.
Los valores predictivos son útiles para determinar la probabilidad de que un paciente esté sano o enfermo, en función de si el resultado de la prueba es negativo o positivo. Sin embargo, por ser altamente dependientes de la prevalencia (o probabilidad pre-prueba), tampoco son de gran utilidad en la práctica, puesto que cada paciente tiene una probabilidad pre-prueba distinta.
El cociente de verosimilitudes informa de cuánto más probable es que un paciente esté enfermo o sano en función de un resultado positivo o negativo de una prueba diagnóstica. Es independiente de la prevalencia, por lo que es constante en distintos escenarios clínicos.
En las figuras 6 y 7 se presenta el modo de cálculo de las medidas de efectos, tanto en estudios de terapia como de diagnóstico25,32,33.
Precisión de los resultados. Finalmente, todas las medidas de efecto analizadas corresponden al estimador puntual del efecto; sin embargo, si uno repitiera el estudio cien veces deberíamos obtener resultados similares al estimador puntual, pero no necesariamente iguales. El intervalo de confianza (IC) de un estimador puntual corresponde al rango dentro del cual éste«caerá»la mayoría de las veces que se repita el estudio30.
El más usado es el IC al 95 %, es decir, si repitiéramos el estudio cien veces, en 95 oportunidades el estimador puntual«caerá»dentro del intervalo considerado. Cuando los resultados se informan con IC estrechos, la precisión de los resultados es mayor que cuando éstos son más amplios. Cuando el IC pasa por el no-efecto (valor igual a 1 en el caso de las medidas relativas o valor cero en el caso de las medidas absolutas) puede tener dos significados, o bien la intervención no tiene efecto, o el tamaño muestral fue insuficiente para demostrarlo.
Resumiendo y almacenando la evidenciaTemas valorados críticamenteLos temas valorados críticamente, o Critically Appraised Topics, son un tipo de documento que permite archivar una pregunta clínica, junto con su respuesta, siguiendo el esquema de la MBE34. La elaboración de este tipo de documentos cumple con una doble misión: por un lado permite tener un registro personal de las preguntas que hemos ido respondiendo, y por otro permite compartir esta información con otros colegas que eventualmente requieran responder a las mismas preguntas. Asimismo, el formato de estos documentos es una pauta ideal para la presentación y el resumen de sesiones clínicas, así como para enseñar MBE a colegas principiantes.
El formato básico de estos documentos es el siguiente:
- 1.
Título que resume el contenido del documento.
- 2.
La pregunta clínica.
- 3.
La estrategia de búsqueda que se ha utilizado para encontrar la información.
- 4.
La referencia del estudio utilizado para responder a la pregunta.
- 5.
Un resumen de los resultados.
- 6.
Un comentario, que guarda relación con las características metodológicas del estudio, la relevancia de los resultados y la aplicación que éstos tienen en la práctica clínica.
- 7.
Referencias que complementan la información discutida en los comentarios.
Existen varios sitios que recopilan estos temas valorados críticamente, siendo asequibles por Internet. Entre los más conocidos está la sección de temas valorados críticamente de Archives of Dermatology35 y la sección del sitio Ebderm36, con un listado de estos temas.
Por otro lado, existe una herramienta disponible y gratis en Internet, llamada CatMaker, que permite una elaboración fácil y rápida de estos temas37.
Aplicando la evidencia al pacienteUna vez encontrada y analizada la evidencia, resta por introducir esta nueva información en la toma de decisiones en la situación clínica que hizo nacer la incertidumbre, siendo éste uno de los pasos más difíciles y delicados del proceso de la MBE.
Con este objetivo debemos evaluar la similitud del paciente al cual quiero beneficiar con esta evidencia con los sujetos que fueron incluidos en el estudio analizado, de modo que mi paciente se beneficie de los resultados de este
estudio, con una tasa de efectos adversos también similar. En este punto es vital establecer si la edad, el sexo, el tipo o el estadio clínico de la enfermedad en los sujetos incluidos y las intervenciones estudiadas, entre otras, permiten generalizar estos resultados a mi situación clínica concreta.
También es necesario establecer si los resultados del estudio tienen una consecuencia clínica real, de modo que sea esperable un cambio clínicamente relevante después de la aplicación de una determinada intervención. Así también es necesario considerar todos los potenciales efectos adversos de esta intervención.
Finalmente es vital considerar las preferencias y creencias del paciente, junto con los costes y recursos disponibles, a la luz del correcto juicio y la experiencia clínica.
Límites de la medicina basada en la evidenciaSi bien la práctica y la docencia en la MBE es el estándar en muchos centros y universidades, esta herramienta tiene varios límites que han hecho surgir fuertes críticas. Algunos de estos límites son:
- 1.
Es frecuente encontrarse, sobre todo en especialidades como la dermatología, ante la situación de que la literatura médica no permite tomar decisiones de forma concreta. Esta situación suele surgir la mayoría de las veces porque la información publicada es de mala calidad, o bien es inexistente. Sin embargo, como discutimos anteriormente, esta limitación la podemos resolver siguiendo ordenadamente los niveles de evidencia, incorporando la información del estudio con mayor calidad existente, en el primer caso, o bien aferrándonos a nuestra experiencia o a la de otros colegas más expertos, en el segundo.
- 2.
El paradigma de la MBE es el ensayo clínico aleatorizado y las revisiones sistemáticas, este tipo de información es relativamente escaso en nuestra especialidad, sobre todo en las enfermedades menos frecuentes. Esto, sin embargo, no descarta el rol de la MBE en dermatología, puesto que, por un lado, la MBE nos entrega las herramientas para seleccionar aquella información de mayor calidad, que no proviene de ensayos clínicos o revisiones sistemáticas, y por otro, considerando el crecimiento explosivo que han tenido en los últimos años tanto los estudios clínicos como las revisiones sistemáticas, es sólo cuestión de tiempo para que la mayoría de nuestras preguntas clínicas puedan ser resueltas mediante estos diseños metodológicos.
- 3.
Muchas veces pasa que teniendo la mejor evidencia para tomar decisiones esto no nos es posible, dadas las preferencias del paciente o bien por falta de recursos. Si volvemos a la definición de la MBE esto no parece ser un defecto de la propia MBE, sino más bien parte del proceso en el que las decisiones no necesariamente deben ser tomadas exclusivamente en base a lo que dicte la evidencia, sino que debe ser la integración de todos los factores (evidencia, juicio clínico, circunstancias) en un caso particular.
En nuestra opinión, gran parte de las críticas y limitaciones que se le adjudican a la MBE derivan del desconocimiento de su definición y metodología. Es esperable en los años venideros que esta situación mejore y sean muchos más los colegas que utilicen esta valiosa herramienta.
Conflicto de interesesDeclaramos no tener ningún conflicto de intereses.