La introducción de las terapias biológicas ha mejorado la calidad de vida de los pacientes con psoriasis y artritis psoriásica, aunque podría haber incrementado su carga económica.
Objetivo: Revisar los estudios de costes del manejo de la psoriasis y artritis psoriásica en cinco países de Europa (Alemania, España, Francia, Italia y Reino Unido).
MétodosRevisión sistemática de la literatura en Medline y Embase hasta mayo 2015. La calidad metodológica de las publicaciones se evaluó mediante las recomendaciones de la Consolidated Health Economics Reporting Standard (CHEERS). Se consideraron costes directos (sanitarios y no sanitarios) e indirectos, actualizados por la inflación de cada país y ajustados a dólares internacionales 2015 mediante la Paridad de Capacidad Adquisitiva (USD-PPP).
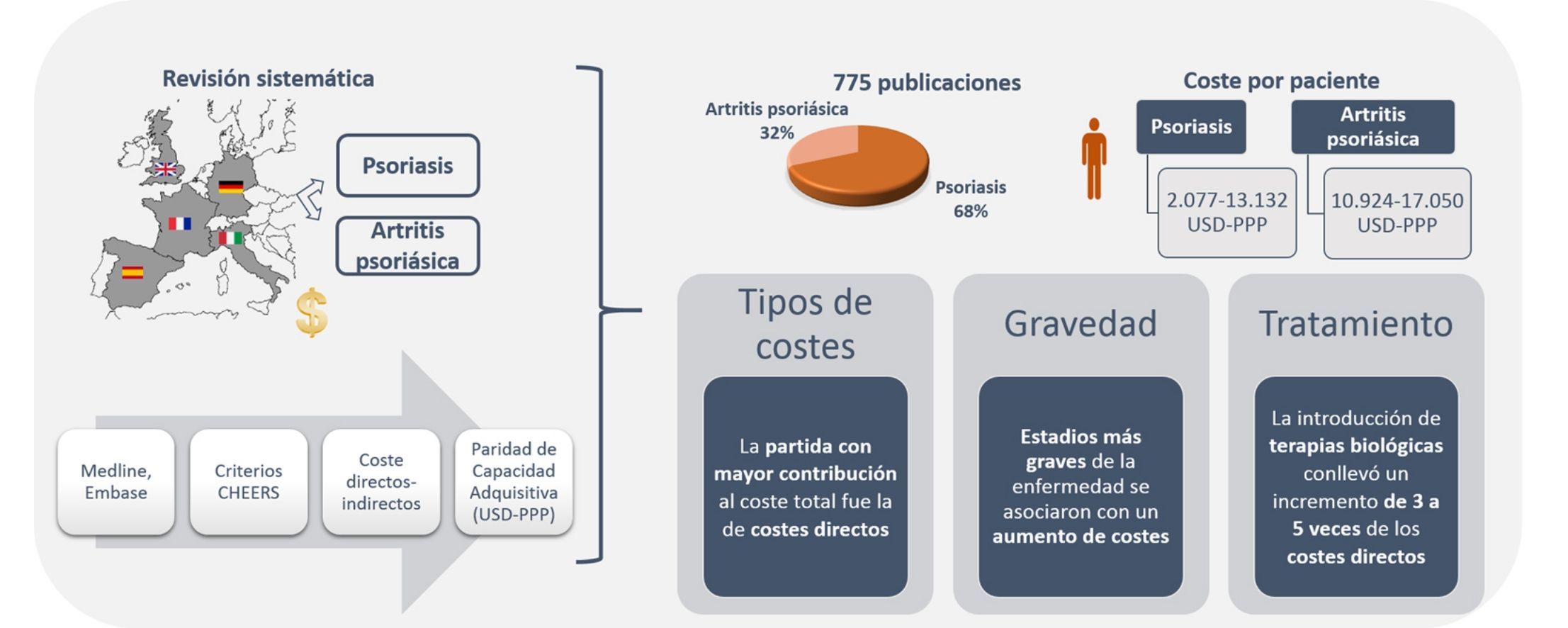
ResultadosSe identificaron 775 publicaciones, 68,3% de psoriasis y 31,7% de artritis psoriásica. El coste total anual por paciente osciló entre 2.077-13.132 USD-PPP y 10.924-17.050 USD-PPP en psoriasis y artritis psoriásica, respectivamente. En ambas patologías, la partida con mayor contribución al coste total fue la relacionada con costes directos. Estadios más graves de la enfermedad se asociaron con un aumento de costes. La introducción de terapias biológicas conllevó un incremento de 3 a 5 veces de los costes directos, que repercutió en los costes totales.
ConclusionesEsta revisión pone de manifiesto el impacto económico que supone el tratamiento y manejo de la psoriasis y artritis psoriásica, el cual aumenta en función de la gravedad del paciente y de la inclusión de terapias biológicas.
While the introduction of biologics has improved the quality of life of patients with psoriasis and psoriatic arthritis, it may have increased the economic burden of these diseases.
ObjectiveTo perform a systematic review of studies on the costs associated with managing and treating psoriasis and psoriatic arthritis in 5 European countries: Germany, Spain, France, Italy, and the United Kingdom.
MethodsWe undertook a systematic review of the literature (up to May 2015) using the MEDLINE and EMBASE databases. The methodological quality of the studies identified was evaluated using the Consolidated Health Economic Evaluation Reporting Standards checklist. We considered both direct costs (medical and nonmedical) and indirect costs, adjusted for country-specific inflation and converted to international dollars using purchasing power parity exchange rates for 2015 ($US PPP).
ResultsThe search retrieved 775 studies; 68.3% analyzed psoriasis and 31.7% analyzed psoriatic arthritis. The total annual cost per patient ranged from US $2,077 to US $13,132 PPP for psoriasis and from US $10,924 to US $17,050 PPP for psoriatic arthritis. Direct costs were the largest component of total expenditure in both diseases. The severity of these diseases was associated with higher costs. The introduction of biologics led to a 3-fold to 5-fold increase in direct costs, and consequently to an increase in total costs.
ConclusionsWe have analyzed the economic burden of psoriasis and psoriatic arthritis and shown that costs increase with the treatment and management of more severe disease and the use of biologics.
Las manifestaciones clínicas en la piel y las articulaciones asociadas a la psoriasis (Ps) y a la artritis psoriásica (APs), ambas enfermedades autoinmunes de carácter crónico, no solo suponen un impacto significativo en la calidad de vida relacionada con la salud de los pacientes1, sino también un importante impacto económico en los sistemas sanitarios2,3. La Ps generalmente sigue un curso crónico con recidivas que presenta diferentes manifestaciones cutáneas4. La APs es una entidad patológica crónica de afectación musculoesquelética, habitualmente seronegativa y que puede estar asociada a la Ps5. Los pacientes con APs, aunque no siempre, desarrollan manifestaciones cutáneas antes que síntomas articulares6, y en alrededor de un 80% de los casos, la presencia de Ps precede el comienzo de la APs7 con un periodo habitualmente superior a más de 10 años desde un diagnóstico previo de Ps6. Por otro lado, aunque no hay una correlación clara, parece más probable la presencia de APs en pacientes con formas más graves de Ps7.
La prevalencia de estas enfermedades no está bien definida, debido a la heterogeneidad de las manifestaciones clínicas y a la falta de homogeneidad de los criterios diagnósticos y de clasificación9–11. Las estimaciones de prevalencia de Ps y APs varían entre 1,3-2,2% y 0,3-1% de la población, respectivamente6,8. En España, aunque los estudios realizados son escasos, los últimos datos disponibles estiman que la prevalencia de la Ps se sitúa entre el 1,2% y el 2,3%12,13, mientras que la APs se estima que afecta al 0,17% de la población12. Por otro lado, la prevalencia de la APs en pacientes con Ps en Europa es significativa, variando de un 9,8% en la población española12 a un 13,8% en el Reino Unido14.
El abordaje terapéutico de la Ps y la APs es amplio, e incluye una primera etapa con terapia convencional (agentes tópicos, fototerapia, glucocorticoides, antiinflamatorios no esteroideos y fármacos antirreumáticos modificadores de la enfermedad sistémicos no biológicos) y una segunda con terapias biológicas (TB) en pacientes refractarios a la terapia convencional8,15,16.
Aunque recientemente se ha observado una relación dosis-dependiente entre la utilización de TB y el riesgo de infección3, estas presentan una gran efectividad y han mejorado considerablemente la calidad de vida relacionada con la salud de los pacientes8. La contrapartida a esta situación es que la introducción de nuevas TB podría incrementar la carga económica asociada a ambas enfermedades2,8. Por ello, el objetivo de este trabajo fue revisar los estudios de costes del manejo de la Ps y la APs en las 5 principales economías de Europa (Alemania, España, Francia, Italia y Reino Unido).
MétodosIdentificación de los estudiosSe realizó una revisión sistemática de la literatura en las bases de datos Medline y Embase (vía OVID) hasta mayo de 2015. La estrategia de búsqueda se basó en la utilización de términos de búsqueda relacionados con el tipo de pacientes e intervención (Medical Subject Headings, texto libre), operadores sintácticos y técnicas empleadas (búsqueda simple y combinada). La búsqueda no se limitó a ningún año de publicación, tipo de estudio o idioma e incluyó tanto artículos completos como comunicaciones a congresos. El anexo1 desglosa la estrategia empleada para las 2 enfermedades.
Selección de estudiosSe seleccionaron como elegibles aquellas publicaciones en revistas nacionales o internacionales que analizaran el coste de la enfermedad, en inglés o español, e incluyeran información sobre estimación de costes directos sanitarios (por ejemplo tratamiento farmacológico y no farmacológico, visitas médicas, pruebas diagnósticas, hospitalización, rehabilitación, costes sufragados por el paciente), no sanitarios (transporte, rehabilitación, desembolso del paciente) y/o costes indirectos (pérdida de productividad laboral por absentismo, baja por enfermedad, jubilación anticipada, desempleo, reorientación profesional). No hubo restricciones sobre el horizonte temporal de los estudios.
Se excluyeron publicaciones que no fueran estrictamente estudios de costes de la enfermedad (por ejemplo análisis coste-efectividad, coste-utilidad, coste-beneficio, impacto presupuestario, etc.), así como realizadas en países europeos distintos a los 5 seleccionados.
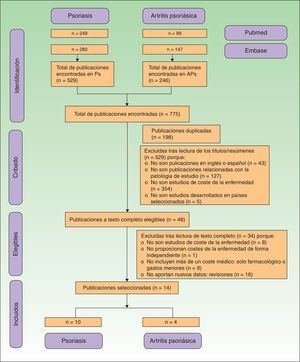
Todas las publicaciones duplicadas, rechazadas y seleccionadas se representan a través de un diagrama de flujo según los criterios de la declaración PRISMA17.
Extracción de datosLa extracción de los datos de las publicaciones fue realizada en 2 fases. En la primera uno de los autores (RB) recogió los datos y un segundo autor realizó la revisión de los mismos (IE). Finalmente, las discrepancias encontradas se resolvieron mediante discusión y consenso entre dichos autores. Se utilizó una plantilla normalizada con diferentes parámetros (autores/año de publicación, enfermedad, país, población de estudio, perspectiva utilizada, estimación de costes, resultados) para la recogida de los datos.
Los resultados de costes se recogieron en la divisa original de cada país (euros y libras esterlinas) (costes originales). Aquellos estudios que mostraban resultados en una moneda diferente al euro (Reino Unido, libras esterlinas) fueron transformados en euros según el tipo de cambio de referencia existente en el año de estimación del coste del artículo, con los índices proporcionados por el Banco Central Europeo18. Para su actualización en costes del año 2015, los costes del año de valoración en cada estudio se ajustaron por la inflación del país correspondiente, según los datos de variación del índice de precios de consumo armonizado proporcionados por OCDE.STAT19 (costes actualizados). Posteriormente, para equiparar el poder de compra de las diferentes monedas y eliminar la diferencia de precios entre países, se aplicó el factor de conversión de paridad de capacidad adquisitiva (en inglés Purchasing Power Parity [PPP]), convirtiendo los costes a dólares internacionales actualizados a 2015 (USD-PPP)20.
Evaluación de la calidadLa calidad de los estudios incluidos se valoró según la lista de recomendaciones de la Consolidated Health Economics Reporting Standard (CHEERS)21. De las 27 recomendaciones incluidas en los 24 ítems que conforman la lista, 11 de ellos no eran aplicables al tipo de estudio seleccionado para la revisión (estudios de costes de la enfermedad).
ResultadosSe identificaron 775 publicaciones, 529 (68,3%) sobre Ps y 246 (31,7%) sobre APs. Durante el proceso de selección se excluyeron 761 publicaciones, al tratarse de publicaciones duplicadas o por no cumplir con los criterios de inclusión (fig. 1). Finalmente se incluyeron 14 publicaciones, 10 relacionadas con los costes de la Ps (n=5.537 pacientes) y 4 con la APs (n=3.828 pacientes).
Alemania es el país con más publicaciones de estudios de costes de la enfermedad, tanto en Ps como en APs (n=5), seguido de Italia y España (n=3), Reino Unido (n=2) y Francia, con una sola publicación.
Todos los estudios en Ps recogieron costes directos sanitarios (farmacológicos y no farmacológicos) y en 2 de ellos se especificaron costes directos no sanitarios22,23. La perspectiva social se utilizó en todos los estudios, a excepción de 2, que utilizaron la perspectiva del sistema sanitario24,25. El método de capital humano se empleó para valorar los costes indirectos en 3 publicaciones22,26,27, mientras que una utilizó el método de costes de fricción28. El resto de publicaciones que utilizaron la perspectiva social no especificaron el método de cálculo de costes indirectos empleado. El horizonte temporal varió de 324,27 a 12 meses22,23,25,27,29,30. En 6 de las 10 publicaciones se seleccionaron pacientes con Ps de moderada a grave23,25–28,31, y solo 3 de ellas utilizaron herramientas como el Psoriasis Area Severity Index y/o el Body Surface Area26–28. De las 4 publicaciones restantes 2 estratificaron a los pacientes dependiendo de si habían sido hospitalizados o no22,29 y 2 evaluaron los costes asociados al manejo antes y después de la administración de TB23,25 (tabla 1).
Características de los estudios de análisis de costes de la psoriasis
| País | Autor, año de publicación | Características del estudio (pacientes, diseño) | Perspectiva | Estimación de costes |
|---|---|---|---|---|
| Alemania | Berger et al., 200526 | Con Ps en placas moderada (BSA: 10-20%) a grave (BSA>20%) de 18-75 años (n=156) Observacional retrospectivo (3 meses previos) y prospectivo (6 meses posteriores), nacional y multicéntrico | Social | Directos: tratamiento farmacológico y no farmacológico, pruebas diagnósticas, visitas médicas, hospitalización, rehabilitación u otros gastos adicionales Indirectosa: pérdida de productividad laboral: absentismo laboral, incapacidad laboral, desempleo y jubilación anticipada (CH) |
| Alemania | Schöffski et al., 200728 | Con Ps en placas moderada a grave (PASI>12 y/o BSA>10%),>18 años (n=184) Observacional retrospectivo (12 meses), nacional y multicéntrico | Social | Directos: tratamiento farmacológico y no farmacológico (fototerapia), visitas médicas, hospitalización, rehabilitación u otros gastos menores. Indirectosa: pérdida de productividad laboral por absentismo laboral, desempleo, reorientación profesional, incapacidad laboral y jubilación anticipada (CF) |
| Alemania | Lang et al., 200929 | Con Ps sin especificar gravedad (n=120). Estratificación de pacientes en pacientes externos y hospitalizados y según modalidad de tratamiento. Observacional retrospectivo (12 meses), nacional en único centro | Social | Directos: médicos: farmacológico y no farmacológico (fototerapia). Otros gastos directos sanitarios cubiertos por el sistema sanitario no especificados Indirectos: pérdida de tiempo de trabajo (pérdida de productividad). Incluye directos no médicos. Costes no especificados |
| Alemania | Steinke et al., 201322 | Con Ps (n=120). Análisis del consumo de recursos de pacientes ambulatorios (n=71) vs pacientes hospitalizados (n=49) Observacional retrospectivo (12 meses), nacional en único centro | Social | Directos: tratamiento farmacológico y no farmacológico (radioterapia), visitas médicas, pruebas diagnósticas. Directos no sanitarios: transporte Indirectosa: pérdida de productividad laboral (CH) |
| España | Carrascosa et al., 200630 | Ps con diferente gravedad (n=797) (EPIDERMA project: fase ii) Observacional prospectivo (12 meses), nacional, multicéntrico | Social | Directos: tratamiento farmacológico y no farmacológico, visitas médicas, pruebas de laboratorio, hospitalización Indirectos: pérdida productividad laboral |
| España | Sanchez-Carazo et al., 200931 | Ps de moderada a grave, sin especificar herramienta valoración gravedad (n=1.217) Observacional prospectivo (4 meses), nacional, multicéntrico | Social | Directos: farmacológicos y no farmacológico (fototerapia), cirugía, visitas a urgencias, consultas médicas, pruebas diagnósticas y de laboratorio Indirectos: pérdida de productividad (a tiempo total o parcial), asistencial social, gastos de bolsillo realizados directamente por el paciente (gastos de viajes, cuidadores formales) |
| Francia | Le Moigne et al., 201423 | Ps moderada a grave≥18 años (n=1.924) en tratamiento con fármacos biológicos (n=69) y con terapia convencional (n=1.855) Observacional retrospectivo (6 meses previos y 6 meses después de la utilización de biológicos), nacional, multicéntrico | Social | Directos: tratamiento farmacológico y no farmacológico (fototerapia), visitas médicas u otros profesionales de la salud, pruebas de laboratorio y diagnósticas, hospitalización y cuidados de enfermería. Directos no sanitarios: transporte Indirectos: pérdida de productividad laboral: solo remuneración diaria por baja por enfermedad |
| Italia | Finzi et al., 200124 | Ps sin especificar gravedad (n=793) Observacional retrospectivo (3 meses), nacional multicéntrico | SNS | Directos: tratamiento farmacológico (no incluye fármacos biológicos) y no farmacológico, visitas médicas y hospitalización |
| Italia | Colombo et al., 200827 | Ps en placa moderada (PASI 12-20) a grave (PASI>20) Observacional prospectivo (3 meses), nacional, multicéntrico | Social | Directos: tratamiento farmacológico y no farmacológico (radioterapia), visitas médicas, pruebas diagnósticas y de laboratorio, hospitalización Indirectosa: pérdida de productividad laboral (CH) |
| Reino Unido | Fonia et al., 201025 | Ps en placa≥18 años que había iniciado el tratamiento con biológicos durante los 6 primeros meses previos a la recogida de datos (n=76) Observaciones retrospectivo (12 meses), nacional, en un solo centro | SNS | Directos: tratamiento farmacológico y no farmacológico (fototerapia), visitas médicas, hospitalización |
BSA: body surface area o área de superficie corporal; CF: costes de fricción; CH: capital humano; PASI: Psoriasis Area Severity Index; o índice de gravedad de psoriasis; Ps: psoriasis; SNS: Sistema Nacional de Salud.
En el método de costes de fricción la cantidad de productividad perdida por enfermedad depende del periodo de tiempo necesario para sustituir al trabajador enfermo. En el método de capital humano los costes indirectos se cuantifican en función de la reducción de ganancias brutas de los pacientes en el futuro.
Las 4 publicaciones seleccionadas en APs analizaron los costes farmacológicos y no farmacológicos entre los costes directos sanitarios, incluyendo 2 de ellas además los costes directos no sanitarios32,33. La perspectiva social es la utilizada en 3 de las publicaciones32–34, empleándose el método de capital humano exclusivamente en una de ellas33 y ambos métodos (capital humano y costes de fricción) en otra34. Una publicación no especificó el método de cálculo costes indirectos empleado32, y otra utilizó la perspectiva del sistema sanitario7. El horizonte temporal varió entre 1234 y 18 meses7,33. En un estudio no se especificó el horizonte temporal, aunque los costes se presentaron anualizados32. Todos los análisis calcularon el coste total de la APs después de un año, salvo un estudio que valoró el consumo de recursos 6 meses antes y después de la exposición a TB33. Uno de los estudios valoró el coste de la enfermedad en pacientes con APs no tratados previamente con TB7 (tabla 2).
Características de los estudios de análisis de costes de artritis psoriásica
| País | Autor (año publicación) | Características del estudio (pacientes, diseño) | Perspectiva | Estimación de costes |
|---|---|---|---|---|
| Alemania | Huscher et al., 200634 | Pacientes (<65 años) diagnosticados con APs que precisan cuidado reumatológico durante al menos un mes (n=908) Observacional retrospectivo (12 meses), nacional, multicéntrico | Social | Directos: tratamiento farmacológico y no farmacológico, cirugía, visitas médicas, estancia hospitalaria, pruebas diagnóstico, gastos adicionales por los tratamientos prescritos y pagados por el paciente relacionados con la enfermedad Indirectosa: pérdida de productividad: baja por enfermedad y jubilación anticipada (CH y CF) |
| España | Moreno et al., 200932 | Pacientes con APs sin especificar gravedad ni edad de reclutamiento (n=287) Observacional retrospectivo nacional, multicéntrico | Social | Directos: a) médicos: medicamentos (adquisición) de medicamentos pagados o no por el paciente, hospitalización, cirugía, visitas médicas u otros profesionales sanitarios o de medicina alternativa, pruebas de laboratorio y diagnósticas y sesiones de fototerapia; b) no médicos: asistencia social y otros gastos pagados por el paciente (cuidadores formales y otras inversiones relacionadas con la enfermedad) Indirectos: pérdida de productividad (parcial o completa) |
| Italia | Olivieri et al., 200833 | Pacientes diagnosticados (>18 años) con APs con fracaso o intolerancia a la terapia convencional (n=107) Observacional prospectivo (18 meses) nacional multicéntrico | Social | Directos: tratamiento farmacológico, cirugía, visitas médicas, pruebas de laboratorio y diagnóstico, hospitalización, proceso de rehabilitación y otros costes y transporte Indirectosa: costes realizados por pacientes y cuidadores y absentismo laboral (CH) |
| Reino Unido | Poole et al., 20106 | Pacientes con APs, bien procedentes del BSRBR (n=296 pacientes naïve a TB y que comienzan con etanercept), bien procedentes del THIN (n=2.526) observados 6 meses antes del diagnóstico de APs y 12 meses después Observacional retrospectivo nacional multicéntrico | SNS | Directos: tratamiento farmacológico, visitas médicas u otros profesionales de la salud, pruebas diagnósticas y hospitalización |
APs: artritis psoriásica; BSRBR: British Society of Rheumatology Biologics Register; CH: capital humano; CF: costes de fricción; SNS: Sistema Nacional de Salud; TB: terapia biológica; THIN: The Health Improvement Network.
En el método de capital humano los costes indirectos se cuantifican en función de la reducción de ganancias brutas de los pacientes en el futuro. En el método de costes de fricción la cantidad de productividad perdida por enfermedad depende del periodo de tiempo necesario para sustituir al trabajador enfermo.
Tras aplicar la lista CHEERS a los estudios seleccionados se observó que en 8 de ellos (7 en Ps y uno en APs) no especificaba explícitamente la fuente de financiación y 6 (5 en Ps y uno en APs) no informaban sobre el conflicto de intereses, población incluida y metodología para obtener las preferencias para cada medida de resultado. En 5 de los estudios (3 Ps y 2 APs) no se detallaron los subgrupos de población seleccionados (tabla 3).
Resultados de la evaluación según la lista recomendaciones CHEERSa
| Berger et al. 200526 | Schöffski et al. 200728 | Lang et al. 200929 | Steinke et al. 201322 | Carrascosa et al. 200630 | Sanchez-Carazo et al. 200931 | Le Moigne et al. 201423 | Finzi et al. 200124 | Colombo et al. 200827 | Fonia et al. 201025 | Huscher et al. 200634 | Moreno et al. 200932 | Olivieri et al. 200833 | Poole et al. 20106 | % (n)b | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Título, introducción y método | |||||||||||||||
| Título | 0% (0) | ||||||||||||||
| Resumen | 29% (4) | ||||||||||||||
| Antecedentes y objetivos | 21% (3) | ||||||||||||||
| Población objetivo y subgrupos | 36% (5) | ||||||||||||||
| Contexto y lugar | 14% (2) | ||||||||||||||
| Perspectiva | 14% (2) | ||||||||||||||
| Horizonte temporal | 7% (1) | ||||||||||||||
| Medición y valoración resultados basados en preferencias | 43% (6) | ||||||||||||||
| Estimación del uso de recursos y costes | 0% (0) | ||||||||||||||
| Moneda, fecha costes y conversión | 29% (4) | ||||||||||||||
| Métodos de análisis | 29% (4) | ||||||||||||||
| Resultados | |||||||||||||||
| Parámetros del estudio | 29% (4) | ||||||||||||||
| Caracterización heterogeneidad | 29% (4) | ||||||||||||||
| Discusión | |||||||||||||||
| Hallazgos limitaciones, y conocimientos actuales | 21% (3) | ||||||||||||||
| Otros | |||||||||||||||
| Fuente financiación | 57% (8) | ||||||||||||||
| Conflicto interés | 43% (6) | ||||||||||||||
| % (n) | 13% (2) | 13% (2) | 69% (11) | 6% (1) | 25% (4) | 63% (10) | 19% (3) | 44% (7) | 6% (1) | 0% (0) | 0% (0) | 75% (12) | 13% (2) | 0% (0) | |
Los resultados se expresan en porcentaje de no cumplimiento. En gris, no cumple el ítem y en verde sí cumple el ítem correspondiente
Fuente: Husereau et al.21.
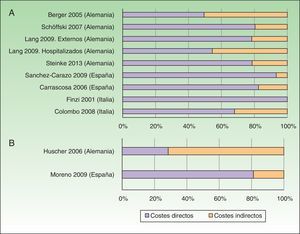
El coste anual por paciente con Ps, independientemente de su gravedad, se situó entre los 2.077-13.132USD-PPP paciente-año30,31, excluyendo aquellos estudios relacionados con tratamiento con TB23,25 y un estudio que valoró exclusivamente pacientes hospitalizados29. Los costes directos e indirectos oscilaron entre 1.715-8.925 y 364-4.207 USD-PPP paciente-año, respectivamente (tabla 4). Los costes directos fueron los que más contribuyeron al coste total (entre el 50-93%), correspondiendo el valor máximo a un estudio español31 (fig. 2A).
Costes de la psoriasis
| Autor, año publicación (año costes) | Población | Costes originales (paciente-año, €año costes) | Δ IPCA aplicado19 | Costes actualizados (paciente-año, euros de 2015) | Costes actualizados ajustados PPP20 (paciente-año, USD-PPP 2015) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Coste directo | Coste indirecto | Coste total | Coste directo | Coste indirecto | Coste total | Coste directo | Coste directo | Coste total | |||
| Alemania | |||||||||||
| Berger et al., 200526a (€2002) | Ps general | 1.426 | 1.440 | 2.866 | 21,9% | 1.738 | 1.755 | 3.494 | 2.217 | 2.239 | 4.456 |
| Ps moderada | 1.393 | 1.266 | 2.658 | 1.698 | 1.543 | 3.240 | 2.166 | 1.968 | 4.133 | ||
| Ps grave | 1.423 | 1.429 | 2.852 | 1.735 | 1.742 | 3.477 | 2.213 | 2.222 | 4.434 | ||
| Schöffski et al., 200728 (€2006) | Ps moderada grave | 5.397 | 1.310 | 6.707 | 14,3% | 6.169 | 1.497 | 7.666 | 7.868 | 1.910 | 9.778 |
| Lang et al., 200929 (ND)(€2009) | Pacientes hospitalizados | 9.510 | 2.973 | 17.458 | 8,5% | 10.318 | 3.226 | 18.942 | 13.161 | 4.114 | 24.161 |
| Paciente externo | 1.850 | 509 | 7.657 | 2005 | 552 | 8.297 | 2.560 | 704 | 10.597 | ||
| Steinke et al., 201322 (€2006) | General | 5.576 | 1.515 | 7.092 | 14,3% | 6.373 | 1.732 | 8.106 | 8.129 | 2.209 | 10.339 |
| Pacientes hospitalizados | 10.070 | 2.973 | 13.042 | 11.510 | 3.398 | 14.907 | 14.681 | 4.334 | 19.014 | ||
| Pacientes ambulatorios | 2.476 | 509 | 2.985 | 2.830 | 582 | 3.412 | 3.610 | 742 | 4.352 | ||
| España | |||||||||||
| Carrascosa et al., 200630 (€2003) | General | 891 | 189 | 1.079 | 27,8% | 1.139 | 242 | 1.379 | 1.715 | 364 | 2.077 |
| Leve | 775 | 118 | 893 | 990 | 151 | 1.141 | 1.492 | 227 | 1.719 | ||
| Moderado | 1.028 | 245 | 1.265 | 1.314 | 313 | 1.617 | 1.979 | 472 | 2.435 | ||
| Grave | 1.574 | 595 | 2.169 | 2.012 | 760 | 2.772 | 3.029 | 1.145 | 4.175 | ||
| Sanchez-Carazo et al., 200931 (ND; €2009) | Ps moderada a grave | 6.420 | 461 | 6.881 | 8,3% | 6.953 | 499 | 7.452 | 10.471 | 752 | 11.223 |
| Francia | |||||||||||
| Le Moigne et al., 201423 (ND, €2012) | Previo a TB | 1.586 | 105 | 1.678 | 1,7% | 1.613 | 107 | 1.707 | 1.967 | 130 | 2.081 |
| Posterior a TB | 8.111 | 28 | 8.107 | 8.249 | 28 | 8.245 | 10.060 | 35 | 10.055 | ||
| Italia | |||||||||||
| Finzi et al., 200124 (€1994) | General | 905 | No | 905 | 59,3% | 1.442 | No | 1.442 | 1.938 | No | 1.938 |
| Colombo et al., 200827 (€2006) | General | 5.690 | 2.682 | 8.372 | 16,7% | 6.640 | 3.130 | 9.770 | 8.925 | 4.207 | 13.132 |
| Moderada | 3.643 | 1.583 | 5.226 | 4.251 | 1.847 | 6.099 | 5.714 | 2.483 | 8.197 | ||
| Grave | 7.683 | 3.751 | 11.434 | 8.966 | 4.377 | 13.343 | 12.051 | 5.884 | 17.935 | ||
| Reino Unido | |||||||||||
| Fonia et al., 201025b (£2008) | Previo a TB | 4.207£/5.283€ | No | 4.207£/5.283€ | 18,1% | 4.968£/6.239€ | No | 4.968£/6.239€ | 7.097 | No | 7.097 |
| Posterior a TB | 11.891£/15.046€ | 11.891£/15.046€ | 14.043£/17.769€ | 14.043£/17.769€ | 20.061 | 20.061 | |||||
IPCA: índice de precios de consumo armonizado; ND: no datos; PPP: Purchasing Power Parity o paridad poder adquisitivo; Ps: psoriasis: TB: terapias biológicas.
Porcentaje de costes directos e indirectos en función del coste total por paciente-año (según costes actualizados, USD-PPP 2015). A. Psoriasis. B. Artritis psoriásica.
Se han excluido 2 estudios relacionados con psoriasis desarrollados en Francia23 y Reino Unido25 y uno en artritis psoriásica desarrollado en Italia33 al tratarse de estudios que valoran la exposición a fármacos biológicos.
Se observó un incremento de los costes en aquellos estudios que analizaron pacientes con estadios graves de la enfermedad (coste directo, indirecto y total entre 2.213-12.051, 1.145-5.884 y 4.175-17.935USD-PPP paciente-año, respectivamente). Cuando se valoraron los costes agrupando a pacientes con Ps moderada a grave, los costes directos y totales encontrados fueron similares (7.868-10.471 y 9.778-11.223 USD-PPP paciente-año, respectivamente), correspondiendo los costes más altos al estudio desarrollado en España31.
El coste total de los pacientes hospitalizados fue analizado en 2 estudios alemanes, siendo los costes directos y totales superiores al resto de estudios incluidos en esta revisión (13.161-14.681 y 19.014-24.161USD-PPP paciente-año, respectivamente)22,29.
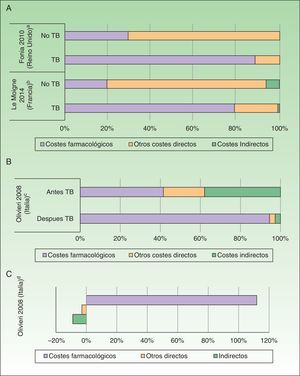
Por otro lado, se observó que los costes directos del manejo de la Ps aumentaron de 3 a 5 veces tras la administración de TB (antes de TB: 1.967 a 10.060; después de TB: 7.097-20.061 USD-PPP paciente-año), debido a un incremento de los costes farmacológicos (antes de TB: 412 a 8.013; después de TB: 2.111 a 18.064 USD-PPP paciente-año) afectando de forma similar a los costes totales23,25 (fig. 3A).
Impacto de la introducción de las terapias biológicas (TB). A. Porcentaje de costes antes y después de la exposición TB en psoriasis. B. Porcentaje de costes antes y después de la exposición TB en artritis psoriásica. C. Variación (en porcentaje) de costes antes y después de la exposición a TB en artritis psoriásica.
aPorcentaje de costes asociados a pacientes con psoriasis en placas. Los pacientes recibieron tratamiento con sistémicos no biológicos, tópicos antes y después del tratamiento con fármacos biológicos.
bPacientes con psoriasis grave a moderada. El coste farmacológico de los pacientes tratados con TB también incluye otros fármacos sistémicos.
cPacientes con artritis psoriásica con fracaso o intolerancia a la terapia convencional. El porcentaje de costes después del inicio del tratamiento basado en TB se ha calculado a partir del incremento del coste y el coste antes del inicio con TB.
dExpresa el incremento en costes en pacientes tratados con TB respecto al periodo anterior.
El coste anual por paciente de la APs se situó entre los 10.924-17.050USD-PPP paciente-año32,34, pudiendo superar los 57.000USD-PPP paciente-año si se consideran solo pacientes graves34. Los costes directos variaron entre 3.693-8.871USD-PPP paciente-año, y los indirectos entre 2.053-3.716 (método costes de fricción) y 12.192 USD-PPP paciente-año (método capital humano) (tabla 5). Entre los estudios que utilizaron la perspectiva social, la partida con mayor contribución al coste total varió de un estudio a otro presentando un mayor coste directo el estudio desarrollado en España32, mientras que el realizado en Alemania presentó costes indirectos superiores34 (fig. 2B).
Costes de la artritis psoriásica
| Autor, año publicación (año costes) | Población | Costes originales (paciente-año, €año, costes) | Δ IPCA aplicado19 | Costes actualizados (paciente-año, euros de 2015) | Costes actualizados ajustado PPP20 (paciente-año, USD 2015) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Coste directo | Coste indirectoa | Coste total | Coste directo | Coste indirectoa | Coste total | Coste directo | Coste indirectoa | Coste total | |||
| Alemania | |||||||||||
| Huscher et al., 200634 (€ 2003) | General | 3.156 | CF: 2.414 | CF: 5.570 | 20,7% | 3.809 | CF: 2.914 | CF: 6.723 | 4.859 | CF: 3.716 | CF: 8.575 |
| CH: 7.919 | CH: 11.075 | CH: 9.558 | CH: 13.368 | CH: 12.192 | CH: 17.050 | ||||||
| Mujeres vs. hombres | 3.406 | CF: 2.850 | CF:6.256 | 4.111 | CF: 3.440 | CF: 7.551 | 5.244 | CF: 4.338 | CF: 9.631 | ||
| CH: 9.463 | CH: 12.870 | CH: 11.422 | CF: 15.534 | CH: 14.569 | CF: 19.814 | ||||||
| 2.855 | CF: 1.986 | CF: 4.841 | 3.446 | CF: 2.397 | CF: 5.843 | 4.395 | CF: 3.058 | CF: 7.453 | |||
| CH: 6.134 | CH: 8.989 | CH: 7.404 | CH: 10.850 | CH: 9.444 | CH: 13.839 | ||||||
| Duración enfermedad (<5/5-10/>10 años) | 3.254/2.602/3.455 | CF: 2.529/1.578/2.548 | CF: 5.783/4.180/6.003 | 3.928/3.141/4.170 | CF: 3.053/1.905/3.075 | CF: 6.980/5.045/7.246 | 3.924/3.137/4.166 | CF: 3.893/2.429/3.923 | CF: 8.903/6.435/9.242 | ||
| CH: 4.654/6.365/11.173 | CH: 7.908/8.968/14.628 | CH: 5.617/7.683/13.486 | CH:9.545/10.824/17.656 | CH: 7.165/9.799/17.201 | CH: 12.175/13.807/22.520 | ||||||
| Estado funcional (70/50-70/<50) | 2.331/4.46/5.721 | CF: 1.280/4.831 12.098 | CF: 3.610/9.292/17.819 | 2.814/5.384/6.905 | CF: 1.545/5.831/14.602 | CF: 4.357/11.215/21.508 | 3.589/6.868/8.808 | CF: 1.971/7.438/18.625 | CF: 5.558/14.305/27.433 | ||
| CH: 3.268/14.252/31.720 | CH: 5.599/18.712/37.441 | CH: 3.944/17.202/38.286 | CH: 6.758/22.585/45.191 | CH: 5.031/21.942/48.834 | CH: 8.620/28.808/57.642 | ||||||
| España | |||||||||||
| Moreno et al., 200932 (euros de2008) | General | 5.449 | 1.261 | 6.710 | 8,1% | 5.890 | 1.363 | 7.254 | 8.871 | 2.053 | 10.924 |
| Italia | |||||||||||
| Olivieri et al., 200833 (euros de2007) | Previos terapia TB (anti TNF) | 943 | 576 | 1.519 | 14,4% | 1.079 | 659 | 1.738 | 1.450 | 886 | 2.336 |
| Incremento/descenso coste medio tras TB (anti-TNF) | 5.052 | –413 | 4.639 | 5.779 | –472 | 5.307 | 7.768 | –635 | 7.133 | ||
| Reino Unido | |||||||||||
| Poole et al., 20106,b (libras de 2007) | General | 1.446£ (2.113) | No | 1.446£ (2.113) | 22,4% | 2.585 | No | 2.585 | 3.693 | No | 3.693 |
| Edad (≤ 50/>50) | 1.094£ (1.599)/1.660£ (2.426) | 1.094£ (1.599)/1.660£ (2.426) | 1.957/2.968 | 1.957/2.968 | 2.796/4.240 | 2.796/4.240 | |||||
| Gravedad (HAQ≤1,2-HAQ>2,6 (leve-grave) | 548-4.832£ (801-7.061) | 548-4.832£ (801-7.061) | 980/8.640 | 980/8.640 | 1.400/10.997 | 1.400/10.997 | |||||
Anti-TNF: inhibidores del factor de la necrosis tumoral; APs: artritis psoriásica; CH: capital humano; CF: costes de fricción; IC: intervalo de confianza; IPCA: índice de precios de consumo armonizado; ND: no datos; PPP: purchasing power parity o paridad de poder adquisitivo; TB: terapias biológicas.
En el método de capital humano los costes indirectos se cuantifican en función de la reducción de ganancias brutas de los pacientes en el futuro. En el método de costes de fricción la cantidad de productividad perdida por enfermedad depende del periodo de tiempo necesario para sustituir al trabajador enfermo.
Por otro lado, se observó un incremento de costes en aquellos estudios que analizaron el coste de los pacientes con estadios graves (coste directo, indirecto y total de 8.808, 48.834 y 57.642 USD-PPP paciente-año, respectivamente)34. De igual manera, al analizar el coste entre pacientes con APs que recibieron tratamiento durante un periodo de 6 meses con o sin TB, se observó un incremento superior a 5 veces de los costes directos (7.768USD-PPP paciente-año), particularmente debido al incremento del coste farmacológico (7.101USD-PPP paciente-año), así como una reducción de 635USD-PPP paciente-año en los costes indirectos en aquellos pacientes tratados con TB33 (figs. 3B y C).
DiscusiónLos resultados de este trabajo sugieren que, en Europa, la Ps y APs están asociadas a un importante impacto económico. El coste anual del manejo de un paciente con Ps es variable, siendo consistente con otras revisiones publicadas anteriormente2,35, a excepción del coste anual en Suecia, que fue superior (11.928€ —en euros de 2009— equivalente a 14.820USD-PPP)2.
A excepción de 2 estudios alemanes26,34, los costes directos son la partida de mayor peso dentro del coste total, desde la perspectiva social, tanto en Ps (6 estudios) como en APs (2 estudios). España fue el país que presentó estudios con los costes directos anuales por paciente más bajos en Ps y más altos en APs.
Basándonos en el presente estudio, se puede establecer una relación directamente proporcional entre la gravedad del paciente y el coste asociado, motivada principalmente por un aumento de los costes directos. En la revisión mencionada anteriormente35 se identificó un aumento del coste del manejo de la Ps grave respecto a la moderada (hasta 2,5 veces más), debido principalmente al mayor consumo de recursos y a la pérdida de productividad asociada.
Si bien la introducción de TB parece contribuir a la disminución de costes hospitalarios en el manejo de la Ps, con una reducción de 2.357€ vs 564€ paciente-año (euros de 2013, equivalente a 2.902 a 695USD-PPP paciente-año)35, el incremento en el coste directo y total identificado en los estudios23,25,33 de Ps y APs, muestran el enorme impacto económico que supone su incorporación en el arsenal terapéutico. El efecto de la introducción de TB ha sido valorado con anterioridad en Europa36–38. Así, la utilización de los diferentes tratamientos biológicos disponibles para el tratamiento de la Ps de moderada a grave en España se asoció a un coste total por paciente-año que osciló entre los 12.120-18.370€ paciente-año (euros de 2010, equivalentes a 19.385 y 29.381USD-PPP paciente-año)36. En Holanda la inclusión de TB aumentó el coste del manejo de la Ps, de 17.712€ vs 10.146€ (euros de 2010, equivalentes a 13.628 a 23.791USD-PPP paciente-año)37.
En Italia se evaluó el coste del tratamiento en pacientes con APs refractarios a fármacos antirreumáticos modificadores de la enfermedad sistémicos no biológicos y tratados con fármacos anti-TNF durante 5 años, mostrando un aumento significativo de los costes directos debido al coste farmacológico de los anti-TNF, ligeramente compensado con una disminución de los costes indirectos38.
Una de las posibles limitaciones del estudio es la heterogeneidad metodológica entre estudios (población de estudio, tamaño muestral, periodo de observación, perspectiva utilizada, año de costes valorado), que podría dificultar la comparación de resultados y, por tanto, la extrapolación de conclusiones.
La calidad metodológica de los estudios incluidos, valorado a través de los criterios CHEERS21, ha permitido identificar diferencias considerables entre estudios. Algunas publicaciones se presentan en forma de resumen a congreso29,31,32, sin que se encontrara la correspondiente publicación a texto completo en una revista científica, lo que limita la información disponible y podría explicar el porcentaje de no cumplimiento encontrado en la valoración CHEERS. La falta de información sobre la fecha de costes en algunos estudios23,24,29,31 es otro factor crítico que no se cumple en algunas publicaciones. Este hecho se solventó utilizando el año de recogida de datos23,24 o la fecha de publicación29,31. En este sentido, la presentación de costes con diferentes fechas de fechas y monedas podría presentar una seria limitación para la comparabilidad de resultados. No obstante, el ajuste al incremento del índice de precios al consumo armonizado realizado para cada país19 y la aplicación posterior a un valor monetario basado en dólares internacionales actuales (USD-PPP2015)20 ha permitido eliminar las diferencias en los niveles de precios existente entre países y, por lo tanto, equiparar el poder de compra de diferentes monedas, haciendo más factible la comparabilidad39.
Otra diferencia a considerar es el empleo de diferentes métodos para el cálculo de los costes indirectos. Por un lado, el método de costes de fricción valora la pérdida que supone la incapacidad por el coste que supondría reemplazar al trabajador40. En cambio, el método de capital humano mide la productividad monetaria futura de los individuos beneficiarios de una actividad sanitaria, como las pensiones que no habría que pagar por evitar enfermedades profesionales o los días de trabajo no perdidos41. El empleo de uno u otro método puede afectar a los costes totales, como se observa en una publicación en APs que presentó un sustancial incremento del coste indirecto cuando se empleó el cálculo de costes indirectos por el método de capital humano34.
Otra posible limitación del presente estudio podría ser el reducido número de publicaciones localizadas, ya que aunque se han aplicado los criterios PRISMA17 y utilizado las bases de datos PubMed y Embase, no se han valorado otras fuentes de literatura gris (ver anexo 1).
Por otro lado, es conveniente considerar que el manejo clínico de la Ps y de la APs ha evolucionado mucho en las últimas décadas, fundamentalmente por la introducción de las TB a la práctica clínica habitual. Dado que el trabajo más reciente de los aquí revisados23 recogió datos de 2011, el coste de las enfermedades en la actualidad podría ser superior.
El reducido número de análisis enfocados a la estimación del coste de la Ps o APs sugiere la necesidad e interés del desarrollo futuro de estudios de coste de la enfermedad, que reflejen la práctica clínica habitual y aporten información útil y actualizada para la toma de decisiones en el ámbito sanitario, especialmente considerando la entrada de fármacos biológicos biosimilares en el manejo de ambas enfermedades.
En conclusión, y a pesar de las limitaciones anteriores, la revisión de los estudios incluidos pone de manifiesto el elevado impacto económico que supone el tratamiento y manejo de la Ps y APs, el cual aumenta con la gravedad del paciente y de forma considerable con la inclusión de TB.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónCelgene S.L. ha financiado de forma no condicionada a resultados la realización de este proyecto.
Conflicto de interesesMTC realiza su labor profesional en Celgene. RBP, IE y MAC desarrollan su actividad profesional en Pharmacoeconomics & Outcomes Research Iberia (PORIB), que ha recibido financiación no condicionada de Celgene para el desarrollo del presente manuscrito. JMMS ha recibido honorarios por parte de PORIB por su colaboración y asesoría en el desarrollo del proyecto. JMVC declara no tener ningún conflicto de intereses y no haber recibido ningún honorario por su participación y contribución en este trabajo.
Los autores agradecen a Itziar Oyagüez y Nuria Ortega los comentarios aportados durante la revisión del manuscrito.