El carcinoma de células escamosas cutáneo localmente avanzado (CEC-la) y/o metastásico que no es candidato a cirugía y/o radioterapia curativa tiene aprobado el tratamiento con inmunoterapia anti-PD1 por la Agencia Europea del Medicamento1. Esta indicación solo la tiene actualmente el cemiplimab. Sin embargo, no existe actualmente financiación en España para esta indicación ni para ningún otro fármaco anti-PD1, por lo que su uso es fuera de ficha técnica o mediante el uso expandido. Se describe a continuación la experiencia con anti-PD1 en el tratamiento del CEC-la o metastásico en una unidad de dermatología.
Se realizó un estudio observacional retrospectivo de los pacientes tratados con inmunoterapia con indicación para CEC-la o metastásico en nuestra unidad desde enero de 2019 hasta enero de 2022. Se recogieron datos demográficos, localización, estadio, tratamientos previos, agente terapéutico, respuesta, tiempo en alcanzar respuesta, tiempo libre de enfermedad, así como los efectos adversos inmunomediados presentados (irAE registrados mediante CTCAE 5.0) y su tratamiento2. Del tumor se estudió la expresión PD-L1 (determinada mediante inmunohistoquímica), la presencia de desmoplasia y el infiltrado linfocitario intratumoral (determinado mediante el método Klintrup-Mäkinen modificado, clasificando el infiltrado en ausente, leve, moderado y prominente)3.
Se identificaron 7 pacientes (tabla 1) con una edad mediana de 85 años, de los cuales 4 eran varones. La indicación de la inmunoterapia fue para la primera línea de tratamiento sistémico para un CEC metastásico en un paciente y para un CEC-la en 6 pacientes. Todos fueron discutidos en un comité multidisciplinar y firmaron un consentimiento informado. El tratamiento anti-PD1 fue controlado por dermatología.
Casos de carcinoma de células escamosas cutáneo localmente avanzado o mestastásico tratados con anti-PD1
| Todos los pacientes (N=7) | Respuesta completa (n=5) | Enfermedad estable/no respuesta (n=2) | |
|---|---|---|---|
| Edad, mediana (rango) | 85 (81-91) | 85 (81-91) | 85,5 (84-87) |
| Sexo masculino, n (%) | 4 (57,1) | 3 (60) | 1 (50) |
| Tratamiento antes de inhibidores PD1, n (%) | |||
| Cirugía | 7 (100) | 5 (100) | 2 (100) |
| Radioterapia | 4 (57,1) | 3 (60) | 1 (50) |
| Localización tumor primario, n (%) | |||
| Cabeza/cuello | 5 (71,4) | 3 (60) | 2 (100) |
| Extremidades | 1 (14,3) | 1 (20) | 0 (0) |
| Tronco | 1 (14,3) | 1 (20) | 0 (0) |
| Alcance de la enfermedad, n (%) | |||
| Localmente avanzada | 6 (85,7) | 4 (80) | 2 (100) |
| Metástasis regionales | 1 (14,3) | 1 (20) | 0 (0) |
| Metástasis a distancia | 0 (0,0) | 0 (0) | 0 (0) |
| Expresión PD-L1>1%, n (%) | 2 (28,6) | 2 (40) | 0 (0) |
| Desmoplasia, n (%) | 4 (57,1) | 2 (40) | 2 (100) |
| Infiltrado inflamatorio intratumoral, n (%) | |||
| Ausente | 1 (14,3) | 0 (0) | 1 (50) |
| Leve | 5 (71,4) | 4 (80) | 1 (50) |
| Moderado | 1 (14,3) | 1 (20) | 0 (0) |
| Prominente | 0 (0) | 0 (0) | 0 (0) |
| ECOG, n (%) | |||
| 0 | 4 (57,1) | 3 (60) | 1 (50) |
| 1 | 3 (42,8) | 2 (40) | 1 (50) |
| Efectos adversos inmunomediados, n (%) | |||
| Grado 1-2 | 3 (42,9) | 3 (60) | 0 (0) |
| Grado 3-4 | 1 (14,3) | 1 (20) | 0 (0) |
| Grado 5 | 1 (14,3) | 1 (20) | 0 (0) |
Cinco pacientes recibieron tratamiento fuera de ficha técnica con pembrolizumab 200mg cada 3 semanas y 2 pacientes recibieron tratamiento con cemiplimab en uso expandido 350mg cada 3 semanas. Todos habían sido tratados previamente con cirugía y 4 de ellos también con radioterapia. La respuesta fue completa en 5 pacientes, enfermedad estable en un paciente y otro no obtuvo respuesta. La mediana de respuesta fue de 3 meses desde el inicio del tratamiento y la mediana de intervalo libre de enfermedad de 21 meses (tabla 2).
Respuesta global obtenida a tratamiento anti-PD1
| Todos los pacientes (n=7) | |
|---|---|
| Mejor respuesta global, n (%) | |
| Respuesta completa | 5 (71,4) |
| Respuesta parcial | 0 (0) |
| Enfermedad estable | 1 (14,3) |
| Progresión | 1 (14,3) |
| Tiempo en alcanzar respuesta (meses), mediana (rango) | 1,5 (0-6) |
| Intervalo libre de enfermedad (meses), mediana (rango) | 21 (0-31) |
En 3 pacientes se suspendió de forma permanente la inmunoterapia, por un irAE grado 4 en un caso y por una remisión completa mantenida tras 2 años de tratamiento en 2 pacientes. En todos ellos se logró una respuesta completa mantenida tras la suspensión de la inmunoterapia incluso tras más de un año desde su cese, con un intervalo libre de enfermedad superior a 20 meses en todos los casos (21, 21 y 31 meses, respectivamente).
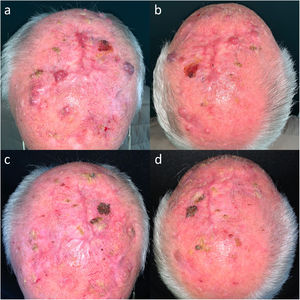
Cinco pacientes presentaron irAE. Tres fueron grado 1-2 reumatológicos (tipo polimialgia reumática y artralgias) que se resolvieron con prednisona a dosis bajas y/o hidroxicloroquina 200mg/día. Un paciente desarrolló una hepatitis inmunomediada grado 4 al tercer ciclo de pembrolizumab que se resolvió suspendiendo definitivamente la inmunoterapia e iniciando pulsos de metilprednisolona 250mg/día durante 5 días y micofenolato mofetilo 1g/12h hasta su resolución total. El paciente se mantuvo en remisión completa desde entonces hasta 21 meses después de seguimiento sin tratamiento (fig. 1). Una paciente sufrió un irAE grado 5 que consistió en una miocarditis inmunomediada.
Imágenes clínicas de un paciente con un carcinoma epidermoide cutáneo multifocal localmente avanzado en el cuero cabelludo. (a y b) Antes del inicio de la inmunoterapia. (c y d) Remisión completa tras un ciclo de pembrolizumab 200mg cada 3 semanas. Persistencia de la remisión completa tras únicamente 3 ciclos de pembrolizumab y 21 meses sin tratamiento.
Fallecieron 3 pacientes: uno por progresión de la enfermedad, otro por irAE grave y el último por causas ajenas a la enfermedad.
La eficacia y seguridad de los fármacos anti-PD1 para CEC-la ha sido demostrada en ensayos clínicos para el cemiplimab y el pembrolizumab4,5. Estos resultados se han evaluado posteriormente en práctica clínica real en algunas series con resultados favorables y datos de respuesta objetivable de un 58% y de respuesta completa de un 16%6,7. En nuestra serie, presentamos datos adicionales sobre el uso de inmunoterapia para CEC-la o metastásico en práctica clínica real.
Destacamos la alta tasa de respuestas completas presentadas (5/7 pacientes, 71,4%), que podría estar en relación con que ninguno de nuestros pacientes recibió tratamiento sistémico previo. Esto coincide con las mayores tasas de respuesta completa para pacientes que recibieron el tratamiento en primera línea en los ensayos clínicos5. Destacamos los 3 casos en los que se logró una respuesta completa mantenida incluso tras más de un año desde la suspensión de la inmunoterapia, que consideramos potencialmente curados. En cuanto a la toxicidad presentada, 5 de los 7 pacientes presentaron irAE, que llegaron a ser graves en 2 pacientes, uno de los cuales falleció por esta causa. Destacamos también que todos los pacientes que tuvieron una respuesta completa presentaron algún irAE, lo que contribuye a la hipótesis de que su aparición podría estar relacionada con un mejor efecto terapéutico.
Existe una necesidad terapéutica en el manejo del CEC-la y metastásico. El perfil de seguridad de los fármacos anti-PD1 es favorable y similar al descrito en los ensayos clínicos para su uso en este escenario, aun siendo pacientes de edad avanzada.
En conclusión, este trabajo aporta nuevos datos sobre inmunoterapia en práctica clínica real para CEC-la y metastásico. Destacamos la necesidad del conocimiento y manejo por parte de los dermatólogos de estos fármacos y sus potenciales toxicidades.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.