La asociación entre los inhibidores de la dipeptidil peptidasa 4 (iDPP-4) y el penfigoide ampolloso (PA) se ha demostrado en varios estudios. El objetivo principal de este estudio era estimar el uso del tratamiento con iDPP-4i en pacientes diagnosticados de PA en nuestro entorno
Material y métodosSeleccionamos pacientes diagnosticados histológicamente de PA en nuestro departamento entre octubre de 2015 y octubre de 2018. Realizamos una revisión retrospectiva para evaluar los datos clínicos-epidemiológicos y los patrones de inmunofluorescencia directa (IFD).
ResultadosDe los 70 pacientes diagnosticados con PA durante el período de estudio, el 50% eran diabéticos y el 88,57% de ellos estaban siendo tratados con un iDPP-4 en el momento del diagnóstico de PA. El iDPP-4 más frecuente era la linagliptina (utilizada en el 18,6% de los pacientes), seguida de la vildagliptina (el 17,1%). La mediana de tiempo de latencia entre el inicio del tratamiento con iDPP-4 y el diagnóstico de PA fue de 27,5 meses, siendo de 16 meses para la linagliptina y 39 meses para la vildagliptina (log Rank < 0,01). La IFD fue negativaUn resultado negativo de DIF fue significativamente más común en pacientes que no fueron tratados con un DPP-4i. El patrón DIF más fuertemente (y significativamente) asociado con el tratamiento con DPP-4i fueron los depósitos lineales de inmunoglobulina G a lo largo de la unión dermoepidérmica. El tratamiento con DPP-4i se retiró en el 87% de los pacientes y el 96% de ellos logró una respuesta completa.
ConclusiónEl tratamiento con DPP-4i es muy común en pacientes con BP en nuestro entorno. El período de latencia entre el inicio del tratamiento y el inicio de la PA parece ser más corto con linagliptina que con otros tipos de gliptinas. Los pacientes que reciben tratamiento con DPP-4i pueden mostrar patrones DIF diferentes a los que no reciben tratamiento
The association between dipeptidyl peptidase 4 inhibitors (DPP-4i) and bullous pemphigoid (BP) has been demonstrated in several studies. The main aim of this study was to estimate the use of DPP-4i treatment in patients diagnosed with BP in our setting.
MethodsWe selected patients histologically diagnosed with BP in our department between October 2015 and October 2018 and performed a retrospective chart review to assess clinical and epidemiological data and direct immunofluorescence (DIF) patterns.
ResultsOf the 70 patients diagnosed with BP during the study period, 50% were diabetic and 88.57% of these were being treated with a DPP-4i when diagnosed with BP. The most common DPP-4i was linagliptin (used in 18.6% of patients), followed by vildagliptin (17.1%). The median latency period between initiation of DPP-4i treatment and diagnosis of BP was 27.5 months for all treatments, 16 months for linagliptin, and 39 months for vildagliptin (log rank < 0.01). A negative DIF result was significantly more common in patients not being treated with a DPP-4i. The DIF pattern most strongly (and significantly) associated with DPP-4i treatment was linear immunoglobulin G deposits along the dermal-epidermal junction. DPP-4i treatment was withdrawn in 87% of patients and 96% of these achieved a complete response.
ConclusionsDPP-4i treatment is very common in patients with BP in our setting. The latency period between start of treatment and onset of BP seems to be shorter with linagliptin than with other types of gliptins. Patients receiving DPP-4i treatment may show different DIF patterns to those not receiving treatment.
El penfigoide ampolloso (PA) es la enfermedad ampollosa autoinmune más frecuente en nuestro medio1. Es debida a la presencia de autoanticuerpos circulantes frente a proteínas que conforman los hemidesmosomas de la unión dermoepidérmica (antígenos BP180 y BP230) y se caracteriza habitualmente por formación de placas urticariformes intensamente pruriginosas y ampollas tensas afectando a toda la superficie cutánea, con predilección en los pliegues siendo la afectación de mucosas infrecuente2. En los últimos 20 años la incidencia de esta enfermedad ha aumentado de 2 a 4 veces. Este aumento se relaciona con la administración de diversos fármacos como la espironolactona. En los últimos años se ha observado la asociación de PA con la administración de antidiabéticos orales de la familia de los inhibidores de la dipeptidilpeptidasa-4 (iDPP-4), también conocidos como gliptinas3,4. Esta asociación no se observó en los ensayos clínicos previos a la comercialización.
El objetivo de nuestro estudio es estimar la prevalencia de iDPP-4 entre los pacientes diagnosticados histológicamente de PA en el Servicio de Dermatología del Hospital General Universitario de Valencia durante octubre de 2015 y octubre de 2018, así como valorar si existen diferencias en el tiempo de aparición de PA en función del tipo de gliptina empleada.
Material y métodosSe diseñó un estudio observacional, descriptivo y retrospectivo, unicéntrico, en el servicio de Dermatología del Hospital General de Valencia entre octubre de 2015 y octubre de 2018 en el que se incluyeron todos los pacientes diagnosticados histológicamente de PA. Estos pacientes se seleccionaron de forma continua a través de la base de datos de biopsias de nuestro servicio. Se descartaron aquellos pacientes con otras dermatosis ampollosas o con penfigoides cicatriciales o paraneoplásicos.
Tras la selección de la muestra se realizó una búsqueda retrospectiva a través de las historias clínicas electrónicas de cada paciente para obtener los datos de las distintas variables incluidas en el estudio: sexo, edad, antecedente de diabetes, tratamiento actual con iDPP-4, tipo de gliptina, meses entre que había sido pautado el fármaco y había consultado en nuestro servicio por la clínica, patrón de inmunofluorescencia directa (IFD) y respuesta al tratamiento en función de la retirada o no del iDPP-4. Los patrones de IFD que se analizaron fueron la presencia de depósitos lineales de IgG, del factor 3 del complemento (C3) y la presencia de depósitos de IgM. Todos los pacientes fueron tratados con corticoides orales y aquellos en tratamiento con iDPP-4 fueron remitidos a su médico de atención primaria para retirada del fármaco y sustitución por otro antidiabético de distinta familia. Se consideró respuesta completa la desaparición total de las lesiones, mientras que se consideró respuesta parcial la presencia de lesiones que requirieron de tratamiento corticoideo tópico u oral.
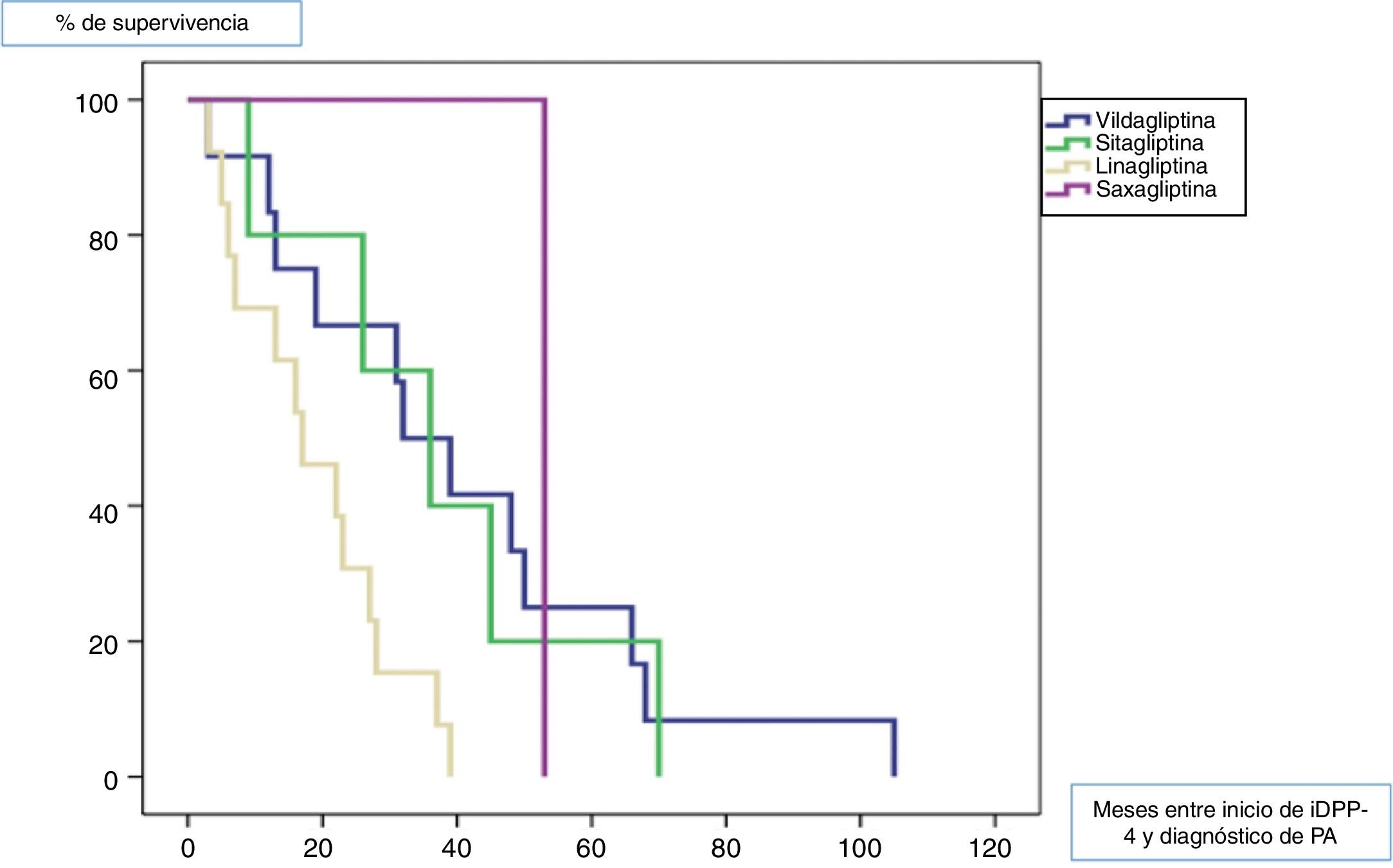
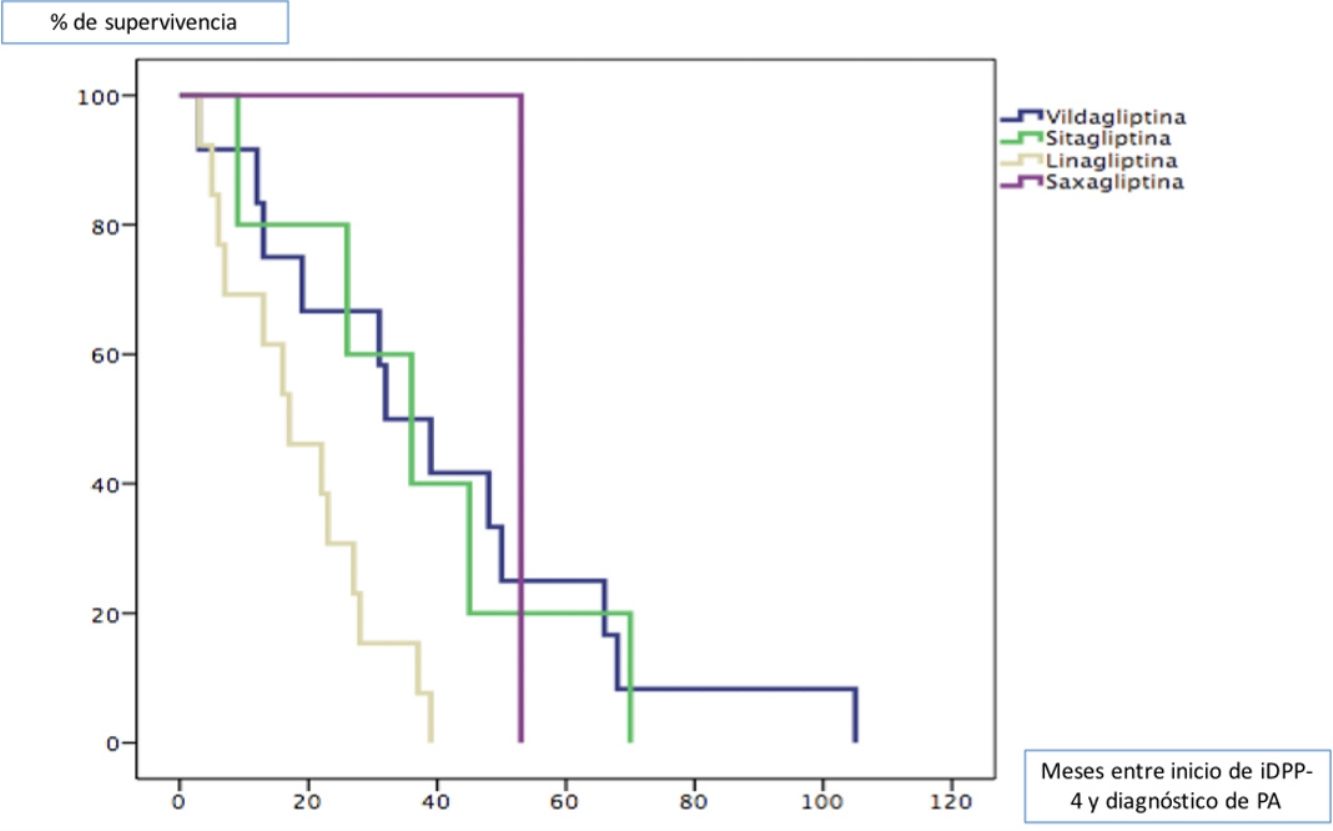
Para el análisis estadístico se empleó el programa informático Statistical Package for the Social Sciences versión 21.0. Las variables continuas están expresadas con la mediana ± intervalo intercuartílico (ICC). Las variables cualitativas están expresadas con el número entero más el porcentaje. Para los contrastes de hipóstesis entre variables cuantitativas se empleó la prueba de la ji cuadrado de Pearson (test χ2). Se realizó un análisis de supervivencia mediante una curva de Kaplan Meyer entre el tiempo de aparición en meses de PA y las diferentes gliptinas empleadas, contrastándose con una prueba de los rangos logarítmicos (test de log rank). Se consideró significativa una p < 0,05.
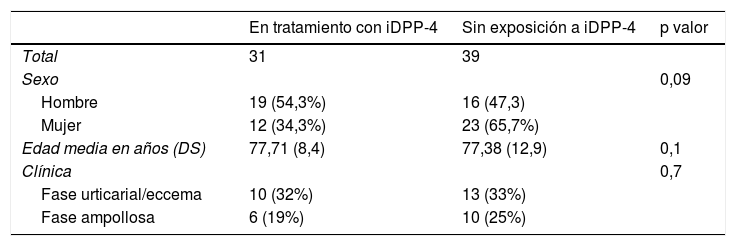
ResultadosUn total de 70 pacientes fueron diagnosticados histológicamente de PA en los 3 años de seguimiento del estudio, siendo 35 (50%) hombres y 35 (50%) mujeres con una edad mediana de 82 años y un ICC de 38 – 97 años. Del total de pacientes, 35 (50%) eran diabéticos tipo 2 de los cuales 31 (88,5%) estaban en tratamiento actual con un iDPP-4. Las características demográficas de los pacientes en función de si se encontraban en tratamiento con gliptinas se resumen en tabla 1.
Características demográficas de los pacientes diagnosticados de penfigoide ampolloso
| En tratamiento con iDPP-4 | Sin exposición a iDPP-4 | p valor | |
|---|---|---|---|
| Total | 31 | 39 | |
| Sexo | 0,09 | ||
| Hombre | 19 (54,3%) | 16 (47,3) | |
| Mujer | 12 (34,3%) | 23 (65,7%) | |
| Edad media en años (DS) | 77,71 (8,4) | 77,38 (12,9) | 0,1 |
| Clínica | 0,7 | ||
| Fase urticarial/eccema | 10 (32%) | 13 (33%) | |
| Fase ampollosa | 6 (19%) | 10 (25%) |
En el momento del diagnóstico, el tipo de iDPP-4 más empleado fue la linagliptina en 13 (18,6%) pacientes del total, seguido de la vildagliptina en 12 (17,1%), la sitagliptina en 5 (7,1%) y la saxagliptina en uno (1,4%). En 8 (11,4%) pacientes, esta era la segunda gliptina que les había sido pautada. Anteriormente 6 de ellos habían sido tratados con sitagliptina, uno con vildagliptina y uno con linagliptina, con una mediana de tiempo de tratamiento con dicho fármaco de 9 meses (RIQ 4). De los 31 pacientes en tratamiento actual con iDPP-4, 25 (80,64%) de ellos lo hacían de forma combinada con metformina, 5 (16,13%) lo hacían de forma única y uno (3,22%) de ellos lo tomaba en combinación con sulfonilurea.
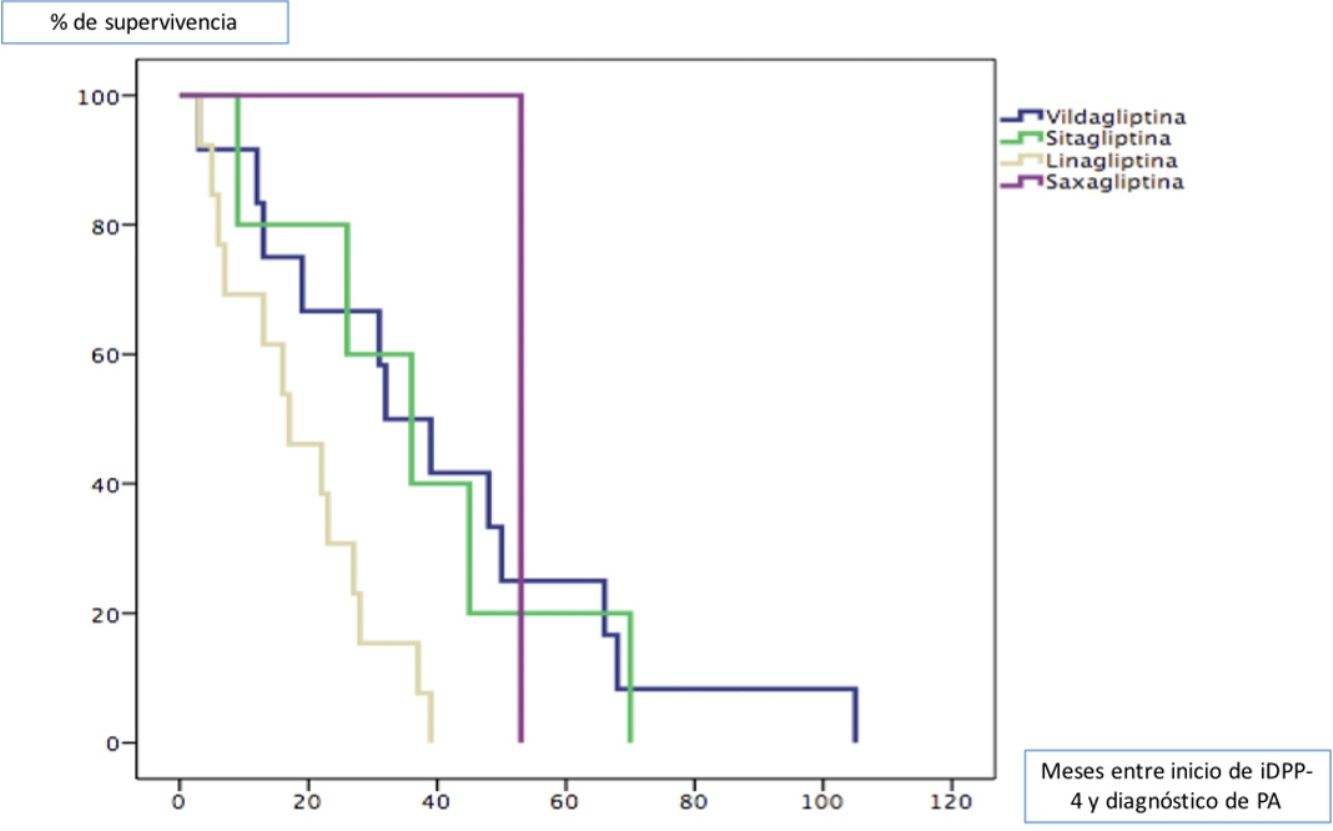
Todos los pacientes fueron diagnosticados de PA posteriormente al inicio del tratamiento con gliptinas, con una mediana de tiempo de 27,5 meses (ICC 33). La mediana de tiempo en meses (ICC) desde el inicio del tratamiento de cada una de las gliptinas hasta la aparición de lesiones de PA fue de 3913 para la vildagliptina, 367 para la sitagliptina, 163 para la linagliptina y 53 (0) para la saxagliptina (log rank < 0,011). La figura 1 muestra la curva de supervivencia entre los diferentes tipos de gliptinas para la aparición de PA.
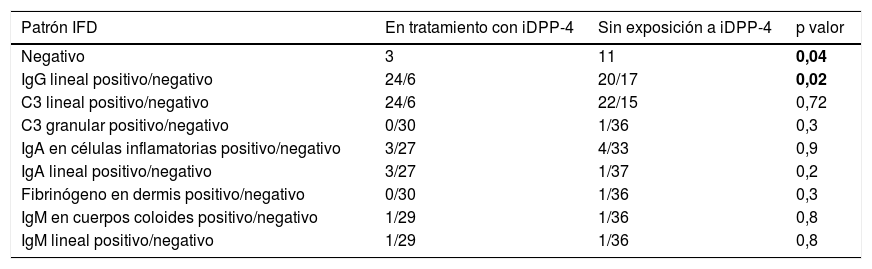
Se realizó IFD en 67 (95,7%) de todos los pacientes. Los resultados de la IFD en función de los distintos patrones analizados están descritos en la tabla 2.
Patrones IFD analizados en los pacientes diagnosticados de penfigoide ampolloso
| Patrón IFD | En tratamiento con iDPP-4 | Sin exposición a iDPP-4 | p valor |
|---|---|---|---|
| Negativo | 3 | 11 | 0,04 |
| IgG lineal positivo/negativo | 24/6 | 20/17 | 0,02 |
| C3 lineal positivo/negativo | 24/6 | 22/15 | 0,72 |
| C3 granular positivo/negativo | 0/30 | 1/36 | 0,3 |
| IgA en células inflamatorias positivo/negativo | 3/27 | 4/33 | 0,9 |
| IgA lineal positivo/negativo | 3/27 | 1/37 | 0,2 |
| Fibrinógeno en dermis positivo/negativo | 0/30 | 1/36 | 0,3 |
| IgM en cuerpos coloides positivo/negativo | 1/29 | 1/36 | 0,8 |
| IgM lineal positivo/negativo | 1/29 | 1/36 | 0,8 |
En negrita valores con significación estadística (p < 0,05).
De los 31 pacientes en tratamiento con iDPP-4, a todos se les recomendó la retirada del fármaco, lo que se produjo en 27 (87%) de ellos. En 26 (83,8%) se obtuvo una respuesta completa de la enfermedad, mientras que uno no volvió a la consulta por éxitus. De los 4 pacientes a los que no se les retiró el fármaco, 3 (9,6%) de ellos obtuvieron una respuesta parcial, mientras que uno perdió el seguimiento.
DiscusiónLa relación entre los iDPP-4 y el PA ha sido demostrada en varios estudios de casos-controles, pero no en nuestro medio. El mecanismo patogénico subyacente todavía no ha sido aclarado. Se sabe que la dipeptidilpeptidasa-4 (DPP-4) es un receptor de plasminógeno de la superficie celular que se expresa en los queratinocitos y en otros tipos celulares como las células endoteliales y los linfocitos T. La activación de la DPP-4 in vitro da lugar a la formación de plasmina, una proteasa que escinde la BP-180 a través del dominio NC-16A. Por otra parte, se ha demostrado in vivo que la inhibición de este receptor a través de los iDPP-4 puede aumentar la actividad de citoquinas proinflamatorias como la eotaxina CCL11, dando lugar al reclutamiento dérmico de eosinófilos y a la formación de ampollas5.
En 3 años han sido diagnosticados de PA un total de 70 pacientes. Teniendo en cuenta la población asignada al Hospital General de Valencia (aproximadamente 370.000 personas), esta incidencia es aproximadamente 3 veces mayor a la publicada en un estudio francés (21,7 casos por millón de personas al año)6. Esto podría explicarse por varias razones. Existen datos sobre el incremento de casos de PA en los últimos años6, entre otros motivos por el aumento en el uso de los iDPP-4 así como por otros fármacos. Eso añadido a que el estudio francés sobre la incidencia está publicado hace casi 8 años, es de esperar que la incidencia se haya incrementado. Por otra parte, es complejo estimar la prevalencia únicamente sobre la población asignada al hospital dado que algunos de los pacientes diagnosticados de PA en estos años son de fuera de nuestra área.
Se estima que estos fármacos pueden aumentar el riesgo de PA hasta un 2,8, especialmente con vildagliptina y, en menor medida, con linagliptina5,7. Además, se ha reportado en series cortas de pacientes que el PA inducido por iDPP-4 aparece con un fenotipo poco inflamatorio8,9. Kridin y Bergman (con un gran estudio de casos-controles) no encuentran diferencias en cuanto al patrón clínico de presentación del PA (más allá de mayor afectación mucosa)7. Al ser un estudio retrospectivo, la descripción clínica de las lesiones era muy pobre, así como la valoración explícita a nivel mucosa, además de no encontrar diferencias en los casos que hemos recogido. Aunque muchos de estos fármacos se emplean en combinación con metformina (en nuestra cohorte el 80,64%), este fármaco no se ha relacionado con un aumento del riesgo de PA ni en análisis univariantes ni en multivariantes7.
La latencia mediana entre el inicio de tratamiento con estos antidiabéticos y el inicio de la enfermedad varía sustancialmente en función de los diferentes estudios, desde 6 a 26,4 meses7. La latencia mediana en nuestra cohorte es ligeramente superior (27,5 meses) tal vez porque tuvimos en cuenta como inicio de la enfermedad el momento en el que estos pacientes consultaron en nuestro servicio. Teniendo en cuenta que estos pacientes probablemente tardaron cierto tiempo en consultar, tal vez nuestros resultados hubieran estado en consonancia con los estudios previos. No hemos encontrado estudios que comparen la latencia de aparición del PA en función del tipo de gliptina empleada. En nuestra cohorte el fármaco que más precozmente dio lugar a la aparición de PA fue la linagliptina. Revisando la literatura parece que los tiempos de latencia con esta gliptina son similares a los de nuestra cohorte, aunque suelen ser casos aislados10,11.
El patrón IFD es similar tanto en los PA asociados con iDPP-4 como en aquellos donde no están implicados estos fármacos. En nuestra cohorte, se ha relacionado de forma estadísticamente significativa la negatividad en la IFD con la ausencia de iDPP-4, mientras que la presencia de una IgG lineal en la unión dermoepidérmica era más frecuente de forma estadísticamente significativa en aquellos PA asociados a iDPP-4. Aunque infrecuente, se han identificado pacientes con diagnóstico de PA en los que la IFD es inicialmente negativa o indeterminada, requiriendo en este caso de una segunda biopsia para el diagnóstico12. Según nuestra cohorte, los falsos negativos son menores en aquellos pacientes tratados con iDPP-4, aunque no se confirmó con una segunda IFD. Además, en estos pacientes la detección de IgG lineal con o sin C3 parece más sensible en el diagnóstico de PA. Este hallazgo es frecuente en los pacientes con PA inducido por fármacos en general y no solo en los casos inducidos por iDPP-4. No hemos encontrado estudios que evalúen la diferencia de patrones en la IFD de PA según la presencia de estos antidiabéticos.
La suspensión del tratamiento se asoció a una remisión clínica completa en la mayoría de los pacientes, confirmando datos similares previamente descritos13. Otros autores en cambio no encuentran diferencias en cuanto a la respuesta clínica entre los pacientes a los que se les suspende la gliptina y a los que la continúan14.
La principal limitación de nuestro estudio es la recogida de datos de forma retrospectiva. Esto ha impedido que valoremos las características clínicas de los pacientes dado que en muchos casos no se encontraba disponible en la historia clínica previa. Además, hubiera sido interesante estudiar los valores serológicos de anticuerpos antimembrana basal de los pacientes y observar si existen diferencias entre aquellos pacientes bajo tratamiento con gliptinas y aquellos que no las tomaban (pese a que en algún estudio no se han encontrado)7. En nuestro caso no realizamos estos marcadores analíticos de rutina, sino únicamente en aquellos pacientes con discrepancia clínico-patológica donde la IFD es negativa. Como ventaja frente a otros estudios, consideramos que hemos evitado un sesgo de Berkson seleccionando todos los pacientes diagnosticados histológicamente de PA. El pequeño tamaño muestral es un inconveniente a la hora de extraer conclusiones firmes, aunque es muy similar o incluso mayor que los estudios con más número de casos publicados.
Como conclusión, la prevalencia de tratamientos con iDPP-4 entre los pacientes diagnosticados de PA es elevada. El patrón de IFD en estos pacientes puede diferir con respecto a los que no se están administrando estos fármacos, con una mayor tasa de positividad en la inmunofluorescencia directa para la combinación IgG-C3 lineal. También observamos que el tiempo de latencia desde el inicio del fármaco y la aparición de PA es menor con linagliptina que con el resto de gliptinas de forma significativa. La supresión del tratamiento con iDPP-4 asociado al tratamiento habitual del PA da como resultado respuestas clínicas completas en la práctica totalidad de los pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.