Desde su descubrimiento, se han ido introduciendo continuamente agentes biológicos para el tratamiento estándar de las enfermedades inflamatorias, con resultados terapéuticos excelentes. A pesar de sus ventajas evidentes, han surgido diversos efectos secundarios a su uso. Hasta la fecha, sigue sin esclarecerse el límite hasta el cual se solapan las múltiples vías moleculares, sin embargo, se argumenta que la inhibición de una vía puede causar la exacerbación de las rutas antagónicas, conduciendo inevitablemente a la aparición de una serie de patologías secundarias.
Secukinumab, el agente más ampliamente utilizado de este grupo, para el tratamiento de diversas patologías inflamatorias, es un anticuerpo monoclonal anti-IL-17A. Su focalización selectiva e inhibición de IL-17A puede causar síntomas específicos, debido a la exacerbación de las vías antagónicas. En tal contexto reportamos tres casos de pacientes tratados con secukinumab, que desarrollaron alopecia no cicatricial.
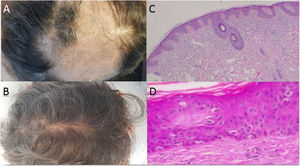
Caso 1: una mujer de 58 años con artritis seronegativa, quien recibió diversos tratamientos incluyendo metotrexato, leflunomida, etanercept/leflunomida, adalimumab (discontinuado debido al desarrollo de lesiones psoriásicas), y finalmente terapia de secukinumab con buena respuesta. Alrededor de la semana 16 de tratamiento, la paciente reportó pérdida de cabello repentina. La exploración física reveló una gran zona alopécica a lo largo de la región parietal-temporal-occipital, con escamas de color blanco a amarillento (fig. 1A). No se observaron síntomas asociados y el «pull test» resultó negativo. Se realizaron dos biopsias cutáneas, prescribiéndose metilprednisolona sistémica. En ambas muestras, la histopatología reveló dermatitis de interfase vacuolar, que puede estar relacionada con una reacción farmacológica adversa (fig. 1B,C) y, por tanto, se interrumpió el tratamiento de secukinumab. La paciente comenzó a recibir tofacitinib, observándose el crecimiento total del pelo transcurridos 10 meses (fig. 1D).
a: Gran zona de alopecia a lo largo de la región parietal-temporal-occipital, con escamas de color blanco a amarillento; b: Evidencia de rebrote de cabello tras la interrupción del tratamiento con secukinumab; c-d: Tinción hematoxilina-eosina: Dermatitis de interfase vacuolar asumida como farmacodermia debido al tratamiento biológico (c x4, d x100).
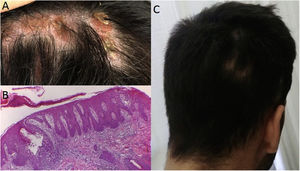
Caso 2: un varón de 25 años, con antecedentes de espondilitis anquilosante, inició terapia de tres meses de duración con etanercept, seguida de adalimumab durante tres años, cuando la psoriasis pustulosa paradójica afectó a sus palmas y plantas, obligando a su suspensión. El tratamiento posterior con secukinumab originó alopecia focal en el cuero cabelludo, en la semana 12. Durante la exploración se observaron zonas alopécicas difusas con hiperqueratosis en el lugar donde emergían mechones de pelo. Se tomó una muestra del cuero cabelludo alopécico, que reveló la presencia de dermatitis espongiótica que comprometía los folículos, semejante a un patrón psoriasiforme, con apoptosis queratinocítica e hiperqueratosis folicular, interpretándose como reacción farmacológica paradójica adversa. Por tanto, se inició tratamiento con tofacitinib, con buena respuesta clínica.
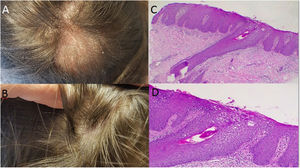
Caso 3: mujer de 37 años con psoriasis en grandes placas, que había sido tratada con fototerapia, metotrexato, ciclosporina y secukinumab (en el contexto de un protocolo de investigación). Se observaron efectos exitosos con la administración de secukinumab, aunque apareció una placa inflamatoria alopécica fina y escamosa alrededor de la semana 20 en la zona de la coronilla (fig. 2A). Se inició tratamiento tópico con clobetasol, con mejora significativa. Lamentablemente, transcurridas cuatro semanas de volver a administrarse el tratamiento biológico, la lesión reapareció, presentando signos inflamatorios y tamaño incrementado. Se interrumpió el tratamiento de secukinumab y la biopsia cutánea fue consistente con psoriasis en cuero cabelludo (fig. 2B,C). Transcurridos dos meses, con recuperación clínica casi completa, se inició la administración de adalimumab (fig. 2D).
a: Placa inflamatoria alopécica en la zona de la coronilla. En la parte superior pudieron observarse escamas finas de color blanco; c-d: Tinción hematoxilina-eosina: Examen histopatológico que refleja un patrón psoriasiforme (c x4, d x100); b: Recuperación clínica casi completa transcurridos dos meses de la interrupción de secukinumab.
Cabe destacar que en el momento en que dichos pacientes acudieron a nuestro departamento, la normativa nacional no había autorizado los fármacos anti-IL-23 como posible tratamiento de la artritis psoriásica. (fig. 3)
a: Placa inflamatoria alopécica con escamas hiperqueratósicas en el lugar en que emergían mechones de pelo; b: Dermatitis espongiótica que comprometía los folículos, semejante a un patrón psoriasiforme, apoptosis queratinocítica e hiperqueratosis folicular; c: Recuperación de cabello tras la interrupción de secukinumab.
Los fármacos anti-IL-17A se utilizan normalmente para el tratamiento de las enfermedades inflamatorias. Reportamos tres casos de alopecia no cicatricial como reacción inflamatoria adversa al tratamiento biológico1–3. En nuestra serie, este fue un episodio adverso de novo. Conforme a la escala de Naranjo, que determina la existencia de una relación causal entre una reacción adversa identificada y un fármaco específico, la alopecia presentada por nuestros pacientes puede haber estado relacionada con el tratamiento de secukinumab. Es digno de mencionar que en los tres casos, la alopecia fue diagnosticada tras 12-20 semanas de tratamiento con secukinumab, mejorando progresivamente al discontinuarse el fármaco anti-IL-17, lo cual probó la relación directa entre el episodio adverso y el fármaco. Habiendo descartado otras causas potenciales como desencadenantes subyacentes del episodio adverso, mediante el estudio histopatológico de las lesiones, la alopecia fue contemplada como reacción farmacológica adversa paradójica4.
Debe destacarse que dos de los pacientes habían tenido previamente reacciones paradójicas a agentes anti-TNF, que no afectaron al cuero cabelludo. Esto destaca el hecho de una posible recidiva de episodios adversos paradójicos relacionados con el uso de diversos agentes biológicos, con mecanismos de acción diferentes. Otro paciente, que no había seguido terapia previa anti-TNF, pero había recibido secukinumab en dos ocasiones separadas, reportó alopecia como episodio adverso durante la segunda administración.
Un artículo japonés sobre un caso clínico reflejó características cronológicas similares a nuestro primer y segundo pacientes, como primer tratamiento con adalimumab seguido del inhibidor de IL-17 brodalumab, que fue discontinuado debido a alopecia psoriásica, interpretando los autores una reacción paradójica a brodalumab5.
La alopecia manifestada como reacción paradójica individual, secundaria a tratamiento biológico, es inusual. Es más común observar la alopecia asociada a otras presentaciones dermatológicas, tales como lesiones psoriásicas en placa o pustulosas. Hasta la fecha se ha descrito más comúnmente esta reacción adversa al tratamiento anti-TNF, en lugar de los inhibidores de IL-176,7.
ConclusiónLa alopecia deberá considerarse una reacción farmacológica adversa paradójica secundaria a las terapias biológicas, especialmente asociadas a los inhibidores de IL-17. Dado que los hallazgos histopatológicos son bastante inespecíficos, recomendamos basar el diagnóstico en escalas validadas, tales como la escala de Naranjo, a fin de establecer una relación causal potencial causal entre un fármaco y un episodio adverso. Nuestro primer caso mostró cambios farmacológicos cutáneos que se manifestaron en forma de alopecia, mientras que los casos 2 y 3 revelaron reacciones cutáneas psoriasiformes. Sobre la base de los hallazgos clínicos, concluimos que los tres casos pueden considerarse reacciones farmacológicas adversas asociadas al tratamiento con anti-IL-17.
Conflicto de interesesLos autores declaran la ausencia de conflicto de intereses.