Presentamos el caso de un varón de 50 años, sin alergias conocidas a fármacos hasta el momento, hipercolesterolemia, asma y conjuntivitis alérgica, controlado con simvastatina, inhaladores y antihistamínicos. Había padecido dermatitis atópica (DA) desde la infancia. En el año 2010 había sido sometido a queratoplastia penetrante protegida (trasplante de córnea) en el ojo izquierdo debido a queratitis herpética complicada con perforación corneal y endoftalmitis. Dos años después, fue sometido a cirugía de cataratas en el mismo ojo, desarrollando cinco años más tarde úlcera fúngica en la córnea. En el momento del examen cutáneo su situación era estable, y no seguía ningún tratamiento oftalmológico.
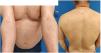
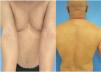
La DA del paciente había sido tratada con corticosteroides tópicos e inmunomoduladores hasta 2013, cuando requirió el uso de tratamientos sistémicos. Siguió numerosos ciclos de terapia oral de corticosteroides, y dos ciclos de 14 y 16 meses de ciclosporina a dosis máxima de 300mg/día de 2013 a 2016. Dichos ciclos fueron efectivos, pero fueron seguidos de recaídas hasta su discontinuación. El paciente recibió también un curso de 14 meses de 12,5mg/semana de metotrexato (2016–2017), que fue discontinuado debido a su inefectividad. Además, recibió 17 sesiones de fototerapia de rayos ultravioleta B de banda estrecha en 2017 y micofenolato mofetil [2g/día durante 25 meses (2017–2019)], que fueron discontinuadas debido a respuesta parcial. En 2020, se inició un nuevo ciclo de terapia de ciclosporina (200mg/día). Tras 15 meses de terapia, las puntuaciones EASI (Eczema Area Severity Index), SCORAD (Scoring Atopic Dermatitis) y BSA (Body Surface Area) del paciente fueron de 27, 62,1% y 65,5%, respectivamente (fig. 1), lo cual propició la discontinuación de ciclosporina y la iniciación del tratamiento de dupilumab, conforme a indicación.
La semana 12ª del régimen terapéutico, el paciente reportó mejora del prurito y eccema a la enfermera, aunque mencionó alopecia, que atribuyó a estrés. La semana 16ª, los valores de EASI, SCORAD y BSA fueron 1, 13% y 12%, respectivamente, mostrando evidencia clínica y tricoscópica de alopecia areata universalis (AAU), que el paciente prefirió no tratar (fig. 2). La semana 24ª, los valores de EASI, SCORAD y BSA fueron 1, 7% y 12%. Fue entonces cuando el paciente experimentó enrojecimiento, dolor y visión borrosa en el ojo izquierdo. La evaluación oftalmológica confirmó la presencia de hiperemia conjuntival con inyección ciliar, injerto leucomatoso y precipitados queráticos finos, junto con reacción de efecto Tyndall +++ y reacción particulada +++, aunque sin hipopion ni hifema. Existió adelgazamiento focal entre el donante y el receptor, indicativo de rechazo de la córnea. El paciente recibió corticosteroides tópicos y orales y profilaxis herpética, discontinuándose dupilumab. El paciente recuperó casi completamente su pelo transcurridos 6 meses, y su enfermedad oftalmológica mejoró sin tratamiento adicional. Para el manejo de su DA recibió metotrexato, que fue discontinuado transcurridos 4 meses debido a hipertransaminasemia elevada, e inició eventualmente tratamiento con baricitinib, un inhibidor de la quinasa Janus. Se desconoce el estado del paciente en el momento de su último seguimiento.
Dupilumab es un anticuerpo monoclonal humano recombinante que inhibe las vías de señalización de interleucina (IL) 4 y 13, reduciendo así la respuesta inmune de Th21–5. En 2017 fue aprobado por la Agencia Europea del Medicamento para tratar la DA de moderada a severa1–5.
Dupilumab puede inducir las enfermedades de la superficie ocular (DIOSD: enfermedad de la superficie ocular inducida por dupilumab.) Principalmente se trata de conjuntivitis de leves a moderadas que pueden controlarse a menudo mediante tratamiento tópico sin necesidad de discontinuar el fármaco1–3,5. Otros efectos secundarios oculares reportados incluyen queratitis, blefaritis, prurito ocular, ojo seco, úlceras corneales, formación de cicatrices conjuntivales y madarosis2,4. Hasta la fecha no se han documentado casos de rechazo de trasplante de córnea relacionados con dupilumab. Deberá realizarse una evaluación oftalmológica antes de iniciar el tratamiento con dupilumab en pacientes con historia oftalmológica previa1,2,4,5. Nuestro paciente no realizaba chequeos regulares ni fue derivado a la consulta de oftalmología previamente a la terapia, dada su estabilidad.
La tasa de supervivencia de los injertos corneales alcanza el 90% dentro del primer año, pero cae al 55% transcurridos 15 años6. Los factores de riesgo de rechazo del injerto dependen principalmente de la técnica utilizada, los mecanismos inmunológicos implicados, y las características del receptor6,7. En nuestro caso, la relación temporal estrecha y la DIOSD ya conocida sugieren la posible asociación de dupilumab con este episodio. No puede descartarse la discontinuación de los tratamientos inmunosupresores para DA como mecanismo adicional. Sin embargo, los inmunosupresores sistémicos no son utilizados normalmente para la prevención del rechazo de trasplante de córnea, ya que tienen eficacia moderada y baja evidencia científica con relación a su uso6,7.
Sobre el posible impacto de dupilumab en la AAU, sigue existiendo controversia alrededor de la literatura médica científica actualmente disponible8–10. Algunos autores han sugerido que la inhibición inducida por dupilumab de los linfocitos Th2 pudo promover la amplificación de otras vías (Th1 y Th17) implicadas en la AAU, mientras que los casos de mejora podrían justificarse por la inhibición de mediadores inflamatorios comunes a AAU y DA8. Otros autores proponen que la inducción o mejora de AAU son procesos aleatorios, y que su inmunidad está mediada principalmente por vías diferentes a Th2. En conclusión, se desconoce el modo en que el bloqueo de la vía de Th2 puede afectar a las respuestas de Th1 y Th17, o por qué dupilumab causa reacciones paradójicas relativas a AAU8–10.
Hemos descrito el primer caso real de rechazo de trasplante de córnea y AAU concomitante en un paciente con DA y tratamiento de dupilumab. Sin embargo, son necesarios más estudios para comprender el modo en que dupilumab está implicado en ambos fenómenos. De igual modo, debemos mencionar la importancia de la supervisión oftalmológica estrecha en los pacientes con historia oftalmológica previa.
Conflicto de interesesLos autores declaran la ausencia de conflicto de intereses.