Las directrices actuales para el tratamiento de la urticaria crónica recomiendan los antihistamínicos H1 de segunda generación como tratamiento de primera línea, con un aumento de hasta 4 veces la dosis si no se controla. Sin embargo, la terapia en la urticaria crónica espontánea suele ser decepcionante, por lo que es necesario un tratamiento adyuvante adicional para mejorar la eficacia de la terapia, especialmente en los pacientes que son refractarios a dosis mayores de antihistamínicos. Las investigaciones más recientes recomiendan varias modalidades de tratamiento adyuvante para la urticaria crónica espontánea, como los agentes biológicos, los inmunosupresores, los antagonistas de los receptores de leucotrienos, los antihistamínicos H2, las sulfonas, la terapia con suero autólogo, la fototerapia, la vitaminaD, los antioxidantes y los probióticos.
Esta revisión bibliográfica presenta estudios recientes sobre la eficacia de diversas terapias adyuvantes en el tratamiento de la urticaria crónica espontánea.
Recent guideline on the management of urticaria recommends second-generation H1-antihistamine as the first-line therapy, with dose increases of up to fourfold if inadequately controlled. However, the treatment of chronic spontaneous urticaria (CSU) is often disappointing, so additional adjuvant therapies are needed to increase the effectiveness of first-line therapy, especially in patients who are refractory to the increase of antihistamine doses. Recent studies recommend various adjuvant therapy modalities for CSU, such as biological agents, immunosuppressants, leukotriene receptor antagonists, H2-antihistamine, sulfones, autologous serum therapy, phototherapy, vitaminD, antioxidants, and probiotics. This literature review was made to determine the effectiveness of various adjuvant therapies in managing CSU.
Actualmente las guías de manejo de la urticaria recomiendan el uso de los antihistamínicos H1 de segunda generación como terapia de primera línea. Así mismo, estas guías recomiendan incrementar la dosis 4veces cuando no se observa una mejoría clara de los síntomas clínicos1. Por otro lado, en muchas oportunidades, a pesar de dicho incremento en la dosis de antihistamínicos, el tratamiento de la urticaria crónica espontánea (UCE) requerirá además el uso de algún agente complementario. Por lo tanto, el uso de terapia adyuvante será necesario para poder incrementar la efectividad de las terapias de primera línea. La terapia adyuvante en la UCE será necesaria especialmente en aquellos pacientes en los que, a pesar de haber incrementado la dosis de los antihistamínicos, sigan siendo refractarios al tratamiento. Esta revisión de la literatura busca discutir en mayor profundidad las distintas terapias adyuvantes, así como su papel en el manejo de la UCE. Como se muestra en la tabla 1, el nivel de evidencia (LoE) del manejo se basa en el Oxford Center for Evidence-Based Medicine 2011 para el estudio de terapias, y las distintas alternativas de terapia adyuvante se observan en la tabla 2.
Nivel de evidencia (LoE) del Oxford Centre for Evidence-Based Medicine 2011 para el estudio de terapias
| Nivel I | Nivel II | Nivel III | Nivel IV | Nivel V |
|---|---|---|---|---|
| Revisión sistemática de ensayos aleatorizados o ensayos n-de-1 | Ensayo aleatorizado o estudio observacional con efecto dramático | Estudio de seguimiento/cohorte controlado no aleatorizado | Serie de casos, estudios de casos y controles o estudios históricamente controlados | Mecanismo basado en el razonamiento |
Modalidad de terapia adyuvante en el tratamiento de la urticaria crónica
| Modalidad | Tipo | Indicación | Dosis | Mejora inicial | LoE |
|---|---|---|---|---|---|
| Agente biológico | Omalizumab | UCE/UindC | 150-300mg/4 sem, s.c. | 1-2 sem | I |
| Rituximab | UCE | 375mg/m2/sem, i.v. | 1 sem | IV | |
| Inhibidor TNF-α (etanercept) | UCE/UindC | 50mg/sem, s.c. | 1 sem | IV | |
| Inmunosupresor | Ciclosporina | UCE/UindC | 3-5mg/kgBB/día, v.o. | 5-7 días | I |
| Metotrexato | UCE/UindC | 7,5-15mg/sem, v.o. | 3 sem-meses | II | |
| MMF | UCE | 1.000-2.000mg/día, v.o. | 12-14 sem | II | |
| LTRA | Montelukast | UCE/UindC | 10mg/día, v.o. | 2-4 sem | I |
| Antihistamínicos H2Sulfona | Ranitidina | UCE | 150-300mg/día, v.o. | 1-2 sem | I |
| Dapsona | UCE/UindC | 50-100mg/día, v.o. | 1-6 sem | II | |
| Sulfasalazina | UCE/UindC | 500-2000mg/día, v.o. | 3-6 meses | IV | |
| Fototerapia | NBUVB | UCE/UindC | 200mJ/cm2, 3×/sem, 10-20% | 7-8 sem | I |
| Autohemoterapia | AST | UCE | 0,05ml/kgBB/sem, i.m. | 4-7 sem | I |
| VitaminaD | VitaminaD3 | UCE | 2.000IU/día o 60.000IU/sem, v.o. | 4-12 sem | I |
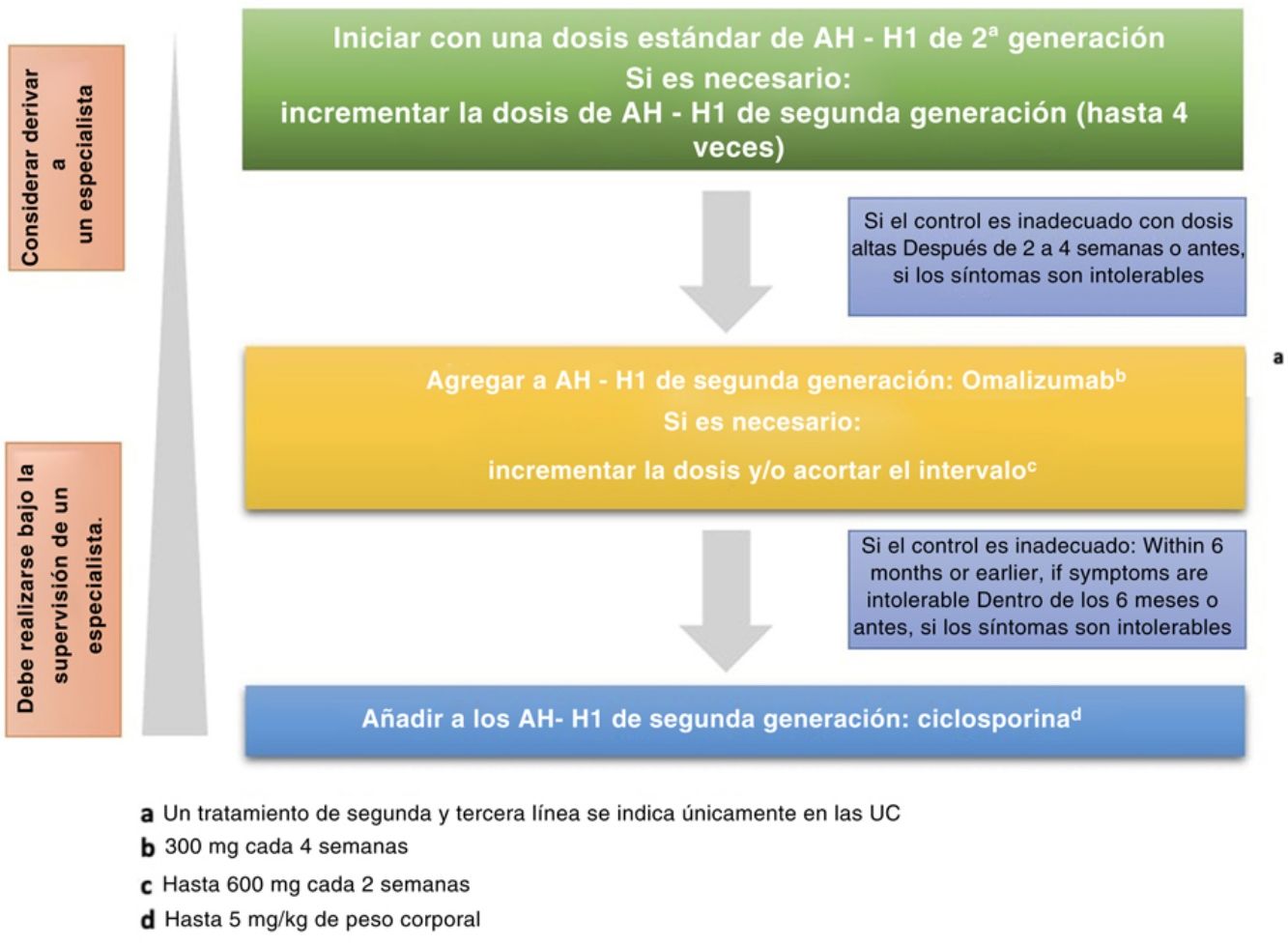
El objetivo del tratamiento de la UCE es resolver todos los síntomas a través de enfoques no farmacológicos, incluida la identificación y la eliminación de las causas de la urticaria, evitando los factores desencadenantes y la inducción de tolerancia. La terapia farmacológica se usará para prevenir la liberación de los mediadores de mastocitos o inhibir el efecto de estos. El tratamiento farmacológico debe buscar la dosis más baja con la que se puedan aliviar los síntomas. El tratamiento es ajustable, de acuerdo con el grado de actividad de la enfermedad2. Como se ilustra en la figura 1, la guía EAACI/GA2LEN/EDF/WAO en 2022 recomienda la segunda generación de antihistamínicos H1 como primera línea de terapia en la UCE, con el aumento de la dosis hasta en 4veces si no hay mejoría en los síntomas clínicos1.
Algoritmo de tratamiento de la UCE basado en EAACI/GA2LEN/EDF/WAO en 2022.
Fuente: Zuberbier et al.2.
La terapia adyuvante es un tratamiento que se administra de manera simultánea con la terapia de primera línea con el propósito de aumentar la efectividad de esta3. La terapia adyuvante en la UCE será necesaria principalmente en aquellos pacientes que no responden al tratamiento o que son refractarios a dosis crecientes de antihistamínicos. Las siguientes secciones discutirán diversas terapias adyuvantes y sus funciones en la UCE.
Agente biológicoLos agentes biológicos provienen de los seres vivos y se utilizan para prevenir, diagnosticar o tratar una enfermedad. Los agentes biológicos utilizados para tratar la urticaria refractaria crónica son el omalizumab, el rituximab, la inmunoglobulina intravenosa (IGIV), los inhibidores del TNF-α (el infliximab, el adalimumab y el etanercept), todos utilizados en combinación con el régimen estándar de antihistamínicos4.
OmalizumabEl omalizumab (OMA) es un anticuerpo monoclonal recombinante de origen humano que actúa como un anticuerpo anti-IgE, impidiendo la unión de la IgE a las células receptoras5,6. La eficacia del OMA está demostrada, y este suele ser bien tolerado por los pacientes con UCE. Las guías EAACI/GA2LEN/EDF/WAO de 2022 recomiendan el OMA como terapia de tercera línea para pacientes con urticaria crónica refractaria a pesar del aumento de la dosis de antihistamínico H12.
El mecanismo de acción del OMA no está completamente claro. Kaplan et al.7 han informado que el mecanismo de acción del OMA en el tratamiento de la UCE se debe a la disminución de la IgE libre y de los receptores de IgE, a la reducción de la capacidad de los mastocitos para liberar histamina, a la restauración de la basopenia, a la restauración de la función de los receptores de IgE en los basófilos, a la reducción de la actividad de autoanticuerpo IgG hacia IgE y sus receptores, a la reducción de la actividad intrínseca anormal de la IgE, con lo cual se reduce el autoanticuerpo IgE hacia un antígeno o un autoantígeno desconocido, y se reduce la coagulación anormal relacionada con la actividad de la enfermedad observada in vitro.
La efectividad del uso del OMA como tratamiento adyuvante en la UCE se ha demostrado en diversos ensayos clínicos de faseII8,9 y faseIII10-12, así como en un metaanálisis13. Los tres ensayos clínicos de faseIII concluyeron que en los pacientes con UCE/urticaria inducible crónica (UindC) moderados-graves que no respondieron al tratamiento estándar y otras terapias adicionales, y que recibieron OMA 75mg, 150mg o 300mg durante 12 a 24semanas, hubo una disminución en el puntaje de gravedad del prurito (ISS) en el tratamiento de 12semanas. Casale et al.14 informaron que se observaron más pacientes con un puntaje de actividad de urticaria7 (UAS7) ≤6 (los síntomas están bien controlados) o UAS7 0 (los síntomas están perfectamente controlados) cuando se les pautó OMA 300mg en comparación con el placebo.
El OMA es eficaz en dosis de 150-300mg por mes. La dosis y la duración de la terapia pueden variar entre países. En general, el OMA se tolera bien y los efectos secundarios más comunes son la nasofaringitis, la sinusitis, el dolor de cabeza y la tos14. El riesgo de anafilaxia puede ocurrir 2h después de la primera administración del OMA; por lo tanto, se necesita una observación cuidadosa14.
RituximabEl rituximab es un anticuerpo monoclonal quimérico que actúa contra el CD20. El mecanismo de acción del rituximab en la UCE impide la producción de autoanticuerpos15. El resultado del tratamiento con rituximab es muy variable. En el reporte de un caso, un paciente con urticaria por presión, que fracasó a la primera y a la segunda línea de tratamiento, recibió una infusión de rituximab de 375mg/m2/semana en 4 oportunidades, aunque no se observó ninguna mejoría. Por otro lado, otro reporte de un caso de UCE e inmunodeficiencia tratado con 4 dosis de rituximab 375mg/m2/semana demostró una recuperación completa de los síntomas de la urticaria tras una semana, con una remisión de más de un año de duración. Los síntomas posteriores se trataron fácilmente con antihistamínicos16. En otro caso de UCE autoinmune refractaria que recibió rituximab por semana (4 dosis durante 4 semanas) junto con la administración de metotrexato, se demostró una remisión completa a las 6semanas después de la última administración17. No se han encontrado ensayos controlados aleatorizados (ECA) del uso de rituximab en la UCE.
Inhibidor TNF-αAlgunos fármacos inhibidores del TNF-α, como son el etanercept, el infliximab y el adalimumab, se utilizaron para tratar la UCE o la vasculitis urticaria basándose en la hipótesis de que el TNF puede tener funciones muy relevantes en algunos tipos de urticaria18,19. Por ejemplo, el etanercept 2×25mg/semana es útil para tratar la urticaria por presión retardada y la psoriasis. En el día5 de tratamiento la urticaria se resolvió y no reapareció hasta que se finalizó el tratamiento20. En una serie de 6casos de pacientes con urticaria idiopática crónica o vasculitis urticaria tratados con el inhibidor TNF-α demostró una mejoría clínica espectacular en todos los pacientes21.
Se han publicado diversas infecciones graves, como es el caso de la tuberculosis, de infecciones por hongos, linfomas y otras neoplasias. Este fármaco no se recomienda para el tratamiento de la UCE debido a la falta de pruebas que respalden la seguridad y la eficacia de dicho tratamiento. Además, no existe ningún ensayo clínico que compare este fármaco con el OMA, en el que se haya comprobado su seguridad y su eficacia.
InmunosupresorCiclosporinaUna dosis baja de ciclosporina se usa comúnmente en pacientes con UCE/UindC graves y refractarias. Las guías EAACI/GA2LEN/EDF/WAO de 2022 recomiendan el uso de ciclosporina como terapia de cuarta línea en los pacientes con UCE resistentes a antihistamínicos H1 y al OMA. La ciclosporina actúa como un inmunosupresor. Se sabe que su efecto se basa en que atenúa la actividad de las célulasT. En la UCE, la ciclosporina tiene un papel en algunos mecanismos, como los inhibidores de la calcineurina, que dificultan la liberación dependiente de calcio por histamina, leucotrieno C4 y otros mediadores de mastocitos y varias otras células. La ciclosporina también interrumpe la actividad del TNF-α y secundariamente inhibe la acumulación de los neutrófilos22.
Una revisión sistemática realizada en el año 2018 demostró una mejoría significativa en los síntomas de urticaria en pacientes con UCE que recibieron una dosis relativamente alta de ciclosporina (5-6mg/kg/día). Sin embargo, el paciente suele suspender la terapia debido a la aparición de efectos secundarios. En la mayoría de los estudios recientes se usan dosis más baja (2-4mg/kg/día) o una terapia inicial con una dosis alta para continuar disminuyendo la dosis hasta obtener la dosis efectiva más baja22. Los estudios realizados en la población pediátrica también usan un rango de bajas dosis. Los ensayos clínicos aleatorizados que incluyeron pacientes refractarios a la UCE resistentes a los antihistamínicos estándar compararon un grupo que recibió 4mg/kg/día de ciclosporina y un grupo que recibió placebo durante 4semanas. Ocho de 19 pacientes (42%) que recibieron ciclosporina presentaron una mejoría al compararlos con el grupo placebo. Se observaron efectos secundarios leves en 29 de los 30 sujetos23.
Aún no se cuenta con una guía clínica que indique la dosis óptima de ciclosporina en la UCE. La última revisión sistemática recomienda una dosis inicial de 3mg/kg de ciclosporina, dividida en 2dosis. A la mayoría de los pacientes adultos se les administró una dosis de 100 a 150mg, 2veces al día. Algunos de los pacientes mostraron mejoría entre la semana1 a la2, mientras que en la mayoría de los otros pacientes la mejoría se evidenció a los 3meses22. Los efectos secundarios leves asociados al uso de la ciclosporina (relacionados con la dosis) son la aparición de parestesias, síntomas gastrointestinales y dolor de cabeza. La reducción de la dosis puede disminuir los síntomas. La hipertensión y la insuficiencia renal son un efecto secundario grave y poco común que obliga a la interrupción del tratamiento.22
MetotrexatoExisten varios casos y series de casos publicados acerca de la eficacia del metotrexato en la reducción de los síntomas de los pacientes con UCE que son dependientes de los corticoides24,25, así como de aquellos con vasculitis urticaria26. Un ensayo controlado aleatorizado realizado en la India concluyó que el uso combinado de metotrexato (7,5-15mg por semana) durante 3meses en las urticarias refractarias crónicas no demostró ningún beneficio significativo27. Aunque los datos disponibles aún son limitados, varios estudios recomiendan el uso del metotrexato como terapia alternativa en algunos casos de urticaria refractaria, basándose principalmente en que este medicamento tiene un precio asequible, a su disponibilidad, a que tiene una pauta de fácil cumplir, y a que su uso está ampliamente aceptado.
Micofenolato de mofetiloEl micofenolato de mofetilo (MMF) es un agente inmunomodulador que se utiliza en el tratamiento del rechazo de trasplantes de órganos sólidos y en varias patologías dermatológicas (como uso fuera de ficha técnica). El mecanismo de este inmunomodulador (MMF) en la urticaria crónica autoinmune e idiopática no se conoce del todo. Se sabe que el MMF es eficaz en el tratamiento de la urticaria al inhibir la producción de autoanticuerpos hacia los receptores de IgE de alta afinidad y/o IgE, así como al reducir la expresión de moléculas de adhesión a las células endoteliales, inhibiendo así la invasión leucocitaria a la piel28.
En un estudio clínico de 9 pacientes con UCE refractaria resistente a antihistamínicos y/o corticoides, la administración de 2×1.000mg de MMF durante 12semanas redujo la puntuación del UAS y frenó la actividad de la enfermedad incluso sin corticoides29. Un estudio retrospectivo de 19 pacientes con urticaria autoinmune y urticaria idiopática crónica mostró que el 89% de los síntomas de urticaria se controlaron durante las 14 semanas de consumo de MMF (dosis de 1.000-6.000mg/día, en dosis divididas). Así mismo, se observó que los efectos secundarios más comunes son los síntomas gastrointestinales30. Debido a la falta de evidencia científica, la dudosa eficacia, su alto precio y los efectos secundarios registrados, no se recomienda el uso de MMF como tratamiento en la guía para pacientes con UCE/UindC.
Antagonistas de los receptores de leucotrienos (LTRA)En la mayoría de los casos, la UCE es difícil de controlar solo con antihistamínicos. Por lo tanto, se sospecha que existen otros mediadores que tienen un papel diferente a las histaminas, como la cinina, las prostaglandinas y el leucotrieno. Estos mediadores pueden ser los responsables de que algunos de los síntomas de la urticaria no se puedan controlar únicamente con antihistamínicos. Los cisteinil leucotrienos son un potente mediador proinflamatorio que puede ser inhibido por los LTRA; estos son el montelukast, el zafirlukast y el pranlukast31. El uso de estos fármacos en el asma y en la rinitis alérgica ya ha demostrado ser beneficioso. Las pautas para el tratamiento de la UCE de la Sociedad Británica de Alergia e Inmunología Clínica (BSACI) y en el Documento de Consenso Americano recomiendan agregar LTRA antes de prescribir el OMA y la ciclosporina.
Una revisión sistemática de De Silva et al.31 evidenció una reducción en el número de lesiones de urticaria en pacientes en monoterapia con los LTRA en comparación con el placebo. Se ha demostrado que la combinación de antihistamínicos y los LTRA es beneficiosa en muchos estudios, aunque hubo un estudio en el que se objetivaron hallazgos contradictorios. En general, algunos de los estudios más recientes apoyan el uso de los LTRA en combinación con los antihistamínicos. Esta combinación demostró resultados beneficiosos con la dosis de 10mg/día durante 2 a 4 semanas. Una de las debilidades de la terapia con los LTRA es el precio, ya que será más cara si se compara con el precio de los antihistamínicos durante el mismo rango de tiempo. Sin embargo, como terapia combinada con antihistamínicos, los LTRA demostraron una buena tolerancia con efectos secundarios mínimos31.
Antihistamínicos H2Los antihistamínicos H2, como su nombre lo indica, son medicamentos que se unen a los receptores de histamina H2. Estos receptores se encuentran comúnmente en las células del estómago. Los antihistamínicos H2 se usan en el tratamiento de las patologías gastrointestinales relacionadas con el ácido, como es el caso de la úlcera péptica, el reflujo gastroesofágico (ERGE) y la dispepsia. Los antihistamínicos H2 también se pueden usar en el tratamiento de la urticaria. Generalmente, estos medicamentos se suelen combinar con los antihistamínicos H1. Como ejemplos de estos medicamentos tenemos a la cimetidina, la ranitidina, la famotidina, la roxatidina, la lafutidina y la nizatidina.
Una revisión sistemática concluyó que la combinación de los antihistamínicos H1 y los antihistamínicos H2 en los pacientes con UCE demostró una mejor respuesta, si comparados con el uso de los antihistamínicos H1 en monoterapia; sin embargo, cabe mencionar que el nivel de evidencia observado fue escaso32. La sinergia entre los antihistamínicos H1 y los antihistamínicos H2 aún es discutible. La posible causa puede deberse a su efecto farmacocinético, ya que los antihistamínicos H2 provocarán un aumento del nivel sérico de los antihistamínicos H1. Un ensayo clínico aleatorizado en 45 pacientes con UCE que recibieron terfenadina y ranitidina como terapia adyuvante demostró un mejor resultado en comparación con la administración de terfenadina sola, principalmente en cuanto a la disminución del prurito. A pesar de esto, no se logró evidenciar un efecto significativo sobre los síntomas de la urticaria33.
La mayoría de los ECA y algunos informes de casos mostraron que el agregar antihistamínicos H2 proporciona beneficios insuficientes; además, en algunos estudios no se llegaron a cumplir los objetivos propuestos32. Por lo tanto, este fármaco no está incluido en el tratamiento primario de la UCE según las guías EAACI/GA2LEN/EDF/WAO en 2022. En general, los antihistamínicos H2 pueden tolerarse bien. Algunos de los efectos secundarios descritos fueron: hipotensión, dolor de cabeza, mareos, diarrea, erupciones cutáneas, ginecomastia, pérdida de la libido e impotencia.
SulfonasLa dapsona y la sulfasalazina se han utilizado en diversos estudios como tratamiento adyuvante en los casos de UCE34.
DapsonaLa dapsona suprimirá la actividad de las prostaglandinas y de los leucotrienos. Esto influye en la liberación o en la función de las enzimas lisosomales de los neutrófilos35, interfiere con la adhesión de los neutrófilos mediada por las integrinas, en la inhibición del reclutamiento y en la activación de la señal de los neutrófilos36, así como en la eliminación de los intermediarios de los radicales libres de oxígeno37.
Un ECA, en el que se incluyeron un total de 22 pacientes con UCE tratados con dapsona 100mg/día durante 6semanas, ha demostrado buenos resultados en el control de los síntomas de urticaria y prurito38. Otro ECA informó que la combinación de dapsona con antihistamínicos, en comparación con el uso en monoterapia de antihistamínicos, demostró una disminución en las puntuaciones del UAS, presentando incluso una remisión completa de los síntomas en algunos de los casos39. Además, la dapsona es eficaz en el tratamiento de la urticaria vasculitis y en el angioedema idiopático40-42.
Los efectos secundarios de la dapsona incluyen la metahemoglobinemia, la neuropatía periférica y la hepatotoxicidad. Por lo tanto, es necesario verificar la deficiencia de la G6PD antes de comenzar el tratamiento. Debido a la disponibilidad limitada de una evidencia científica y a la posibilidad de efectos secundarios graves, las guías EAACI/GA2LEN/EDF/WAO 2022 no recomiendan el uso de la dapsona como terapia para la UCE/UCE.34
Sulfasalazina (SSZ)El mecanismo de acción de la SSZ en pacientes con UCE incluye la liberación de adenosina, la reducción de la síntesis de leucotrienos y prostaglandinas, la inhibición de la degranulación de los mastocitos mediada por IgE, así como la inhibición de la proliferación y la diferenciación en fase temprana de los linfocitosB43.
Los estudios han concluido que la sulfasalazina es útil como complemento de la terapia estándar en pacientes con síntomas refractarios43,44. En un estudio retrospectivo en 39 pacientes con UCE refractaria a los antihistamínicos y a otras terapias, estos recibieron sulfasalazina como terapia concomitante, utilizando una dosis de inicio de 500mg por día, la que luego se incrementó semanalmente hasta llegar a los 2.000mg por día (y hasta 3.000mg por día en 15 pacientes) si es que se toleraba43. El 84% de los pacientes mejoraron dentro de los 3meses de tratamiento, con una duración media de 74semanas.
En adultos, la terapia con sulfasalazina se puede iniciar con una dosis de 500mg, 1 o 2veces al día, y aumentar gradualmente a 1g, 2veces al día. La duración óptima de la terapia varía de un individuo a otro. En general, la sulfasalazina está bien tolerada en la mayoría de los pacientes. Los efectos secundarios incluyeron náuseas, dolor de cabeza, leucopenia leve y transitoria, y en menor grado, agranulocitosis.
FototerapiaLa fototerapia utilizando psoralenos con ultravioletaA (PUVA) o UVB de banda estrecha (NBUVB) y UVA es beneficiosa en la UCE45,46. La fototerapia también se considera una opción de tratamiento en pacientes con intolerancia a fármacos sistémicos. La piel expuesta directamente a la radiación ultravioleta experimentó una mejoría espectacular; en este hecho se basa la hipótesis de que hay mediadores y células locales que actuarán como objetivos primarios47. Aunque la efectividad de NBUVB en la UCE se ha sugerido en diversos estudios, el mecanismo exacto de acción de la NBUVB en la UCE aún no está claro. La NBUVB tiene un efecto supresor sobre la respuesta inmune sistémica y la actividad de las células asesinas naturales (NK), la proliferación de los linfocitos y la regulación de la producción de citoquinas por Th1 (IL-2, IFN-g) y Th2 (IL-10). La NBUVB también tiene un efecto inhibitorio sobre los mediadores proinflamatorios y las citocinas.
Una revisión sistemática concluyó que la NBUVB es una modalidad de terapia adyuvante en el manejo de la UCE refractaria48. Un ECA en 50 pacientes con UCE refractarios a los antihistamínicos H1 y pacientes dependientes de corticoides orales comparó la administración de NBUVB y PUVA. Se observó una mayor mejoría clínica en el grupo con la NBUVB que en el grupo con PUVA. Los efectos secundarios solo ocurrieron en un pequeño número de pacientes, incluyendo el bronceado y la xerosis49.
Un estudio de Sheikh et al.50 demostró que la NBUVB en combinación con los antihistamínicos puede ser una terapia adyuvante eficaz en pacientes con UCE. Esta combinación permitirá una mayor reducción del UAS en comparación con el uso únicamente de antihistamínicos. En este estudio se pautó una dosis inicial de fototerapia de 200mJ/cm2 y se realizaron 16 sesiones durante 8semanas. Berroeta et al.51 informaron que la mediana de sesiones de fototerapia en pacientes con UCE fue de 22 sesiones, la frecuencia fue de 3×/semana con una dosis inicial del 70%, comenzando con una dosis eritematosa mínima, y luego se fue incrementando, en un 10-20% por visita, a una dosis media de 1.238mJ/cm2 (rango 100-2.111mJ/cm2). Por su parte, Engin et al.52 sugirieron que se necesitó un número total de 20 sesiones, con una frecuencia de 3×/semana y una dosis inicial de 200mJ/cm2, incrementada en un 10-20% hasta una dosis máxima de 1.300mJ/cm2. Los efectos secundarios de la terapia NBUVB incluyen el eritema, el prurito y la formación de vesículas50.
Terapia de suero autólogoAproximadamente el 30-50% de los pacientes con UCE tienen autoanticuerpos que se unen al receptor de IgE de alta afinidad FcɛRiα en basófilos o mastocitos que producen histamina e IgE53. Hide et al.54 informaron que la inyección intracutánea de suero, la prueba cutánea de suero autólogo (ASST), provoca un tipo de reacción de hipersensibilidad rápida en pacientes con UCE, que se conoce como UCE autorreactiva o autoinmune. Estos pacientes tenían puntuaciones de picazón o urticaria y síntomas sistémicos más severos asociados con otras enfermedades autoinmunes. Debido a que los factores liberadores de histamina circulantes desempeñan un papel en la inducción de síntomas de urticaria en pacientes con UCE positivos para ASST, la autohemoterapia se considera prometedora y tiene potencial como opción de tratamiento en la urticaria autoinmune crónica.
Una revisión sistemática realizada por Chang et al.55 en 2019 concluyó que la sangre entera autóloga (AWB) y la terapia con suero autólogo (AST) no fueron significativamente más eficaces para aliviar los síntomas de la UCE que el placebo. Nageswaramma et al.56 informaron que 50 pacientes con UCE con ASST positivo y negativo recibieron inyecciones de terapia de suero autólogo (AST) semanalmente durante 9semanas y fueron seguidos durante 12semanas después de 9semanas de inyecciones. Los síntomas de urticaria disminuyeron en la semana4 y el uso de antihistamínicos disminuyó un 100% desde el inicio en ambos grupos. Se encontró que el paciente estaba en remisión completa en la semana21.
En un estudio realizado por Kumaravel et al.57, en el que participaron 200 pacientes con UCE, se administró AST por vía intramuscular a 47 pacientes con ASST(+) cada semana durante 9semanas y se les dio seguimiento durante 3meses. Al final de la terapia, ninguno de los pacientes tenía puntuación total de gravedad (TSS) grave, 9 pacientes estaban libres de síntomas y la mayoría tenía solo TSS leve. Como informaron Karn y Kc58, 102 pacientes con UCE con ASST(+) y (−), se les administró una inyección intramuscular de 0,05ml/kg de suero autólogo semanalmente durante 10semanas. Hubo una mejora significativa en la UAS en la semana10 en comparación con el valor inicial en ambos grupos. En pacientes con urticaria autoinmune crónica, la AST es una modalidad terapéutica económica y efectiva con efectos secundarios mínimos.
Vitamina DLa vitaminaD juega un papel importante en los sistemas inmunitarios innato y adaptativo a través de la estimulación de los receptores tipo Toll, aumentando la producción de citoquinas proinflamatorias y posiblemente mejorando la respuesta Thelper2. Este mecanismo podría explicar la asociación de la vitaminaD con varias enfermedades alérgicas autoinmunes, incluida la UCE4.
Una revisión sistemática realizada por Tuchinda et al.32 indicó que la suplementación con dosis altas de vitaminaD podría reducir significativamente la actividad de la UCE. Otro estudio indicó que la suplementación con vitaminaD de 2.000UI/día y 60.000UI/semana redujo la actividad de la enfermedad en casi todos los pacientes con UCE. De las diversas pautas, se informó que las dosis más altas de vitaminaD (vitaminaD3 al menos 28.000UI/semana durante 4 a 12semanas o vitaminaD2 140.000UI/semana durante 6semanas) fueron las más eficaces. Aunque los estudios son relativamente escasos, los pacientes con UCE con vitaminaD sérica baja, tras haber ingresado al estudio tienden a mejorar con suplementos de vitaminaD en dosis altas. La vitaminaD tiene un alto límite de dosis de seguridad. La ingesta máxima tolerable es de 4.000 a 10.000UI/día para adultos y ancianos, pero menor para lactantes y niños.
Aunque no hay datos acerca de los efectos secundarios durante la administración de la terapia con vitaminaD, se debe considerar la seguridad del paciente cuando se usan dosis altas. La evaluación de los niveles séricos de vitaminaD se puede usar para evaluar la seguridad y determinar la relación con los resultados terapéuticos, y se debe tener precaución con respecto a los posibles efectos secundarios cuando los niveles séricos de 25(OH)D son superiores a 50ng/ml (125nmol/l). En pacientes con UCE recalcitrantes con niveles séricos bajos de vitaminaD se pueden usar dosis altas de suplementos de vitaminaD durante 4 a 12 semanas como terapia adyuvante.
ConclusiónEl omalizumab se ha convertido en la primera opción de terapia adyuvante; sin embargo, en algunos países el omalizumab aún no está disponible ni es accesible. Otras razones son el coste-efectividad: el omalizumab tiene un elevado precio y no está cubierto por la seguridad social en todos los países. Los pacientes deben ser evaluados exhaustivamente antes de elegir el tratamiento. Si bien la fototerapia es una de las alternativas de tratamiento, sobre todo si consideramos que sus efectos secundarios son leves, por otro lado, presenta una mala adherencia por parte del paciente, por lo que se prefiere recomendar el uso de terapia sistémica, como son el metotrexato y otros agentes.
En la UCE diversas modalidades de terapia adyuvante pueden actuar sinérgicamente para incrementar la efectividad de la terapia de primera línea, como es el caso de los antihistamínicos H1 de segunda generación. Es necesario ampliar los estudios de investigación y así poder evaluar las diversas modalidades de tratamiento adyuvante utilizando un método mejor y más consistente, con lo cual se pueda mejorar la práctica clínica.
FinanciaciónLos autores no han recibido apoyo financiero para la publicación de este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.