El manejo del carcinoma de células escamosas cutáneo (cSCC) avanzado es complicado, siendo modesta la eficacia de muchos de los fármacos sistémicos disponibles. Cemiplimab ha demostrado su eficacia en el tratamiento del cSCC avanzado en ensayos clínicos, pero los datos del mundo real siguen siendo limitados. Con el objetivo de evaluar la eficacia de cemiplimab en un entorno clínico del mundo real, realizamos un estudio observacional prospectivo de 13 pacientes con cSCC avanzado. Seis pacientes (46%) tenían enfermedad localmente avanzada, mientras que 7 (54%) tenían enfermedad metastásica. Un total de 8 pacientes (62%) respondieron a cemiplimab, 5 (38%) mostraron una respuesta parcial y 3 (23%) mostraron una respuesta completa. Cuatro pacientes con respuesta parcial inicial presentaron una progresión de la enfermedad subsiguiente durante el seguimiento. Seis pacientes (46%) desarrollaron efectos secundarios, siendo leves la mayoría de los mismos (G1). La supervivencia libre de progresión fue de 5,9 meses, con un seguimiento medio de 9 meses. En conclusión, cemiplimab demostró su utilidad en el tratamiento del cSCC avanzado, con unas tasas de respuesta aceptables, un número destacable de respuestas completas y un perfil de seguridad muy bueno.
Management of advanced cSCC is challenging, and many available systemic medications have modest efficacy. Cemiplimab has demonstrated efficacy in the treatment of advanced cSCC in clinical trials, but real-world data are still limited. With the objective of evaluating the efficacy of cemiplimab in a real-world clinical setting, we conducted a prospective observational study of 13 patients with advanced cSCC. Six patients (46%) had locally advanced disease, while 7 (54%) had metastatic disease. A total of 8 patients (62%) responded to cemiplimab. Five (38%) showed a partial response, while 3 (23%) showed a complete response. Four patients with an initial partial response presented subsequent disease progression during follow-up. Six patients (46%) developed AEs, most of which were mild (G1). PFS was 5.9 months, with a median follow-up was 9 months. In conclusion, cemiplimab demonstrated its utility in the treatment of advanced cSCC, with acceptable response rates, a remarkable number of complete responses, and a very good safety profile.
El carcinoma de células escamosas cutáneo (cSCC) es la segunda neoplasia cutánea más común, habiéndose incrementado su incidencia en los últimos decenios1,2. La mayoría de los casos de cSCC comportan un buen pronóstico y pueden ser tratados mediante escisión quirúrgica2,3. Si embargo, un pequeño porcentaje de casos entran en la categoría de cSCC avanzado, que se define como un tumor quirúrgicamente extirpable, y no susceptible de terapia curativa de radiación, y/o que ha desarrollado metástasis ganglionares o viscerales1,4. El manejo de los pacientes con cSCC avanzado es frecuentemente complicado, y hasta hace poco la elección de fármacos sistémicos era limitada, y con eficacia modesta3–6. Sin embargo, últimamente existe evidencia creciente sobre la eficacia de la inmunoterapia para el cSCC. Cemiplimab (anticuerpos monocolonales anti-PD1) es el primer agente inmunoterapéutico aprobado para el tratamiento del cSCC metastásico o localmente avanzado, habiendo demostrado una actividad antitumoral sustancial con un perfil de seguridad aceptable en los ensayos clínicos7–9. La evidencia de los estudios en el mundo real con cemiplimab es aún escasa, y consiste principalmente en informes sobre casos individuales, existiendo solo dos estudios retrospectivos recientes de pacientes tratados con diversos inhibidores de PD-1 (incluyendo cemiplimab)10,11. En el presente estudio reportamos los resultados clínicos de 13 pacientes con cSCC avanzado tratados con cemiplimab. La principal medida del resultado fue la respuesta al tratamiento. Los objetivos secundarios fueron la evaluación de las reacciones adversas (RA) graves relacionadas con el tratamiento, y la supervivencia libre de progresión (SLP).
MétodosSe realizó un estudio prospectivo observacional, que incluyó 13 pacientes tratados con cemiplimab en la Fundación Instituto Valenciano de Oncología, entre abril de 2019 y noviembre de 2020 (6 pacientes con enfermedad localmente avanzada, 7 con enfermedad metastásica nodular o visceral). Se administró el tratamiento por vía intravenosa a una dosis autorizada de 350mg cada 3 semanas. Se definió la respuesta parcial (RP) como la reducción ≥20% del diámetro clínico y/o radiológico, y la respuesta completa (RC) como la desaparición clínica y radiológica completa del tumor. Se definió la progresión como el incremento de la masa tumoral de ≥10%. La enfermedad estable no cumplió los criterios de progresión o respuestas completa o parcial. Los pacientes con progresión de la enfermedad recibieron hasta 6 ciclos de cemiplimab antes de suspenderse el tratamiento. Los departamentos de Oncología y Dermatología llevaron a cabo un seguimiento conjunto de todos los pacientes, realizando un examen físico minucioso y una entrevista previa a cada infusión, así como pruebas de laboratorio de control que incluyeron un recuento celular completo y un panel bioquímico básico (electrólitos, función hepática y renal, y niveles de lactato deshidrogenasa). Se realizaron cuadros clínicos de control cada 6-9 semanas por parte del departamento de Dermatología. Se realizaron estudios de imagen de control con una periodicidad variable: para confirmar las respuestas al tratamiento clínico, para evaluar la progresión de la enfermedad, y para verificar el mantenimiento de la respuesta. Se estudió la expresión de PDL-1 en muestras histológicas de 11 casos. Se realizó un análisis estadístico descriptivo utilizando el programa IBM-SPSS 25.0. El presente estudio fue aprobado por el comité de revisión institucional de la Fundación Instituto Valenciano de Oncología, obteniéndose consentimiento informado de los pacientes o de sus familiares, conforme a los procedimientos establecidos por el comité de ética de nuestro hospital.
ResultadosSe incluyó en el presente estudio a un total de 13 pacientes, de los cuales todos eran varones, salvo una paciente, y la mayoría de ellos eran personas mayores (edad media de 81 años, rango 56-91). Las principales características clínicas y los resultados del tratamiento se muestran en la tabla 1. Los pacientes recibieron una media de 6 ciclos de cemiplimab (rango 1-23). A nivel general, 8 casos (62%) respondieron a cemiplimab tras una media de 2 ciclos (rango 2-4). Tres pacientes (23%) reflejaron una respuesta completa, y 5 (38%) una RP. Los pacientes respondedores recibieron una media de 9 ciclos de tratamiento. Todos los pacientes, salvo uno, con RP inicial, presentaron progresión de la enfermedad subsiguiente, lo cual originó la suspensión del tratamiento. Uno de los pacientes con RC (caso 2) falleció por causas diferentes mientras seguía recibiendo cemiplimab. En el caso 8, se suspendió cemiplimab tras 11 ciclos (5 ciclos tras lograr una respuesta radiológica completa), sin progresión hasta la fecha. Finalmente, el último paciente con RC (caso 4) sigue recibiendo cemiplimab (23 ciclos hasta la fecha): dada la localización de alto riesgo del tumor, nos pareció muy arriesgada la suspensión del tratamiento. La SLP para los pacientes respondedores fue de 5,9 meses (rango 1,9-15,5). Cinco pacientes no reflejaron respuesta al tratamiento (uno de ellos se perdió durante el seguimiento tras haber recibido solo un ciclo de tratamiento). El seguimiento medio fue de 9 meses (rango 3,5-16). En cuanto a la toxicidad relacionada con el tratamiento, 6 pacientes (46%) desarrollaron RA, siendo la mayoría de ellas leves (G1). Uno de los pacientes de nuestra serie presentó una RA grave o letal. Ningún paciente suspendió el tratamiento debido a RA. Los efectos secundarios más comunes fueron fatiga, mareo y diarrea (tabla 1). Por último, la expresión de PD1-L se midió en 11 casos, con un valor medio del 10% (rango 1-90%). La expresión de PD1-L no parece guardar relación con la respuesta al tratamiento.
Principales características clínicas y resultados del tratamiento
| Edad | Sexo | Localización del tumor primario | Metástasis | Expresión de PDL-1 | Mejor respuesta | Número de ciclos | Toxicidad inmunorrelacionada | Suspensión del tratamiento | Causa de la suspensión | |
|---|---|---|---|---|---|---|---|---|---|---|
| Paciente 1 | 83 | V | Cuero cabelludo | No | Débil positivo (10%) | Enfermedad progresiva | 3 | Erupción de grado 2 | Sí | Progresión tumoral |
| Paciente 2 | 82 | V | Mejilla izquierda | No | Débil positivo (5%) | Respuesta parcial | 14 | Astenia de grado 1 | Sí | Murió de ictus isquémico (paciente con historia de infarto de miocardio e ictus previo) |
| Paciente 3 | 73 | V | Cuero cabelludo | Ganglios linfáticos regionales | Débil positivo (10%) | Respuesta parcial | 10 | Toxicidad no reportada | Sí | Progresión tumoral |
| Paciente 4 | 80 | V | Frente derecha (invasión orbital, invasión perineural clínica) | Ganglios linfáticos regionales | Fuerte positivo (90%) | Respuesta completa | 23 | Astenia de grado 1 y mareo | No | |
| Paciente 5 | 81 | V | Cuello | Ganglios linfáticos regionales | Débil positivo (5%) | Respuesta parcial | 6 | Mareo de grado 1 | Sí | Progresión tumoral |
| Paciente 6 | 86 | V | Nariz | No | Débil positivo (5%) | Enfermedad progresiva | 2 | Toxicidad no reportada | Sí | Progresión tumoral |
| Paciente 7 | 59 | V | Mano izquierda | Ganglios linfáticos regionales; carcinomatosis pleural | Fuerte positivo (60%) | Enfermedad progresiva | 4 | Toxicidad no reportada | Sí | Progresión tumoral |
| Paciente 8 | 77 | V | Mejilla izquierda | No | Débil positivo (20%) | Respuesta completa | 11 | Diarrea de grado 1 | Sí | Respuesta completa sostenida |
| Paciente 9 | 78 | V | Cuero cabelludo | No | Débil positivo (5%) | Enfermedad progresiva | 1 | Toxicidad no reportada | Sí | Perdido durante el seguimiento durante la pandemia por COVID-19, progresión tumoral subsiguiente |
| Paciente 10 | 56 | V | Pierna izquierda | Ganglios linfáticos regionales | Fuerte positivo (55%) | Respuesta parcial | 8 | Toxicidad dermatológica (psoriasis de grado 2; penfigoide bulloso de grado 1)Diarrea de grado 1 | Sí | Progresión tumoral |
| Paciente 11 | 88 | V | Labio | Ganglios linfáticos regionales | No estudiada | Respuesta parcial | 3 | Toxicidad no reportada | Sí | Murió de infección por COVID-19 |
| Paciente 12 | 91 | V | Nariz | No | Débil positivo (1%) | Respuesta parcial | 6 | Toxicidad no reportada | No | |
| Paciente 13 | 88 | V | Oreja izquierda | Ganglios linfáticos regionales | No estudiada | Enfermedad progresiva | 6 | Toxicidad no reportada | Sí | Progresión tumoral |
Cemiplimab demostró una actividad antitumoral sustancial en los ensayos clínicos conducentes a su aprobación, con una tasa de respuesta objetiva de casi el 50% en el tratamiento del cSCC localmente avanzado y metastásico7–9. En nuestra serie, observamos una tasa considerablemente alta de RC (23%), con una tasa de respuesta (TR) general mayor en comparación con los ensayos clínicos (62%). Los datos de los dos otros estudios previos en el mundo real difieren: Hanna et al.10 encontraron una TR general menor en comparación con los ensayos clínicos (31,5%), mientras que Salzmann et al.11 reportaron una TR mayor (58,7%). La experiencia con pembrolizumab y nivolumab es más limitada, pero los resultados preliminares reflejan unas TR muy similares a las de cemiplimab10,11. Sigue sin estar claro por qué algunos pacientes muestran respuestas extraordinarias a la inmunoterapia, y otros no responden en absoluto. Se ha puesto el foco en el rol de la expresión de PD-L1 y en la presencia de TILs11. De manera sorprendente, los datos disponibles sugieren que la respuesta al tratamiento no parece estar relacionada con la expresión de PD-L15. Nuestra serie respalda estos hallazgos, pues los pacientes con respuestas completas muestran niveles muy variables de la expresión de PD-L1. La duración del tratamiento óptima sigue siendo imprecisa, no existiendo evidencia suficiente para determinar durante cuánto tiempo debería mantenerse la terapia tras haberse logrado una respuesta objetiva5,10,11. Sin embargo, parece que los pacientes que responden a la terapia inducen una respuesta a largo plazo (especialmente aquellos con respuestas completas), y pocos pacientes progresan subsiguientemente11. En nuestra serie, este no fue el caso para los pacientes con respuestas parciales, ya que todos los pacientes salvo uno presentaron progresión de la enfermedad subsiguiente a pesar de la terapia continua. En los pacientes con respuesta completa, la decisión de proseguir el tratamiento se tomó sobre la base de su perfil de riesgo. En el caso 5, la localización de alto riesgo del tumor y el miedo a una recidiva de la enfermedad potencialmente fatal impidieron la suspensión del tratamiento. En el caso 8, debido a la localización de bajo riesgo del tumor (potencialmente susceptible de tratamiento quirúrgico en caso de recidiva) decidimos suspender el tratamiento, sin producirse signos de progresión de la enfermedad durante el seguimiento. En esta serie compuesta principalmente de personas mayores, cemiplimab demostró un perfil de seguridad muy bueno, sin ninguna RA grave relacionada con el tratamiento, y sin ninguna suspensión del tratamiento debido a RA intolerables (fig. 1). Las RA más comunes fueron similares a las reportadas en estudios previos. Sin embargo, todos los pacientes tratados con cemiplimab deberán ser supervisados en términos de efectos secundarios potenciales, ya que estos podrían ser graves o letales. En resumen, cemiplimab reflejó una actividad antitumoral evidente, aunque las tasas de respuesta fueron menores que lo anteriormente reportado en ensayos clínicos. En esta serie de casos, el número de respuestas completas y el buen perfil de tolerabilidad al fármaco fueron significativos. Las principales limitaciones del presente estudio son el pequeño número de pacientes incluidos y el periodo de seguimiento relativamente corto (fig. 2).
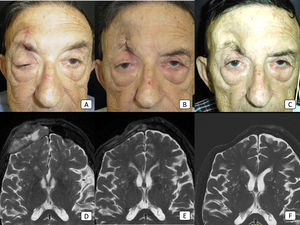
Caso 8: cSCC avanzado con invasión orbital, invasión perineural clínica, y metástasis ganglionares regionales. (A-C): fotografías clínicas del paciente antes de iniciar la terapia, tras 2 ciclos, y tras 8 ciclos, respectivamente. En (A), existe ptosis obvia del párpado derecho debido a la invasión perineural tumoral. (D-F): imágenes de RM ponderadas en T2 antes de iniciar la terapia, tras 4 ciclos, y tras 18 ciclos, respectivamente. La masa grande frontal observada en (D) ha desaparecido completamente en (F) lo cual refleja, por tanto, la respuesta completa al tratamiento.
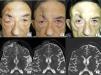
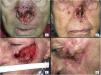
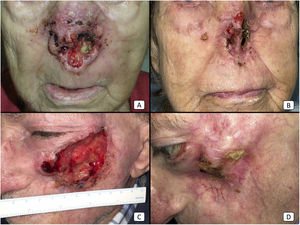
Casos 12 (A y B) y 2 (C y D). (A y B): cSCC localmente avanzado en la nariz de una mujer anciana. Existe una reducción drástica de la masa tumoral tras solo 2 ciclos de cemiplimab (B). (C y D): cSCC localmente avanzado en la mejilla izquierda de un hombre anciano. Antes de iniciarse la terapia, el paciente presentó un gran tumor ulcerado (C). Tras 10 ciclos, el paciente mostró una respuesta completa al tratamiento, con desaparición completa de la masa tumoral y exposición ósea maxilar secundaria.
Cemiplimab ha demostrado ser efectivo para el tratamiento del cSCC avanzado en la práctica clínica del mundo real. Aunque los datos preliminares han demostrado unas tasas de respuesta menores que lo anteriormente reportado en los ensayos clínicos, su actividad antitumoral y su buena tolerabilidad la sitúan como una de las terapias de primera línea para el cSCC avanzado. Es necesaria más investigación para definir enfoques terapéuticos adicionales (tales como inmunoterapia adyuvante y neoadyuvante) y determinar los perfiles de los pacientes que puedan predecir la probabilidad de respuesta al tratamiento.
Conflicto de interesesLos autores declaran la ausencia de conflicto e intereses.