La cirugía micrográfica de Mohs (CMM) es la técnica que ofrece las tasas más altas de curación, así como la mayor capacidad de ahorro de tejido sano, en comparación con la extirpación estándar.
ObjetivoCuantificar la capacidad de ahorro del tejido de la CMM en el carcinoma de células escamosas (CCE) en comparación con la extirpación estándar (EE).
Material y métodosSe realizó un estudio de tipo descriptivo bidireccional, para el cual se incluyeron un total de 94 casos de CCE. Los pacientes habían sido diagnosticados de un CCE (in situ, bien diferenciado, moderadamente diferenciado e indiferenciado) e intervenidos mediante CMM en el Hospital de Clínicas Dr. Manuel Quintela, en Montevideo, Uruguay, entre los años 2013 y 2018. Tanto el tamaño del tumor como el área resultante del defecto tras la CMM se midieron tomando las dos medidas del tumor perpendiculares entre sí. El área hipotética calculada del defecto tras la extirpación estándar se estimó agregando un margen de seguridad de 4mm en las lesiones de bajo riesgo y de 10mm en las lesiones de riesgo elevado. El resultado primario de este estudio fue determinar el tamaño del área del defecto tras la CMM en comparación con el área del defecto calculado si el tumor hubiera sido intervenido mediante una extirpación estándar.
ResultadosEl tamaño medio del tumor fue de 1,41mm2 y el tamaño medio del defecto tras la CMM fue de 4,12mm2. El tamaño medio del defecto calculado para la extirpación quirúrgica estándar fue de 8,36mm2.
LimitacionesNo se utilizaron todos los criterios de la National Comprehensive Cancer Network (NCCN). Las lesiones de riesgo bajo y elevado se definieron teniendo en cuenta la ubicación anatómica de la lesión, el tamaño, la histopatología y si se trataba de un tumor primario o de una recidiva.
ConclusiónLos resultados del presente estudio demostraron un ahorro de al menos el 52% con la CMM en comparación con la EE.
Micrographic Mohs Surgery (MMS) offers the highest cure rates and healthy skin tissue sparing effect compared with standard excision.
ObjectiveTo quantify the tissue-sparing properties of MMS in squamous cell carcinoma (SCC) in comparison with standard excision (SE).
MethodsA bidirectional, descriptive study, including 94 cases of SCC, was performed, on patients with histologic diagnosis of SCC (in situ, well differentiated, moderately differentiated, and undifferentiated), that where operated with MMS between 2013 and 2018 at Hospital de Clínicas Dr. Manuel Quintela in Montevideo, Uruguay. Tumor size and defect area after MMS were measured in 2 perpendicular directions. The suspected defect area was calculated with standard excision using a 4-mm margin for low risk lesions and a 10-mm margin for high risk lesions. The primary outcome of this study was the size of the defect area post MMS compared with the calculated defect area with standard excision.
ResultsThe median tumor size was 1,41mm2, and the median defect size after MMS was 4,12mm2. The median defect size calculated for standard surgical excision was 8,36mm2.
LimitationsWe do not use all National Comprehensive Cancer Network (NCCN) criteria. We define low and high risk lesions just taking into account anatomical location, size, histopathology and whether it was a primary or recurrent tumor.
ConclusionOur results show that MMS has a tissue-sparing effect of at least 52% compared to SE.
El carcinoma de células escamosas (CCE) es la segunda neoplasia cutánea en frecuencia. Inclusive, en algunos estudios se ha demostrado que las tasas de incidencia del CCE están aumentando de manera más rápida que las tasas de carcinoma basocelular (CBC)1.
La cirugía micrográfica de Mohs (CMM) es una técnica que se utiliza en la extirpación de los tumores cutáneos, especialmente en los CCE y en el CBC. La ventaja principal de la CMM, en comparación con la extirpación estándar es la posibilidad de extirpar el tumor de forma completa, ya que el 100% del margen quirúrgico será analizado histológicamente, logrando unas tasas de curación superiores2,3. Otro de los beneficios que se ha atribuido a la CMM es la mayor capacidad que tiene de ahorrar tejido sano. Este hecho será de gran relevancia, sobre todo cuando se intervienen lesiones localizadas en la cara. En numerosos estudios se han demostrado tanto la eficacia como la seguridad de la CMM. Sin embargo, existe poca información acerca de la capacidad de ahorro de tejido de esta técnica, especialmente en el caso de los CCE.
El objetivo del presente estudio fue determinar cuál es la cantidad de tejido ahorrado al realizar una CMM en comparación con la extirpación estándar (EE).
Pacientes y métodosEn el presente estudio se incluyeron todos los pacientes que fueron intervenidos por el diagnóstico de CCE (confirmado histológicamente) mediante una CMM en la Unidad de Cirugía Dermatológica del Hospital de Clínicas Dr. Manuel Quintela en Montevideo, Uruguay, entre los meses de noviembre de 2013 y noviembre de 2018.
Los datos se obtuvieron a partir de la historia clínica quirúrgica. Se recogieron datos acerca de la información epidemiológica y clínica del paciente (sexo, edad y fototipo), las características del tumor (ubicación anatómica, tamaño, resultado histopatológico, tumor primario o recidiva, y el nivel de riesgo correspondiente), así como el tamaño del defecto. Todos los pacientes fueron intervenidos mediante una CMM, ya que presentaban al menos un criterio de alto riesgo de la National Comprehensive Cancer Network (NCCN). Para realizar este estudio, las lesiones de bajo riesgo se definieron como aquellas que se ubicaban en áreas consideradas como de riesgo intermedio y que asociaban un tamaño tumoral <10mm, o aquellas localizadas en un área de bajo riesgo y que tenían un tamaño <20mm, además de contar con un resultado histopatológico de tumor bien diferenciado, ausencia de afectación perineural y un grosor <2mm. Los tumores de riesgo elevado se definieron como aquellos ubicados en un área de alto riesgo, área de riesgo medio y que tuvieran un tamaño >10mm o que estuvieran localizados en un área de bajo riesgo pero con un tamaño >20mm; así mismo, se incluyeron dentro de los tumores de riesgo elevado los casos de recidivas tumorales y, finalmente, aquellos en que al examen histopatológico se trataba de tumores pobremente diferenciados, tenían subtipo acantolítico, adenoescamoso o desmoplásico, con afectación perineural o un grosor >2mm4.
El área tumoral y la del defecto se estimaron en función de la forma redonda u ovalada habitual de los tumores, para lo cual se utilizó la siguiente fórmula: 0,25×π×radio de mayor longitud×radio perpendicular al de mayor longitud. Durante la consulta se realizaron fotografías digitales. El área hipotética del defecto tras la EE se calculó utilizando la fórmula mencionada y sumando 4mm en cada radio en los tumores que tenían bajo riesgo y 10mm en cada radio de los tumores con riesgo elevado5,6.
El presente estudio fue aprobado por el Comité de Ética del Hospital de Clínicas Dr. Manuel Quintela, de la Universidad de la República.
Análisis estadísticoLas variables se registraron en una hoja de cálculo MsExcel®. Para el análisis estadístico se usó el STATA 11.0®.
ResultadosSe incluyeron 72 pacientes (43 hombres y 29 mujeres), con un total de 94 CCE diagnosticados. La edad media fue de 75años, con un rango entre 30 y 92años. De acuerdo con los fototipos de Fitzpatrick, 2 de los pacientes tenían fototipoI, 29 fototipoII, 39 fototipoIII y 2 fototipoIV.
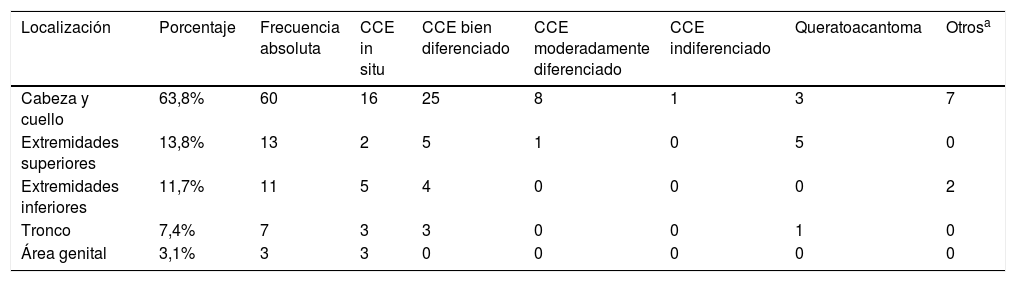
El número de tumores, sus ubicaciones y el subtipo histopatológico se muestran en la tabla 1.
Localización y variante histológica de las lesiones
| Localización | Porcentaje | Frecuencia absoluta | CCE in situ | CCE bien diferenciado | CCE moderadamente diferenciado | CCE indiferenciado | Queratoacantoma | Otrosa |
|---|---|---|---|---|---|---|---|---|
| Cabeza y cuello | 63,8% | 60 | 16 | 25 | 8 | 1 | 3 | 7 |
| Extremidades superiores | 13,8% | 13 | 2 | 5 | 1 | 0 | 5 | 0 |
| Extremidades inferiores | 11,7% | 11 | 5 | 4 | 0 | 0 | 0 | 2 |
| Tronco | 7,4% | 7 | 3 | 3 | 0 | 0 | 1 | 0 |
| Área genital | 3,1% | 3 | 3 | 0 | 0 | 0 | 0 | 0 |
Sesenta de las lesiones (63,8%) se ubicaron en la cabeza y el cuello, 19 en las mejillas, 12 en las zonas auriculares y periauriculares, 6 en los labios, 5 en la nariz, 5 en el área periocular, 5 en el cuero cabelludo, 4 en la frente, 3 en la sien y una en el área perioral.
Ochenta tumores (85,1%) eran primarios y 14 (14,8%) eran recidivas tumorales. De este último grupo, 5 de los tumores recidivaron tras una extirpación estándar, 2 tras haber sido intervenidos mediante CMM y 7 tras haber recibido otros tratamientos (criocirugía, imiquimod o criocirugía/imiquimod).
Teniendo en cuenta el tamaño tumoral, la localización anatómica y si es que se trataba de un tumor primario o recidivado, 77 (81,9%) de las lesiones se clasificaron dentro de las lesiones de riesgo elevado y 17 (18,08%) como de bajo riesgo. De todas las lesiones, 47 (50%) estaban en zonas de alto riesgo y 24 (25,5%) en zonas de bajo riesgo.
Con respecto a los tumores primarios y recidivados, como se muestra en las tablas 2 y 3, no hubo diferencias estadísticamente significativas entre el área del tumor, el área del defecto después de la CMM y el área del defecto calculado.
Media de áreas de los tumores, de grado bajo y elevado, previo y posterior a los procedimientos
| Primario, n=80p50 (p25-p75) | Recidiva, n=14p50 (p25-p75) | Total, n=94p50 (p25-p75) | p | |
|---|---|---|---|---|
| Área del tumor | 1,37 (0,52-2,96) | 1,71 (0,94-2,89) | 1,41 (0,58-2,95) | 0,2301 |
| Área tras CMM | 4,15 (1,87-7,19) | 3,63 (2,41-12,59) | 4,12 (1,92-8,4) | 0,2400 |
| Área tras EE | 7,3 (4,6-12,28) | 9,48 (7,54-12,23) | 8,36 (4,9-12,34) | 0,0773 |
CMM: cirugía micrográfica de Mohs; EE: extirpación estándar.
Prueba de Mann-Whitney.
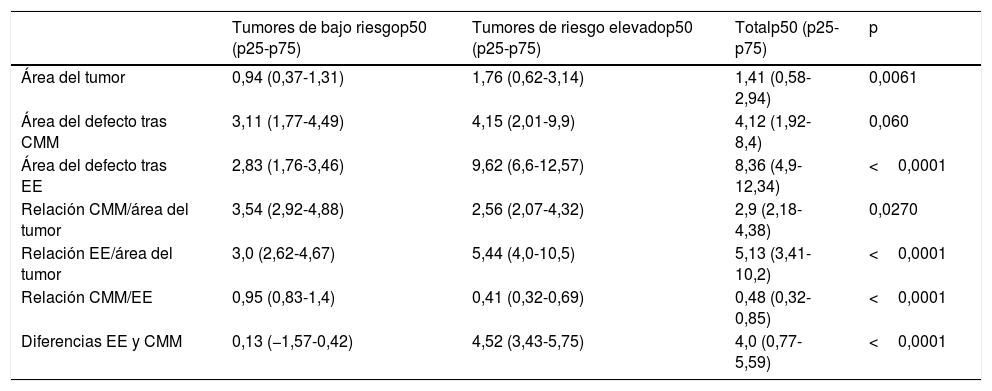
Media de diversas variables en los tumores de riesgo bajo y elevado
| Tumores de bajo riesgop50 (p25-p75) | Tumores de riesgo elevadop50 (p25-p75) | Totalp50 (p25-p75) | p | |
|---|---|---|---|---|
| Área del tumor | 0,94 (0,37-1,31) | 1,76 (0,62-3,14) | 1,41 (0,58-2,94) | 0,0061 |
| Área del defecto tras CMM | 3,11 (1,77-4,49) | 4,15 (2,01-9,9) | 4,12 (1,92-8,4) | 0,060 |
| Área del defecto tras EE | 2,83 (1,76-3,46) | 9,62 (6,6-12,57) | 8,36 (4,9-12,34) | <0,0001 |
| Relación CMM/área del tumor | 3,54 (2,92-4,88) | 2,56 (2,07-4,32) | 2,9 (2,18-4,38) | 0,0270 |
| Relación EE/área del tumor | 3,0 (2,62-4,67) | 5,44 (4,0-10,5) | 5,13 (3,41-10,2) | <0,0001 |
| Relación CMM/EE | 0,95 (0,83-1,4) | 0,41 (0,32-0,69) | 0,48 (0,32-0,85) | <0,0001 |
| Diferencias EE y CMM | 0,13 (−1,57-0,42) | 4,52 (3,43-5,75) | 4,0 (0,77-5,59) | <0,0001 |
CMM: cirugía micrográfica de Mohs; EE: extirpación estándar.
Prueba de Mann-Whitney.
La media del área de los tumores de bajo riesgo fue de 0,94cm2. El área del defecto promedio después de la CMM fue de 3,11cm2 y el área hipotética de defecto promedio calculada para la EE fue de 2,83cm2. El área media del tumor para lesiones con riesgo elevado fue de 1,76cm2, el área de defecto medio después de la CMM fue de 4,15cm2 y la media del área hipotética del defecto calculado para la EE fue de 9,62cm2.
Teniendo en cuenta la relación entre el área del tumor y el área del defecto posterior a la CMM, la media fue de 3,54cm2 para lesiones de bajo riesgo y de 2,56cm2 para lesiones de riesgo elevado, respectivamente. En cuanto a la relación entre el área del tumor y el área del defecto hipotético calculado para la EE, la media fue de 3,0cm2 para lesiones de bajo riesgo y de 5,44cm2 para lesiones de riesgo elevado.
Encontramos una diferencia estadísticamente significativa entre el área del defecto posterior a la CMM y el área del defecto hipotético calculado para la EE. La media fue de 0,95 para lesiones de riesgo bajo y de 0,41 para lesiones de riesgo elevado. La diferencia entre el área del defecto calculada para la EE y para la CMM fue de 4,52cm2 en las lesiones de riesgo elevado y de 0,13cm2 en las de bajo riesgo, respectivamente.
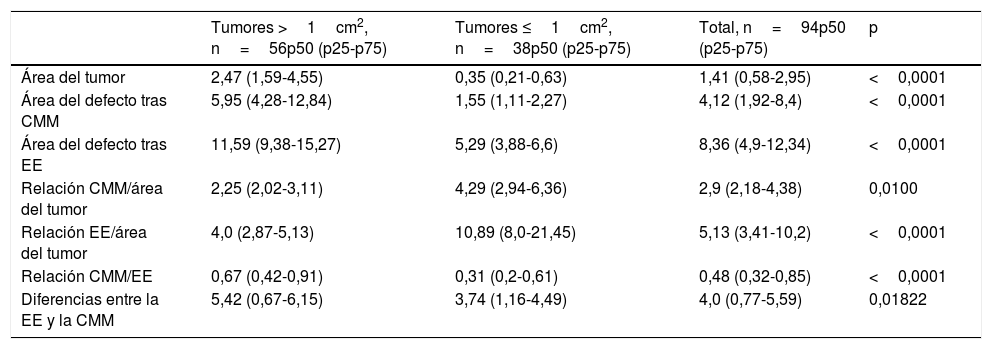
Cincuenta y seis de los CCE fueron tumores >1cm2 y 38 de los CCE <1cm2. La relación entre ellos se muestra en la tabla 4.
Media de las variables en los tumores ≤1cm2 y >1cm2
| Tumores >1cm2, n=56p50 (p25-p75) | Tumores ≤1cm2, n=38p50 (p25-p75) | Total, n=94p50 (p25-p75) | p | |
|---|---|---|---|---|
| Área del tumor | 2,47 (1,59-4,55) | 0,35 (0,21-0,63) | 1,41 (0,58-2,95) | <0,0001 |
| Área del defecto tras CMM | 5,95 (4,28-12,84) | 1,55 (1,11-2,27) | 4,12 (1,92-8,4) | <0,0001 |
| Área del defecto tras EE | 11,59 (9,38-15,27) | 5,29 (3,88-6,6) | 8,36 (4,9-12,34) | <0,0001 |
| Relación CMM/área del tumor | 2,25 (2,02-3,11) | 4,29 (2,94-6,36) | 2,9 (2,18-4,38) | 0,0100 |
| Relación EE/área del tumor | 4,0 (2,87-5,13) | 10,89 (8,0-21,45) | 5,13 (3,41-10,2) | <0,0001 |
| Relación CMM/EE | 0,67 (0,42-0,91) | 0,31 (0,2-0,61) | 0,48 (0,32-0,85) | <0,0001 |
| Diferencias entre la EE y la CMM | 5,42 (0,67-6,15) | 3,74 (1,16-4,49) | 4,0 (0,77-5,59) | 0,01822 |
CMM: cirugía micrográfica de Mohs; EE: extirpación estándar.
Prueba de Mann-Whitney.
Como se describe en la tabla 3, en al menos el 25% de estos tumores la EE con un margen de 4mm habría conllevado a una extirpación incompleta del tumor.
DiscusiónEn escasos estudios se ha logrado cuantificar la capacidad de ahorro del tejido sano de la CMM en comparación con la EE; sin embargo, todos ellos han sido realizados predominantemente en carcinomas de células basales.
El área del tumor y el área del defecto, tanto en la CMM como en la EE, fueron significativamente mayores en las lesiones de riesgo elevado. En las lesiones de bajo riesgo el defecto final fue de 3,54 veces el tamaño del tumor después de la CMM y el área del defecto calculada para la EE fue de 3veces la lesión tumoral.
Como se describe en la tabla 3, uno de cada 4 tumores removido con margen de seguridad de 4 mm era inadecuadamente extirpado al utilizar la EE.
En las lesiones de riesgo elevado, el área del defecto calculado para la EE duplica el área del defecto tras la CMM: 5,44 y 2,56 veces el área del tumor, respectivamente.
En 11 de los 94 tumores (11,7%) el área calculada del defecto en la EE fue menor que el defecto tras la cirugía de Mohs, lo que hubiera resultado en una extirpación incompleta del tumor. Tres de ellos eran tumores con riesgo elevado.
En cuanto a la relación entre el área del defecto tras la CMM y el área calculada de los defectos tras la EE, no se objetivó un ahorro importante de tejido con la CMM en el CCE de bajo riesgo. En el 59% de los casos la CMM no permitió un ahorro de tejido en comparación con la EE con márgenes predeterminados en las lesiones de riesgo elevado. Sin embargo, independientemente del nivel de riesgo de estas lesiones, nuestro estudio demostró un 52% de ahorro de tejido mediante la CMM.
Además, se pudo objetivar una diferencia estadísticamente significativa entre el área del defecto después de la CMM y el área del defecto calculada para la EE en tumores <1cm2 y en los >1cm2.
Hasta donde sabemos, este es el primer estudio descriptivo bidireccional que cuantifica la capacidad que tiene la CMM de ahorrar tejido en la extirpación del CCE. Gniadecki et al.7 realizaron un estudio retrospectivo en 263 carcinomas basocelulares (CBC), de los que el 54% eran tumores primarios. Los resultados de este estudio demostraron que el área de la extirpación puede reducirse en >40% mediante la CMM en comparación con la EE con márgenes predeterminados.
Un estudio realizado por Muller et al.8 incluyó 30 tumores con el diagnóstico clínico de CBC nodular <1cm de diámetro. Las lesiones de riesgo elevado fueron excluidas. Los pacientes se asignaron aleatoriamente a CMM o cirugía estándar. La media del área de los defectos quirúrgicos en el grupo de la CMM fue de 116,6 mm2, versus 187,7 mm2 en el grupo de cirugía estándar con un margen de seguridad de 4mm (IC95%: 61-126; p<0,001); es decir, una media con la cirugía estándar 1,6 veces al área con CMM.
Un reciente estudio prospectivo realizado por Van Kester et al.9, donde se incluyeron 256 lesiones, tuvo la finalidad de cuantificar la capacidad de ahorro de tejido de la CMM en los CBC primarios con un patrón de crecimiento infiltrativo. La superficie del área sospechosa del defecto con extirpación estándar se calculó dejando un margen de seguridad de 5mm. Este estudio demostró que la CMM pudo ahorrar el 46,4% del tejido del defecto en comparación con la extirpación quirúrgica estándar (IC95%: 43,4-49,1%; p<0,001).
ConclusionesLa CMM logró un ahorro del 52% en los CCE. El ahorro del tejido fue mayor en los tumores de riesgo elevado. La CMM eliminó menos tejido de piel sana en comparación con la EE, siendo 33% de la capacidad de ahorro de tejido en lesiones >1cm2 y 69% en tumores <1cm2.
Conflicto de interesesEl Dr. Julio Correa es el responsable del presente artículo y asume la responsabilidad de la integridad del trabajo en su conjunto. Todos los autores declaran no tener conflictos de intereses de ningún tipo.