INTRODUCCION
La percepción de la infección por el virus de la inmunodeficiencia humana (VIH) como una enfermedad mortal va cambiando en los últimos años, ya que los enfermos y la sociedad están deseosos de creer que esta enfermedad está cerca de convertirse, si no lo ha hecho ya, en una infección crónica más que precisa de un tratamiento intenso y constante, pero que, en definitiva, está bajo control. En esta revisión trataremos de aclarar hasta qué punto está fundado este optimismo, qué es lo que tenemos en este momento y a qué podemos aspirar en un futuro inmediato.
Intentaremos contestar a las siguientes preguntas: ¿con qué tratamos la infección por VIH?, ¿cuándo comenzamos el tratamiento?, ¿cómo valoramos su eficacia?, ¿cuándo hay que cambiar el tratamiento?, ¿qué opciones de cambio tenemos?, ¿cuándo y cómo lo interrumpimos?, ¿qué efectos indeseables tienen interés para el dermatólogo?, ¿qué interacciones existen con medicamentos empleados en Dermatología?, ¿qué actitud tomar en el embarazo?, así como la aparición de resistencias, tratamiento de la infección aguda VIH, el cumplimiento terapéutico y la relación médico enfermo.
Pero hay una primera pregunta: ¿será de utilidad esta información para el dermatólogo? No podemos negar la alta incidencia de patología dermatológica en los pacientes VIH+ (1) que determina una alta frecuencia de visitas al dermatólogo durante la enfermedad, precisando éste de unos conocimientos mínimos sobre el manejo terapéutico de estos enfermos. Además somos los dermatólogos los que frecuentemente diagnosticamos la infección por VIH a partir de una manifestación cutánea inicial, siendo interrogados por el paciente sobre los tratamientos actualmente disponibles y la conveniencia o no de comenzarlo de forma precoz. Tampoco debemos olvidar la interacción medicamentosa de los antirretrovirales con fármacos frecuentemente utilizados en Dermatología, así como la existencia de efectos cutáneos indeseables de estos fármacos, como redistribución de la grasa cutánea, toxicodermias, etc. Por último hay que recordar que la infección VIH es cada vez más una enfermedad de transmisión sexual (ETS) y como tal corresponde tratarla al dermatovenereólogo a pesar de su complejidad y dificultades.
¿CON QUÉ TRATAMOS LA INFECCION VIH?
Para compreder el mecanismo de acción de estos fármacos revisaremos sus dianas moleculares:
-- Transcriptasa inversa viral: enzima que transforma el ARN viral en ADN de doble cadena, para poder así integrarse en el ADN de la célula huésped. Sus inhibidores pueden ser análogos de nucleósidos (INTI) o no análogos (INNTI).
-- Proteasas virales: enzimas que catalizan rupturas específicas en las proteínas codificadas por el virus para posteriormente formar nuevas partículas virales (2).
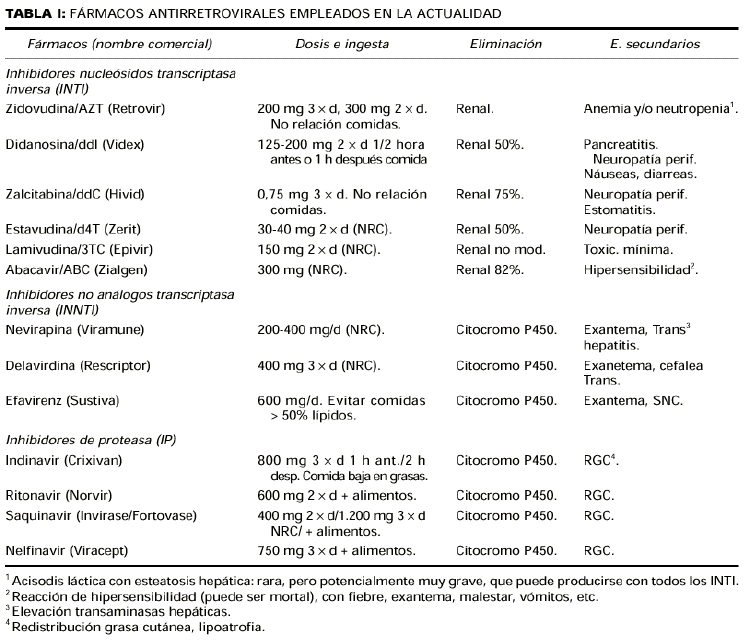
En la tabla I se revisan los medicamentos disponibles en la actualidad, dosis e interacción con alimentos, eliminación metabólica y efectos adversos.
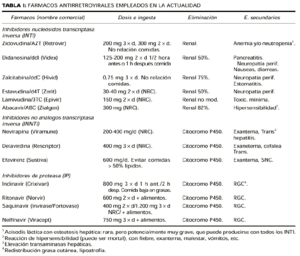
Históricamente hay que recordar que en 1988 se generalizó el empleo de la zidovudina (AZT) como monoterapia antirretroviral, que en 1990 aparecieron dos nuevos inhibidores de la transcriptasa inversa (ddI y ddC) que a partir de 1995 se combinan los tres anteriores y que hasta 1997 no aparecieron los inhibidores de proteasas, administrándose ya tres o cuatro medicamentos de forma conjunta. El esquema terapéutico actual suele combinar uno o dos inhibidores de proteasa (IP) con dos inhibidores de la transcriptasa inversa (tabla II).
¿COMO VALORAMOS LA EFICACIA DEL TRATAMIENTO?
Los dos parámetros que manejamos para precedir la probabilidad que tiene un enfermo de desarrollar SIDA son el contaje de linfocitos CD4 (grado de deterioro inmunológico) (3) y la carga viral (CV = cantidad de partículas virales en el plasma del enfermo) (4). Será esta CV la que emplearemos para monitorizar la eficacia del tratamiento, realizando la primera determinación a las 2-8 semanas de comenzar el tratamiento (reducción de 0,5 a 0,7 log10 ), Y la segunda a las 12-16 semanas (CV indetectable, o sea, < 500 copias/ml). A partir de entonces repetiremos la determinación cada 3-4 meses (5). En la actualidad se utilizan dos métodos para cuantificar la CV: la bRNA y la PCR, alcanzando con esta última valores dobles que los obtenidos con la primera técnica. Así un valor de 10.000 c/ml con la bRNA equivale a 20.000 c/ml con PCR (6). Estas técnicas no permiten detectar CV inferiores a 500 c/ml, por lo que hasta ahora éste es el límite de detección aceptado. Sin embargo, ya existen métodos capaces de detectar CVs entre 25 y 50 c/ml, observándose que los enfermos con CV < 50 c/ml tienen una supresión viral más completa y prolongada que los que presentan CV < 500 c/ml (4). Respecto al contaje de linfocitos CD4, cada vez queda más en un segundo plano en cuanto a la valoración de la eficacia del tratamiento antirretroviral. Además, aproximadamente en el 20% de los pacientes VIH+ existe discordancia entre los valores de CV y los de linfocitos CD4: pacientes con disminución significativa de la CV, pero con disminuciones en vez de recuperaciones de los contajes de CD4. Y también al contrario, enfermos con recuperaciones de los CD4, pero con CV que no disminuyen adecuadamente. En estos casos se le da prioridad a la CV respecto a los CD4 (7).
¿CUANDO COMENZAMOS EL TRATAMIENTO?
Está clara la indicación del tratamiento en pacientes VIH+ sintomáticos: cuando haya criterios definitorios de SIDA (8) o bien con fiebre de más de 2 semanas de duración, aftas o consunción. Sin embargo, no existe consenso sobre cuándo comenzamos en pacientes asintomáticos (9-12), ya que hay especialistas que aconsejan comenzar el tratamiento durante el síndrome agudo de infección por VIH, otros se definen por empezar inmediatamente si la seropositividad se produjo en los 6 meses anteriores y un tercer grupo se inclina por hacer terapéutica sólo cuando el paciente presente una CV > 10.000 c/ml (bRNA) o > 20.000 c/ml (PCR) o en pacientes con contajes de CD4 < 500 células/mm3. No obstante, hay otros especialistas que adoptan una opción más conservadora en aquellos enfermos con CD4 < 500 cél/mm3 y CV bajas, retrasando el inicio del tratamiento y realizando controles analíticos periódicos.
Aunque la mayoría de nosotros preferimos hacer tratamiento cuando el paciente presente una CV > 20.000 c/ml por PCR, en la actualidad se están imponiendo indicaciones cada vez más agresivas, iniciando el tratamiento lo antes posible, basándose en consideraciones teóricas, si bien también existen datos en contra de este comienzo precoz (tabla III). La decisión final dependerá de balance de riesgo/beneficio, los datos de laboratorio (CV y contajes CD4), sin olvidar el deseo del paciente y la probabilidad de que éste cumpla el tratamiento. Siempre comenzaremos de forma simultánea y a dosis completa con todos los medicamentos que compongan el régimen terapéutico elegido (13). Conviene recordar que en las mujeres la CV es un 50% menor para la misma tasa de CD4 y el mismo tiempo de progresión a SIDA, por lo que en ellas es recomendable comenzar tratamiento con CV > 5.000 (bRNA) o > 10.000 c/ml (PCR) (14-15).
Respecto a los pacientes con enfermedad avanzada, comenzaremos de inmediato con el mismo tipo de régimen terapéutico ya comentado (tabla II), cuidando no interrumpirlo ante infecciones agudas oportunistas ni neoplasias. Sólo se interrumpirá en casos de toxicidad, intolerancia o interacciones farmacológicas (5). También hay que resaltar la posibilidad de interacción entre los antirretrovirales y los múltiples fármacos que toman estos pacientes con enfermedad avanzada. Los IP y los INNTI inhiben el sistema hepático del citocromo p450, aumentando el riesgo de toxicidad de los medicamentos que utilizan esta vía, mientras que la nevirapina activaría la p450 reduciendo los niveles sanguíneos y, por tanto, la efectividad de los medicamentos que utilizan esta vía metabólica (16).
TRATAMIENTO DE LA INFECCION AGUDA
Entre el 50 y el 90% de los pacientes VIH+ presentan algún síntoma del síndrome retroviral agudo, si bien este cuadro no suele diagnosticarse en atención primaria por su similitud con un síndrome gripal u otras patologías habituales (tabla IV). De diagnosticarse, existe cierto consenso en comenzar el tratamiento de forma inmediata, aunque sean escasos los ensayos clínicos que demuestren un beneficio clínico a largo plazo (17-20). Los fundamentos teóricos que apoyarían este tratamiento precoz serían la menor diseminación del virus por el organismo, menor gravedad de la enfermedad aguda, prevención del daño inmunológico inicial y menor riesgo de transmisión del virus (21). El régimen terapéutico es el descrito en los casos anteriores (tabla II), debiendo comprobar a las 12 semanas que hemos alcanzado una CV indetectable; además hay que mantener el tratamiento de forma indefinida y monitorizar la CV y los CD4 cada 3-4 meses (22-24). También se recomienda esta pauta en aquellos pacientes con seroconversión demostrada en los 6 meses previos.
INTERRUPCIÓN DEL TRATAMIENTO
Se suprimirá de forma temporal por la aparición de efectos indeseables de los medicamentos, interacciones farmacológicas, primer trimestre del embarazo o, a veces, por la no disponibilidad de los medicamentos. Debemos suspender todos los medicamentos de forma simultánea con el fin de evitar la aparición de resistencias. No hay datos contrastados que cuantifiquen cuántas semanas o meses de interrupción inciden de forma significativa en el pronóstico de la enfermedad, si bien es lógico pensar en reanudar el tratamiento lo antes posible.
EFECTOS SECUNDARIOS E INTERACCIONES MEDICAMENTOSAS
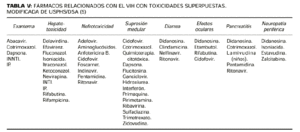
Los efectos secundarios más importantes ya se han resumido en la tabla I (25-26). Respecto a las interacciones, hay que destacar que los hipolipemiantes simvastatina y lovastatina no deben emplearse con IP y delavirdina, aunque son seguros con nevirapina y efavirenz. La rifampicina tampoco debe emplearse conjuntamente con los IP. El ritonavir es el único medicamento que presenta interacciones con analgésicos como meperidina, prixocam y propoxifeno, fármacos cardíacos del tipo de la amiodarona, encainida, flecinida, propafenona, quinidina y bepridil, así como los psicotrópicos clorazepato, diazepam, estazolam, flurazepam, bupropión y zolpidem y los neurolépticos clozapina y primocide. Midazolam y triazolam no deben emplearse con IP, delavirdin ni efavirenz. Los antihistamínicos como astemizol y terfenadina son incompatibles con los IP, al igual que los derivados del cornezuelo de centeno (dihidroergotamina y ergotamina) que, además, son incompatibles con delavirdina y efavirenz. Entre los fármacos gastrointestinales hay que resaltar que el cisapride está contraindicado en pacientes en tratamiento con IP y con dalavardina. No debemos emplear bloqueantes H-2 ni inhibidores de la bomba de protones en pacientes en tratamiento con dalavardina. El ketoconazol y antibacterianos como claritromicina y rifabutina afectan los niveles séricos de los IP y los INNTI, precisando ajustar la dosis. En la tabla V se recogen los fármacos relacionados con VIH con toxicidades superpuestas (5).
CAMBIO DE TRATAMIENTO
El régimen terapéutico administrado puede fracasar por diferentes motivos:
-- Resistencia viral inicial, documentándose porque no se alcanza una CV indetectable a los 4-6 meses de comenzar el tratamiento; o desarrollo posterior de resistencias a uno o varios de los fármacos del esquema terapéutico teóricamente supresor, observándose que sube la CV después de una supresión inicial correcta.
-- Régimen incompleto, no supresor.
-- Interacciones con otros medicamentos.
-- Toxicidad.
-- Alteraciones en la absorción o metabolismo de los fármacos.
--Falta de cumplimiento por parte del paciente.
En caso de toxicidad sustituiremos el fármaco por otro de la misma clase y potencia. En los demás casos cambiaremos el régimen terapéutico en su totalidad, procurando que sean fármacos que no se hayan administrado previamente al paciente y que además no generen resistencia cruzada con medicamentos tomados con anterioridad (5). Como criterio aceptado deberemos cambiar el tratamiento cuando aumente más de tres veces la CV no atribuible a infección intercurrente, vacunación o metodología del ensayo. Recordemos que ante un aumento significativo de la CV deberemos repetir esta determinación en el mismo laboratorio y con la misma técnica. En la actualidad también se considera criterio para el cambio de régimen terapéutico el estar en tratamiento sólo con dos INTI aún con viremias indetectables.
DESARROLLO DE RESISTENCIAS
Es la primera causa de fracaso terapéutico, detectándose inicialmente por el aumento de la carga viral y más tarde por el descenso de los CD4 o la aparición de sintomatología asociada a la infección VIH. Cuando se produce la infección VIH surgen variantes genéticamente diferentes en cada individuo, apareciendo mutaciones farmacológicas aisladas incluso antes del comienzo del tratamiento, seleccionándose estas cepas sobre todo con regímenes terapéuticos parcialmente supresores (27-28). Por tanto, cuanto más potente sea el tratamiento para inducir supresión viral prolongada (CV indetectable) menor será la lo probabilidad de aparición de resistencias farmacológicas. Existen ensayos genotípicos para detectar variantes genéticas del VIH con resistencias farmacológicas específicas. Estas variantes genéticas están registradas y puede consultarse su resistencia farmacológica asociada en la siguiente dirección de internet: http://hiv-web.lanl.gov (5). Del mismo modo podemos realizar ensayos fenotípicos determinando las concentraciones inhibitorias in vitro (50 y 90% de inhibición) de los diferentes fármacos sobre la cepa del virus del paciente, siempre y cuando el paciente esté recibiendo tratamiento, ya que el virus nativo sustituye a las cepas resistentes en ausencia de presión farmacológica. El conocer qué medicamento ha inducido la resistencia farmacológica no evitará que tengamos que sustituir todos los fármacos del régimen terapéutico por otros sin resistencia cruzada con el medicamento responsable de la resistencia (29).
CONSIDERACIONES EN ADOLESCENTES, EMBARAZADAS Y RECIÉN NACIDOS
La historia natural de la infección por VIH en niños es diferente que la de los adultos (30). La mayoría de ellos han adquirido la infección por transmisión vertical y presentan una supervivencia más prolongada que los adultos; sin embargo, tenemos que hacer algunas puntualizaciones respecto a los adolescentes: la mayoría de ellos han adquirido la infección por vía sexual o por drogas intravenosas y su evolución es similar a la de los adultos, lo que implica desestimar la actitud expectante que podemos aplicar a los niños y realizar un tratamiento lo más precoz e intenso posible como hacemos con los adultos (5).
En la actualidad se desconoce la repercusión potencial del tratamiento sobre el feto y el recién nacido, admitiéndose tanto una conducta expectante como un tratamiento agresivo, similar a las no embarazadas, durante el primer trimestre de gestación (31-32). La zidovudina (AZT) es el único fármaco con capacidad demostrada de disminuir (66%) el riesgo de transmisión perinatal, independientemente de su efecto sobre la carga viral; así, para similares niveles de CV las mujeres en tratamiento con AZT presentan unas menores tasas de transmisión del VIH al feto (33-35). Por tanto, para gestantes con CV < 10.000/20.000 (bRNA/PCR) y CD4 > 500 cél/mm3 es aconsejable prescribir AZT oral de forma aislada debido a la escasa posibilidad de resistencias durante el segundo y tercer trimestre, e intravenoso intraparto y al RN en las primeras 6 semanas de vida (tabla VI) (36, 37). Sin embargo, en gestantes con enfermedad más avanzada se recomienda un régimen combinado de tres o cuatro fármacos (tabla II) que incluya al AZT. Si no lo incluyera se recomienda añadir AZT intraparto y al recién nacido. Si la paciente presiona para suprimir el tratamiento antirretroviral previo durante el primer trimestre hay que informarle que es posible que aumente la CV y el riesgo de transmisión al feto, además de la progresión de la enfermedad en la madre (38). Si a pesar de nuestro consejo insiste en interrumpir el tratamiento ha de suspender todos los fármacos, y de forma simultánea, para evitar la aparición de resistencias.
CUMPLIMIENTO TIRAPÉUTICO Y RELACION MÉDICO-ENFERMO
Debido a la cronicidad del tratamiento, número de comprimidos diarios y especiales caracteríaticas psicosociales de gran parte de estos enfermos VIH+ es fundamental evaluar el grado de cumplimiento esperado por parte del paciente, insistiendo en la importancia del mismo y logrando una relación médico-enfermo que refuerce positivamente dicho cumplimiento.