La dermatitis atópica es una enfermedad inflamatoria crónica que afecta al 20% de los niños y casi al 3% de los adultos, produciendo un deterioro importante de la calidad de vida de los pacientes y sus familias. En más del 75% de los casos es autorresolutiva y mejora después de la pubertad. No obstante, hay casos que no consiguen esta mejoría o que en los primeros años de la vida alcanza niveles de severidad que afectan de forma importante la salud y el desarrollo social de los pacientes. Actualmente no contamos con guías terapéuticas adecuadas para solucionar estas situaciones que se escapan del manejo habitual. En el siguiente artículo repasamos las opciones terapéuticas de las que disponemos actualmente para afrontar casos de dermatitis atópica moderada-severa, aportamos nuestra experiencia y planteamos un posible algoritmo terapéutico
Atopic dermatitis is a chronic inflammatory disease that affects 20% of children and almost 3% of adults and is associated with considerable impairment of quality of life for both patients and their families. While the condition resolves spontaneously after puberty in over 75% of cases, it can persist into adulthood. Furthermore, in young children severe forms can have serious health consequences and affect social development. There are no appropriate guidelines on how to handle cases that do not respond to routine treatment. In this article, we review the current treatments for moderate to severe atopic dermatitis, describe our experience with this disease, and propose a management algorithm.
La dermatitis atópica es una enfermedad inflamatoria crónica que cursa en brotes, caracterizada por un prurito muy intenso, en ocasiones incoercible y una xerosis muy marcada. Se considera bifásica desde un punto de vista inmunológico, con una fase aguda fundamentalmente tipo Th2 y una fase crónica Th2/Th1. En su etiopatogenia se involucran íntimamente 4 factores: predisposición genética, alteración de la inmunidad, disfunción de la barrera epidérmica y factores ambientales. Puede afectar casi al 20% de los niños, considerándose la enfermedad crónica más prevalente de la infancia, y entre 1-3% de los adultos, sobre todo en las sociedades occidentales más desarrolladas. Considerada una enfermedad autorresolutiva suele mejorar con el paso del tiempo y hasta en el 75% de las ocasiones desaparece después de la pubertad, sin embargo, hasta que esto ocurre, los pacientes sufren los síntomas durante muchos años.
Esta patología causa un importante impacto en la calidad de vida y en la esfera psicosocial de los pacientes y sus familias. Se ha demostrado1 que los niños con eccema atópico tienen un riesgo elevado de desarrollar trastornos de hiperactividad e inatención a los 10 años de edad, y si además del eccema asocian problemas del sueño, desarrollan con mayor frecuencia trastornos emocionales y de conducta. Son niños que tienen altos niveles de estrés2 y ansiedad, que a su vez empeoran aún más los síntomas de la dermatitis atópica a través de neuropéptidos como la sustancia P o el neuropéptido Y. Los familiares3 de los pacientes con dermatitis atópica también se ven afectados por la enfermedad, de forma que solo un 3,4% de las familias refieren tener una calidad de vida normal frente al 23,3% que refieren afectación leve, 66,4% moderada y 6,9% severa. Se ha demostrado que esta afectación en la calidad de vida está íntimamente relacionada con la severidad de la enfermedad. Por todo ello es importante conseguir un buen control de la dermatitis atópica, sobre todo en pacientes en edad infantil, permitiendo así su normal desarrollo personal y social.
Selección de pacientesAntes de abordar terapéuticamente a estos pacientes es fundamental realizar una selección de los mismos y establecer la severidad de la enfermedad. Para ello contamos con diferentes scores ampliamente conocidos, entre los que destacamos el SCORAD, EASI y SASSAD resumidos en la tabla 1.
Principales scores en la valoración de la severidad de la dermatitis atópica
| SCORAD (Scoring Atopic Dermatitis) | EASI (Eczema Area and Severity Index) | SASSAD (Six Area Six Sign Atopic Dermatitis Severity Index) |
| 1.- Extensión de áreas afectas (%)2.- Intensidad de una lesión típica (nada=0; leve=1; moderado=2; severo=3) en cuanto a:EritemaEdema-pápulasCostrasExcoriaciónLiquenificaciónSequedad de áreas no afectas3.- Síntomas subjetivos:Prurito (0-10 escala visual analógica)Alteración sueño (0-10 escala visual analógica)SCORAD=A/5+7xB/2+CA=% Extensión/100B=Intensidad/18C=Síntomas subjetivos/20VALORES=Leve 1-14Moderado 15-39Severo 40-103 | Regiones corporales a valorar:1.- Cabeza y cuello2.- Miembros superiores3.- Tronco4.- Miembros inferioresElegir un área representativa de cada región corporal y valorar la intensidad (nada=0; leve=1; moderado=2; severo=3) de:1.- Eritema2.- Grosor3.- Costras4.- LiquenificaciónCálculo del área afectada (%) en cada región0=1-9%1=10-29%2=30-49%3=50-69%4=70-89%5=90-100%Score máximo 72Score mínimo 0 | Valoración en 6 localizaciones los siguientes parámetros:1.- Eritema2.- Exudación3.- Excoriación4.- Sequedad5.- Agrietamiento6.- LiquenificaciónSegún intensidad:0=nada1=leve2=moderado3=severoScore máximo 108Score mínimo 0 |
El PO-SCORAD4 o SCORAD orientado por el paciente ha sido validado en Europa en 2011 y ha demostrado guardar buena correlación con el SCORAD clásico. Quizá nos pueda dar una idea más exacta de la evolución5 y del estado de nuestros pacientes. Como toda enfermedad que cursa en brotes, si realizamos una valoración aislada exclusivamente cuando el paciente acude a consulta podemos infravalorar, o por el contrario sobrevalorar, el grado de severidad de la dermatitis atópica. Existen publicaciones que hablan del EASI6 y del EASI-SA (EASI autoadministrado) como scores que consiguen una mejor valoración y estimación de la superficie corporal afectada; sin embargo, se ha establecido que ambos scores7 (SCORAD y EASI) son válidos, reproducibles y sensibles para la valoración inicial y la monitorización durante el tratamiento de los pacientes con dermatitis atópica. Además de los scores previos, se aconseja realizar escalas de valoración de la calidad de vida adaptadas según edad: DLQI (adultos), IDLQI (para niños<4 años)8 y CDLQI9(para niños>4años).
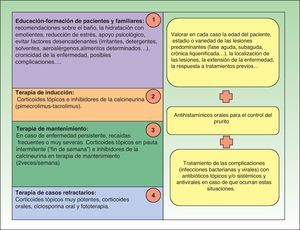
TratamientoGeneralidadesLas guías terapéuticas que existen actualmente para el control y manejo de la dermatitis atópica10–14 establecen los siguientes escalones de tratamiento resumidos en la figura 1.
Pero existen casos que aun cumpliendo todos y cada uno de los pasos establecidos siguen sin obtener mejoría clínica.
Alimentación, hidratación y cuidadosLa utilización o no de dietas restrictivas15,16 en niños con dermatitis atópica es un tema muy controvertido que ha sido punto de debate de diferentes especialistas y sobre el que actualmente no existe acuerdo. La mayoría de los autores recalcan la escasa evidencia existente, ya que la mayoría de los hallazgos que relacionan atopia y dieta son contradictorios, inconsistentes y poco concluyentes. Sin embargo, hay autores que consideran que determinados alimentos (huevos, leche de vaca, cacahuetes, trigo y soja) en niños menores de 2 años pueden contribuir al desarrollo de dermatitis atópica hasta en el 20% de los casos, y por tanto, se recomienda evitar su administración en edades muy tempranas de la vida. Del mismo modo, aquellos niños que hayan experimentado episodios alérgicos en relación con un determinado alimento deberían evitarlo, ya que existen casos descritos de anafilaxia por la reintroducción del alimento seleccionado. Existe un acuerdo en la importancia de evitar dietas muy restrictivas sin supervisión médica, ya que pueden producir estados serios de malnutrición. En cuanto al papel de la lactancia materna, la situación es igualmente controvertida. Se considera dudoso el papel protector de evitar la lactancia materna durante los 3 primeros meses de la vida cuando existen antecedentes familiares de atopia, así como el continuar la lactancia materna exclusiva y retrasar el inicio de la alimentación complementaria. Ante la no existencia de datos concluyentes, se considera que los niños con dermatitis atópica deberían recibir las mismas pautas de lactancia materna que los niños sanos. La utilización de prebióticos, probióticos y simbióticos17 (tabla 2) en la dermatitis atópica es un tema no menos ambiguo que los anteriores. La utilización de probióticos en pacientes con dermatitis atópica ya establecida no ha demostrado beneficios. Sin embargo, se ha comprobado que la utilización de simbióticos18 en niños con dermatitis atópica menores de 7 meses en comparación con placebo y tras un año de seguimiento consigue reducir el riesgo de desarrollo de asma infantil, disminuyendo casi a un 50% la aparición de síntomas. Dado el alto riesgo de desarrollo de asma que presentan estos niños, sería una intervención a tener en cuenta para detener o retrasar la marcha atópica. Por otro lado, respecto a su actuación sobre la dermatitis atópica, se ha comprobado que no modifica la severidad ni el curso de la enfermedad. Mucho se ha hablado del tipo de dieta19. Parece que deberían evitarse dietas ricas en ácidos grasos poliinsaturados y, por el contrario, fomentarse las dietas ricas en antioxidantes como la dieta mediterránea. Los ácidos grasos poliinsaturados podrían intensificar la producción de IgE a través de la formación de ácido araquidónico y promover de esta manera la aparición de enfermedades alérgicas. Por el contrario, los suplementos de ácidos grasos omega 3 y 6 podrían ser beneficiosos en la prevención de la dermatitis atópica y enfermedades de base alérgica en general, aunque no existen datos definitivos. Se acepta la asociación entre obesidad y dermatitis atópica, y se considera el tejido adiposo un órgano neuroendocrino secretor de IL 6, TNF alfa y leptina que disminuyen la tolerancia inmunológica a diferentes antígenos e impulsan el desarrollo de enfermedades como la dermatitis atópica.
Definiciones según la «World Gastroenterology Organisation» 2008. Guías prácticas de la OMGE
| Conceptos | Definiciones | Ejemplos |
| Prebióticos | Sustancias no digeribles que brindan un efecto beneficioso al huésped, estimulando selectivamente el crecimiento favorable o la actividad de un número limitado de bacterias autóctonas. Favorecen la multiplicación de las bacterias beneficiosas más que de las perjudiciales | Ingredientes de alimentos (galletas, cereales, chocolate, productos lácteos…): oligofructosa, inulina, galactooligosacáridos, lactulosa, oligosacáridos de la leche de pecho |
| Probióticos | Microorganismos vivos que, al administrarse en cantidades adecuadas, confieren un beneficio a la salud al huésped. Ayudan a reforzar el sistema inmunológico y restituyen la flora intestinal alterada | Microbios vivos que pueden incluirse en la preparación de alimentos, medicamentos y suplementos dietéticos: Lactobacillus, Bifidobacterium, Saccharomyces cerevisiae, E. coli y Bacillus |
| Simbióticos | Productos que contienen tanto probióticos como prebióticos, es decir bacterias acompañadas de fructooligosacáridos | Por regla general son lácteos en forma líquida. Se trata de bifidobacterias con galactooligosacáridos o con fructooligosacáridos, fundamentalmente Lactobacilli. Productos de fermentación láctica: Kimchi coreano, Chucruta de col, derivados de soja… |
Los productos emolientes tópicos que contengan aceite de girasol destilado20, rico en ácidos grasos esenciales, sobre todo ácido oleico y linoleico, se han propuesto como muy beneficiosos en el cuidado de la piel atópica. El aceite de girasol destilado actúa como ligando de los PPAR (peroxisome proliferator-activated receptor) estimulando la diferenciación de los queratinocitos, mejorando la función de la barrera epidérmica, reduciendo la inflamación y potenciando el metabolismo lipídico. Se considera un importante ahorrador de corticoides y ha demostrado obtener mejorías muy significativas en la calidad de vida de los pacientes. Reduce infecciones nosocomiales en recién nacidos pretérmino hasta en un 41% en comparación con la vaselina, y disminuye la tasa de mortalidad infantil un 26% comparado con otros emolientes.
Tratamientos tópicosCorticoides tópicosLos corticoides tópicos se consideran actualmente la piedra angular en el tratamiento de la dermatitis atópica. Se ha establecido recientemente el aceponato de metilprednisolona21 como el corticoide de elección en el tratamiento de la dermatitis atópica por su mejor perfil de eficacia y seguridad en comparación con otros corticoides de igual o superior potencia. Sin embargo, en caso de lesiones localizadas en pliegues, cabeza y cuello, y en caso de pacientes de menor edad se recomienda utilizar corticoides de menor potencia. En general la aplicación de corticoides más de una vez al día no suele ser necesaria. Se ha comprobado que la aplicación de corticoides potentes en pauta intermitente («fin de semana») seguidos de emolientes e hidratantes es equivalente a la utilización diaria de un corticoide suave o de potencia media. La utilización de corticoides tópicos en curas húmedas22 sería una opción terapéutica en casos recalcitrantes. La pauta más aceptada consiste en aplicar aceponato de metilprednisolona diluido al 10% con emolientes (pomada, crema o vaselina) directamente sobre la piel y ocluir con 2 capas de vendajes (primera cura húmeda y segunda seca) una vez al día durante una media de 7 días (2-14 días). Periodos más largos de tratamiento no han demostrado mayor eficacia y sí mayor probabilidad de desarrollar efectos adversos. No se recomienda utilizar en niños peripuberales por el riesgo de aparición de estrías. Aunque muy infrecuentes, pueden aparecer efectos secundarios como sensación de disconfort, foliculitis, lesiones refractarias en las zonas no cubiertas, impétigo e infecciones herpéticas.
La utilización rutinaria de combinaciones de corticoides y antibióticos tópicos23–25 no sería una actuación muy recomendable. Mientras el papel de la antibioterapia ante la existencia de signos de sobreinfección está claramente demostrado, es dudoso el hecho de que la disminución de la colonización por Staphylococcus aureus (S. aureus) por agentes antiestafilocócicos modifique el curso y la severidad de la dermatitis atópica. Podrían utilizarse dichas combinaciones durante un corto periodo de tiempo (7-10 días), en lesiones de escasa extensión en zonas determinadas (narinas, flexuras, área perianal, dedos de las manos y los pies…) o al inicio del tratamiento, siendo sustituido posteriormente por un corticoide solo. La utilización de antibióticos tópicos en áreas extensas de piel podría conducir a la aparición de resistencias, y en pacientes con lesiones ampliamente distribuidas la antibioterapia oral es preferible a una combinación de corticoides y antibióticos tópicos. Además, determinados antibióticos como la neomicina o la gentamicina tienen riesgo de desarrollar sensibilización tras su uso prolongado y descontrolado. El potencial actual de sensibilización del ácido fusídico o la mupirocina son excepcionales, sin embargo, su mal uso podría convertirlo en un problema emergente.
Inmunomoduladores tópicosLos inhibidores de la calcineurina, tacrolimus y pimecrolimus, han demostrado su eficacia y seguridad en el tratamiento de la dermatitis atópica moderada y severa26 tanto en adultos como en población infantil. Ambos han sido extensamente evaluados y existen ensayos clínicos que los comparan con placebo, corticoides tópicos27 y entre sí. Hasta el momento han demostrado su utilidad y seguridad en pauta continua durante un corto espacio de tiempo y en pauta discontinua durante un periodo de hasta 4 años. La seguridad a más largo plazo es aún desconocida, ya que ambos productos llevan en el mercado menos de una década.
Tacrolimus28,29 ha demostrado ser eficaz como tratamiento de inducción y en pauta de mantenimiento (2 veces en semana) reduciendo el número de exacerbaciones en un periodo de seguimiento de 12 meses y aumentando el tiempo libre de enfermedad. Además, en estudios de coste/eficacia30, tacrolimus en pauta de mantenimiento, tanto en niños como en adultos, se ha posicionado como el tratamiento más efectivo y menos costoso en comparación con el tratamiento estándar utilizado en los brotes de dermatitis atópica. En comparación31 con pimecrolimus 1%, tacrolimus 0,1% ha demostrado en adultos con dermatitis atópica ser más eficaz en el control de la enfermedad, consiguiendo estos resultados a un menor coste. Existen referencias bibliográficas que recogen datos de su utilización en niños menores de 2 años32, grupo de población en el que solo están aprobados por la FDA para el tratamiento de la dermatitis atópica los corticoides de baja potencia. Los autores confirman la eficacia y seguridad a corto y largo plazo en comparación con corticoides tópicos de baja potencia.
Por otro lado, pimecrolimus33 también ha demostrado su eficacia en el control de los brotes de la enfermedad en pauta continua, similar a tacrolimus 0,03%34, reduciendo el riesgo de recidiva y la necesidad de utilización de corticoides tópicos en pauta intermitente. Consigue mejorar la calidad de vida de los pacientes y sus familias, y ha demostrado mayor seguridad que los corticoides tópicos en un periodo de 2 años. En estudios aún no publicados ha demostrado seguridad a corto y largo plazo (5 años) comparado con corticoides de potencia baja-moderada en lactantes entre 3-12 meses con dermatitis atópica leve-moderada, no existiendo diferencias estadísticamente significativas en los pacientes tratados con pimecrolimus 1% en comparación con los tratados con corticoides en cuanto al desarrollo de inmunidad celular, humoral y respuesta inmunológica a vacunas.
Agentes antiinfecciososLa colonización por S. aureus de la piel y narinas de los pacientes con dermatitis atópica se estima que puede ser de un 76 a un 100% en comparación con la población general (2-25%) pero se ha visto que el porcentaje de S. aureus meticilin resistente (MARSA) no es tan elevado como se pensaba. La barrera epidérmica defectuosa se propone como la principal causa de esta colonización.
La sobreinfección bacteriana35 por S. aureus es la complicación más frecuente en la dermatitis atópica y suele estar siempre presente en los rebrotes. Se ha comprobado que el tratamiento antibacteriano mejora la severidad y las infecciones secundarias, y se propuso la supresión del crecimiento bacteriano como un punto muy importante en el tratamiento de la dermatitis atópica. Con respecto a este tema, el grupo de Paller36 et al. realizó un estudio en el que demostraban que la utilización de baños con hipoclorito sódico para suprimir la colonización aumentada de S. aureus mejoraba la severidad de la dermatitis atópica. El estudio fue llevado a cabo en 31 pacientes de edades comprendidas entre los 6 meses y los 17 años con dermatitis atópica moderada-severa y signos clínicos de sobreinfección bacteriana secundaria. Al cabo de 3 meses de tratamiento observaron diferencias clínicas estadísticamente significativas entre los 2 grupos. Además, al comparar en un mismo paciente las zonas sumergidas en los baños de lejía (tronco y extremidades) en comparación con las no sumergidas (cuello y cabeza) también observaron diferencias. Sin embargo, este estudio fue duramente criticado posteriormente por el grupo ingles de Craig et al.37, indicando que consideraban las diferencias encontradas entre los 2 grupos de tratamiento debidas a diferencias basales en la severidad de los pacientes, a utilización de cotratamientos durante el estudio y a un sesgo por intención de tratar. Posteriormente, a finales del 2010 se publica un riguroso artículo de revisión38 en el que se repasa toda la literatura desde 1980 hasta marzo de 2009 sobre medidas reductoras de la superpoblación de S. aureus en los pacientes con dermatitis atópica. Los autores concluyen que aunque diferentes intervenciones, entre las que se incluyen los baños con lejía y la mupirocina intranasal, hayan demostrado reducir el número de S. aureus, no existe evidencia suficiente que apoye la utilización de agentes antiestafilocócicos en lesiones sin signos de sobreinfección. Añaden que son necesarios estudios a largo plazo que pongan de manifiesto los posibles beneficios de los agentes antiestafilocócicos para prevenir los brotes de dermatitis atópica y modificar el curso de la enfermedad.
FototerapiaLa primera elección de fototerapia39 en el tratamiento de la dermatitis atópica es el UVB de banda estrecha (UVBnb). El UVA a dosis medias ha demostrado también eficacia y tolerabilidad con efectos similares a los recogidos con UVBnb. En casos resistentes a regímenes de fototerapia previos, el PUVA40 con 5 methoxypsoralen (5-MOP 1-2mg/kg 2 h antes de la irradiación) ha demostrado superioridad tanto en velocidad de respuesta como en el tiempo de remisión tras el tratamiento con respecto a dosis medias de UVA y UVBnb. En cuanto al temor de inducir cáncer de piel no melanoma, las sesiones que necesitan estos pacientes, habitualmente 15-36, distan mucho de las 200 sesiones en las que se establece el riesgo de este tipo de cáncer. Un grupo japonés ha propuesto un nuevo sistema de fototerapia denominado FSL (fototerapia de amplio espectro)41 utilizado previamente en enfermedades neuropsiquiátricas como la depresión. Este sistema abarca longitudes de onda desde los 320 a los 5.000nm., similar a la helioterapia pero omitiendo la banda de UVB. En un estudio clínico observan reducciones en el SCORAD del 23,1% en la semana 4 y 35,7% en la semana 8, destacando entre los efectos adversos: eritema, prurito, sensación de quemazón, exacerbación transitoria de la dermatitis atópica y sequedad. Además obtienen diferencias estadísticamente significativas en los niveles de eosinófilos, IgE e IL 4 y 5. Estos resultados serían similares a los obtenidos con UVBnb (24-45%) y dosis media de UVA (27-37%), superiores a dosis bajas de UVA (6%) e inferiores a la helioterapia (70-74%) y a PUVA (54%).
Terapias inmunomoduladorasCorticoides oralesA pesar de que actualmente se considera un tratamiento con nivel de evidencia IV, por la escasez de ensayos clínicos, no cabe duda de que los corticoides orales son el pilar del tratamiento de rescate de los brotes de dermatitis atópica, tanto en adultos como en niños. En ensayos clínicos42 se ha demostrado que la concentración de corticoides en piel sería similar tras la administración de un corticoide tópico potente (propionato de clobetasol 0,05%, hidrocortisona 2,3% o triamcinolona 0,1%) que tras la administración de dosis medias de prednisona oral. Sin embargo, cuando la piel está muy alterada, la distribución de estas sustancias es muy irregular y sería más seguro y controlable realizar la administración vía oral. En el resto de las situaciones sería más recomendable utilizar corticoides tópicos. Por otro lado, varios autores43 han observado un incremento en la producción de IgE por parte de los linfocitos B en pacientes con dermatitis atópica una vez finalizado el tratamiento con prednisolona oral, que reflejaría el efecto inmunomodulador de los corticoides y explicaría el temido efecto «rebote» que sucede tras el cese de la medicación de forma brusca. Es por ello muy importante que, tras obtener mejoría clínica, la dosis de corticoides se reduzca de forma lenta y mantenida a lo largo del tiempo y así minimizar la posibilidad de desarrollar efecto «rebote».
CiclosporinaLa ciclosporina se ha utilizado clásicamente como rescate en el tratamiento de la dermatitis atópica recalcitrante, desarrollando un papel similar al de los corticoides. Actúa inhibiendo la transcripción de IL 2 y otras citocinas, consiguiendo de esta manera evitar la activación de los linfocitos T. En un artículo44 publicado en 2007 se recoge la experiencia más larga revisando un total de 15 estudios y 602 pacientes. La ciclosporina consigue una respuesta dosis dependiente muy rápida, en menos de 2 semanas, pudiendo variar las dosis de inicio desde los 4, 5 y hasta 7mg/kg/día. Se ha comprobado que disminuye la severidad en un 22% cuando se utiliza a dosis menores de 3mg/kg/día y un 40% cuando se utilizan dosis mayores de 4mg/kg/día. La eficacia aumenta con el tiempo de utilización y se estima que tras 6-8 semanas de tratamiento la severidad disminuye de un 55 a un 70%. La eficacia es similar en niños y adultos, aunque los niños muestran mejor tolerancia. Se pueden asociar corticoides e inhibidores de la calcineurina tópicos como tratamiento coadyuvante. Los efectos secundarios son dosis dependientes y mucho más frecuentes en adultos que en niños. Entre los más habituales cabe destacar: síntomas gastrointestinales (40%), infecciones (13%), aumento de la creatinina >30% (11%), hipertensión (6%), cefalea, parestesias distales e hipertricosis. Todos ellos suelen remitir tras el cese de la medicación y no se han registrado efectos adversos que comprometan la vida del paciente. El efecto inmunomodulador de dosis bajas de ciclosporina utilizadas durante un tiempo más prolongado es quizá un concepto más novedoso. A finales de 2010 se publica un estudio45 que valora la eficacia y seguridad a largo plazo de ciclosporina oral en pacientes con dermatitis atópica moderada-severa. Se incluyen 147 pacientes, niños y adultos, 61 de ellos en tratamiento con ciclosporina durante más de 6 meses. La dosis media de ciclosporina fue de 3mg/kg/día y la duración media del tratamiento 18 meses. La dermatitis atópica se clasificó en extrínseca o intrínseca según la asociación o no con otras enfermedades atópicas, niveles de IgE elevados e IgE específica positiva. Se obtuvo una reducción del SCORAD estadísticamente significativa desde el primer mes de tratamiento tanto en niños como en adultos y tanto en las formas moderadas como severas de dermatitis atópica. Los niveles de IgE fueron significativamente menores tras el tratamiento. Observaron que la mejoría fue mucho mayor en los casos de dermatitis atópica extrínseca (asociada a otros signos de atopia, niveles elevados de IgE e IgE específica positiva). Entre las complicaciones observadas destacaban: hipertensión (7,6%), náuseas y dolor abdominal (4,9%), hipertricosis (1,6%) y alteración del aclaramiento de creatinina (1,6%). La explicación de este efecto inmunomodulador es que niveles bajos de ciclosporina aumentan la población tisular de linfocitos T reguladores46, que son inmunomoduladores, en pacientes con dermatitis atópica. Así que no solo la inhibición de la activación de los linfocitos T que consiguen las dosis altas mejorarían la clínica, sino que serían ambos mecanismos los que contribuirían a mejorar la dermatitis atópica. El miedo a la disminución de la densidad mineral ósea en los tratamientos a largo plazo en población infantil queda resuelto tras la publicación de una revisión47 en la que se realizan densitometrías a 60 niños de edades comprendidas entre los 5 y 16 años con dermatitis atópica moderada-severa e historia de tratamientos previos con corticoides sistémicos y/o ciclosporina durante un periodo mínimo de 5 años. Los autores concluyen que no existe una mayor disminución de la densidad mineral ósea en el grupo tratado en comparación con la población general.
AzatioprinaLa azatioprina ha demostrado en diferentes estudios ser un tratamiento efectivo48 y seguro a corto y largo plazo tanto en adultos como en niños. La seguridad es mucho mayor si realizamos la determinación de la enzima tiopuril metil transferasa49, que permite un mejor ajuste de dosis para conseguir una máxima eficacia minimizando los efectos adversos. La dosis de inicio se estima en 0,75-2,5mg/kg/día con una dosis de mantenimiento de 0,7-1,5mg/kg/día. El problema de la azatioprina es su demora en el inicio de la respuesta terapéutica, que se estima en unos 2 meses como mínimo con una media de 4 meses. Este hecho determina su uso como medicamento estabilizador involucrado en el control de las recidivas más que como fármaco de rescate. Por este mismo motivo, los primeros meses es habitual utilizar tratamientos concomitantes como corticoides orales. Los efectos secundarios más temidos, la aplasia medular o el linfoma son excepcionales y, por el contrario, los más frecuentes son leves y fáciles de controlar; entre estos últimos destacan: náuseas, cefalea, infecciones víricas o linfopenia leve transitoria asociada o no a neutropenia. Su eficacia y seguridad50 durante 12 semanas a dosis entre 1,5-2,5mg/kg/día se ha comparado a metotrexato a dosis de 10-22,5mg/semana, considerándose ambos tratamientos opciones terapéuticas adecuadas en el control de la dermatitis atópica moderada y severa. En una extensa revisión sistemática51 publicada en 2011, en la que se resume la evidencia existente a cerca de la eficacia y seguridad de las diferentes indicaciones fuera de ficha técnica de azatioprina en dermatología, los autores concluyen que existe una fuerte recomendación clínica para la indicación de azatioprina en dermatitis atópica.
Mofetil micofenolatoEl mofetil micofenolato es un inmunosupresor actualmente aceptado por la FDA para evitar el rechazo en el trasplante renal. Se considera un fármaco eficaz52 en el tratamiento de la dermatitis atópica moderada-severa, consiguiendo mejorías en 4-8 semanas con muy buen perfil de seguridad a largo plazo, mejor incluso que corticoides o ciclosporina. Para muchos es el fármaco recomendado en el tratamiento continuado de mantenimiento de la dermatitis atópica, pero esta afirmación no deja de ser una opinión de un grupo de expertos, pues no existen estudios que lo avalen. Entre sus efectos secundarios frecuentes destacan los síntomas gastrointestinales, pero gracias a la introducción de la molécula de mofetil micofenolato con recubrimiento entérico (ácido micofenólico)53 este efecto secundario se ha conseguido eliminar por completo manteniéndose la misma eficacia y seguridad. El problema es su coste elevado, por lo que debería utilizarse solo en aquellos casos en los que aparezcan efectos adversos. Los efectos secundarios graves son excepcionales y solo se ha registrado un caso de leucoencefalopatía multifocal progresiva y otro de septicemia y endocarditis por S. aureus. La serie más larga es la de Murray y Cohen54 con 20 pacientes seguidos durante 200 semanas con una dosis media de 1g/12h obteniendo mejoría en 17 pacientes a las 4 semanas, 10 de ellos en remisión completa y 7 continuando con terapia de mantenimiento. La experiencia del grupo español de Ballester et al.55 no es tan brillante, con un total de 8 pacientes y una mejoría en 5 de ellos, solo uno en remisión completa y 4 de ellos en terapia de mantenimiento durante un tiempo de seguimiento que oscila entre las 16 y las 72 semanas. El grupo americano de Heller et al.56 publica su experiencia en un grupo de 14 pacientes en edad pediátrica. En los niños parece que los resultados son más prometedores: obtienen remisión completa en 4 pacientes, una mejoría casi completa (>90%) en otros 4, mejoría parcial (60-90%) en 5 pacientes y solo uno de ellos no mostró respuesta al tratamiento.
MetotrexatoDosis bajas de metotrexato57 han demostrado eficacia en el tratamiento de la dermatitis atópica moderada-severa sobre todo en pacientes adultos. En un estudio retrospectivo58 en el que tratan 20 adultos con dermatitis atópica moderada-severa con metotrexato 10-25mg/semana durante un tiempo de seguimiento de 8 a 12 semanas, los autores observaron que el inicio del efecto comenzaba entre las 2-12 semanas. Comprobaron que el tratamiento fue más efectivo en los casos de dermatitis atópica de comienzo en la edad adulta en comparación con los de inicio en la infancia. En el 60% de los casos el SCORAD disminuyó significativamente, siendo esta respuesta moderada (26-50%) en un 15%, marcada (51-75%) en un 20% y excelente (76-100%) en un 25% de los casos. Del mismo modo, en el 70% de los casos se obtuvieron mejorías en el DLQI que fueron moderadas (26-50%) en el 20%, marcadas (51-75%) en un 15% y excelentes (76-100%) en un 35% de los casos. Entre los efectos secundarios registrados destacaron los digestivos, que se resolvieron al cambiar la administración a subcutánea, elevación de enzimas hepáticas y un caso de neuropatía periférica reversible tras el cese del tratamiento. La experiencia en la dermatitis atópica infantil es más escasa en la literatura, sin embargo existen publicaciones que hablan de su eficacia y mejor tolerancia13.
Ligandos PPAR (rosiglitazona)Los PPAR son receptores hormonales nucleares expresados en queratinocitos y en células del sistema inmune, capaces de regular la homeostasis de la barrera epidérmica y el sistema inmunitario. Se ha demostrado en varios estudios experimentales59 que sus ligandos están disminuidos tanto en la fase aguda como en la crónica de la dermatitis atópica. La rosiglitazona60 a dosis de 4-8mg/día en politerapia ha demostrado ser útil como ahorrador de corticoides, comenzando su respuesta en unas 4-12 semanas. Sin embargo, debido a sus efectos adversos, sobre todo al riesgo cardiaco, la FDA ha decidido retirarlo del mercado.
Medicamentos biológicosNo existen grandes series de casos que establezcan la eficacia y seguridad de estos medicamentos61 en la dermatitis atópica. En la mayoría de los casos solo disponemos de casos clínicos aislados y la extrapolación de nuestra experiencia en otras enfermedades inmunológicamente relacionadas. Los podemos dividir en 3 grupos según la diana de actuación:
Moléculas que actúan directamente sobre los linfocitos B y evitan la activación de los linfocitos T: rituximab y alefaceptEl trabajo que abarca un mayor número de pacientes es el que utiliza alefacept. Alefacept62 es una proteína de fusión humana dimérica que evita la activación de los linfocitos T, su proliferación y sobre todo su conversión en células de memoria. Danielle et al. publican su experiencia con 9 pacientes sometidos a una inyección semanal de alefacept (30mg) durante 8 semanas, reduciéndose la dosis al 50% (15mg) en la semana 9 hasta la 16 en caso de conseguir una reducción del EASI del 50%. Solo 2 de los 9 pacientes respondieron al tratamiento.
Simonet al.63 administran a 6 pacientes con dermatitis atópica severa 2 ciclos intravenosos de rituximab de 1.000mg separados por un periodo de tiempo de 2 semanas. Todos los pacientes mostraron mejoría clínica en las 4-8 semanas que siguieron al tratamiento. Se consiguieron reducciones en el EASI estadísticamente significativas. La mejoría fue también histológica, reduciéndose la espongiosis, acantosis e infiltrado dérmico, incluyendo el recuento del número de linfocitos T y B. Se obtuvo además una reducción de los niveles de IgE. Lo autores concluyen que el tratamiento con este anticuerpo monoclonal anti CD20 podría ser útil en el tratamiento de la dermatitis atópica severa. En cuanto a los posibles efectos adversos con rituximab, los más frecuentes son los relacionados con la infusión: fiebre y escalofríos hasta en un 50% de los casos. También, aunque menos frecuente, pueden aparecer reacciones de hipersensibilidad, síntomas digestivos, cardiovasculares, artromialgias, alopecia, disnea, mielosupresión (grave en<2%) e infecciones. Muy raramente, anemia hemolítica, empeoramiento de cardiopatía preexistente, aparición de anticuerpos y leucoencefalopatía multifocal progresiva. La mayoría de estos efectos adversos suelen ocurrir en las 2h que siguen a la infusión y su incidencia suele disminuir en infusiones posteriores.
Moléculas anti IgE: omalizumabQuizá las mayores esperanzas y expectativas estén puestas en el omalizumab. Es un anticuerpo monoclonal recombinante humanizado anti Fc IgE aprobado por la FDA para el tratamiento del asma en mayores de 12 años. La dosis depende del peso del paciente y de los niveles de IgE (máximo 1.500), existiendo 2 presentaciones (75-150mg) que se administran cada 2 o 4 semanas. Entre los efectos secundarios más importantes aunque poco frecuentes destacan: cefaleas, infecciones, urticaria, anafilaxia y patología cardiaca. Es un medicamento que estamos utilizando por extrapolación de los éxitos terapéuticos conseguidos en el asma. Los alergólogos lo utilizan una vez que el paciente está estabilizado del asma bronquial y ha superado la crisis aguda, ya que se han registrado casos de exacerbación de la clínica respiratoria en las primeras semanas de tratamiento; por lo tanto, es habitual asociar en las primeras semanas corticoides orales o ciclosporina. Además de existir casos clínicos exitosos aislados64,65, es el único fármaco de este grupo del que existe un ensayo clínico aleatorizado doble ciego controlado con placebo66, aunque los resultados son contradictorios. El grupo vienés de Heil et al. administran omalizumab a 13 pacientes con dermatitis atópica (7 placebo) durante un tiempo de seguimiento de 16 semanas. Tratan fundamentalmente adultos (edad media 30 años) con dermatitis atópica crónica estable (reagudizaciones en menos de 9 meses al año) la mayoría sin asma (3 con antecedentes de asma) y con niveles medios-bajos de IgE (200-400). Obtienen una llamativa reducción en los niveles de IgE y una mejoría de parámetros inmunológicos e histopatológicos; sin embargo, no observan diferencias estadísticamente significativas en los parámetros clínicos (EASI, IGA=valoración global subjetiva del paciente con dermatitis atópica e IPSA=valoración del prurito en las últimas 24h). Los mismos autores concluyen que estos resultados deben ser considerados con cautela, ya que se trata de un estudio con una escasa muestra de pacientes. Son necesarios más estudios para valorar realmente la eficacia de omalizumab en la dermatitis atópica y describir el perfil de paciente que podría ser candidato de su beneficio.
Moléculas anti TNF alfa/Th17: etanercept, adalimumab y ustekinumabExisten casos clínicos aislados que comunican la eficacia de estas moléculas67 en la dermatitis atópica moderada severa, sin existir series de casos ni estudios clínicos.
Inmunoglobulinas intravenosasDosis altas de inmunoglobulinas intravenosas68 han demostrado ser eficaces en el tratamiento de la dermatitis atópica moderada y severa. Su problema son los costes elevados, aproximadamente 45.000 euros al año (estimación para un adulto de 70kg con pauta de 2g/kg/mes). Para intentar disminuir el gasto se ha propuesto aumentar el intervalo entre dosis en pacientes en remisión o disminuir la dosis por sesión (0,5-1g/kg en lugar de 2g/kg) y estimular la pérdida de peso. En adultos, la respuesta es peor en monoterapia (59%) que en politerapia (80%), sin embargo en los niños se han demostrado respuestas del 90% en monoterapia. Por todo ello sería un tratamiento más indicado en los niños (precio estimado en un niño de 25kg con pauta 2g/kg/mes 16.000 euros al año) que en adultos. En un ensayo clínico69 aleatorizado doble ciego controlado con placebo publicado en el 2011 en población pediátrica, concluyen que el tratamiento con inmunoglobulinas intravenosas mejora clínicamente la dermatitis atópica tras 3 meses de tratamiento, pero esta mejoría puede disminuir 6 meses después del cese del tratamiento. No se han demostrado cambios en los niveles de IgE ni en el recuento de eosinófilos de sangre periférica. Aunque la mayoría de los efectos secundarios suelen ser leves (cefalea, dolor abdominal, náuseas, vómitos, diarrea…), no debemos despreciar importantes efectos secundarios que en ocasiones pueden poner en peligro la vida de los pacientes como es el poder procoagulante e hipertensor. Se recomienda asociar una dosis profiláctica de heparina de bajo peso molecular en el momento de la infusión, así como regular la velocidad de la misma en función de los valores de tensión arterial del paciente registrados durante el tratamiento. Además, se debe descartar siempre una inmunodeficiencia asociada por el peligro de reacciones cruzadas.
Interferón gammaLa utilización de interferón gamma en la dermatitis atópica tuvo su auge cuando se pensaba que esta era una respuesta inmunológica tipo 2 pura en la que el interferón gamma estaba muy reducido. En diferentes ensayos clínicos70 ha demostrado su eficacia y seguridad (corto y largo plazo>2 años) con escasos efectos adversos, principalmente la aparición de un síndrome seudogripal, reacción local en el lugar de inyección e hipersensibilidad. Ha demostrado frente a placebo reducciones significativas en el eritema, prurito y excoriaciones. El resto de los síntomas muestran mejoría, sin ser las diferencias estadísticamente significativas. Se pensaba que bloqueaba la síntesis de IgE inducida por IL 4, disminuyendo los niveles de IgE libre; sin embargo, en ensayos experimentales no se ha demostrado un descenso de IgE a pesar de la mejoría clínica y su mecanismo exacto de acción aún no está aclarado. Con respecto a la dosis recomendada y el esquema de tratamiento71, se ha demostrado que tanto la pauta a dosis altas (75 microgramos o 1,5 MUI/m2) o a dosis bajas (25 microgramos o 0,5 MUI/m2) administrada 3 veces en semana durante 12 semanas son eficaces y seguras en el tratamiento de la dermatitis atópica severa, aunque en las primeras fases del tratamiento la pauta a dosis altas ha demostrado mayor eficacia.
Control del pruritoEl prurito nocturno en pacientes con dermatitis atópica ha sido motivo de múltiples estudios, en los que se ha observado que es independiente de los niveles de citocinas, eosinófilos e IgE libre, y no se correlaciona con la severidad de la enfermedad. Por el contrario, el factor neurotrófico derivado del cerebro72 (producido por eosinófilos circulantes) y la sustancia P sí han sido involucrados en su fisiopatología. Varios estudios experimentales han comprobado que la sustancia P induciría la cascada del ácido araquidónico y produciría un aumento de los leucotrienos. Todo ello explicaría el mal resultado de los antihistamínicos en el control del prurito de estos pacientes y el posible papel beneficioso de los antileucotrienos como el montelukast. En la literatura existen datos contradictorios con respecto a este último. Friedmann et al.73 diseñaron un ensayo clínico doble ciego controlado con placebo con montelukast 10mg/día en adultos con dermatitis atópica moderada-severa que no reveló diferencias estadísticamente significativas entre los grupos de tratamiento. Por otro lado, Ehlayel et al.74 publicaron en la misma fecha otro ensayo clínico doble ciego controlado con placebo con montelukast 10mg/día en niños con dermatitis atópica moderada-severa, observando una mejoría del prurito, las alteraciones del sueño, la extensión y severidad, los niveles de eosinófilos y de IgE en el grupo tratado con montelukast. Teniendo en cuenta estos estudios, diversos autores plantean la posibilidad de que el perfil de paciente con más probabilidades de obtener beneficio con mostelukast sean niños, o adultos con dermatitis atópica extrínseca. Por otro lado, se ha involucrado también la secreción de serotonina en el mecanismo etiopatogénico del prurito, ya que está incrementada en la piel inflamada y participa en la liberación mastocitaria. El estrés y la ansiedad exacerban los síntomas de la dermatitis atópica, especialmente el prurito. Por tanto, la intervención psicológica y sobre todo el control de la serotonina serían útiles como parte del tratamiento de la dermatitis atópica. En este sentido, 2 fármacos han demostrado su eficacia. Por un lado, el ondansetrón75, un antagonista serotoninérgico a dosis de 8-12mg/día consigue mejorar el prurito incoercible asociado a diferentes patologías cutáneas entre las que se encuentra la dermatitis atópica. Por otro lado, el tandospirone citrato76, un agonista parcial que disminuye la síntesis y la descarga de serotonina, a dosis de 30mg/día durante 4 semanas ha mostrado mejorías en el SCORAD, la ansiedad, la depresión, el estrés y el insomnio asociado a la dermatitis atópica. Quizá lo más novedoso en el control del prurito de la dermatitis atópica sea la utilización de naltrexona77, un antagonista de los receptores de los opiáceos. En un ensayo clínico doble ciego controlado con placebo a dosis de 50mg/día durante un periodo de 2 semanas se han demostrado reducciones estadísticamente significativas en los valores de la escala visual analógica del prurito. Entre los efectos adversos más frecuentes y que limitan su utilización destacan los gastrointestinales. También pueden aparecer otros efectos secundarios cardiovasculares, neurológicos, musculoesqueléticos y alérgicos, aunque su frecuencia es mucho menor. Las terminaciones78 que recogen los estímulos dolorosos y el prurito corren paralelamente por los cordones posteriores de la médula espinal y están interconectados por las interneuronas. Los agonistas opiáceos hacen que las interneuronas bloqueen las terminaciones que conducen el dolor produciendo analgesia, pero estimulan las que conducen el prurito produciendo un prurito reactivo. De la misma forma, pero en sentido contrario, los antagonistas de los opiáceos hacen que las interneuronas bloqueen las fibras que conducen el prurito produciendo en ocasiones un dolor reactivo. El cromoglicato sódico es una cromona desarrollada como polvo inhalado para el tratamiento del asma y que posteriormente se ha utilizado en rinoconjuntivitis alérgica, alergias alimentarias y mastocitosis diseminadas. En un primer momento se pensó que su mecanismo de acción era la estabilización del mastocito, pero en la piel actúa principalmente inhibiendo la activación de fibras nerviosas que recogen la sensación de prurito. Varios estudios han investigado el efecto de la aplicación tópica79–81 en la dermatitis atópica. Aunque los resultados han sido variables, algunos de ellos han constatado una reducción significativa del prurito. La presentación suele ser en emulsión a una concentración que oscila entre el 1 y el 10%, obteniéndose los mejores resultados con las mayores concentraciones. La tolerancia es adecuada, sin registrarse efectos adversos. También existen publicaciones sobre su utilización vía oral82 con resultados confusos y contradictorios.
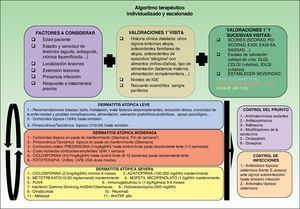
Algoritmo terapéuticoBasándonos en las diversas guías terapéuticas, una extensa revisión bibliográfica y nuestra experiencia personal, proponemos un esquema terapéutico para el control de la dermatitis atópica (fig. 2). Es muy difícil indicar un orden constante de utilización de los diferentes fármacos y la elección final dependerá del nivel de evidencia clínica (tabla 3), de las características del paciente, de la experiencia previa y del medio en el que desarrollemos nuestra actividad asistencial.
Sistema de jerarquización de los niveles de evidencia. Fortaleza de las recomendaciones según el nivel de evidencia
| Fármaco | Nivel de evidencia | Grado de recomendación |
| Corticoides tópicosInmunomoduladores tópicos (tacrolimus y pimecrolimus)Fototerapia: UVBnb/UVB/UVA/PUVACiclosporinaAzatioprinaAntagonistas de los leucotrienosInterferón gamma 1-BInmunoglobulinas intravenosasNaltrexonaSimbióticos | IMetaanálisis/varios ensayos clínicos aleatorizados (A)Un ensayo clínico aleatorizado (B) | Muy recomendable |
| MetotrexatoEmolientesCromoglicato sódicoCuras húmedas corticoides | IIEnsayo clínico sin aleatorizar (A)Estudio de Cohortes (B) | Favorable |
| AntihistamínicosÁcidos grasos omega 3 y 6ProbióticosModificadores de la serotonina | IIIEstudios de casos y controles | Favorable no concluyente |
| AntibióticosMofetil micofenolato. Ácido micofenólicoOmalizumabAlefaceptRituximabCorticoides sistémicosHidroxicloroquinaAnti TNF alfaOndasetron | IVSeries de casos/Casos anecdóticos/Opinión de expertos | Sin evidencia sustentable |
Fuente: Schünemann HJ, Fretheim A, Oxman AD. Improving the use of research evidence in guideline development: 9. Grading evidence and recommendations. Health Res Policy Syst. 2006;4:21.
La dermatitis atópica puede representar todo un reto terapéutico que exige la combinación de recursos tanto científicos como humanos. No solo debemos tener un gran manejo y conocimiento actualizado de todas las opciones terapéuticas disponibles, sino también una adecuada capacidad de individualizar cada caso y la habilidad para mantener una estrecha relación médico-paciente que dé confianza a nuestros pacientes aumentando así su implicación en el proceso y adherencia al tratamiento, consiguiendo de esta manera optimizar los resultados. Es muy importante la creación de algoritmos terapéuticos que nos permitan actuar de una manera consensuada y coordinada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.