El carcinoma epidermoide cutáneo (CEC) es el segundo tumor más frecuente en humanos y tiene una incidencia creciente e infraestimada. En la literatura nos encontramos con términos como CEC de alto riesgo, CEC localmente avanzado, CEC metastásico, CEC avanzado y CEC agresivo, que pueden dar lugar a confusión y que en algunas ocasiones no se encuentran del todo bien definidos. En esta revisión pretendemos aclarar estos conceptos con la idea de lograr homogeneidad en su descripción, algo que parece necesario a la luz de los nuevos fármacos aprobados y en desarrollo para este tumor.
Cutaneous squamous cell carcinoma (cSCC) is the second most common cancer in humans and its incidence is both underestimated and on the rise. cSCC is referred to in the literature as high-risk cSCC, locally advanced cSCC, metastatic cSCC, advanced cSCC, and aggressive cSCC. These terms can give rise to confusion and are not always well defined. In this review, we aim to clarify the concepts underlying these terms with a view to standardizing the description of this tumor, something we believe is necessary in light of the new drugs that have been approved or are in development for cSCC.
El carcinoma epidermoide cutáneo (CEC) es el segundo tumor más frecuente en humanos y tiene una incidencia creciente e infraestimada1,2. El número de casos de CEC se ha incrementado entre el 50 y el 300% en las últimas 3décadas3 y en 2030 su incidencia duplicará a la actual en países europeos4. Se discute si este incremento es real o responde a una detección precoz de la enfermedad5, pero el aumento en la incidencia se mantiene en estudios que excluyen los casos de CEC in situ6. Aunque no hay datos fiables sobre la incidencia real de CEC, se estima que el riesgo de desarrollar un CEC a lo largo de la vida es del 7 al 11% en población caucásica7 (del 9 al 14% en varones y del 4 al 9% en mujeres)8. En España, los estudios que analizan tasas de incidencia brutas estiman 38,16 casos de CEC por 100.000 habitantes y año9, aunque no existen registros que permitan una estimación real. La incidencia es algo superior a la que se ha demostrado en otros países europeos (revisado por Lomas et al.1).
La supervivencia del CEC a 10 años después de la cirugía supera el 90%, la frecuencia de metástasis ganglionares está alrededor del 4% y la mortalidad se sitúa en torno al 2%, aunque debido a su elevada frecuencia es un problema de salud relevante y con un impacto significativo en la mortalidad10. De hecho, el CEC es la segunda causa de muerte por cáncer cutáneo después del melanoma, es responsable de la mayoría de las muertes por cáncer de piel en mayores de 85 años3 y en algunas áreas de EE. UU. ostenta una mortalidad comparable con la de carcinomas renales, orofaríngeos o melanomas3.
En los últimos años, varios autores han centrado su investigación en analizar los factores que pueden predecir un peor pronóstico en el CEC. En la literatura nos encontramos términos como CEC de alto riesgo (CECar), CEC localmente avanzado (CECla), CEC metastásico (CECm), CEC avanzado (CECav) y CEC agresivo (CECag), que pueden dar lugar a confusión y que en algunas ocasiones no se encuentran bien definidos. En el presente artículo se pretende aclarar estos conceptos con la idea de lograr homogeneidad en su descripción, algo que parece necesario a la luz de los nuevos fármacos aprobados y en desarrollo para este tumor.
Factores pronósticos en el carcinoma epidermoide cutáneoFactores pronósticos clínicosRelacionados con el tumorEl tamaño horizontal del tumor primario es un factor pronóstico bien conocido en el CEC11-22. Un tamaño superior a 2cm de diámetro horizontal se ha asocia a un riesgo 3 veces mayor de recidiva local y 6 veces más alto de metástasis22. El punto de corte más específico para determinar un alto riesgo relacionado con el tamaño tumoral se ha situado en 4cm23.
Determinadas localizaciones se asocian a un peor pronóstico en el CEC3,11,13,15,16,19,24-30. Clásicamente, se han considerado de alto riesgo el pabellón auricular y el labio inferior, que duplican el riesgo de metástasis12,15, y en una revisión sistemática, la sien se asoció a un riesgo de recidiva y metástasis incluso mayor. El borde rojo del labio inferior concede un riesgo 5 veces más alto de metástasis ganglionares que la afectación de la piel de este, mientras los CEC localizados en la porción cutánea del labio tienen una tasa de afectación ganglionar similar a la de otras áreas31. El riesgo de diseminación ganglionar no es tan alto en la nariz o en el canto interno del ojo, aunque la progresión local es un problema importante en estas áreas.
La recurrencia del tumor primario se ha relacionado con un mayor riesgo de metástasis ganglionares12,13,24. El CEC recurrente parece además ser más agresivo que el CEC primario, se ha relacionado con un mayor tamaño tumoral y con un mayor riesgo de infiltración perineural y linfovascular, así como de invasión del tejido celular subcutáneo14. En esta línea también la presencia de bordes afectados en la primera extirpación se considera un factor de riesgo (recurrencia del 50%).
La evidencia clínica sugiere que la velocidad de crecimiento (VC) rápida es un importante factor de riesgo para el CEC y así se considera en las guías de la NCCN32. Un estudio antiguo ya relacionaba tumores de crecimiento rápido con un peor pronóstico33. Más recientemente, se ha observado que una VC > 4mm de diámetro mayor del tumor al mes se asocia a un peor pronóstico de la enfermedad y a un mayor riesgo de metástasis ganglionares34.
Finalmente, la asociación de síntomas neurológicos al CEC es un marcador clínico de mal pronóstico que suele estar asociado a la presencia de invasión perineural (IPN) (véase Factores pronósticos histopatológicos). Los síntomas asociados a la IPN del CEC incluyen sobre todo dolor y parestesias, aunque puede asociarse también a picor, escozor y, más rara vez, a parálisis de nervios motores32,35. El dolor además parece ser un síntoma clave en la identificación de CEC en pacientes trasplantados de órganos sólidos36.
Relacionados con el pacienteLa inmunosupresión es un factor de riesgo para el desarrollo de CEC. El CEC es especialmente frecuente en pacientes trasplantados de órganos sólidos, sobre todo en aquellos tratados mediante trasplante cardiaco, seguido del trasplante pulmonar, renal y hepático37; en pacientes con hemopatías malignas, especialmente con leucemia linfática crónica y linfoma linfocítico de célula pequeña38; en pacientes en tratamiento inmunosupresor crónico, especialmente con ciclosporina39 y azatioprina40 —sobre cuando hay exposición a radiación UV40,41— y en pacientes VIH positivos42. La incidencia acumulada de CEC se incrementa de forma progresiva con la duración de la inmunosupresión43,44 y, en general, en pacientes inmunodeprimidos, los CEC son más agresivos15,42,45-47.
Se ha demostrado un peor pronóstico en el CEC que asienta en cicatrices de largo tiempo de evolución, especialmente por quemaduras48,49, y en áreas previamente irradiadas50,51. El CEC es también más agresivo en algunas genodermatosis, especialmente en la epidermólisis ampollosa, donde es la principal causa de muerte52. El CEC es más frecuente en otras enfermedades hereditarias, como el xeroderma pigmentoso53,54, el albinismo oculocutáneo55,56, la disqueratosis congénita, el síndrome de Bloom57, el síndrome de Rothmund-Thomson58,59, el síndrome de Werner60, el síndrome KID61,62, el síndrome de Ferguson-Smith63,64, el síndrome de Muir-Torre65 y el síndrome de Lewandosky-Lutz66, entre otras. Aunque no hay información que permita afirmar que el CEC sea más agresivo en todas estas enfermedades, e incluso en algunas de ellas tiende a exhibir un razonable buen pronóstico, el elevado riesgo obliga a manejar a estos pacientes con protocolos de seguimiento estrictos67,68.
Factores pronósticos histopatológicosEl espesor se ha relacionado con el pronóstico del CEC en diversos estudios11,12,14-17,21,22,25,69-72 e incluso se ha identificado como el factor predictivo más importante para el desarrollo de metástasis16. Se ha visto que la probabilidad de metástasis es casi nula si el espesor del CEC es menor de 2mm, es de en torno al 6% en tumores de 2 a 6mm y del 16% en tumores de más de 6mm de espesor16. La determinación del espesor debe realizarse desde la capa granulosa de la piel normal adyacente al tumor hasta la última célula que infiltra23, lo cual puede plantear dificultades en la determinación del espesor de las lesiones exofíticas.
La invasión del tumor más allá de la grasa subcutánea es otro factor pronóstico al que se ha prestado atención en los últimos años10,17,18. Se ha relacionado con un riesgo 7 veces mayor de recidiva y 11 veces mayor de metástasis22. La invasión del tumor más allá de la grasa puede plantear algunas ventajas sobre la determinación del espesor. Por un lado, es útil en la cirugía de Mohs, que evalúa cortes horizontales de la pieza quirúrgica —en los que el espesor tumoral en mm no puede ser valorado—; en segundo lugar, no plantea las dificultades que presenta la determinación del espesor tumoral en lesiones exofíticas y, además, justifica el mal pronóstico de algunas lesiones que infiltran el músculo a pesar de tener un espesor moderado.
El pobre grado diferenciación se ha relacionado con un mal pronóstico del CEC en múltiples estudios11,16,17,19-22,25-27,69-79. Según las series, entre el 876 y el 25%16 de los CEC son pobremente diferenciados. Se ha asociado a un riesgo 3 veces mayor de recidiva local y 5 veces superior de metástasis22, así como a recurrencias más precoces.
La IPN está presente entre el 2,5 y el 10% de los CEC, y se asocia a otros rasgos histopatológicos de mal pronóstico14. Los estudios coinciden en reconocer su implicación pronóstica y se ha visto asociada a un riesgo 4 veces superior de recidiva y 5 veces mayor de metástasis22. Más recientemente, se ha establecido que la IPN debe considerarse de alto riesgo, cuando afecta a nervios de ≥ 0,1mm de diámetro10,17,18. Además, la IPN de nervios profundos (localizados por debajo de la dermis) y la IPN extensiva se consideran rasgos de la IPN también asociados a mal pronóstico80. Debe distinguirse entre IPN y diseminación perineural, la primera responde a la detección histológica, mientras que la segunda, por definición, es un estadio más avanzado, detectable clínica o radiológicamente y es la vía para la invasión del sistema nerviosa central por parte del CEC81.
Otros factores de riesgo histopatológicos en el CEC son la infiltración linfovascular25, el patrón de crecimiento infiltrativo82, la desmoplasia16,83,84 —definida por al menos un 30% de estroma desmoplásico asociado al tumor— y el budding85,86 —definido por la presencia de nidos de 4-5 células en el frente de invasión, aunque sin consenso claro87. Además, se han asociado a un peor pronóstico algunas variantes histopatológicas de CEC, especialmente el CEC acantolítico88,89 y el CEC adenoescamoso90, aunque series más recientes parecen haber sugerido que su relevancia pronóstica puede ser escasa91 y la existencia de un infiltrado rico en eosinófilos y células plasmáticas26, pero se necesitan más estudios que caractericen los infiltrados inflamatorios asociados al CEC y los relacionen con el pronóstico de manera fiable. Algunos marcadores, como EGFR92,93, D2-4094,95 y marcadores de transición epitelio-mesénquima96 se han asociado a un pronóstico desfavorable en el CEC. Recientemente, la expresión de PD-L197-99 se ha vinculado a un riesgo más alto metástasis ganglionares.
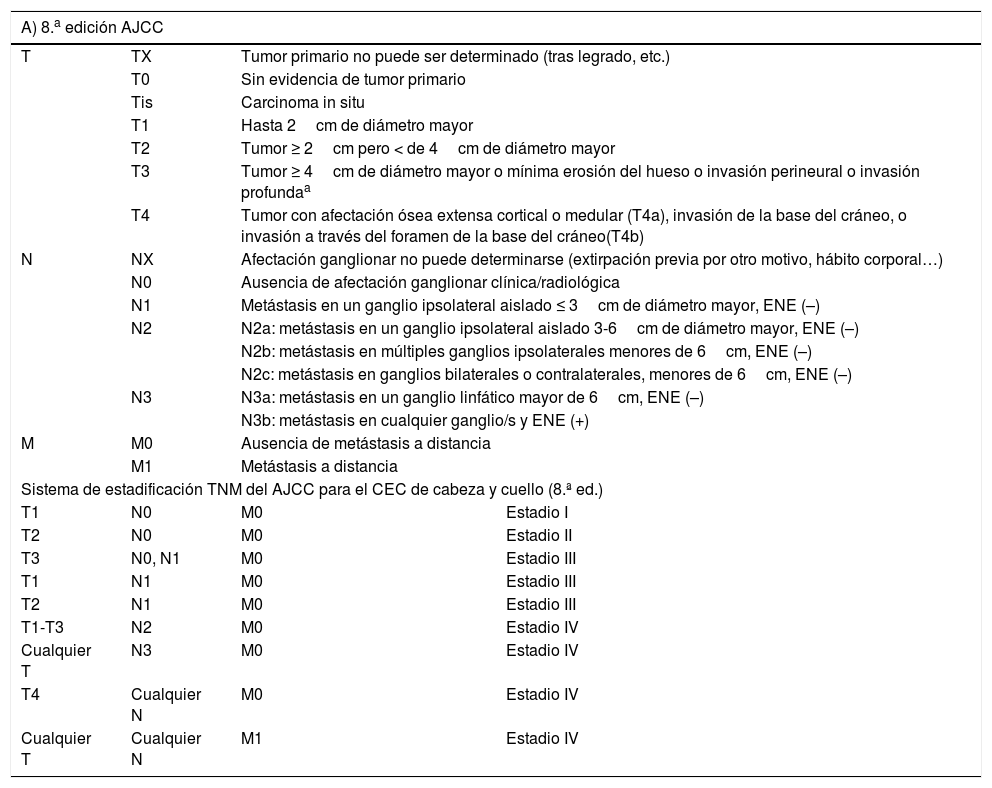
La combinación de factores de riesgo es lo que se emplea para definir los diferentes grupos de riesgo en los sistemas de estadificación. En el CEC se emplea la octava edición del sistema de estadificación del AJCC y el sistema alternativo del Brigham and Women's Hospital, cuyas características se recogen en la tabla 1.
Estadificación del carcinoma epidermoide cutáneo
| A) 8.a edición AJCC | |||
|---|---|---|---|
| T | TX | Tumor primario no puede ser determinado (tras legrado, etc.) | |
| T0 | Sin evidencia de tumor primario | ||
| Tis | Carcinoma in situ | ||
| T1 | Hasta 2cm de diámetro mayor | ||
| T2 | Tumor ≥ 2cm pero < de 4cm de diámetro mayor | ||
| T3 | Tumor ≥ 4cm de diámetro mayor o mínima erosión del hueso o invasión perineural o invasión profundaa | ||
| T4 | Tumor con afectación ósea extensa cortical o medular (T4a), invasión de la base del cráneo, o invasión a través del foramen de la base del cráneo(T4b) | ||
| N | NX | Afectación ganglionar no puede determinarse (extirpación previa por otro motivo, hábito corporal…) | |
| N0 | Ausencia de afectación ganglionar clínica/radiológica | ||
| N1 | Metástasis en un ganglio ipsolateral aislado ≤ 3cm de diámetro mayor, ENE (–) | ||
| N2 | N2a: metástasis en un ganglio ipsolateral aislado 3-6cm de diámetro mayor, ENE (–) | ||
| N2b: metástasis en múltiples ganglios ipsolaterales menores de 6cm, ENE (–) | |||
| N2c: metástasis en ganglios bilaterales o contralaterales, menores de 6cm, ENE (–) | |||
| N3 | N3a: metástasis en un ganglio linfático mayor de 6cm, ENE (–) | ||
| N3b: metástasis en cualquier ganglio/s y ENE (+) | |||
| M | M0 | Ausencia de metástasis a distancia | |
| M1 | Metástasis a distancia | ||
| Sistema de estadificación TNM del AJCC para el CEC de cabeza y cuello (8.ª ed.) | |||
| T1 | N0 | M0 | Estadio I |
| T2 | N0 | M0 | Estadio II |
| T3 | N0, N1 | M0 | Estadio III |
| T1 | N1 | M0 | Estadio III |
| T2 | N1 | M0 | Estadio III |
| T1-T3 | N2 | M0 | Estadio IV |
| Cualquier T | N3 | M0 | Estadio IV |
| T4 | Cualquier N | M0 | Estadio IV |
| Cualquier T | Cualquier N | M1 | Estadio IV |
| B) Sistema alternativo de estadificación del Brigham and Women's hospital | |
|---|---|
| T1 | 0 factores de alto riesgo |
| T2a | 1 factor de alto riesgo |
| T2b | 2-3 factores de alto riesgo |
| T3 | 4 o más factores alto de riesgo/invasión ósea |
| Factores de alto riesgo para el sistema BWH | |
| Diámetro de 2cm o más | |
| Pobre grado de diferenciación | |
| Invasión perineural de nervios ≥ 0,1mm de diámetro | |
| Invasión más allá de la grasa (excluyendo invasión ósea que clasifica un tumor como T3 directamente) | |
A) 8.a edición del AJCC: se incluye la localización en el labio inferior; se excluye el carcinoma de párpado. Se excluyen tumores de vulva, pene, región perineal y resto de localizaciones fuera de cabeza y cuello. ENE (extensión extranodal o extracapsular, definida como extensión a través de la cápsula del ganglio linfático en el tejido conectivo circundante, con o sin reacción estromal). B) Sistema alternativo del Brigham and Women's Hospital.
Invasión profunda se define como espesor mayor de 6mm o invasión más allá de la grasa subcutánea. La invasión perineural para clasificar un tumor como T3 debe ser de nervios mayores de 0,1mm, más profundos que la dermis, o afectación clínica o radiológica de afectación de nervios nominados sin afectación o invasión de la base del cráneo.
En términos prácticos, la presencia de alguno de los factores de mal pronóstico es lo que define un CEC como CECar (tabla 2). No obstante, la relevancia pronóstica de cada factor no es la misma y la combinación de varios de ellos se sabe que confiere un riesgo mayor que la presencia de cada uno de ellos por separado18,100-102. En este sentido, definir mejor el CECar pasaría por definir mejor la relevancia pronóstica de cada uno de los factores de riesgo por un lado y la de la combinación de estos, por otro. Si tenemos en cuenta el actual sistema de estadificación23 y el sistema alternativo BWH100, podría definirse como CECar aquel T3/T4 con arreglo al sistema AJCC-8 o T2b/T3 con arreglo al sistema alternativo de estadificación del BWH. No obstante, muchos tumores así estadificados no van a tener un comportamiento especialmente agresivo.
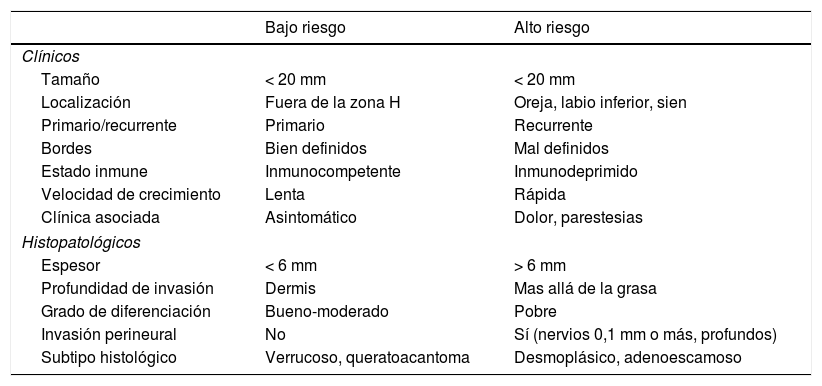
Factores pronósticos en el carcinoma escamoso cutáneo (CEC): CEC de bajo riesgo y CEC de alto riesgo
| Bajo riesgo | Alto riesgo | |
|---|---|---|
| Clínicos | ||
| Tamaño | < 20 mm | < 20 mm |
| Localización | Fuera de la zona H | Oreja, labio inferior, sien |
| Primario/recurrente | Primario | Recurrente |
| Bordes | Bien definidos | Mal definidos |
| Estado inmune | Inmunocompetente | Inmunodeprimido |
| Velocidad de crecimiento | Lenta | Rápida |
| Clínica asociada | Asintomático | Dolor, parestesias |
| Histopatológicos | ||
| Espesor | < 6 mm | > 6 mm |
| Profundidad de invasión | Dermis | Mas allá de la grasa |
| Grado de diferenciación | Bueno-moderado | Pobre |
| Invasión perineural | No | Sí (nervios 0,1 mm o más, profundos) |
| Subtipo histológico | Verrucoso, queratoacantoma | Desmoplásico, adenoescamoso |
No hay una definición homogénea de CECla, aunque todas las referencias al CECla tienen puntos en común. Se ha definido como el CEC que no es potencialmente curable o que resulta poco probable que sea curable con cirugía, radioterapia o con el tratamiento combinado (cirugía + radioterapia) tras la discusión razonada en un comité multidisciplinar103. Esta definición se ajusta a la práctica clínica y además ha sido tomada como referencia en algunos ensayos clínicos en otros tipos de CCNM, concretamente en carcinoma basocelular104.
Los criterios para considerar un CECla en el ensayo del fármaco anti-PD1 recientemente aprobado para el CEC fueron el de pacientes que no eran candidatos a la cirugía: 1) por recaída tras 2o más intervenciones y curación quirúrgica poco probable, y 2) porque el tratamiento quirúrgico podía implicar complicaciones sustanciales o deformidad105. Resulta más difícil definir de manera teórica qué pacientes con CEC pueden no ser candidatos a tratamiento convencional. Podría considerarse que aquellos casos con invasión ósea extensa a la luz de la existencia de los nuevos fármacos podrían beneficiarse de ellos. En la tabla 3 se recogen algunos escenarios clínicos que permiten clasificar un CEC como CECla.
Escenarios clínicos que permiten clasificar un CEC como CEC localmente avanzado
| Tumor que invade estructuras óseas |
| Tumor con invasión perineural clínica o radiológica |
| Tumor cuyo tamaño no hace posible una cirugía con intención curativa o la consigue solo a expensas de un resultado cosmético o funcional inaceptables |
| Tumor que invade la punta nasal en toda su extensión o tumor que requiere para su extirpación de la realización de una rinectomía |
| Tumor que invade cavidades corporales (craneal, torácica o abdominopélvica) o tiene alto riesgo de invadirlas |
| Tumor que afecta a la oreja y requiere auriculectomía |
| Tumor de cabeza y cuello con extensión directa a los senos paranasales |
| Tumor con metástasis en tránsito |
| Recurrencia profunda en una zona previamente sometida a extirpación de CEC suprayacente |
| Tumor que afecta al párpado o canto interno y amenaza con invasión orbitaria |
El CECm se define como aquel CEC que ha abandonado su localización primaria en la piel. En la mayoría de los casos, el CECm afecta a ganglios linfáticos o a la glándula parótida y en menor medida a otros órganos. La afectación en tránsito en la piel por CEC, definida como la presencia de focos de tumor diferenciados del CEC primario y antes que el primer escalón de drenaje linfático106, podría considerarse una forma de CECm locorregional, tal como se tiene en cuenta para el melanoma, aunque no modifica la estadificación de la categoría N en el CEC107.
Se ha estimado que en torno a un 5% de los CEC pueden dar lugar a metástasis108, aunque hasta ahora no han existido registros exhaustivos que hayan permitido una estimación real. En 2013, en Inglaterra, se incluyeron en los registros automatizados el CEC y el CECm, lo que ha permitido en un estudio reciente ofrecer datos al respecto con una base poblacional por primera vez109. Durante 15,5 meses de seguimiento, el 2,1% de los pacientes con CEC tenían un CECm109, aunque los autores consideran que la tasa podría estar infraestimada por cuanto la ICD-10 no contempla códigos específicos para el CECm. De esos CECm, más del 90% se desarrollaron en los 3 años posteriores al diagnóstico109.
Carcinoma epidermoide cutáneo avanzado y carcinoma escamoso agresivoDe manera práctica, se han empleado en la literatura también los términos de CECav y CECag para hacer referencia a situaciones clínicas más generales. Así, el térmico CECav se ha empleado para agrupar el CECla y el CECm105. Por otra parte, el término de CECag se ha utilizado para hacer referencia al CECm y al CEC que da lugar a muerte por progresión local45. Los términos avanzado y agresivo, no obstante, pueden resultar poco específicos y, por tanto, cuando se empleen es oportuno definir convenientemente a qué contexto clínico hacen referencia. En este sentido, existirían los siguientes términos relacionados con el mal pronóstico en el CEC: CECar, CECla, CECm, CECav y CECag (tabla 4).
Definiciones de CEC de mal pronóstico en práctica clínica
| Definiciones del CEC en práctica clínica | |
|---|---|
| CECar | CEC que presenta alguno de los factores de alto riesgo |
| CECla | CEC que no es potencialmente curable con los tratamientos convencionales (cirugía, radioterapia o combinación de ambos) tras una discusión razonada en un comité multidisciplinarCEC en el que la cirugía supondría secuelas funcionales o cosméticas inaceptables |
| CECm | CEC que ha abandonado su localización primaria en la piel |
| CECav | CECla o CECm |
| CECag | CECla o CECm que da lugar a muerte por progresión local |
CEC: carcinoma epidermoide cutáneo; CECar: CEC de alto riesgo; CECag: CEC agresivo; CECav: CEC avanzado; CECla: CEC localmente avanzado; CECm: CEC metastásico.
La cirugía convencional es el tratamiento de elección en la mayoría de los casos de CEC, con diferencias en el margen en función de que el tumor sea CEC de bajo riesgo (CECbr) (4mm) o CECar (10mm)110. La cirugía de Mohs se reserva para casos recurrentes y para localizaciones de alto riesgo en las que los márgenes de seguridad puedan dar lugar a un compromiso funcional significativo o cosméticamente inaceptable. La radioterapia adyuvante de tumor primario se reserva para casos con IPN, especialmente de clínica, radiológica, extensiva, de nervios de 0,1mm o más, o de nervios profundos, y para casos con márgenes positivos que no puedan ser reintervenidos con la seguridad de dejar al paciente libre de tumor80. En pacientes inoperables, la radioterapia electiva y tratamientos tanto destructivos como intralesionales pueden ser una opción32,110. La utilidad de la biopsia selectiva del ganglio centinela está aún por determinar, aunque es posible que pueda tener utilidad determinados grupos de pacientes111.
El manejo del CECla es complejo. En general, el abordaje quirúrgico no es suficiente o resulta inapropiado por las repercusiones cosméticas o funcionales. Con la existencia de los nuevos fármacos anti-PD1 y la aprobación del cemiplimab en el tratamiento del CECla105, esta sería la opción preferida siempre que el paciente tenga un adecuado performance status (PS) —situación clínica basal. Si la opción sistémica no es posible por las circunstancias del paciente, el tratamiento paliativo es una opción para considerar. Está por definir la utilidad del tratamiento sistémico para reducir la masa tumoral y permitir el tratamiento quirúrgico con menores secuelas para el paciente (neoadyuvancia).
En el caso de CECm se recomienda la cirugía, siempre que sea posible, seguida de radioterapia complementaria80,112,113. En los casos no operables, si el paciente tiene un buen PS el tratamiento sistémico, actualmente con anti-PD1 es la opción preferida. A pesar de la edad, una proporción significativa de paciente con CECav tienen una situación clínica que permite el tratamiento sistémico103. Cemiplimab es el único fármaco aprobado para el tratamiento del CECm y del CECla105. En casos con mal PS y en pacientes inoperables que no sean susceptibles de tratamiento sistémico o que no respondan, el tratamiento paliativo es una opción que debe considerarse. Dado que el CECm y el CECla presentan un manejo razonablemente parecido, el término CECav puede emplearse para hacer referencia a dichos escenarios clínicos.
ConclusiónEn el momento actual, no existe una definición consensuada de CECla y, a la luz del advenimiento de los nuevos fármacos, parece necesaria. El grupo de trabajo ha considerado que el CECla podría considerarse aquel que no es potencialmente curable con los tratamientos convencionales (cirugía, radioterapia o combinación de ambas) tras una discusión razonada en un comité multidisciplinar o aquel CEC en el que la cirugía supondría secuelas funcionales o cosméticas inaceptables. El CECm sería aquel que ha abandonado su localización primaria en la piel. El CECav agruparía los casos de CECla y CECm, y tanto los casos de CECm como los del CECla que dan lugar a la muerte por progresión local (lo que podría considerarse el CEC que da lugar a eventos mayores) pueden referirse como CECag. El CECar sería aquel CEC que presenta alguno de los factores clínicos o histopatológicos de alto riesgo, aunque posiblemente esta sea una definición demasiado amplia dado que agrupa a tumores que muy probablemente no darán lugar a eventos desfavorables, por lo que será necesaria una mejor estratificación de estos casos en el futuro.
FinanciaciónJ.C. está parcialmente financiado por los proyectos: PI18/000587 (Instituto de Salud Carlos III cofinanciado con fondos FEDER) y GRS 1835/A/18 (Gerencia Regional de Salud de Castilla y León).
Conflicto de interesesLos autores han recibido honorarios como miembros de un Advisory Board para Sanofi.