En dermatología pediátrica, la correcta elección de la dosis de principio activo, así como del excipiente, se vuelve fundamental para conseguir los resultados terapéuticos deseados, por lo que se deben tener en cuenta aspectos tan variados como las características de la lesión, las del paciente y las del medicamento seleccionado. En la población pediátrica se plantean dificultades añadidas, tales como la limitada variedad de especialidades comerciales que se ajusten a sus particularidades. Por ello, la formulación magistral o formulación de medicamentos individualizados supone una buena alternativa terapéutica que permite emplear principios activos en los rangos terapéuticos aceptados, vehiculizados en las formas farmacéuticas idóneas, asociar varios en un mismo medicamento e incluso adaptar el vehículo al estado de la lesión, así como a las necesidades intrínsecas del paciente. Las formulaciones recogidas en este artículo, se basan en una amplia experiencia clínica y permiten a los médicos prescriptores adaptar el tratamiento de forma personalizada.
The administration of appropriate doses of active ingredients and excipients is crucial for achieving desired treatment outcomes in pediatric dermatology. A number of factors need to be considered, including the characteristics of the lesion, the patient, and the drug. An additional challenge in pediatric settings is the limited number of commercially available formulations suitable for use in children. Drug compounding, which is the preparation of medications tailored to the needs of individual patients, is a good alternative for pediatric populations for a number of reasons. Using a customized compound, the clinician can prescribe formulations that contain the optimal dose of the active ingredients within acceptable limits and the most suitable vehicle and formulation components. Compounding can also be used to combine several active ingredients in a single medication and even adapt the vehicle to the characteristics of the lesion and the needs of the patient. The pharmaceutical formulations described in this review are based on extensive clinical experience and can be customized to meet individual needs.
La piel de los lactantes y de los niños se caracteriza por ser más suave y blanda que la de los adultos. En los lactantes el estrato córneo es más delgado y la pérdida transepidérmica de agua es mayor que en los niños de 5años o en los adultos. El factor natural de hidratación y la producción de lípidos de la piel son menores que en los niños de 5años que son más similares a los de los adultos1.
Dadas estas diferencias del desarrollo, la piel en los niños es más susceptible de irritarse o inflamarse ante determinadas agresiones que la de los adultos. La pérdida transepidérmica de agua (TEWL) medida en la mejilla es mayor en niños de 1año de edad comparado con los de 5años o con los adultos2.
De esta forma, los niños pequeños, especialmente los lactantes, pueden absorber a través de la piel una mayor cantidad de las sustancias que se les aplican tópicas que los adultos, y por otro lado tienen menor capacidad de metabolizar y excretar cualquier sustancia3.
Esto hace que los niños tengan un mayor riesgo de sufrir efectos adversos y toxicidades por los fármacos tópicos que los adultos. Además, los niños tienen un mayor riesgo de toxicidad sistémica de los medicamentos aplicados tópicos dado su mayor ratio entre área de superficie corporal y peso. De esta forma, una ante la aplicación de una misma cantidad la concentración sistémica alcanzada (mg/kg) será mayo en los niños que en los adultos4.
Según la Organización Mundial de la Salud (OMS), más de la mitad de los niños en países desarrollados reciben medicamentos cuyas dosis están preparadas para adultos y no cuentan con autorización para ser usados en menores5.
Existe una importante escasez de especialidades farmacéuticas dirigidas al tratamiento de patologías dermatológicas en pediatría. Se estima que un elevado porcentaje de los medicamentos que se usan en estos casos están indicados únicamente para la población adulta.
Esto significa que se emplean en gran medida preparados farmacéuticos que no cuentan con información suficiente sobre su uso en niños, lo que evidencia la necesidad de recurrir a la formulación como una herramienta terapéutica de primer nivel para alcanzar criterios de seguridad y de eficacia óptimos.
A continuación se proponen algunas formulaciones para las dermatosis pediátricas más frecuentes o para las que no existe alternativa terapéutica comercializada. Dichas fórmulas se presentan con la concentración más habitual, indicando los rangos de dosis en dos franjas de edad (de 0 a 2años y de 3 a 12años) y especificando los vehículos idóneos para cada una de ellas.
Se debe advertir que el principal problema del tratamiento tópico con ácido salicílico es la posibilidad de absorción percutánea, produciendo intoxicación salicílica con síntomas de quemazón en mucosa bucal, cefalea frontal, acidosis metabólica, síntomas del SNC, tinnitus, náuseas y vómitos. El riesgo es mayor en el tratamiento de grandes áreas de superficie corporal y en los niños. Por ello no debe usarse en más del 10% de la superficie corporal en niños. En general, los casos de intoxicación por salicilatos aplicados de forma tópica han sido en niños menores de 3años6.
Dermatitis atópicaLas formulaciones propuestas para el tratamiento de esta patología se clasifican según la fase en la cual se encuentre la lesión, de este modo se adecúa la vehiculización de los principios activos a las características del área a tratar. El tratamiento tópico sigue siendo un pilar básico en el abordaje de la dermatitis atópica.
Fase agudaSe busca controlar la exudación de las lesiones agudas empleando principios activos antimicrobianos y astringentes, como el sulfato de cobre, el permanganato potásico o la eosina (tabla 1)7.
Fórmulas propuestas para el tratamiento de la dermatitis atópica en niños
| Fase aguda13-15 | ||
|---|---|---|
| Rango de concentración por edad | ||
| Composición | 2 meses-2 años | 3-12 años |
| Fórmula 1 (vía tópica) | ||
| Sulfato de cobre 0,1% | 0,1-1% | 0,1-1% |
| Agua destilada csp 100 ml | ||
| Fórmula 216(vía tópica) | ||
| Permanganato potásico 0,01% | 0,001-0,01% | 0,001-0,1% |
| Agua destilada csp 100 ml | ||
| Fórmula 3 (vía tópica) | ||
| Fusidato sódico 2% | 2% | 2% |
| Agua destilada csp 100 ml | ||
| Fórmula 4 (vía tópica) | ||
| Eosina 1% | 0,5-2% | 0,5-2% |
| Agua destilada csp 100 ml | ||
| Vehículo idóneo | ||
| Soluciones tópicas que favorecen el paso de exudados y evitan la maceración de las lesiones. Además, permiten la solubilización de los activos con el menor número de excipientes | ||
| Fase subaguda13,14 | ||
|---|---|---|
| Rango de concentración por edad | ||
| Composición | 2 meses-2 años | 3-12 años |
| Fórmula 1 (vía tópica) | ||
| Hidrocortisona 1% | 0,5-2,5% | 0,5-2,5% |
| Gentamicina 0,1% | 0,05-0,1% | 0,05-0,1% |
| Extracto de avena 5% | 5% | 5% |
| Aloe vera 5% | 5-10% | 5-10% |
| Emulsión O/W csp 100 g | ||
| Fórmula 2 (vía tópica) | ||
| Prednicarbato 0,1% | Noa | 0,1-0,25% |
| Fusidato sódico 2% | 2% | 2% |
| Extracto de centella asiática 1% | 1% | 1% |
| Alantoína 1% | 1-2% | 1-2% |
| Loción O/W csp 200 g | ||
| Existe evidencia sobre la eficacia de uso de prednicarbato al 0,1% en pacientes a partir de 4 meses durante 3 semanas de tratamiento17 | ||
| Fórmula 3 (vía tópica) | ||
| Betametasona valerato 0,05% | Noa | 0,01-0,2%No facial/No pliegues |
| Ictiol 1% | No recomendado | 0,5-2% |
| Pasta al agua csp 100 g | ||
| Vehículo idóneo | ||
| Cierto contenido graso. Considerando el estado de la lesión, se sugieren formulaciones en emulsión O/W, loción O/W y pasta al agua (ordenadas de mayor a menor porcentaje de fase grasa), en función del grado de oclusión deseado | ||
| Fase crónica13-15 | ||
|---|---|---|
| Rango de concentración por edad | ||
| Composición | 2 meses-2 años | 3-12 años |
| Fórmula 1 (vía tópica) | ||
| Triamcinolona acetónido 0,05% | No | 0,025-0,1%bNo facial/no pliegues |
| Urea 10% | 10-20% | 10-20% |
| Lanolina 5% | 5-10% | 5-10% |
| Emulsión O/W csp 100 g | ||
| Fórmula 2 (vía tópica) | ||
| Prednicarbato 0,1% | Noc | 0,1-0,25% |
| Ácido salicílico 5% | No | Máx 10% |
| Urea 10% | 10-20% | 10-20% |
| Tacrolimus 0,03% | Nod | 0,03% |
| Alantoína 1% | 1-2% | 1-2% |
| Aceite de rosa mosqueta 5% | 5-20% | 5-20% |
| Ungüento hidrófilo csp 100 g | ||
| Vehículo idóneo | ||
| Grado de oclusividad mayor, como la vaselina o el ungüento. No obstante, se ofrecen varias alternativas para que el médico prescriptor valore cuál es la más adecuada para el paciente. Todas ellas permiten una mayor hidratación y regeneración de la lesión ya que en esta fase hay liquenificación y un alto grado de xerosis. | ||
Existe evidencia sobre la eficacia de uso de prednicarbato al 0,1% en pacientes a partir de 4 meses durante 3 semanas de tratamiento17.
Se debe controlar la inflamación, el prurito, así como la posible sobreinfección de las lesiones. Se usarán corticoides de diferentes potencias (hidrocortisona, prednicarbato y betametasona de menor a mayor) para la inflamación y el prurito8. Otras sustancias antiinflamatorias, como el aloe vera, el extracto de avena o la alantoína, se emplean por sus propiedades antiinflamatorias, reepitelizantes y calmantes9,10.
La adición de breas suaves, como el ictiol, tiene la capacidad de reducir la reactividad de la piel, disminuyendo así la sensación de prurito, eritema e inflamación. Siempre habrá que considerar que el empleo de breas de hulla se ha asociado al aumento de riesgo de cáncer; solo debe utilizarse durante un tiempo breve y en pequeñas superficies, y es preferible reservarlo para niños mayores.
Las guías actuales no recomiendan el empleo de productos tópicos que combinen antibióticos con corticoides11. De forma excepcional se podrán combinar antibióticos (gentamicina, fusidato sódico) con corticoides tópicos para el tratamiento de placas concretas de eccema con infección confirmada en aras de evitar el uso de un antibiótico sistémico y favorecer la adherencia al tratamiento (solo 2 aplicaciones tópicas al día en lugar de 3 o 4) (tabla 1)12.
Fase crónicaA la inflamación se une la liquenificación de las lesiones en la fase crónica. Además de los principios activos clásicos antiinflamatorios, como los corticoides y los inhibidores de la calcineurina, se pueden usar como coadyuvantes la alantoína o el aceite de rosa mosqueta por sus propiedades antiinflamatorias, calmantes y antioxidantes9. La urea y el ácido salicílico ayudarán a controlar las lesiones liquenificadas. Siempre se deberá tener en cuenta que la aplicación de ácido salicílico se llevará a cabo con precaución, ya que puede provocar acidosis metabólica; por ello está desaconsejado en menores de 2años y su uso debe limitarse en cuanto a la extensión de la zona a tratar (<10% de la superficie cutánea) y la duración del tratamiento (tabla 1).
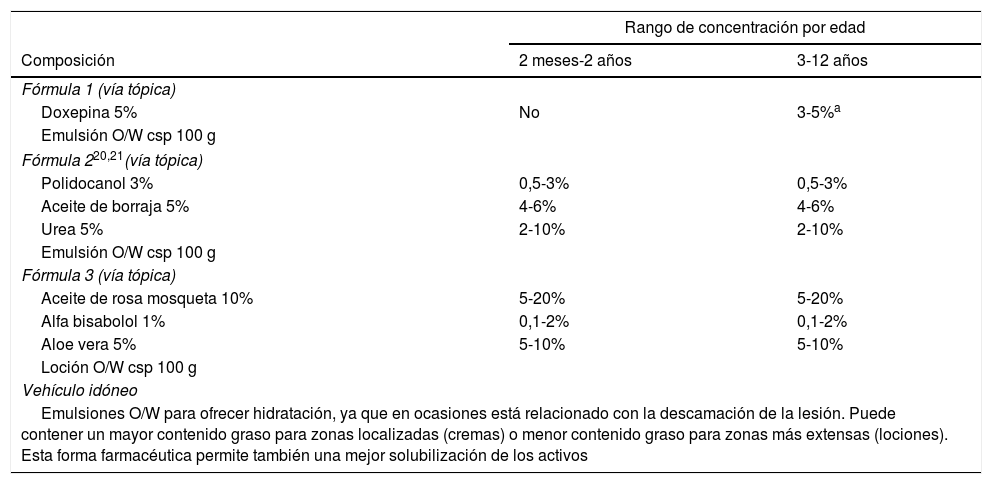
PruritoLas formulaciones propuestas en esta sección van principalmente dirigidas a aliviar el prurito intenso que afecta a la calidad de vida del paciente. Son de elección los principios activos antiinflamatorios y analgésicos, y para casos más graves se propone el uso de anestésicos locales (tabla 2).
Fórmulas propuestas para el manejo del prurito en niños13,14
| Rango de concentración por edad | ||
|---|---|---|
| Composición | 2 meses-2 años | 3-12 años |
| Fórmula 1 (vía tópica) | ||
| Doxepina 5% | No | 3-5%a |
| Emulsión O/W csp 100 g | ||
| Fórmula 220,21(vía tópica) | ||
| Polidocanol 3% | 0,5-3% | 0,5-3% |
| Aceite de borraja 5% | 4-6% | 4-6% |
| Urea 5% | 2-10% | 2-10% |
| Emulsión O/W csp 100 g | ||
| Fórmula 3 (vía tópica) | ||
| Aceite de rosa mosqueta 10% | 5-20% | 5-20% |
| Alfa bisabolol 1% | 0,1-2% | 0,1-2% |
| Aloe vera 5% | 5-10% | 5-10% |
| Loción O/W csp 100 g | ||
| Vehículo idóneo | ||
| Emulsiones O/W para ofrecer hidratación, ya que en ocasiones está relacionado con la descamación de la lesión. Puede contener un mayor contenido graso para zonas localizadas (cremas) o menor contenido graso para zonas más extensas (lociones). Esta forma farmacéutica permite también una mejor solubilización de los activos | ||
Se ha evitado la propuesta de anestésicos locales ya que pueden provocar metaglobinemia en niños: deben emplearse en poca cantidad y evitarlos en la medida de lo posible19.
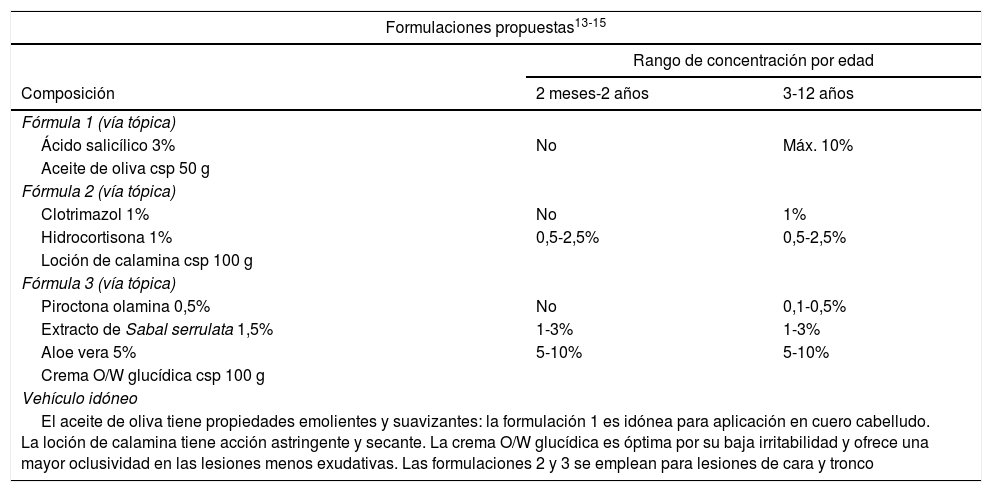
Dermatitis seborreicaEl tratamiento tópico sigue siendo un pilar básico en el tratamiento de la dermatitis seborreica.
El objetivo de las formulaciones propuestas es la eliminación de las escamas de las lesiones utilizando un agente queratolítico (ácido salicílico), antifúngicos (clotrimazol o piroctona olamina) y antiinflamatorios (hidrocortisona, aloe vera)22.
El extracto de Sabal serrulata es un activo antiseborreico que actúa directamente sobre los mecanismos productores de sebo; de ahí su utilidad terapéutica en este caso23.
Como se ha advertido con anterioridad, siempre se deberá tener en cuenta que la aplicación de ácido salicílico se llevará a cabo con precaución, ya que puede provocar acidosis metabólica; está desaconsejado en menores de 2años y debe limitarse a la extensión de la zona a tratar (<10%) y la duración del tratamiento en niños mayores.
Todo ello en un vehículo hidratante y con poder oclusivo que favorezca la regeneración de la barrera protectora de la piel y controle el sobrecrecimiento de Malassezia spp. (tabla 3).
Fórmulas propuestas para el tratamiento de la dermatitis seborreica en niños
| Formulaciones propuestas13-15 | ||
|---|---|---|
| Rango de concentración por edad | ||
| Composición | 2 meses-2 años | 3-12 años |
| Fórmula 1 (vía tópica) | ||
| Ácido salicílico 3% | No | Máx. 10% |
| Aceite de oliva csp 50 g | ||
| Fórmula 2 (vía tópica) | ||
| Clotrimazol 1% | No | 1% |
| Hidrocortisona 1% | 0,5-2,5% | 0,5-2,5% |
| Loción de calamina csp 100 g | ||
| Fórmula 3 (vía tópica) | ||
| Piroctona olamina 0,5% | No | 0,1-0,5% |
| Extracto de Sabal serrulata 1,5% | 1-3% | 1-3% |
| Aloe vera 5% | 5-10% | 5-10% |
| Crema O/W glucídica csp 100 g | ||
| Vehículo idóneo | ||
| El aceite de oliva tiene propiedades emolientes y suavizantes: la formulación 1 es idónea para aplicación en cuero cabelludo. La loción de calamina tiene acción astringente y secante. La crema O/W glucídica es óptima por su baja irritabilidad y ofrece una mayor oclusividad en las lesiones menos exudativas. Las formulaciones 2 y 3 se emplean para lesiones de cara y tronco | ||
El tratamiento de la tiña de cuero cabelludo debe ser siempre sistémico. El antifúngico griseofulvina sigue siendo de elección, especialmente en las tiñas causadas por el género Microsporum (tabla 4)24. La dosis adecuada de griseofulvina es de 25mg/kg/día25.
Fórmulas propuestas para el tratamiento de la tiña de cuero cabelludo13,14
| Rango de concentración por edad | ||
|---|---|---|
| Composición | 2 meses- 2 años | 3-12 años |
| Fórmula 1 (vía oral)a | ||
| Griseofulvina | 25 mg/kg/día | |
| Jarabe csp 200 ml | ||
| Administrar con comidas grasas | ||
| Vehículo idóneo | ||
| La griseofulvina no es soluble en agua, por lo que el jarabe es el vehículo de administración oral idóneo para suspender el activo. Además, tiene buena aceptación en pediatría debido a que su sabor azucarado enmascara las posibles características desagradables de la formulación | ||
En la tabla 5 se proponen combinaciones para el tratamiento de la pediculosis, las cuales incluyen principios activos con propiedades insecticidas y antiparasitarias aplicados por vía tópica con el objetivo de conseguir la eliminación de los piojos. En el caso de pediculosis resistentes a los tratamientos tópicos se puede recurrir a la ivermectina oral (formulaciones 4 y 5)28 y de aplicación tópica (formulación 6).
Fórmulas propuestas para el tratamiento de la pediculosis en niños13,14,29
| Rango de concentración por edad | ||
|---|---|---|
| Composición | 2 meses-2 años | 3-12 años |
| Fórmula 1 (vía tópica) | ||
| Permetrina 1% | 1-2% | 1-2% |
| Crema lavable cuero cabelludo csp 50 g | ||
| Se emplea en niños a partir de 2 meses30 | ||
| Fórmula 2 (vía tópica) | ||
| Fenotrina 0,6% | 0,2-1% | 0,2-1% |
| Butóxido de piperonilo 2,4% | Máx. 5% | Máx. 5% |
| Solución HA csp 100 ml | ||
| Se emplea en niños a partir de 2 meses en los mismos rangos de concentración | ||
| Fórmula 3: Tratamiento de Phthiriasis palpebrarum | ||
| Permetrina 5% | 5% | 5% |
| Pomada oftálmica | ||
| Debe aplicarse sobre la base de las pestañas y dejar que actúe durante al menos 8 h. Generalmente suele ser suficiente con una sola aplicación. Mejor aplicación nocturna para evitar que pueda entrar en los ojos | ||
| Fórmula 4 (vía oral) | ||
| Ivermectina 200 μg/kg | Noa | 200 μg/kga |
| Para 1 cápsula, número 2 | ||
| Fórmula 5 (vía oral) | ||
| Ivermectina 0,8% | Noa | 0,8% |
| Vehículo para suspensión infantil csp 30 ml | ||
| Fórmula 6 (vía tópica) | ||
| Ivermectina 0,5% | Noa | 0,5% |
| Emulsión fluida csp 100 ml | ||
| Vehículo idóneo | ||
| Cremas lavables con propiedades hidratantes y oclusivas debido a su mayor porcentaje de fase grasa, o en soluciones hidroalcohólicas, por su cosmeticidad y su facilidad de aplicación. Especial atención al contenido alcohólico de las soluciones por ser potencialmente irritantes, sobre todo en pacientes de 2 meses a 2 años. Ambos permiten incluir principios activos insolubles en agua. En la formulación 3 la pomada oftálmica debe elaborarse en condiciones de esterilidad. La formulación para administración oral está indicada para casos de resistencia donde las características del paciente lo permitan. En la formulación 5 se elabora una suspensión a base de jarabe simple y carboximetilcelulosa28 | ||
Mayores de 5 años o > 15 kg de peso. No obstante, se ha demostrado que su uso como fuera de indicación en menores de 15 kg ha demostrado efectividad y seguridad, presentado efectos adversos leves en un grupo pequeño de pacientes31. Se debe tener en cuenta que los menores de 6 años se entiende que son incapaces de deglutir comprimidos28.
La ivermectina puede ser elaborada como cápsulas para pacientes jóvenes que puedan ingerir las mismas, pero también en suspensión oral al 0,8%, que permite una cómoda dosificación de gota por kilo de peso y que facilita su uso para población infantil28.
La formulación para administración oral está indicada únicamente para casos de resistencias.
La actividad de estos principios activos consiste en su acción sobre las membranas de las células nerviosas del parásito, provocando su parálisis y posteriormente la muerte. Estas formulaciones permiten un ajuste de dosis en función de la edad del paciente y constituyen una alternativa muy interesante a los tratamientos convencionales comercializados.
También se incluye una fórmula (formulación 3) para el tratamiento de la pediculosis corporis de niños en pestañas, cuyo tratamiento solo tiene la alternativa de la formulación.
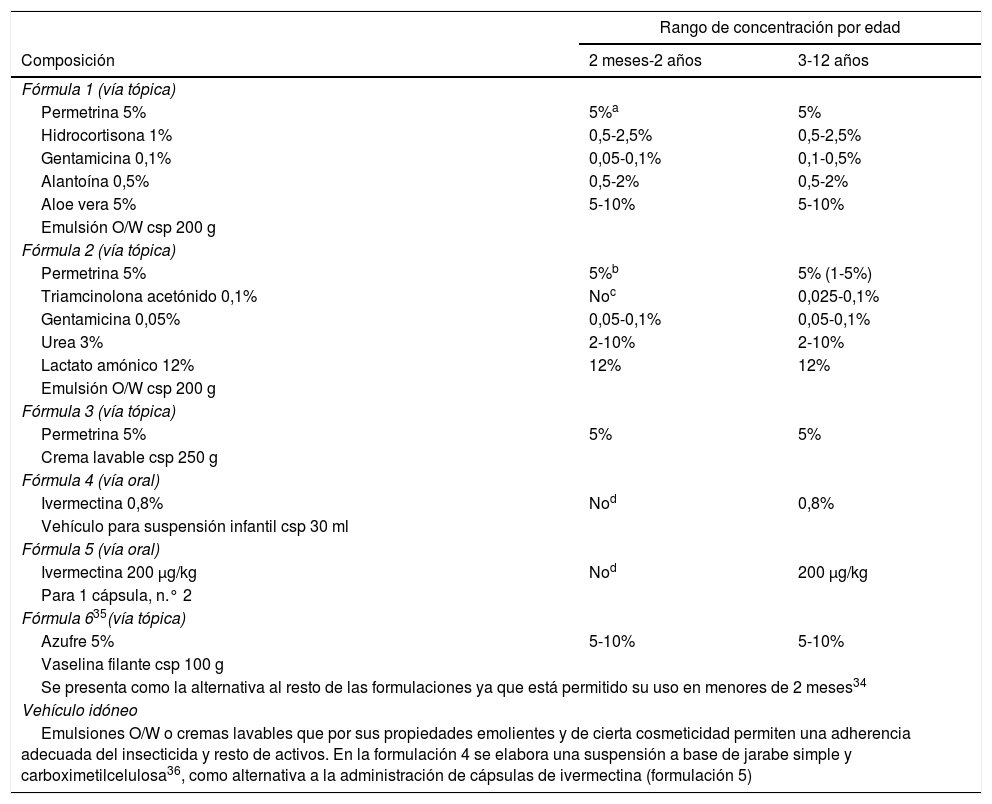
EscabiosisPrincipios activos con propiedades insecticidas y antiparasitarias aplicados por vía tópica cuyo objetivo es la rápida eliminación de la infestación producida por el ácaro en casos refractarios32. En la mayoría de las ocasiones los pacientes presentan lesiones eccematosas secundarias al rascado y a la irritación producida por los acaricidas. En la tabla 6 se proponen algunas combinaciones que pueden resultar de interés en el manejo de estos casos33.
Fórmulas propuestas para el tratamiento de la escabiosis13-15
| Rango de concentración por edad | ||
|---|---|---|
| Composición | 2 meses-2 años | 3-12 años |
| Fórmula 1 (vía tópica) | ||
| Permetrina 5% | 5%a | 5% |
| Hidrocortisona 1% | 0,5-2,5% | 0,5-2,5% |
| Gentamicina 0,1% | 0,05-0,1% | 0,1-0,5% |
| Alantoína 0,5% | 0,5-2% | 0,5-2% |
| Aloe vera 5% | 5-10% | 5-10% |
| Emulsión O/W csp 200 g | ||
| Fórmula 2 (vía tópica) | ||
| Permetrina 5% | 5%b | 5% (1-5%) |
| Triamcinolona acetónido 0,1% | Noc | 0,025-0,1% |
| Gentamicina 0,05% | 0,05-0,1% | 0,05-0,1% |
| Urea 3% | 2-10% | 2-10% |
| Lactato amónico 12% | 12% | 12% |
| Emulsión O/W csp 200 g | ||
| Fórmula 3 (vía tópica) | ||
| Permetrina 5% | 5% | 5% |
| Crema lavable csp 250 g | ||
| Fórmula 4 (vía oral) | ||
| Ivermectina 0,8% | Nod | 0,8% |
| Vehículo para suspensión infantil csp 30 ml | ||
| Fórmula 5 (vía oral) | ||
| Ivermectina 200 μg/kg | Nod | 200 μg/kg |
| Para 1 cápsula, n.° 2 | ||
| Fórmula 635(vía tópica) | ||
| Azufre 5% | 5-10% | 5-10% |
| Vaselina filante csp 100 g | ||
| Se presenta como la alternativa al resto de las formulaciones ya que está permitido su uso en menores de 2 meses34 | ||
| Vehículo idóneo | ||
| Emulsiones O/W o cremas lavables que por sus propiedades emolientes y de cierta cosmeticidad permiten una adherencia adecuada del insecticida y resto de activos. En la formulación 4 se elabora una suspensión a base de jarabe simple y carboximetilcelulosa36, como alternativa a la administración de cápsulas de ivermectina (formulación 5) | ||
Se emplea en niños a partir de 2 meses; como alternativa para esta edad se propone la formulación 6 de este apartado26.
Mayores de 5 años o > 15 kg de peso. No obstante, se ha demostrado que su uso como fuera de indicación en menores de 15 kg ha demostrado efectividad y seguridad, presentado efectos adversos leves en un grupo pequeño de pacientes31. Se debe tener en cuenta que los menores de 6 años se entiende que son incapaces de deglutir comprimidos20.
La ivermectina puede ser elaborada como cápsulas para pacientes jóvenes que puedan ingerir las mismas, pero también en suspensión oral al 0,8%, que permite una cómoda dosificación de gota por kilo de peso y que facilita su uso para población infantil28.
La formulación para administración oral está indicada únicamente para casos de resistencias.
Las formulaciones para tratar las verrugas varían en función del tipo y del número de ellas, así como de su localización, de su tamaño y de la edad del paciente36. Existen numerosas alternativas en el tratamiento de las verrugas mediante formulaciones con un único principio activo o en combinación (tabla 7). El principal objetivo del tratamiento consiste en la destrucción y reducción de la proliferación del epitelio infectado37.
Fórmulas propuestas para el tratamiento de las verrugas en niños
| Verrugas palmo-plantares13–15 | ||
|---|---|---|
| Rango de concentración por edad | ||
| Composición | 2 meses-2 años | 3-12 años |
| Formula 1 (vía tópica) | ||
| Ácido salicílico 10% | No | Máx. 10% |
| Ácido láctico 15% | Máx. 15% | Máx. 20% |
| Eosina 0,1%a | 0,1-0,2% | 0,1-0,2% |
| Colodión csp 30 g | b | |
| Fórmula 2 (vía tópica) | ||
| Ácido salicílico 5% | No | Máx. 20% |
| Vaselina csp 30 g | ||
| Fórmula 3 (vía tópica) | ||
| Formaldehído 0,7%c | 0,7% | 0,7% |
| Gel csp 30 ml | ||
| Vehículo idóneo | ||
| Los vehículos deben permitir que los principios activos permanezcan el mayor tiempo posible en contacto con la lesión. La formulación 3 se plantea como solución acuosa por la solubilidad del activo | ||
| Verrugas planas | ||
|---|---|---|
| Composición | Rango de concentración por edad | |
| 2 meses-2 años | 3-12 años | |
| Fórmula 1 (vía tópica) | ||
| Ácido retinoico 0,02% | 0,02-0,05%d | 0,02-0,05%d |
| Ácido salicílico 3% | No | Máx. 10%e |
| Hidrocortisona 1% | 0,5-2,5% | 0,5-2,5% |
| Crema O/W csp 50 g | ||
| Vehículo idóneo | ||
| Vehículo idóneo con contenido graso medio (en torno 20-30%) vehiculizar los principios activos en crema base Beeler por su naturaleza O/W, pues se emplea mayoritariamente a nivel facial y en la parte anterior de las piernas | ||
| Verrugas vulgares | ||
|---|---|---|
| Rango de concentración por edad | ||
| Composición | 2 meses-2 años | 3-12 años |
| Fórmula 1 (vía tópica) | ||
| Ácido salicílico 8% | No | Max. 10% |
| Ácido láctico 8% | Máx. 15% | Máx. 20% |
| Eosina 0,1% | 0,1-0,2% | 0,1-0,2% |
| Colodión csp 30 g | f | |
| Fórmula 2 (vía tópica) | ||
| Ácido salicílico 5% | No | Máx. 10% |
| Vaselina filante csp 30 g | ||
| Vehículo idóneo | ||
| El colodión permite la disolución de los componentes en un vehículo líquido que, al solidificarse, genere permanencia prolongada del medicamento. La vaselina garantiza una buena adhesión al área de la lesión | ||
El tratamiento del molusco contagioso debe individualizarse en función del número de lesiones, del tamaño y de la localización (tabla 8). En ocasiones las formulaciones con irritantes y vesicantes pueden tener utilidad para ablandar las lesiones para posteriormente eliminarlas mediante extracción física (curetaje).
Fórmulas propuestas para el tratamiento del molusco contagioso en niños
| Formulaciones propuestas | ||
|---|---|---|
| Rango de concentración por edad | ||
| Composición | 2 meses-2 años | 3-12 años |
| Fórmula 1 (vía tópica) | ||
| Cantaridina 0,7% | Noa | 0,7-1% |
| Ácido salicílico 5% | No | Máx. 10% |
| Verde brillante 0,003% | 0,003% | 0,003% |
| Colodión csp 3 ml | b | |
| Vehículo idóneo | ||
| El colodión permite que los principios activos permanezcan el mayor tiempo posible en contacto con la lesión. Se recomienda de aplicación en consulta | ||
Las fórmulas propuestas se basan en el uso de cantaridina, un activo de gran utilidad en esta patología y con el que se debe tener especial precaución debido a su elevado poder vesicante; tanto es así, que se recomienda su aplicación en consulta39. La aplicación de ácido salicílico como queratolítico en estas fórmulas se llevará a cabo con precaución, ya que puede provocar acidosis metabólica y está desaconsejado en menores de 2años y debe limitarse a la extensión de la zona a tratar y la duración del tratamiento en niños mayores. Comentar que, aunque el KOH 10% se ha mostrado como una alternativa útil aplicado tópicamente, no se sugieren formulaciones al encontrarse el producto comercializado40.
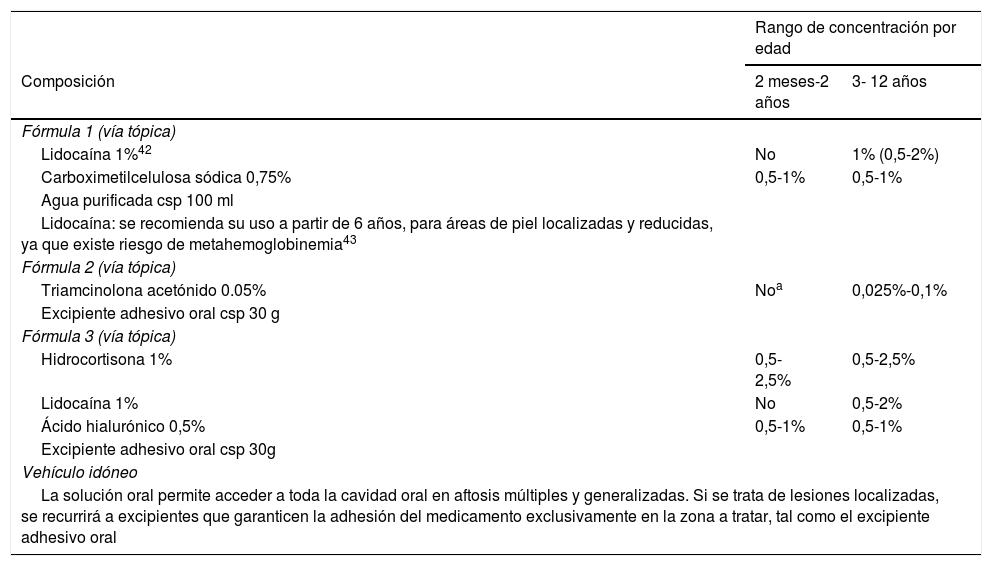
AftasLas siguientes formulaciones están orientadas al tratamiento tópico del dolor y de la inflamación propios de las aftas. Para ello se emplean anestésicos tópicos como la lidocaína, corticoides que aceleran la recuperación de la mucosa y que además disminuyen la sintomatología. En paralelo, se incluyen agentes protectores de la mucosa gástrica como el sucralfato o el ácido hialurónico por su poder demulcente (tabla 9)41.
Fórmulas propuestas para el tratamiento de las aftas en los niños
| Rango de concentración por edad | ||
|---|---|---|
| Composición | 2 meses-2 años | 3- 12 años |
| Fórmula 1 (vía tópica) | ||
| Lidocaína 1%42 | No | 1% (0,5-2%) |
| Carboximetilcelulosa sódica 0,75% | 0,5-1% | 0,5-1% |
| Agua purificada csp 100 ml | ||
| Lidocaína: se recomienda su uso a partir de 6 años, para áreas de piel localizadas y reducidas, ya que existe riesgo de metahemoglobinemia43 | ||
| Fórmula 2 (vía tópica) | ||
| Triamcinolona acetónido 0.05% | Noa | 0,025%-0,1% |
| Excipiente adhesivo oral csp 30 g | ||
| Fórmula 3 (vía tópica) | ||
| Hidrocortisona 1% | 0,5-2,5% | 0,5-2,5% |
| Lidocaína 1% | No | 0,5-2% |
| Ácido hialurónico 0,5% | 0,5-1% | 0,5-1% |
| Excipiente adhesivo oral csp 30g | ||
| Vehículo idóneo | ||
| La solución oral permite acceder a toda la cavidad oral en aftosis múltiples y generalizadas. Si se trata de lesiones localizadas, se recurrirá a excipientes que garanticen la adhesión del medicamento exclusivamente en la zona a tratar, tal como el excipiente adhesivo oral | ||
La utilización de propranolol por vía oral es el tratamiento de elección en el hemangioma infantil de riesgo44. Sin embargo, el uso de betabloqueantes tópicos, como el timolol, ha demostrado su efectividad y su seguridad para hemangiomas no complicados o incluso como continuación de tratamiento al suspender el propranolol oral45. Las contraindicaciones y los efectos adversos del timolol son los mismos que los del propranolol, aunque al ser aplicado de forma tópica estos se presentan mucho menos frecuentemente. Está contraindicado en pacientes con asma, bradicardia, bloqueo cardiaco de segundo o tercer grado y shock cardiogénico. Por otro lado, no se debe utilizar en hemangiomas ulcerados ni en mucosas. Aunque existe algo de absorción sistémica, los efectos adversos son poco frecuentes. Su uso no requiere monitorización. La dosis es de 1-4gotas por día, dividido en 2veces, aplicándolo en toda el área del hemangioma y masajeando ligeramente. Posteriormente lavarse las manos con agua y jabón46. En la tabla 10 se proponen dos fórmulas alternativas.
Fórmulas propuestas para el hemangioma infantil, la esclerosis tuberosa y la ictiosis lamelar en los niños
| Hemangioma infantil29,52-54 | ||
|---|---|---|
| Rango de concentración por edad | ||
| Composición | 2 meses-2 años | 3-12 años |
| Formulación 155,56(vía tópica) | ||
| Timolol HCl 0,5% | 0,5% | 0,5% |
| Gel csp 50 g | ||
| Vehículo idóneo | ||
| El timolol es un activo muy soluble en agua. Esta propiedad permite el uso vehículos hidrófilos como los geles, que en este caso, por las características de las lesiones, son idóneos y altamente cosméticos para su aplicación tópica | ||
| Esclerosis tuberosa57-59 | ||
|---|---|---|
| Rango de concentración por edad | ||
| Composición | 2 meses-2 años | 3-12 años |
| Fórmula 1 (vía tópica) | ||
| Sirolimus 0,4% | Noa | 0,4-1%a |
| Vaselina filante csp 30 g(o emulsión O/W) | ||
| Vehículo idóneo | ||
| Por las características fisicoquímicas del activo se debe recurrir a un vehículo graso como la vaselina, que con un gran poder oclusivo permite conseguir un mayor efecto terapéutico. En pacientes con acné o reacciones acneiformes se puede optar por una emulsión de contenido graso medio | ||
| Ictiosis lamelar | ||
|---|---|---|
| Rango de concentración por edad | ||
| Composición | 2 meses-2 años | 3-12 años |
| Fórmula 1 (vía tópica) | ||
| N-acetilcisteína (NAC) 10% | 5%b | 10% |
| Urea 5% | 5% | 5% |
| Esencia de romero 1,5% | 1,5% | 1,5% |
| Emulsión O/W csp 100 g | ||
| Fórmula 2 (vía tópica) | ||
| Carbocisteína 10% | c | 10% |
| Urea 5% | 5% | 5% |
| Emulsión O/W csp 100 g | ||
| Vehículo idóneo | ||
| El vehículo debe ser no iónico, tipo NeoPCL O/W. Es interesante la adición de esencia como la de romero para contrarrestar el olor intenso sulfurado de la NAC. También puede ser interesante la adición de agentes emolientes e hidratantes como glicerina, aloe vera y aceites (oliva, rosa mosqueta) | ||
En neonatos se han conseguido resultados satisfactorios a la concentración de NAC al 5% + urea al 5%60.
Los inhibidores de mTOR se han mostrado eficaces y seguros en el tratamiento de la esclerosis tuberosa47. Diferentes trabajos han mostrado la eficacia de la rapamicina tópica en el tratamiento de lo angiofibromas faciales característicos de esta enfermedad, y la concentración del 1% es la que mostró mejores resultados48. La aplicación debe ser siempre por la noche. En la tabla 10 se propone una fórmula de interés.
Ictiosis lamelarEn la ictiosis lamelar se debe alcanzar un grado óptimo de hidratación y queratólisis de las zonas afectadas y modular las concentraciones en función de la fase en la cual se encuentre la lesión. El tratamiento es sintomático, empleándose la N-acetilcisteína por su actividad antioxidante, que ha demostrado efectividad dada su capacidad de inhibir la proliferación de queratinocitos49. Pese a que puede aparecer irritación y que su olor azufrado característico puede complicar la adherencia, la eficacia está demostrada50. Además existe otra formulación con carbocisteína, una molécula con propiedades similares y con la ventaja de no presentar mal olor, con la que se han obtenido resultados favorables en pacientes de entre 5 y 9años51.
En la tabla 10 se proponen las fórmulas con ambos principios activos.
ConclusionesLas características fisiológicas de los adultos no son equivalentes a las de los niños. Las dosis, las pautas posológicas, el efecto de una posible absorción del fármaco, así como la gravedad de los efectos adversos, no son comparables, y por ello está justificada la adaptación de los tratamientos.
La presente revisión propone diferentes fórmulas para dermatosis frecuentes o específicas de los niños. La formulación magistral o formulación de medicamentos individualizados supone, por tanto, una herramienta terapéutica imprescindible en dermatología pediátrica, ofreciendo alternativas eficaces, seguras y de calidad a los tratamientos estándar.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.