Sonidegib es un inhibidor del receptor transmembrana Smoothened (SMO), de la vía de señalización de Hedgehog, indicado para el tratamiento del carcinoma basocelular localmente avanzado (CBCla), no susceptible a cirugía curativa ni a radioterapia. Sonidegib ha demostrado su eficacia y seguridad en pacientes con CBCla en el ensayo de fase II (BOLT), donde el 61% (IC 95%: 48; 72) de los pacientes tratados con 200 mg de sonidegib tuvo una respuesta objetiva al tratamiento, con un tiempo medio hasta la respuesta de cuatro meses. La mediana de duración de respuesta fue de 26,1 meses y la mediana de supervivencia libre de progresión fue de 22,1 meses. Los eventos adversos más frecuentes fueron los espasmos musculares (54,4%), alopecia (49,4%) y disgeusia (44,3%), siendo principalmente de grado 1 y 2. Esta revisión proporciona un resumen sobre la eficacia, seguridad y tolerabilidad de sonidegib, así como consideraciones sobre su uso en el manejo de pacientes con CBCla.
Sonidegib is an antagonist of the transmembrane protein Smoothened in the Hedgehog signaling pathway. It is indicated for the treatment of locally advanced basal cell carcinoma (BCC) that is not amenable to curative surgery or radiotherapy. Sonidegib's efficacy and safety were demonstrated in the phase 2 BOLT trial, where 61% (95% CI, 48-72%) of patients with locally advanced BCC treated with sonidegib 200 mg achieved an objective response to treatment with a mean time to response of 4 months. The median duration of response was 26.1 months and the median progression-free survival was 22.1 months. The most common adverse events were muscle spasms (54.4%), hair loss (49.4%), and loss of taste (44.3%); most events were grade 1 or 2. In this review, we summarize the main findings on the efficacy, safety, and tolerability of sonidegib and discuss the management of locally advanced BCC with this drug.
El carcinoma basocelular (CBC) es la neoplasia maligna más frecuente en seres humanos, responsable del 75% de todos los cánceres cutáneos. La incidencia es más alta en Australia, seguida de Estados Unidos y Europa y varía de 70-150/100.000 personas/año entre países, con un aumento en la incidencia con la edad1. Se estima que la incidencia del CBC incrementa anualmente un 6,8% (IC 95%: 5,3; 8,3) en hombres y un 7,9% (IC 95%: 6,2; 9,7) en mujeres, por una mayor exposición a la radiación ultravioleta (UV) solar y artificial2, un aumento de las actividades deportivas y recreativas al aire libre3, una esperanza de vida más alta y la disminución de la capa de ozono4,5. En España, la incidencia de CBC estimada en un metaanálisis en 2016, fue de 113,05/100.000 personas/año, incluyendo únicamente los tumores confirmados histológicamente y el primero de cada paciente6. Además de la exposición a la radiación UV y la edad, el desarrollo de CBC se ha asociado con otros factores de riesgo, como el fototipo de piel clara (I y II), los antecedentes familiares, la exposición a radiaciones ionizantes, la ingesta de arsénico, la inmunosupresión y algunas genodermatosis7.
El CBC se caracteriza por ser un tumor muy heterogéneo, con múltiples presentaciones clínicas y subtipos histológicos. Suele tener un comportamiento poco agresivo, con un crecimiento lento y localizado. Habitualmente se desarrolla en las partes del cuerpo expuestas al sol, siendo la región de cabeza y cuello la más frecuentemente afectada (80%). Es un tumor que se origina a partir de células madre indiferenciadas y pluripotentes de la capa basal epidérmica y folículos pilosebáceos, reguladas por la vía de señalización Hedgehog (Hh). Las células tumorales epiteliales basales forman agrupaciones rodeadas de estroma con diferentes patrones de crecimiento, dando lugar al CBC de crecimiento lento con los subtipos nodular y superficial, y de crecimiento agresivo e infiltrativo con los subtipos morfeiforme, infiltrante, micronodular y basoescamoso7–9. En un tumor puede estar presente un único patrón histológico, o una combinación, denominándose entonces de histología mixta7.
En general, el pronóstico del CBC suele ser favorable y el tratamiento es esencialmente quirúrgico, aunque también, dependiendo de múltiples factores, se puede usar la radioterapia, terapia fotodinámica e imiquimod tópico. Sin embargo, en ocasiones el CBC puede progresar localmente, invadiendo estructuras vecinas (CBC localmente avanzado, CBCla) o metastatizando (CBC metastásico). Se ha estimado que hasta un 0,8% de todos los casos de CBC corresponde a CBCla. En España, en 2017, se estimó una prevalencia del CBCla de al menos 500 personas6. El paciente con CBCla suele presentar un largo historial de CBC sin tratamiento o repetidos fracasos de tratamiento y recurrencias, que se caracteriza por la dificultad o imposibilidad de curar el tumor mediante cirugía o radioterapia (tabla 1)10,11. En estos casos, las opciones terapéuticas habituales resultan ineficaces, lo que conlleva una gran morbilidad funcional, emocional y cosmética, que afecta negativamente a la calidad de vida de los pacientes que lo padecen. La invasión de estructuras locorregionales puede provocar impotencia funcional, dolor e insomnio crónicos de difícil control y el impacto estético negativo, a menudo en polo cefálico, que causa ansiedad, depresión y rechazo social12. Por este motivo, se requieren otras herramientas para su control, como los inhibidores de la vía de señalización de Hh.
Criterios para definir cuando la cirugía y la radiación se consideran inapropiados en CBCla11
| > 5 CBC, si el paciente sufre de síndromes genéticos |
| CBC > 10 mm, reincidente después de dos cirugías en localizaciones críticas (por ejemplo, área periocular y perioral) |
| CBC infiltrado en hueso/cartílago/otras estructuras y resección curativa improbable |
| CBC reincidente después de múltiples cirugías y/o radioterapia |
| CBCla en pacientes que no pueden someterse a anestesia general |
CBC: carcinoma basocelular; CBCla: carcinoma basocelular localmente avanzado.
La vía de señalización Hh fue observada por primera vez en 1980, en la larva de Drosophila melanogaster, donde se vio que mutaciones en los genes Patched y Hedgehog, que codifican esta vía de señalización, producían alteraciones en el desarrollo embrionario13. En diferentes especies, esta vía tiene un papel fundamental en la organogénesis durante la embriogénesis, pero en la edad adulta, la vía Hh está prácticamente inactivada, sólo permanece activa en el folículo piloso, piel y células madre, manteniendo la homeostasis tisular y la reparación celular14.
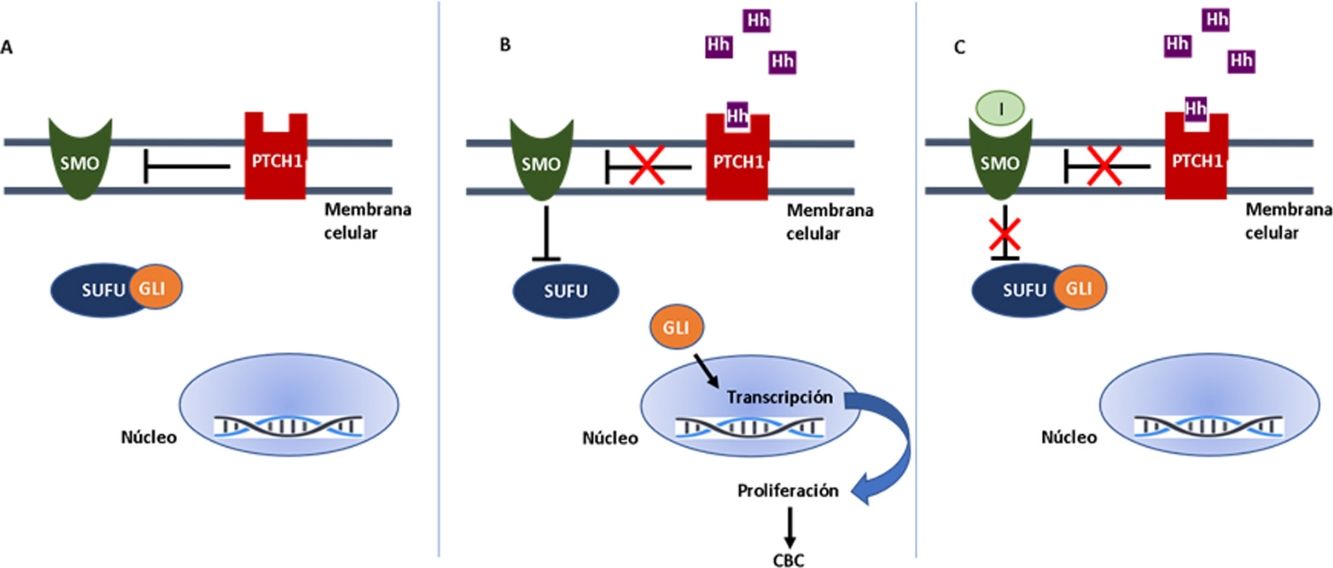
En la vía Hh, el receptor transmembrana Patched 1 (PTCH1), localizado en los cilios primarios de las células, en ausencia de ligando, inhibe a la proteína Smoothened (SMO), un receptor transmembrana que actúa como transductor de señal (fig. 1A). Al unirse un ligando Hh a PTCH1, desaparece la represión sobre SMO, que actúa sobre la proteína mediadora suppressor of fused homolog (SUFU), promoviendo la activación de los factores de transcripción GLI e induciéndose la transcripción de genes implicados en el aumento de la supervivencia celular y mitosis (fig. 1B)15.
Activación y desactivación de la vía de señalización de Hedgehog (Hh). A: en ausencia de ligandos Hh, el receptor PTCH1 inhibe a SMO, permitiendo a la proteína SUFU unirse e inhibir a los factores de transcripción GLI. B: la unión de ligandos Hh a PTCH1 suprime la inhibición a SMO, como consecuencia se inhibe SUFU, disociándose el complejo y activándose los factores de transcripción GLI, que se translocan al núcleo y se induce la transcripción de genes asociados a la vía de señalización Hh implicados en el aumento de la supervivencia celular y mitosis. C: En presencia de ligandos Hh, que activan la vía Hh, los inhibidores bloquean la activación de SMO, permitiendo la supresión de los factores de transcripción GLI por SUFU y la transcripción de los genes asociados a la vía Hh.
GLI: factor de transcripción GLI; Hh: ligando Hedgehog; I: inhibidores de SMO como sonidegib y vismodegib; PTCH1: receptor transmembrana Patched 1; SMO: proteína Smoothened; SUFU: proteína mediadora suppressor of fused homolog.
Una activación aberrante de la vía de señalización Hh es el detonante de la patogénesis del CBC, en más del 90% de los casos, pero también en otros tipos de tumores como neuroblastomas, gliomas y rabdomiosarcomas16. Las alteraciones que se pueden dar en la vía son un aumento en la expresión del ligando Hh, que de forma directa aumenta la señalización o una alteración genética en las proteínas reguladoras, PTCH1 y SMO, dando lugar a receptores activados, produciendo también un aumento en la transducción de la señal. La mayoría de los CBC ocurren por mutaciones esporádicas en alguno de los genes implicados, siendo las más frecuentes en los genes PTCH1 (80%) y SMO (10-20%)16. También existen casos hereditarios, como en el síndrome de Gorlin (SG) o síndrome del nevo basocelular17. El SG es una enfermedad genética de herencia autosómica dominante, que se caracteriza por el desarrollo de múltiples CBC en edades tempranas, debidas principalmente a la mutación del gen PTCH1 o SUFU18. Las personas con SG nacen en su mayoría con una mutación heredada en uno de los alelos de PTCH1 y, posteriormente, una segunda mutación, adquirida sobre el alelo sano del gen por factores externos como la luz UV, es la responsable del desarrollo de los tumores19.
La inhibición de la vía de señalización Hh es una diana terapéutica clave en el tratamiento del CBCla, donde la cirugía o radioterapia son inviables. Vismodegib y sonidegib inhiben la vía Hh al unirse e inactivar la proteína SMO y suprimiendo así el crecimiento tumoral (fig. 1C). Esta revisión proporciona un resumen sobre la eficacia, seguridad y tolerabilidad de sonidegib, así como consideraciones sobre su uso en el manejo de pacientes con CBCla.
Sonidegib: inhibidor de la vía HhSonidegib, comercializado como Odomzo®, fue aprobado por la Food and Drug Administration (FDA) y por la Comisión Europea tras la evaluación de la European Medicine Agency (EMA), en julio y agosto de 2015, respectivamente. Está indicado para el tratamiento de pacientes adultos con CBCla que no son susceptibles a la cirugía curativa ni a la radioterapia. La dosis recomendada es de 200 mg de sonidegib, una vez al día, administrado por vía oral, separado de las comidas.
Eficacia clínica de sonidegib en el CBC localmente avanzadoLa eficacia y seguridad de sonidegib fueron evaluadas en un estudio de fase I y en el ensayo pivotal de fase II, BOLT. Esta revisión se centra en los resultados de sonidegib a una dosis de 200 mg entre la población con CBCla, por ser la dosis y población en la que está aprobado su uso.
El ensayo de fase I fue un ensayo de escalado de dosis y multicéntrico, llevado a cabo para evaluar la eficacia y seguridad de sonidegib, en un total de 103 pacientes con tumores sólidos en estado avanzado, incluyendo 16 pacientes con CBC. Se determinó la dosis máxima tolerada (DMT) en 800 mg al día, en dosis única, o en 250 mg dos veces al día. Además, sonidegib mostró una reducción en la expresión del ARN mensajero de GLI1, dependiente de la dosis, que explicó su actividad antitumoral. Un 37,5% (n = 6) de los pacientes con CBC alcanzaron respuestas tumorales objetivas, que se asociaron con evidencia de la activación de la vía Hh20.
El ensayo BOLT fue desarrollado para evaluar la eficacia y seguridad de sonidegib en pacientes con CBCla o CBC metastásico, no susceptibles a la cirugía curativa o a radioterapia21–24. Los pacientes se aleatorizaron (1:2) para recibir una dosis diaria de sonidegib de 200 mg o de 800 mg hasta progresión de la enfermedad o toxicidad inaceptable. Un total de 230 pacientes con CBC avanzado se incluyeron en el ensayo, de los cuales, el 84,3% (n = 194) presentaban CBCla. La variable principal de eficacia fue la tasa de respuesta objetiva (TRO), evaluada por revisión central de acuerdo con los criterios modificados de evaluación de la respuesta en tumores sólidos, modified response evaluation criteria in solid tumors (mRECIST), criterios más estrictos que los RECIST en la detección de signos de la enfermedad11. No obstante, la respuesta también se evaluó en un análisis predefinido empleando criterios similares a los RECIST, empleados en el ensayo pivotal de vismodegib (ERIVANCE).
Según el análisis final a los 42 meses en el brazo de 200 mg de sonidegib mediante revisión central, el 56% (IC 95%: 43; 68) y el 61% (IC 95%: 48; 72) de los pacientes con CBCla tuvieron una respuesta objetiva al tratamiento (TRO), evaluada mediante criterios mRECIST y RECIST, respectivamente (tabla 2). La TRO evaluada por los investigadores fue superior, siendo del 71,2% (IC 95%: 58,7; 81,7) y del 74,2% (IC 95%: 62; 84), evaluada mediante criterios mRECIST y RECIST, respectivamente25,26. La eficacia fue similar entre pacientes con CBCla con subtipos histológicos agresivos o no agresivos21. La mediana de duración de respuesta (DR) fue de 26,1 meses y la mediana de supervivencia libre de progresión (SLP) fue de 22,1 meses. El tiempo medio hasta la respuesta del tumor fue de cuatro meses y la duración media de seguimiento fue de 50 meses, el seguimiento más prolongado publicado hasta la fecha de un inhibidor de Hh. Los resultados de eficacia fueron consistentes a lo largo del estudio (tabla 3)23. Adicionalmente, los pacientes tratados con sonidegib mantuvieron o mejoraron su calidad de vida, aspecto sumamente importante en un tumor de alta morbilidad y baja mortalidad27.
Comparación de la respuesta en tumores de sonidegib 200 mg, según criterios mRECIST y RECIST en pacientes con CBC localmente avanzado, según evaluación centralizada (análisis a los 42 meses)25,26
| Variable de eficacia | Sonidegib 200 mg al día en pacientes con CBC localmente avanzado (n = 66). Evaluación centralizada a los 42 meses de seguimiento | |
|---|---|---|
| Criterio mRECIST | Criterio RECIST | |
| TRO, % (IC 95%) | 56,1 (43,3; 68,3) | 61 (48; 72) |
| RC, % (IC 95%) | 4,5 (0,9; 12,7) | 21 (12; 33) |
| RP, % | 51,5 | 39 |
| EE, % | 34,8 | 30 |
| TCE, % | 90,9 | 91 |
CBC: carcinoma basocelular; EE: enfermedad estable; IC: intervalo de confianza; mRECIST (modified response evaluation criteria in solid tumors): criterios modificados de evaluación de la respuesta en tumores sólidos; RC: respuesta completa; RECIST (response evaluation criteria in solid tumors): criterios de evaluación de la respuesta en tumores sólidos; RP: respuesta parcial; TCE: tasa de control de la enfermedad; TRO: tasa de respuesta objetiva.
Eficacia de sonidegib 200 mg en pacientes con CBC localmente avanzado, según evaluación centralizada21,23
| Variable | Sonidegib 200 mg al día en pacientes con CBC localmente avanzado (n = 66) | |||
|---|---|---|---|---|
| Análisis primario (6 meses) | Análisis a los 18 meses | Análisis a los 30 meses | Análisis a los 42 meses | |
| TRO, % (IC 95%) | 47,0 (34,6; 59,7) | 56,1 (43,3; 68,3) | 56,1 (43,3; 68,3) | 56,0 (43,3; 68,3) |
| TRC, % (IC 95%) | 3,0 (ND) | 4,5 (ND) | 4,5 (ND) | 5,0 (0,9; 13,0) |
| DR, mediana, meses (IC 95%) | NA | NA | 26,1 (NE) | 26,1 (NE) |
| SLP, mediana, meses (IC 95%) | NA | 22,1 (NE) | 22,1 (NE) | 22,1 (NE) |
CBC: carcinoma basocelular; DR: duración de la respuesta; NA: no alcanzado/a; ND: no disponible; NE: no evaluable; SLP: supervivencia libre de progresión; TRC: tasa de respuesta completa; TRO: tasa de respuesta objetiva.
Además, en el ensayo BOLT se demostró inicialmente la eficacia de sonidegib en SG, donde ocho de los 13 pacientes con SG en el grupo de 800 mg tuvieron una remisión clínica completa del CBC21. Esta eficacia se confirmó recientemente en un estudio exploratorio aleatorizado, donde se evaluó la eficacia y seguridad de sonidegib en 10 pacientes con SG durante 12 semanas. Todos los pacientes (n = 7) tratados con 400 mg de sonidegib al día tuvieron remisión clínica completa (n = 3, 43%) o parcial (n = 4, 57%) del CBC objetivo a las 16 semanas28.
Perfil de seguridad y tolerabilidad de sonidegibLa seguridad y la tolerabilidad de sonidegib se evaluaron en el ensayo BOLT, siendo la dosis de 200 mg de sonidegib mejor tolerada que la dosis de 800 mg. En el brazo de 200 mg, la mediana de exposición al producto fue de 11 meses. El 98% de los pacientes experimentaron, al menos, un evento adverso (EA), aunque estos fueron principalmente de grado 1 o 2, manejables y reversibles con interrupciones temporales de tratamiento o reducciones de dosis. Los EA más frecuentes fueron los espasmos musculares (54,4%), alopecia (49,4%) y disgeusia (44,3%)23. La incidencia de EA fue similar a la observada en análisis previos del estudio (tabla 4).
Eventos adversos notificados con 200 mg de sonidegib a lo largo del ensayo BOLT23
| 6 meses | 12 meses | 18 meses | 30 meses | 42 meses | |
|---|---|---|---|---|---|
| Todos EA | 75 (95) | 77 (98) | 77 (98) | 77 (98) | 77 (98) |
| EA grado 3/4 | 24 (30) | 30 (38) | 31 (39) | 34 (43) | 34 (43) |
| Todos EA relacionados con tratamiento | 68 (86) | 70 (89) | 70 (89) | 70 (89) | 70 (89) |
| EA grado 3/4 | 18 (23) | 22 (28) | 23 (29) | 24 (30) | 25 (32) |
| EA graves | 11 (14) | 13 (17) | 14 (18) | 16 (20) | 16 (20) |
| EA graves relacionados con tratamiento | 3 (4) | 2 (3) | 2 (3) | 3 (4) | 4 (5) |
| EA que causan abandono | 17 (22) | 22 (28) | 24 (30) | 24 (30) | 24 (30) |
| EA que causan interrupción temporal de tratamiento o reducción de dosis | 25 (32) | 30 (38) | 31 (39) | 34 (43) | 34 (43) |
Los datos se presentan como n (%). Los resultados provienen de la población de seguridad.
EA: evento adverso.
Un 30% de los EA causaron el abandono del tratamiento, siendo más de la mitad de grado 1 o 221. Los EA que llevaron al abandono del tratamiento más frecuentemente fueron los espasmos musculares (5%), astenia (4%), disgeusia (4%) y náuseas (4%). Los EA de aparición más temprana fueron la fatiga y los espasmos musculares (1,08 y 2,07 meses, respectivamente) y los de inicio más tardío, la pérdida de peso y la diarrea (6,47 meses, ambos)11.
Eficacia y seguridad de sonidegib, en perspectivaLos inhibidores de la vía Hh, vismodegib y sonidegib, han supuesto un cambio muy relevante en el manejo de los pacientes con CBCla, y como tal se recoge en las guías clínicas de referencia10. Sin embargo, ante la falta de ensayos aleatorizados controlados con tratamiento estándar o que comparen sonidegib con vismodegib, se desconocen sus diferencias clínicas. Por ello, una mesa de expertos reconocidos internacionalmente en el manejo del CBC realizó una evaluación comparativa con base en la evidencia disponible de ambos inhibidores11. En la comparación de los datos de eficacia, siguiendo los criterios RECIST obtenidos por evaluación central de los estudios pivotales BOLT (sonidegib) y ERIVANCE (vismodegib)29, sonidegib y vismodegib mostraron una TRO del 60,6% y 47,6%, respectivamente. A pesar de las dificultades metodológicas también se observaron diferencias interesantes en la DR (26,1 y 9,5 meses) y la SLP (22,1 y 9,5 meses) para sonidegib y vismodegib, respectivamente (tabla 5).
Comparación de los principales resultados de eficacia entre sonidegib (BOLT) y vismodegib (ERIVANCE), según evaluación centralizada siguiendo el criterio RECIST 11
| Variable de eficacia | Sonidegib 200 mg/día(BOLT), 18 mesesa | Vismodegib 150 mg/día(ERIVANCE), 21 mesesb |
|---|---|---|
| TRO, % | 60,6% | 47,6% |
| RC, % | 21,7% | 22,2% |
| RP, % | 39,4% | 25,4% |
| DR, meses | 26,1c | 9,5 |
| SLP, meses | 22,1c | 9,5 |
Los datos de eficacia se analizaron según el criterio de evaluación RECIST.
b Se consideró los resultados a 21 meses de ERIVANCE, porque el seguimiento a 39 meses no incluía una evaluación centralizada.
c La DR y la SLP de sonidegib procede del corte a los 30 meses.
DR: duración de la respuesta; RC: respuesta completa; RP: respuesta parcial; SLP: supervivencia libre de progresión; TRO: tasa de respuesta objetiva.
En cuanto a la tolerabilidad, tanto el perfil de EA como el porcentaje de abandonos debido a EA fue similar para ambos agentes, con una incidencia de EA ligeramente menor en la mayoría de las categorías para sonidegib, menor gravedad y un tiempo hasta el inicio de los EA más prolongado con sonidegib (tabla 6). Aun así, la mayor diferencia entre sonidegib y vismodegib se encuentra en el perfil farmacocinético, donde las evidencias sugieren que sonidegib se distribuye más extensivamente en la piel que vismodegib, lo que podría explicar las diferencias observadas en eficacia y seguridad en favor de sonidegib11. Con las evidencias disponibles, los autores reconocen la dificultad de obtener conclusiones y dirigen este análisis a la contextualización de los resultados. No obstante, ya se han descrito casos complejos tratados con sonidegib30,31, entre los que cabe destacar aquellos de pacientes tratados en primera línea con vismodegib, donde su sustitución por sonidegib ha permitido controlar los EA y continuar así con el tratamiento32,33.
Frecuencia y tiempo hasta aparición de los EA más comunes de sonidegib (BOLT, 30 meses) y vismodegib (ERIVANCE, 21 meses)11
| Evento adverso | Sonidegib 200 mg/día (BOLT), 30 meses | Vismodegib 150 mg/día (ERIVANCE), 21 meses | ||
|---|---|---|---|---|
| Frecuencia (todos los grados), % | Tiempo medio hasta aparición del EA, meses (IC 95%) | Frecuencia (todos los grados), % | Tiempo medio hasta aparición del EA,meses (IC 95%) | |
| Espasmos musculares | 54,4 | 2,07 (1,87; 3,19) | 71,2 | 1,89 (1,35; 2,73) |
| Alopecia | 49,4 | 5,55 (4,70; 6,41) | 65,4 | 3,38 (2,83; 4,11) |
| Disgeusia | 44,3 | 3,71 (2,76; 4,90) | 53,8 | 1,48 (0,99; 2,07) |
| Náuseas | 39,2 | 3,22 (1,51; 4,63) | 32,7 | 2,14 (0,59; 6,67) |
| Pérdida de peso | 30,4 | 6,47 (4,70; 8,31) | 50,0 | 6,13 (4,50; 7,36) |
| Aumento CPK | 15,2 | 2,58 (0,95; 5,59) | No medido | No medido |
| Fatiga | 30,4 | 1,08 (0,53; 3,68) | 40,4 | 2,79 (1,35; 3,75) |
| Diarrea | 31,6 | 6,47 (1,35; 10,32) | 26,0 | 4,47 (2,27; 6,51) |
| Pérdida apetito | 22,8 | 3,60 (1,02; 6,51) | 22,8 | 2,87 (1,38; 4,50) |
CPK: creatina fosfocinasa; EA: evento adverso; IC: intervalo de confianza.
La frecuencia e importancia de los EA asociados a la inhibición de la vía Hh puede ser un factor limitante en la continuidad del tratamiento. El ajuste de dosis o interrupción temporal del tratamiento son convenientes para aumentar el cumplimiento de los pacientes. Durante el ensayo BOLT, se observó que las interrupciones temporales o reducciones de dosis no tuvieron un impacto negativo en la eficacia de sonidegib34. Concretamente, se observaron TRO similares por revisión central en los subgrupos con (50%) o sin (57%) interrupciones o reducciones de dosis. Sonidegib es el único inhibidor Hh que incluye en ficha técnica una pauta de administración en días alternos para la remisión de EA35.
Uso en poblaciones especialesLos datos de eficacia y seguridad disponibles sobre el uso de sonidegib sugieren que no es necesario el ajuste de dosis en poblaciones especiales. Aun así, dado que no existen datos en pacientes con insuficiencia hepática o renal grave, se recomienda individualizar el tratamiento en estos pacientes35. En el caso de pacientes menores de 18 años con CBC, no se dispone de datos para establecer la seguridad y eficacia de sonidegib35.
ConclusionesSonidegib es un inhibidor de la vía de señalización Hh, que ha demostrado ser eficaz en el tratamiento del CBCla, con una proporción significativa de pacientes que se benefician, y un tiempo medio hasta respuesta corto que permite detectar con rapidez a los pacientes respondedores y una DR y SLP favorables. Su perfil de seguridad se ha mantenido a largo plazo, en el seguimiento más prolongado publicado hasta ahora de un inhibidor de Hh, al mismo tiempo que su tolerabilidad mejora ante la posibilidad de uso en días alternos, pauta recogida en la ficha técnica, que ayuda a reducir los abandonos de tratamiento.
Sin duda, sonidegib abre el abanico de posibilidades terapéuticas para el tratamiento del CBCla, si bien, y a falta de un ensayo comparativo enfrentando las dos moléculas disponibles en la actualidad, deberemos esperar hasta que los resultados del uso de ambos inhibidores en práctica clínica habitual permitan definir las diferencias reales y al mismo tiempo ayuden a identificar el perfil óptimo de pacientes respondedores a sonidegib, ajustar las dosis para minimizar los EA y retrasar la aparición de resistencia a inhibidores Hh.
FinanciaciónEl trabajo ha sido financiado por Sunpharma.
Conflicto de interesesRafael Botella-Estrada: Advisory board, and/or speaker, and/or participated in clinical trials for Pfizer, Abbvie, Almirall, Novartis, Janssen, Leo Pharma, Lilly, Celgene, Roche, SunPharma. Susana Puig: Advisory board or speaker or research grants or non-financial support or clinical trials for Abbvie, Almirall, Amgen, Avene, BMS, Canfield, Cantabria, ISDIN, La Roche Posay, Leo Pharma, MSD, Novartis, Pellepharma, Pfizer, Polychem, Regeneron, Roche, Sanofi. El resto de los autores no declara conflicto de intereses.
Los autores agradecen la colaboración de Content Ed Net (Madrid) en la redacción y gestión editorial del artículo.