La neurofibromatosis tipo 1 (NF1) es el síndrome neurocutáneo más frecuente y probablemente el mejor conocido por los dermatólogos. Aunque desde 1987 se sabe que el locus genético de la NF1 se localiza en el cromosoma 17, en la actualidad el diagnóstico de la NF1 sigue siendo fundamentalmente clínico. Los criterios diagnósticos del National Institute of Health están vigentes desde el año 1988 e incluyen 7 criterios diagnósticos, de los cuales tres se manifiestan en la piel: las manchas café con leche [MCCL], las efélides flexurales, y neurofibromas cutáneos. La edad de aparición de los distintos criterios diagnósticos es variable, y algunos pacientes los manifiestan tardíamente o incluso no los desarrollan nunca, por lo que el diagnóstico de certeza puede demorarse durante años. Las MCCL y las efélides aparecen en los primeros años de la vida y son muy sugerentes de la enfermedad, pero no son patognomónicas y resultan insuficientes para realizar el diagnóstico de certeza. Así, cuando los pacientes presentan exclusivamente MCCL y efélides es imprescindible considerar otros diagnósticos. Por el contrario, la existencia de múltiples neurofibromas cutáneos, o al menos un neurofibroma plexiforme, son muy específicos de la NF1. La identificación de las distintas formas de neurofibromas nos permite confirmar el diagnóstico de la enfermedad y hacer un seguimiento adecuado de los mismos.
Neurofibromatosis type 1 (NF1) is the most common neurocutaneous syndrome and probably the one best known to dermatologists, who are generally the first physicians to suspect its diagnosis. Although the genetic locus of NF1 was identified on chromosome 17 in 1987, diagnosis of the disease is still mainly based on clinical observations and the diagnostic criteria of the National Institute of Health, dating from 1988. Cutaneous manifestations are particularly important because café-au-lait spots, freckling on flexural areas, and cutaneous neurofibromas comprise 3 of the 7 clinical diagnostic criteria. However, café-au-lait spots and freckling can also be present in other diseases. These manifestations are therefore not pathognomonic and are insufficient for definitive diagnosis in the early years of life. NF1 is a multisystemic disease associated with a predisposition to cancer. A multidisciplinary follow-up is necessary and dermatologists play an important role.
La neurofibromatosis tipo 1 (NF1) (OMIM #162200) es el síndrome neurocutáneo más frecuente. Tiene una prevalencia estimada de 1:2.500-1:3.000 recién nacidos vivos1,2, y es el mejor conocido por los dermatólogos, que suelen ser los primeros en sospechar y/o confirmar el diagnóstico de la enfermedad. Aunque el locus genético de la NF1 se identificó en 1987 en el cromosoma 173, el diagnóstico de la enfermedad sigue siendo fundamentalmente clínico, y se basa en los criterios diagnósticos del National Institute of Health (NIH), vigentes desde el año 19884 (tabla 1). La NF1 puede afectar a prácticamente todos los órganos y sistemas, provocando trastornos del aprendizaje y problemas oftalmológicos, neurológicos, ortopédicos, cardiovasculares y tumorales. En la presente revisión nos ocuparemos de las manifestaciones dermatológicas y estudiaremos la relación entre NF1 y cáncer.
Criterios clínicos diagnósticos de la NF1 según el NIH1 vigentes desde 1988 (son necesarios al menos 2)
| Al menos 6 manchas café con leche de diámetro superior a 5mm en prepúberes y superior a 15mm en los púberes |
| Presencia de efélides axilares y/o inguinales |
| Al menos 2 neurofibromas cutáneos o un neurofibroma plexiforme |
| Glioma de vía óptica |
| Dos o más nódulos de Lisch |
| Lesión ósea sugerente de NF1: displasia de esfenoides, displasia o adelgazamiento de la cortical de huesos largos con o sin seudoartrosis |
| Un familiar de primer grado con NF1 definida |
El gen NF1 se localiza en la región pericentromérica del cromosoma 17 (17q11.2), y está formado por 60 exones de entre 100 y 200 pares de bases que se extienden a lo largo de 282kb de ADN. Codifica una proteína denominada neurofibromina, que se expresa en las células de Schwann, los melanocitos, los leucocitos, la glándula suprarrenal y, entre otros tejidos, el sistema nervioso central3. La neurofibromina contiene un segmento central denominado NF1-GRD, que ejerce una función inhibidora sobre la vía enzimática mitogen activated protein kinase pathway (RAS/MAPK)5. La vía RAS actúa como interruptor de la transducción de señales desde el exterior al interior celular, activando así una cascada de proteínas implicadas en los procesos de desarrollo (proliferación, diferenciación celular, organogénesis, plasticidad sináptica, crecimiento, apoptosis y envejecimiento celular). La implicación de la neurofibromina en la vía RAS-MAPK no solo aumenta la predisposición a desarrollar tumores, sino que también determina la presencia de anomalías fenotípicas y alteraciones en los procesos de aprendizaje y memoria, características que comparte con otras rasopatías6.
La NF1 es de herencia autosómica dominante, pero la mitad de los casos son esporádicos o de novo, y carecen de antecedentes familiares de la enfermedad. Además, hay formas mosaico de la enfermedad en las que una mutación somática tardía puede dar lugar a una neurofibromatosis mosaica con manifestaciones limitadas a uno o varios segmentos corporales (mosaicismo localizado o neurofibromatosis segmentaria), mientras que mutaciones más tempranas cursan con una clínica indistinguible de las formas generalizadas (mosaicismo generalizado)7. El mosaicismo tipo 2 (en el que a una enfermedad generalizada se añade un segmento de mayor afectación) es mucho más infrecuente en la NF1, y hasta el momento solamente se ha demostrado en segmentos sobreafectados por neurofibromas8.
Manifestaciones cutáneas diagnósticas de neurofibromatosis tipo 1Los hallazgos cutáneos, fácilmente accesibles a la inspección visual, suelen ser el primer signo de la enfermedad. Tres de ellos, las manchas café con leche (MCCL), las efélides y los neurofibromas, son de especial relevancia, porque constituyen 3 de los 7 criterios clínicos diagnósticos del NIH.
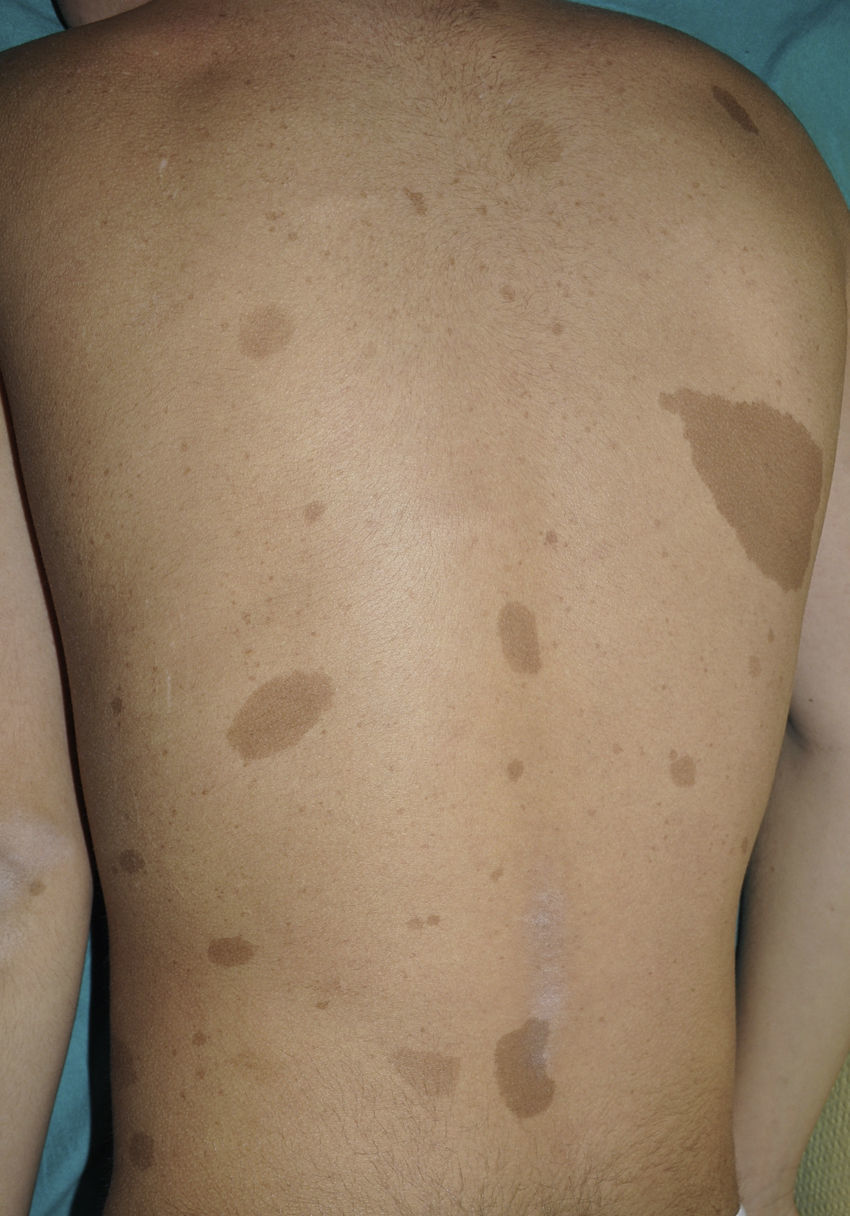
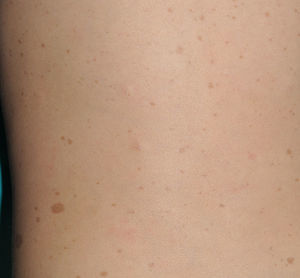
Manchas café con lecheLas MCCL son, probablemente, el criterio clínico diagnóstico más importante durante la edad pediátrica, tanto por su frecuencia, cercana al 100%, como porque suelen ser el primer signo visible de la enfermedad9,10. Las MCCL suelen estar presentes en el momento del nacimiento o hacerse evidentes poco tiempo después. No obstante, en nuestra experiencia el 90% de los pacientes tiene ya un número suficiente de MCCL antes del primer año de vida11. Su tamaño aumenta de manera proporcional al crecimiento, y su tono se oscurece a lo largo de la infancia12, para aclararse de nuevo durante la edad adulta13. Aunque se localizan en cualquier lugar del cuerpo, suelen respetar la cara.
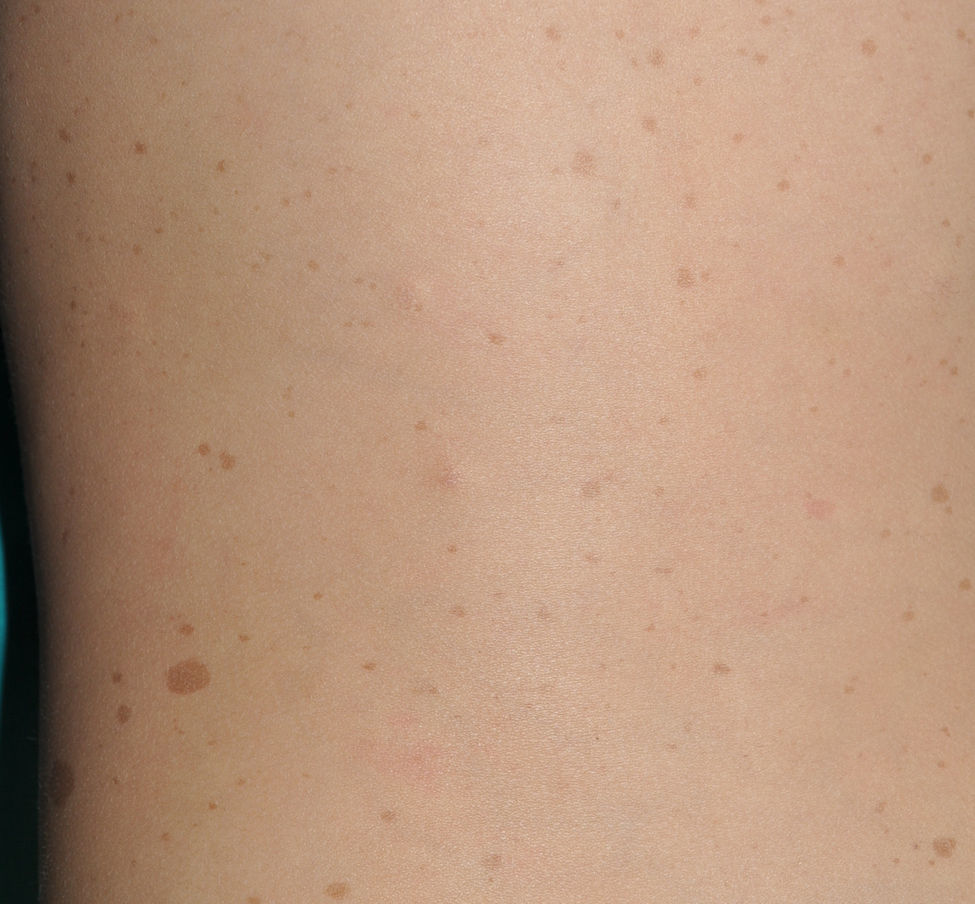
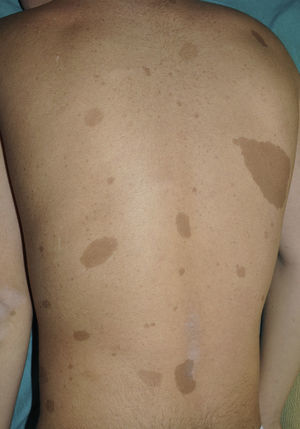
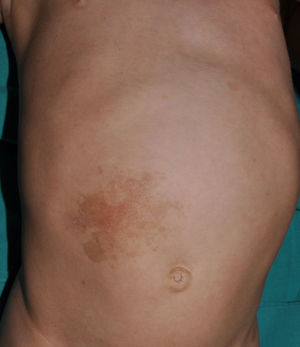
Desde el punto de vista morfológico, las MCCL típicas son de color variable, tono homogéneo y borde liso y regular (fig. 1). Su tamaño también es muy variable, desde unos pocos milímetros a varios centímetros, pero para que se puedan considerar criterio de NF1 han de existir al menos 6 lesiones de diámetro igual o mayor a 5mm en la edad prepuberal y mayor de 15mm tras la pubertad. Excepcionalmente, algunos pacientes con diagnóstico de certeza de NF1 no tienen MCCL, las presentan en número insuficiente o las mismas tienen morfología atípica11,14. No obstante, la mayoría de los pacientes con más de 6 MCCL sin otros marcadores de NF1 acabarán desarrollando una NF1, habitualmente antes del sexto año de la vida, y prácticamente siempre antes del octavo14,15. Cuanto más típica es la morfología de las MCCL, mayor es la probabilidad de que se confirme la NF1, y no existe asociación entre el número de MCCL y la gravedad de la NF114. Histológicamente las MCCL presentan incremento de la melanina en los melanocitos y los queratinocitos basales, pero no proliferación melanocitaria16. También se ha observado presencia de macromelanosomas y una mayor concentración de melanina en las MCCL de los pacientes con NF1 que en las MCCL esporádicas17,18. Desde el punto de vista molecular se ha demostrado que los melanocitos de las MCCL exhiben una segunda mutación en el gen NF1 del alelo sano19.
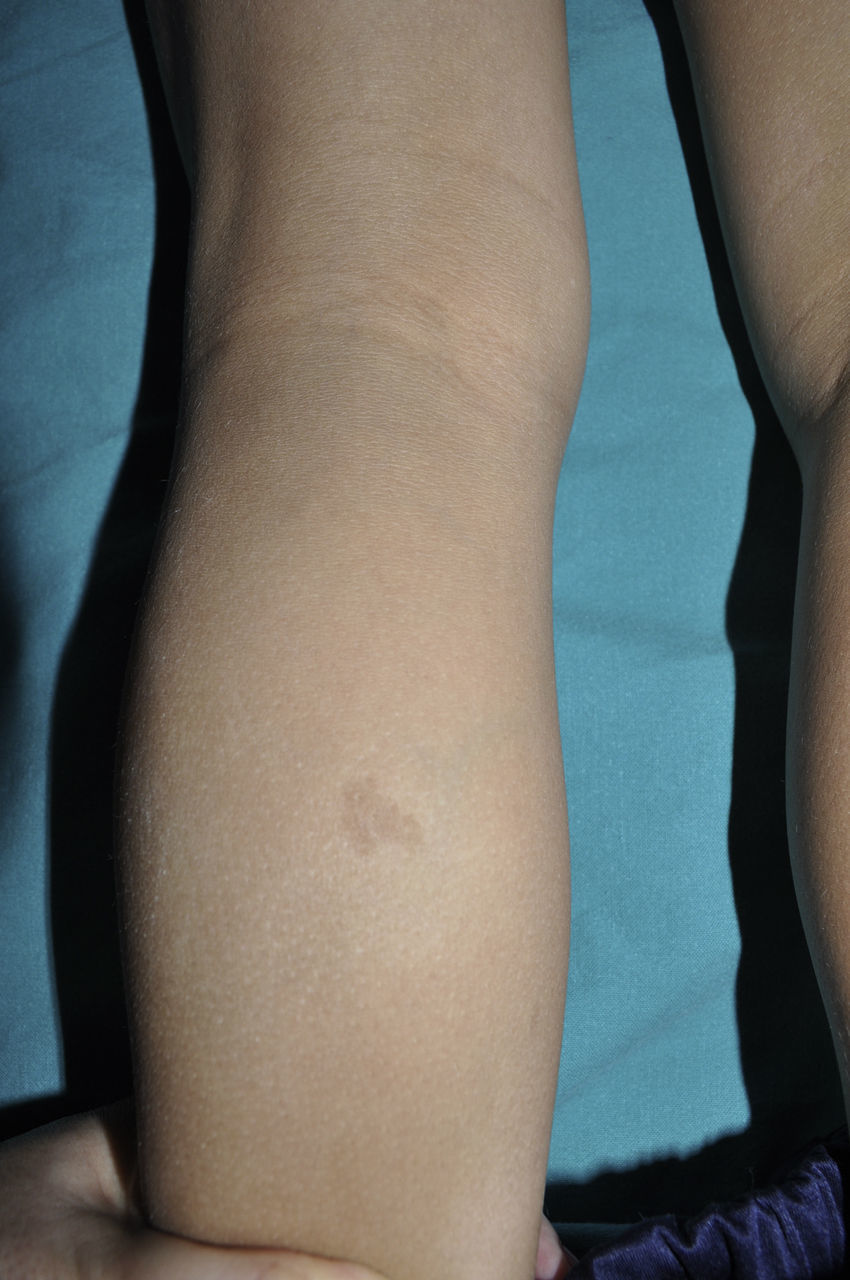
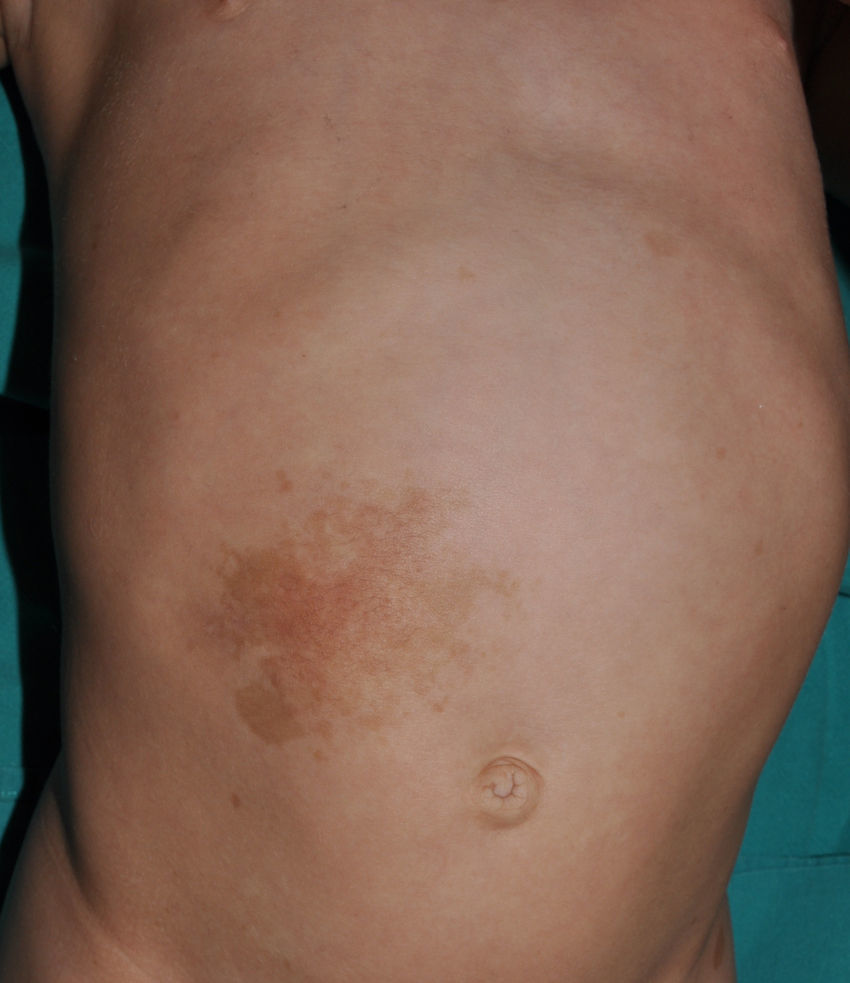
Es muy frecuente que remitan a nuestra consulta a niños pequeños con MCCL con NF1. Sin embargo, y aunque muy sugestivas, las MCCL no son patognomónicas de la enfermedad. Se calcula que hasta el 20% de los niños presentan una MCCL aislada, el 4% tienen 2 y menos del 1% de la población sana tiene más de 320,21, por lo que la anamnesis clínica y la exploración física deben ser particularmente rigurosas en este último caso. Lo primero que debemos valorar es si nos encontramos ante una auténtica MCCL, diferenciándola de otras lesiones pigmentadas como los nevus hipercrómicos (que pueden ser múltiples pero tienen un borde mucho más irregular) (fig. 2), los mosaicismos pigmentarios, los nevus melanocíticos congénitos, los nevus spilus, la urticaria pigmentosa macular o la hiperpigmentación postinflamatoria. Ocasionalmente, en algunos pacientes con NF1 podemos observar extensas máculas hiperpigmentadas de bordes irregulares con o sin hipertricosis que se confunden con MCCL gigantes, y que pueden corresponder con los denominados neurofibromas plexiformes superficiales (fig. 3). Tras valorar el número y el tamaño de las MCCL hay que buscar otros hallazgos clínicos que nos permitan diagnosticar la NF1 con certeza, algo que puede ser difícil en los niños más pequeños, ya que si bien los criterios clínicos de la NIH son muy específicos y sensibles a partir de los 8 años de vida, apenas el 45% de los niños menores de 1 año los cumplen15. Por tanto, es imprescindible realizar exploraciones complementarias y buscar la colaboración de otros especialistas, fundamentalmente neuropediatras y oftalmólogos.
Numerosas enfermedades pueden asociar MCCL (tabla 2). En la práctica, las rasopatías constituyen el diagnóstico diferencial más importante, en particular el síndrome de Legius. El síndrome de Legius (SLG) (OMIM #611431) o NF1-like es una rasopatía fenotípicamente muy parecida a la NF1 descrita en 200722. Se debe a una mutación del gen sprouty related EVH1 domain-containing protein1 (SPRED1), un gen de 7 exones localizado en el cromosoma 15q13.2, cuya alteración determina una pérdida de su función represora sobre la proteína RAF. El SLG es de herencia autosómica dominante y se caracteriza por la presencia de MCCL y/o efélides, a lo que ocasionalmente se asocia macrocefalia, lipomas, un fenotipo tipo Noonan y/o dificultades de aprendizaje23. A menudo estos pacientes cumplen criterios pigmentarios suficientes para diagnosticar una NF, pero en el SLG se excluye específicamente la presencia de nódulos de Lisch, neurofibromas, tumores del sistema nervioso central y mutaciones en el gen NF1. Sin embargo, la probabilidad de encontrar una mutación en el gen SPRED1 en un paciente con MCCL y efélides exclusivamente es apenas del 2%, por lo que muchos laboratorios de genética analizan el gen SPRED1 solo cuando han descartado previamente mutaciones en el gen NF1, las cuales se detectarán hasta en el 75% de los pacientes con MCCL y pecas flexurales24. En particular, las deleciones de un único aminoácido, p.Met992del en el gen NF1, producen un fenotipo indistinguible del SLG25. Un 20% de los casos con MCCL y efélides exclusivamente no presentará mutaciones en ninguno de los 2 genes24. Parece que la probabilidad de encontrar pacientes con SLG es mayor en los casos familiares de MCCL con o sin efélides23.
Diagnóstico diferencial de la NF1
| Enfermedades con manchas café con leche |
| Síndrome de Legius |
| Síndrome LEOPARD/Noonan con lentígines |
| Síndrome de MCCL familiares |
| Síndrome de McCune-Albright |
| Neurofibromatosis tipo 2 |
| Piebaldismo |
| Síndromes de cromosoma en anillo |
| Síndrome constitucional de reparación desajustada (constitucional mismatch repair syndrome) |
| Otras: síndrome de Noonan, síndrome cardio-facio-cutáneo, esclerosis tuberosa, síndrome de Bloom, ataxia-teleangiectasia, anemia de Fanconi, síndrome de Rusell-Silver, síndrome de Turner, síndromes MEN I y MEN II, síndrome de Johanson-Blizzard, síndrome de Rubenstein-Taybi |
| Enfermedades con efélides |
| Síndrome de Legius |
| Síndrome LEOPARD/Noonan con lentígines |
| Síndrome de Peutz-Jeghers |
| Síndrome de Cowden |
| Síndrome de Carney |
| Otras: síndromes con fotosensibilidad, epidermólisis ampollosa simple con pigmentación moteada |
| Enfermedades con tumoraciones subcutáneas |
| Lipomatosis |
| Síndrome de Proteus y otros síndromes de sobrecrecimiento |
| Malformaciones vasculares combinadas complejas |
Las MCCL que aparecen en el resto de las rasopatías apenas han sido caracterizadas en la literatura, con la excepción del síndrome LEOPARD, pero en nuestra experiencia muy raramente cumplen criterios de NF1. Aunque durante un tiempo se habló del síndrome de Noonan-NF1 para describir niños con fenotipo Noonan y hallazgos cutáneos pigmentarios completamente típicos de la NF1, posteriormente se demostró que estos pacientes presentaban mutaciones en el gen NF1, y que en realidad no padecían síndrome de Noonan, sino una verdadera NF126. En concreto, mutaciones en el gen NF1 de tipo missense que afectan al residuo p.Arg1809 cursan con hallazgos fenotípicos típicos del síndrome de Noonan (estenosis pulmorar y baja talla) y lesiones pigmentadas típicas de la NF1, pero ausencia de neurofibromas25. Las MCCL de los pacientes con síndrome LEOPARD suelen ser de tono más oscuro (la literatura clásica las describe como de tono café negro en lugar de café con leche), a menudo son de color heterogéneo, y con frecuencia los bordes tienden a ser más poligonales que redondeados, tal y como puede apreciarse en diversas imágenes de la literatura, incluyendo algunas de nuestros pacientes27–29 (fig. 4). Las lentígines o efélides generalizadas, que aparecen progresivamente a partir de los 4 o 5 años de la vida, son mucho más características del LEOPARD que las MCCL, pero pueden ser similares a las que presentan los pacientes con NF1.. Para mayor dificultad diagnóstica, las manifestaciones sistémicas más típicas del síndrome LEOPARD, como la sordera y la estenosis pulmonar, pueden no estar presentes27, por lo que en algunos casos el diagnóstico molecular resulta imprescindible para diferenciar ambas enfermedades. Finalmente, otras rasopatías como el síndrome de Costello y el cardio-facio-cutáneo pueden asociar MCCL, pero lo hacen en una minoría de pacientes y su número suele ser escaso30–32.
Máculas café con leche de contornos poligonales en 2 pacientes con síndrome LEOPARD.
Fuente: tomada de Ramos-Geldres et al.27.
Hay que sospechar un síndrome de MCCL familiar en individuos de diferentes generaciones con MCCL sin otra manifestación de NF1. Se cree que es de herencia autosómica dominante, pero todavía no ha sido caracterizado a nivel molecular, y aunque existe la posibilidad de que corresponda a un síndrome de Legius, el mismo ha sido descartado en algunos casos24. También cabe la posibilidad de que sean formas mosaico de NF1 con afectación cutánea exclusiva no detectable en los leucocitos sanguíneos19, o incluso que la mutación resida en otro gen de la vía RAS33,34. El síndrome de McCune-Albright se caracteriza por MCCL extensas, frecuentemente segmentarias, unilaterales y de bordes irregulares. Asocia displasia fibrosa poliostótica, pubertad precoz y otras endocrinopatías, y el principal problema diagnóstico viene dado con las formas segmentarias de NF1 y con mosaicismos cutáneos hiperpigmentados. La neurofibromatosis tipo 2 puede asociar MCCL en el 32-47% de los pacientes35, pero es más típico encontrar schwannomas, particularmente vestibulares (antes denominados neurinomas del acústico) que neurofibromas. Durante un tiempo se pensó que los pacientes con piebaldismo que tenían MCCL y efélides flexurales padecían simultáneamente una NF1, pero esta posibilidad se ha descartado en al menos 2 familias en las que se han confirmado mutaciones en el gen KIT y ausencia de anomalías en NF136,37. Algunos autores han propuesto que las mutaciones en KIT conducen a la alteración en la actividad del gen SPRED1 y al desarrollo de manifestaciones fenotípicas parecidas al SLG en pacientes con piebaldismo38. Los síndromes de cromosoma en anillo se caracterizan por anomalías congénitas como dismorfia facial, microcefalia, clinodactilia, talla baja y trastornos cognitivos, y se ha descrito la existencia de MCCL múltiples de características típicas en varios de ellos. El recientemente descrito síndrome de desajuste de reparación constitucional (constitutional mismatch repair syndrome) también puede asociar lesiones hipo o hiperpigmentadas, pero estas últimas parecen tener bordes más irregulares y difusos que las MCCL típicas39. A pesar de la rareza de este síndrome, es importante tenerlo en cuenta, ya que los pacientes tienen un elevado riesgo de padecer tumores intestinales, hematológicos y del sistema nervioso central en las primeras décadas de la vida, y hasta el 97% de los 34 pacientes seguidos por un consorcio internacional presentaba al menos una MCCL desde la niñez39. Finalmente, otras genodermatosis señaladas en la tabla pueden asociar MCCL12, pero habitualmente en número insuficiente para cumplir criterio de NF1.
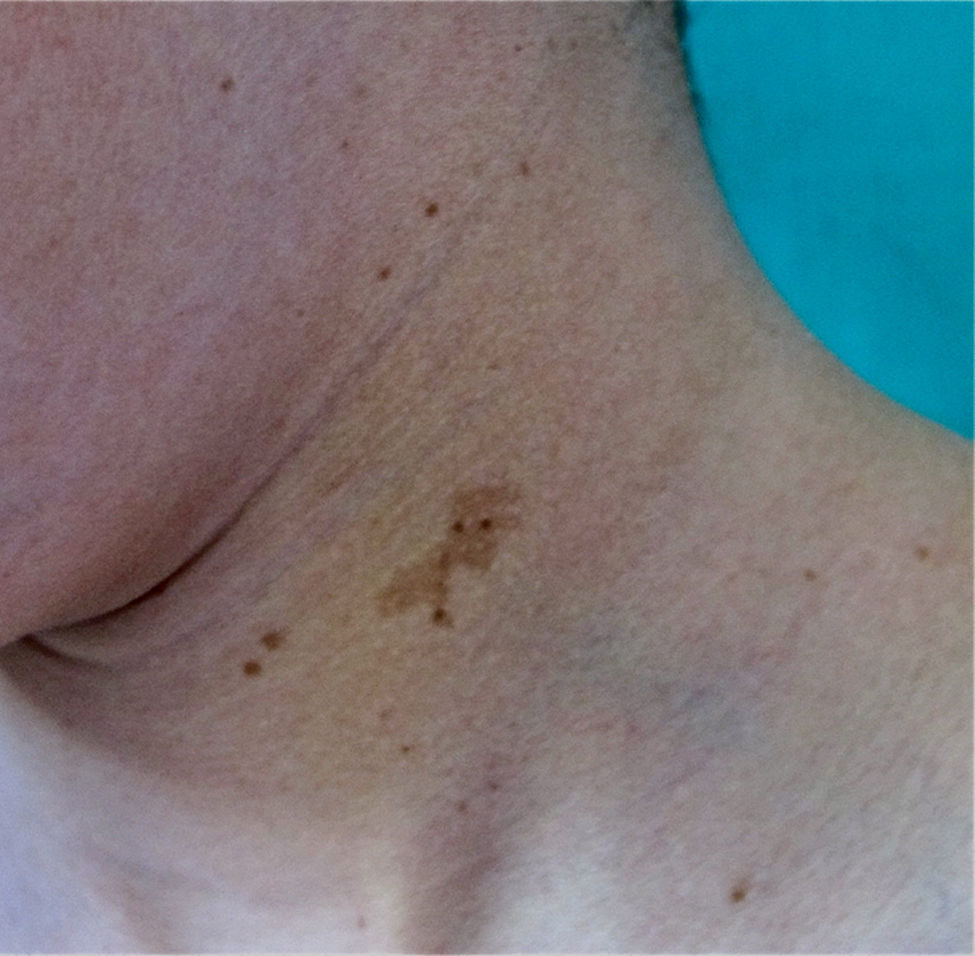
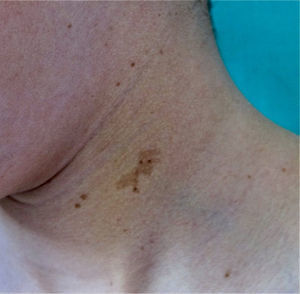
Efélides o pecasLas efélides, clásicamente denominado signo de Crowe, son lesiones pigmentadas de pequeño tamaño (1 o 2mm) y color marrón claro que no suelen estar desde el nacimiento, sino que se desarrollan durante la infancia, habitualmente a partir de los 2 años de vida11,40. Excepcionalmente se observan de modo congénito, y raramente en los primeros meses de la vida11. La presencia de pecas axilares e inguinales es muy característica, y su detección satisface uno los 7 criterios clínicos diagnósticos, pero también pueden observarse en otras localizaciones como la cara, el cuello y el tronco (fig. 5). Su incidencia es muy variable, oscilando entre el 21% y el 93,7%, incluso dentro de series exclusivamente pediátricas9,10. El número de efélides (que oscila entre una o 2 lesiones a decenas), el tamaño (no siempre milimétrico) y la localización de las mismas (a veces fuera de los pliegues) es extraordinariamente variable, lo cual puede explicar los porcentajes de prevalencia tan dispares. Los hallazgos histológicos y ultraestructurales son idénticos a los de las MCCL, por lo que algunos autores proponen incluir efélides y MCCL en un mismo criterio diagnóstico41, propuesta con la que nosotros estamos de acuerdo, máxime si se tiene en cuenta que el SLG verifica estos 2 criterios en el 48% de los casos y la presencia de ambos criterios no aumenta la especificidad diagnóstica24.
Las efélides pueden aparecer en otras enfermedades genéticas con las que hay que hacer el diagnóstico diferencial (tabla 2), particularmente en los casos en los que coexisten con MCCL.
NeurofibromasLos neurofibromas son tumores benignos que derivan de la vaina neural de los nervios periféricos. Se componen de una mezcla celular heterogénea que incluye células de Schwann, fibroblastos y células perineurales, mastocitos, axones, células endoteliales y abundante matriz extracelular. Parece que la célula que prolifera inicialmente es la célula de Schwann, y que es en ella donde el gen NF1 se inactiva bialélicamente42. La presencia de al menos 2 neurofibromas cutáneos o al menos un neurofibroma plexiforme constituye un criterio diagnóstico de NF1. Sin embargo, no suelen desarrollarse (o hacerse evidentes) en la primera infancia, por lo que pueden pasar años antes de que el paciente cumpla este criterio15. Se calcula que aproximadamente el 38% de los pacientes presenta uno o varios tipos de neurofibroma antes de los 17 años9–11.
La clasificación de los neurofibromas varía según los autores, y a menudo resulta confusa porque mezcla términos clínicos e histológicos; en algunos casos se clasifican como superficiales, profundos y plexiformes7, mientras que en otras ocasiones se dividen en cutáneos, subcutáneos y plexiformes (nodulares y difusos)43. En realidad, es difícil clasificar los neurofibromas atendiendo a criterios exclusivamente clínicos o histológicos, ya que existen lesiones difícilmente clasificables porque tienen patrón infiltrativo mixto, presentan más de un componente histológico, o sufren transformaciones histológicas y clínicas a lo largo de la vida. Además, en cualquier intento de clasificación clínica es conveniente mantener los términos de los criterios clínicos vigentes del NIH que utiliza toda la comunidad científica.
Teniendo en cuenta lo anterior, nosotros proponemos una clasificación clínica partiendo de 2 grandes grupos: neurofibromas superficiales y neurofibromas profundos (tabla 3). Dentro de los neurofibromas superficiales diferenciaremos los neurofibromas cutáneos (también denominadas dérmicos en la literatura) y los subcutáneos, que aunque también pueden tener un componente dérmico, se localizan fundamentalmente a nivel del tejido celular subcutáneo e incluso infiltran partes blandas en profundidad. Los neurofibromas subcutáneos pueden ser nodulares o difusos a la palpación, mientras que los profundos no suelen ser palpables y precisan pruebas de imagen para su visualización. En la práctica, la mayoría de los neurofibromas subcutáneos y los neurofibromas profundos suelen corresponder a neurofibromas plexiformes de los criterios clínicos del NIH.
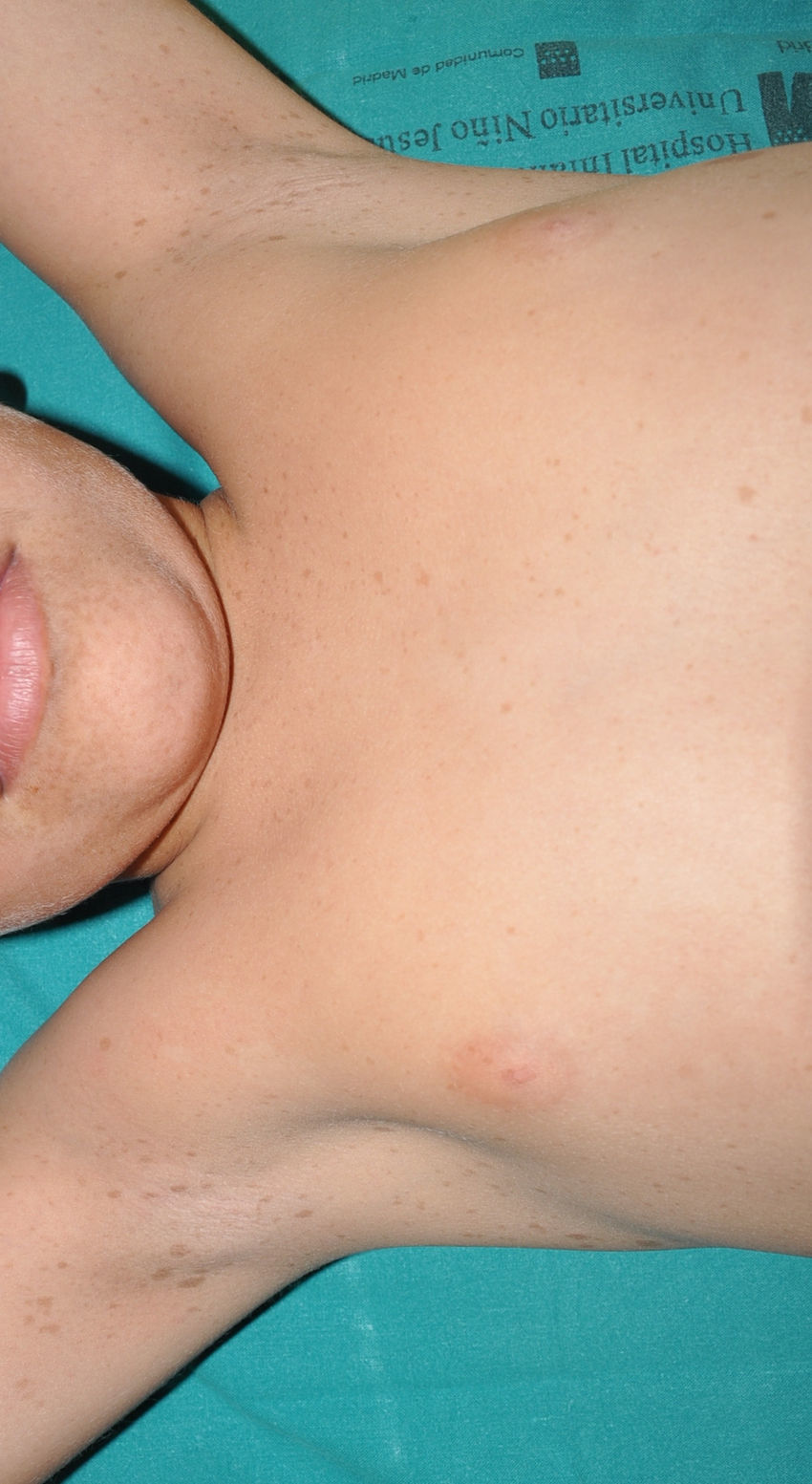
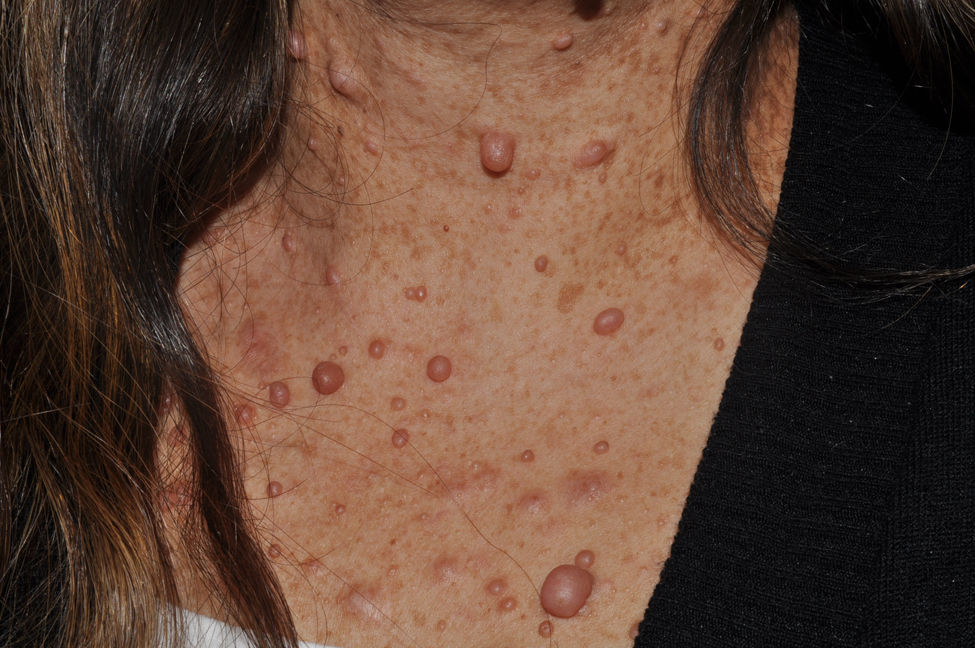
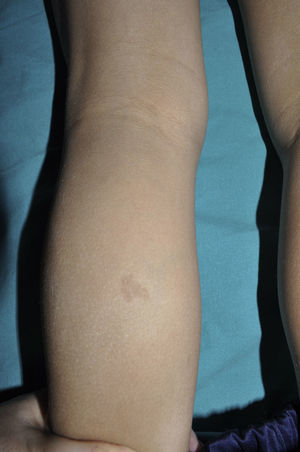
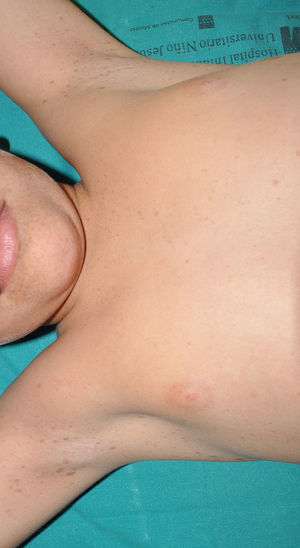
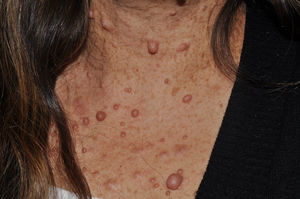
Los neurofibromas cutáneos son los más frecuentes, y suelen aparecer a partir de los 8 años, aumentando su número con la edad13,15. En la fase inicial los neurofibromas cutáneos son casi imperceptibles, apenas sobreelevados y muy discretamente palpables (fig. 6). Presentan 2 periodos críticos de desarrollo, la adolescencia y el embarazo44, por lo que se cree que son hormonodependientes y, de hecho, se ha demostrado que poseen receptores para progesterona45. Son, en su morfología más típica, lesiones sobreelevadas, sésiles, de consistencia blanda o elástica y depresibles a la palpación (signo del ojal de botón o button holing) (fig. 7). Se encuentran en cualquier localización, pero tienen especial predilección por el tronco y, en el caso de las mujeres adultas, la zona periareolar. A veces se observan de manera solitaria en individuos sanos, requiriéndose un mínimo de 2 lesiones para que se puedan considerar criterio de NF1. Aunque suelen ser asintomáticos, pueden producir picor, que se atribuye a la gran cantidad de mastocitos que los infiltran. En ocasiones precisan extirpación quirúrgica cuando por su número o tamaño provocan problemas estéticos o funcionales, pero la transformación maligna es excepcional43. Desde el punto de vista histológico los neurofibromas cutáneos son tumores no encapsulados caracterizados por una mezcla de células de Schwann, fibroblastos, mastocitos y células perineurales inmersas en un estroma colágeno de variable componente mixoide.
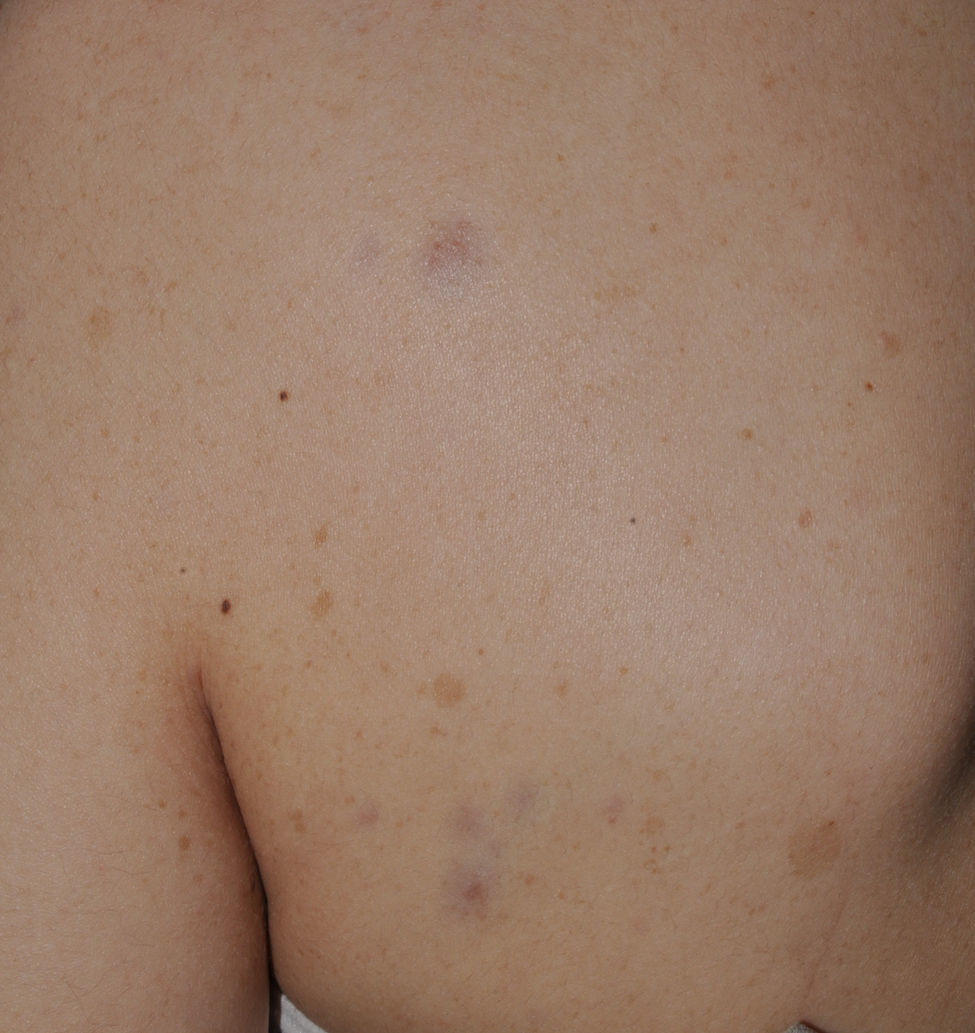
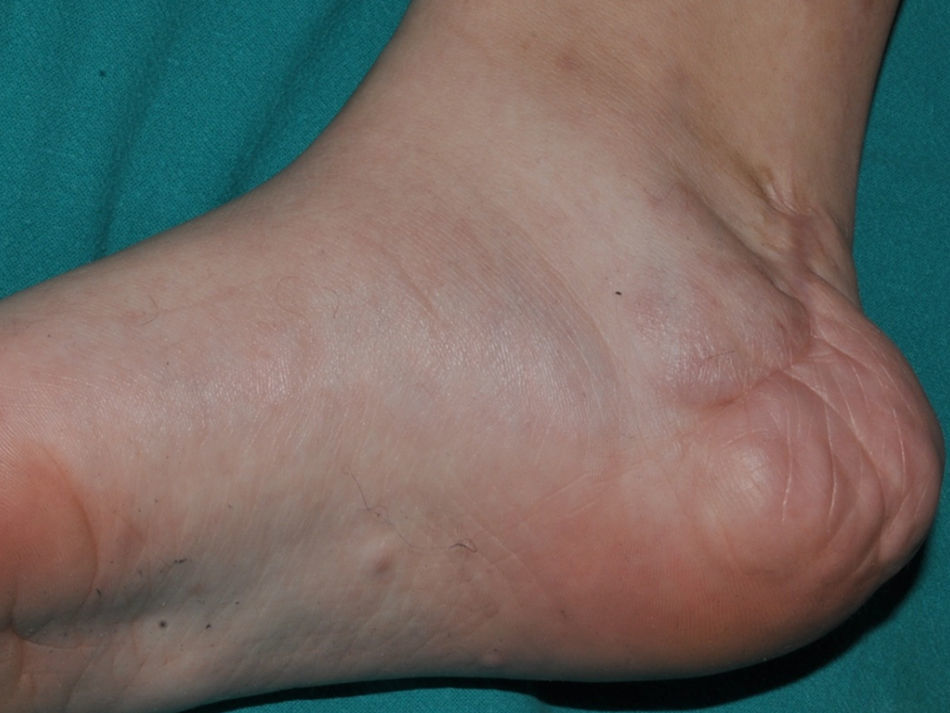
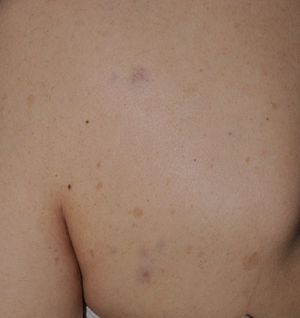
Las denominadas máculas rojo-azuladas (MRA) y los neurofibromas pseudoatróficos son 2 variantes de neurofibromas cutáneos de localización preferentemente troncular46,47. Las MRA son lesiones de 1-2cm de diámetro de un color rojo-azulado tenue, no sobreelevadas (o ligeramente abultadas), y depresibles a la palpación (fig. 8), mientras que los neurofibromas pseudoatróficos miden unos 5-10cm y presentan un aspecto similar al de la piel normal, pero están ligeramente deprimidos y son blandos a la palpación. Parecen estar presentes en aproximadamente el 9% de los pacientes adultos47. Aunque no existen estudios en niños, probablemente tengan la misma cronología de aparición que los neurofibromas cutáneos típicos, y nosotros los detectamos sobre todo en adolescentes. La sutileza de su color y/o la ausencia de relieve les hace pasar desapercibidos con frecuencia, pero pueden constituir el dato diagnóstico de confirmación de la enfermedad48. Histológicamente las MRA se caracterizan por la proliferación de tejido neural que rodea o infiltra los vasos en la dermis papilar y reticular, mientras que los neurofibromas pseudoatróficos muestran disminución del colágeno en la dermis reticular y un aumento del tejido neural perivascular47,49.
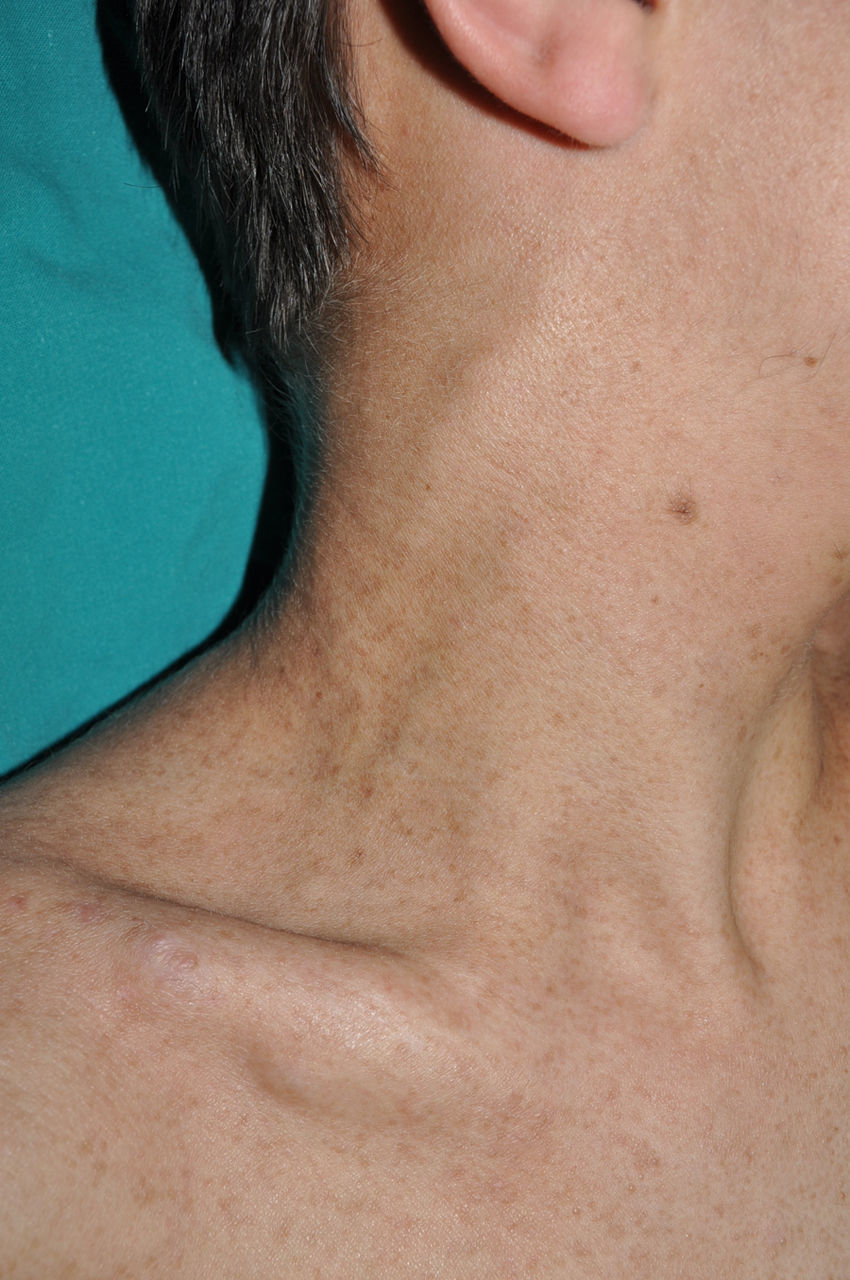
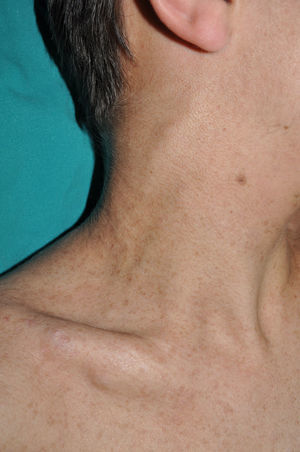
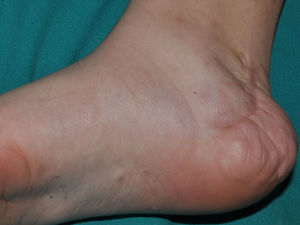
Los neurofibromas subcutáneos, que habitualmente catalogamos como neurofibromas plexiformes debido a que suelen asociar este patrón histológico43, pueden ser predominantemente difusos o nodulares a la palpación. Los difusos se manifiestan como masas subcutáneas más o menos extensas, de límites mal definidos y consistencia elástica. Los neurofibromas subcutáneos nodulares consisten en lesiones nodulares de consistencia gomosa que siguen el trayecto de los nervios periféricos, palpándose como lesiones lineales y arrosariadas de consistencia firme7. Pueden aparecer en cualquier parte, pero son particularmente frecuentes en el polo cefálico y el cuello, donde en la etapa inicial pueden confundirse con adenopatías (fig. 9).
Algunos neurofibromas superficiales pueden ser evidentes en el momento del nacimiento, y en aproximadamente un 5% de los pacientes se observa hiperpigmentación y/o hipertricosis suprayacente congénita9 (fig. 3). Con el paso de los años se hacen palpables y adoptan la consistencia típica de los neurofibromas en saco de gusanos (fig. 10). El reconocimiento precoz de este tipo de neurofibromas en los niños menores de 2 años con MCCL es importante, porque constituyen el criterio clínico adicional necesario para el diagnóstico de certeza de la NF1. Hay que distinguirlos de MCCL extensas, hamartomas de músculo liso, nevus de Becker y nevus melanocíticos congénitos.
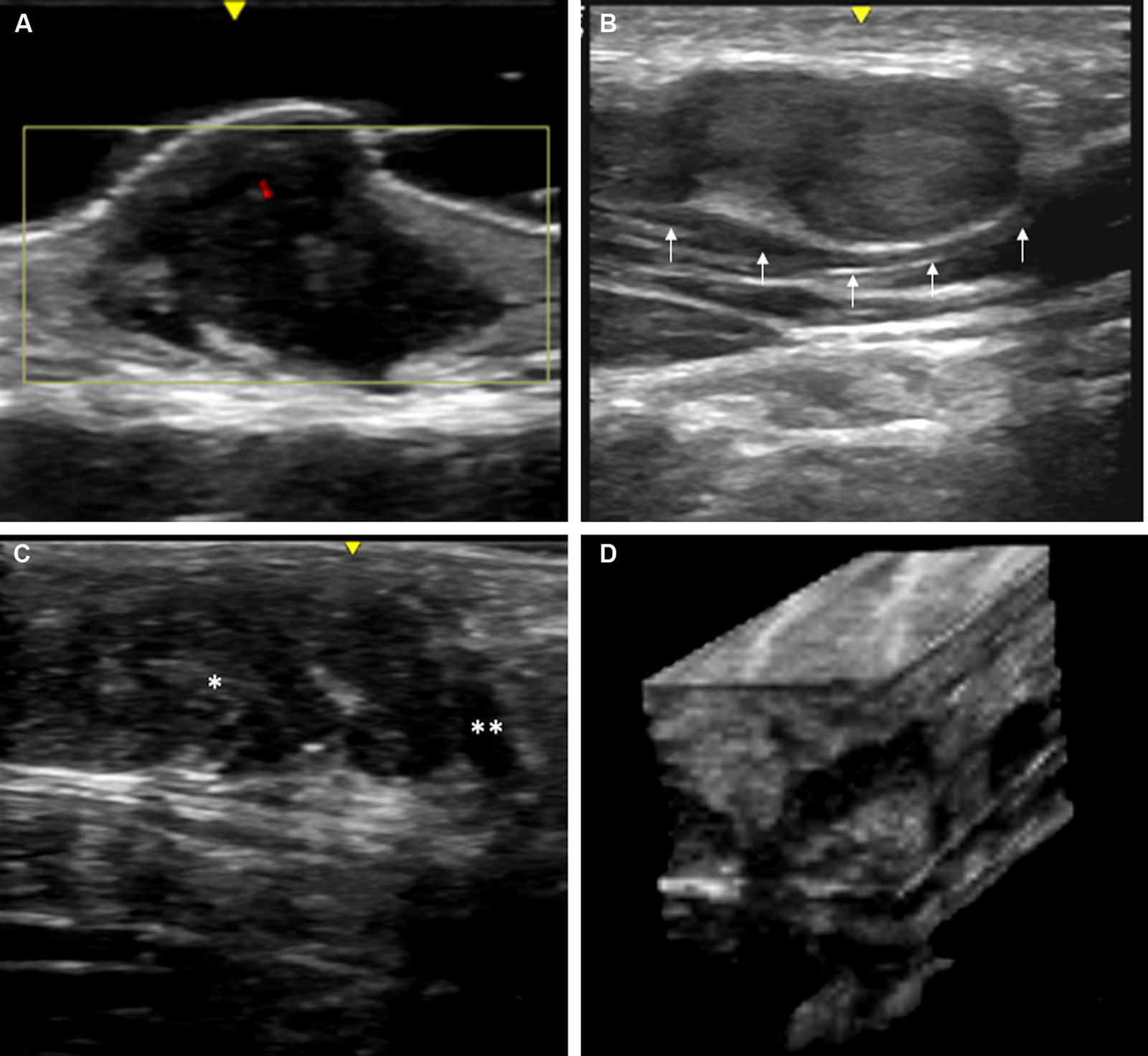
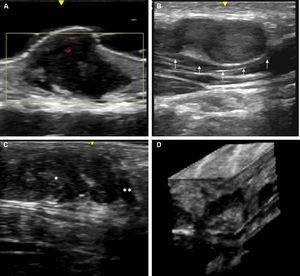
La ecografía cutánea con sondas de alta resolución (20-22MHz) permite la confirmación diagnóstica de los neurofibromas superficiales de manera rápida y no invasiva. Es característica la presencia de zonas hipoecoicas dérmicas de límites bien definidos (neurofibromas cutáneos, localizados en la dermis), dermohipodérmicas irregulares (neurofibromas subcutáneos difusos) o de morfología oval o arrosariada (neurofibromas subcutáneos nodulares) en el tejido celular subcutáneo, siendo el estudio doppler de la vascularización intralesional tenue o ausente50,51 (fig. 11).
Ecografía de alta resolución (20MHz) de distintos neurofibromas. A. Neurofibroma superficial cutáneo donde se aprecia un área hipoecoica bien delimitada en el seno de la dermis que muestra una mínima señal doppler (color rojo). B. Neurofibroma subcutáneo nodular del paciente representado en la figura 9, donde se aprecia una lesión bilobulada bien delimitada heteroecogénica y con leve refuerzo posterior que sigue el trayecto lineal de un nervio periférico laterocervical. C. Neurofibroma subcutáneo que ocupa el tejido celular subcutáneo y la dermis profunda en el que se aprecian zonas difusas (*) y otras cordonales (**).D. Reconstrucción tridimensional ecográfica en la que se aprecia un área lineal convoluta en relación con el engrosamiento de un nervio periférico.
Los neurofibromas profundos (o internos) no se suelen relacionar directamente con la piel, y con frecuencia pasan desapercibidos al examen clínico, suelen estar presentes desde el nacimiento, tardan en desarrollarse y hacerse sintomáticos, por lo que su detección es más tardía. Pueden tener morfología nodular o más bien difusa y presentarse en cualquier localización, de la que dependerá su sintomatología y morbilidad. Aunque el tamaño aumenta a partir de la adolescencia y es más acusado en el sexo femenino, no se han encontrado marcadores hormonales que lo justifiquen44,52. Varios estudios, incluyendo nuestra serie de pacientes, han calculado una prevalencia de estas lesiones en los niños en torno al 10%9,13. Debido a que el 8-13% de estos neurofibromas pueden experimentar transformación maligna43, y que no pueden ser detectados en la exploración clínica, se ha intentado establecer indicadores de su existencia, observándose que los adultos jóvenes (edad igual o menor de 30 años), sin apenas estigmas cutáneos de NF1 (es decir, con menos de 6 MCCL y sin neurofibromas cutáneos), pero con 2 o más neurofibromas subcutáneos son indicativos de la posible presencia de neurofibromas internos, dato que debe tenerse en cuenta para el seguimiento53. Aunque algunos autores detectan neurofibromas plexiformes en el 57% de los pacientes en los que se realiza una RMN de cuerpo entero54, en la actualidad no existen directrices acerca de qué pacientes deben ser monitorizados con estos estudios radiológicos.
Hay 2 variedades de NF1 cuya característica fundamental es la existencia de neurofibromas profundos: la neurofibromatosis espinal, en la que existen neurofibromas profundos bilaterales en todas las raíces espinales con o sin otros estigmas de NF155, y la neurofibromatosis orbitaria o cráneo-orbitotemporal, en la que el neurofibroma ocupa toda la órbita, invade los músculos orbitarios y se asocia a exoftalmos, asimetría ocular, deformidad temporal, displasia del esfenoides y herniación del lóbulo temporal56. Esta última forma de NF1 es terriblemente desfigurante y muy difícil de corregir.
Desde el punto de vista histológico los neurofibromas pueden ser mixoides (muchos de los dérmicos), difusos (con el estroma más colagenizado que mixoide e infiltrativos), o plexiformes, variante en la que se observa un engrosamiento tortuoso de los nervios periféricos y que se considera patognomónica de la NF1. No obstante, con relativa frecuencia el patrón histológico difuso y plexiforme coexisten en las lesiones subcutáneas y profundas57, por lo que la nomenclatura clínica no siempre coincide con las características histológicas.
Los neurofibromas de crecimiento masivo, en los que la cirugía es impracticable, causan una significativa morbilidad en los pacientes con NF1. Existen ensayos clínicos en curso58 y se están desarrollando modelos animales para evaluar la eficacia de los inhibidores MEK 1/2 en estos tumores54.
A diferencia de lo comentado con las lesiones pigmentarias típicas de la NF1, que no son patognomónicas per se, ninguna otra enfermedad con MCCL y efélides asocia neurofibromas. Los neurofibromas subcutáneos masivos pueden requerir diagnóstico diferencial histológico con algunos síndromes (tabla 2).
En conclusión, las MCCL y las efélides son los estigmas más conocidos de la NF1, pero no son patognomónicos de la enfermedad y resultan insuficientes para el diagnóstico de certeza en los primeros años de la vida. Dado que los neurofibromas no se desarrollan (o se hacen evidentes) hasta la edad escolar, es recomendable realizar un seguimiento periódico de estos pacientes, descartar la presencia de otros criterios diagnósticos no cutáneos y considerar otros posibles diagnósticos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al doctor Francisco Javier García Martínez, dermatólogo del Hospital del Sureste (Arganda, Madrid), por su ayuda en la captación y descripción de las imágenes ecográficas de los neurofibromas superficiales.