La leishmaniasis es una enfermedad crónica causada por un protozoo flagelado perteneciente al género Leishmania. Tiene distribución mundial, aunque la mayoría de los casos se agrupan en América del Sur, la cuenca mediterránea y algunas zonas de Asia y África. Existen 3 formas fundamentales de enfermedad: cutánea (la más frecuente), mucocutánea y visceral, también denominada kala-azar, la forma más grave. El diagnóstico se establece con la demostración de la presencia de los amastigotes en muestras clínicas, mediante visión directa al microscopio o mediante técnicas moleculares. Existen múltiples opciones terapéuticas, aunque la evidencia en la que se basa el tratamiento de la leishmaniasis cutánea es débil. Actualmente, las alteraciones de la inmunidad producidas por factores como el VIH o el uso de fármacos anti-TNF han cambiado tanto la forma de presentación de las formas clínicas clásicas como sus tratamientos.
Leishmaniasis is a chronic disease caused by flagellate protozoa of the genus Leishmania. It is a global disease, but most cases are seen in South America, the Mediterranean, and some areas of Asia and Africa. The 3 main types of leishmaniasis are cutaneous (the most common), mucocutaneous, and visceral (the most severe). Visceral leishmaniasis is also known as kala-azar. Leishmaniasis is diagnosed by demonstrating the presence of Leishmania amastigotes in clinical specimens using direct microscopic examination or molecular analysis. Various treatments exist, although the evidence supporting the options available for cutaneous leishmaniasis is weak. Both the classical presentation of leishmaniasis and our management of the disease have changed in recent decades because of acquired immune deficiency caused by conditions such as HIV infection or the use of TNF inhibitors.
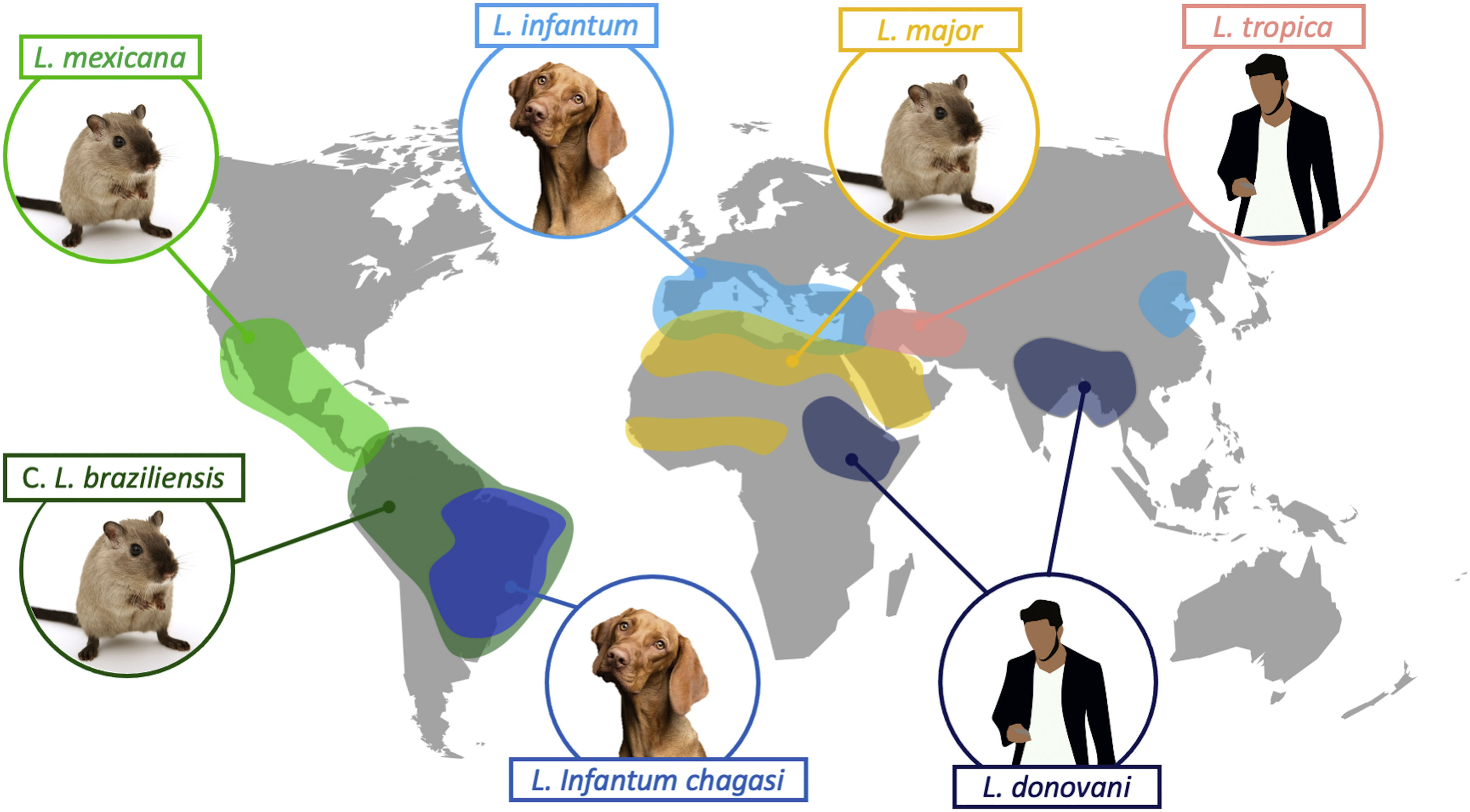
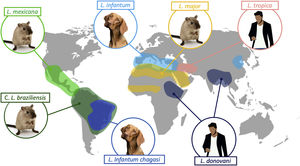
La leishmaniasis es una enfermedad crónica causada por un protozoo flagelado perteneciente al género Leishmania. Es un parásito intracelular obligado del cual existen más de 20 especies y que se transmite por la picadura de flebótomos hembra infectados, de los géneros Phlebotomus y Lutzomyia. Es una enfermedad fundamentalmente zoonótica, siendo los cánidos y los roedores el reservorio principal, con la excepción de la producida por Leishmania donovani y Leishmania tropica, cuyo reservorio principal es el ser humano.
EpidemiologíaLa Organización Mundial de la Salud (OMS) estima entre 700.000 y un millón de casos nuevos al año, de los cuales alrededor de 50.000-90.000 son de leishmaniasis visceral (LV)1. Aproximadamente el 95% de los casos de leishmaniasis cutánea (LC) se producen en América del Sur, la Cuenca del Mediterráneo, Oriente Medio y Asia Central; y la mayoría de los casos de LV se producen en Brasil, África Oriental e India. En 2018, más del 85% de los casos de LC se registraron en 10 países: Afganistán, Argelia, Bolivia, Brasil, Colombia, Irán, Irak, Pakistán, Siria y Túnez1, y más del 95% de los casos nuevos de LV notificados a la OMS se produjeron en: Brasil, China, Etiopía, India, Irak, Kenia, Nepal, Somalia y Sudán1. Finalmente, más del 90% de los casos de leishmaniasis mucocutánea (LMC) se producen en Brasil, Bolivia, Etiopía y Perú1.
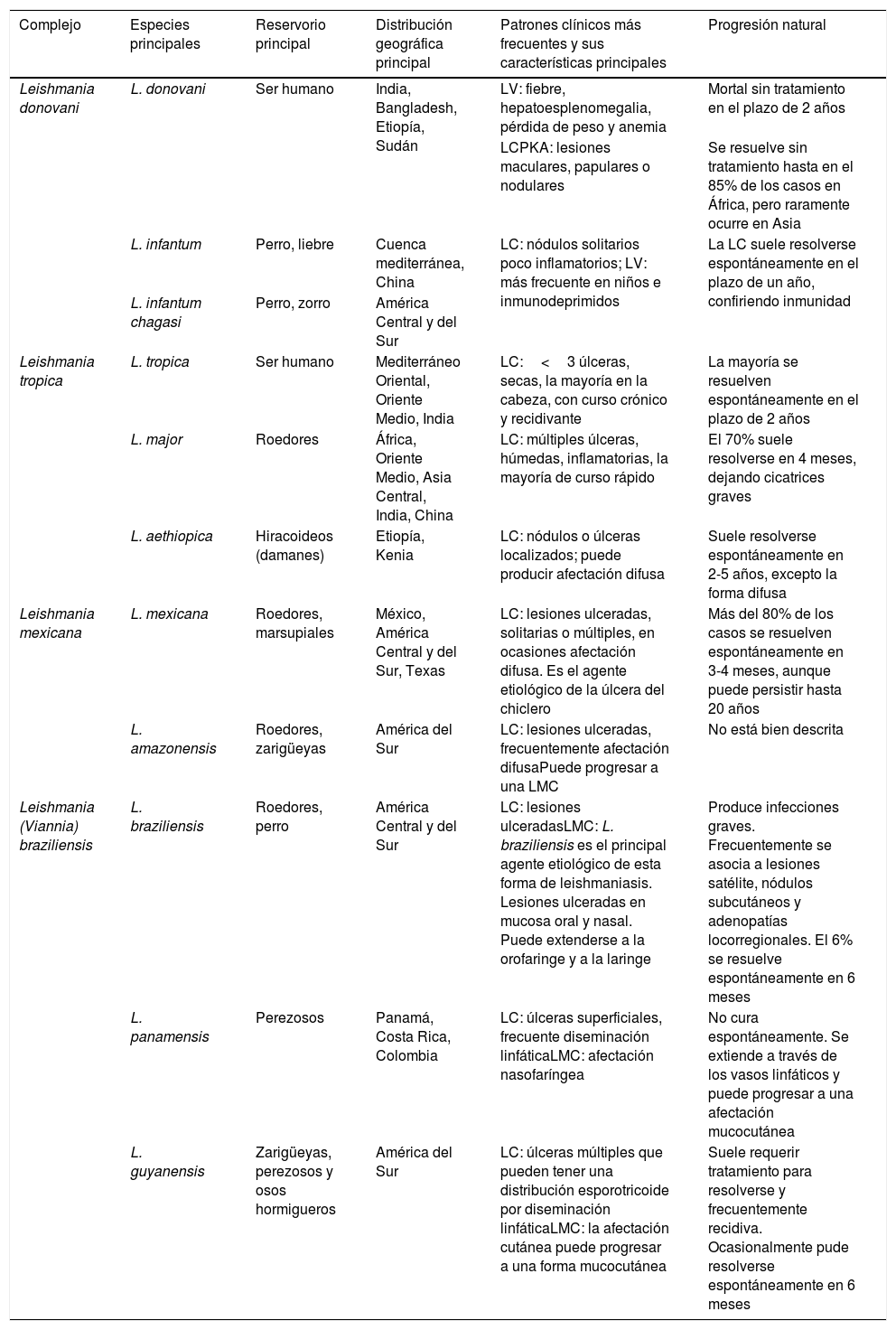
Clásicamente, la leishmaniasis se ha clasificado en función de la región del mundo en la que ocurre. Así, la leishmaniasis del Viejo Mundo es la que se produce en Asia, África y Europa, y las especies más frecuentemente implicadas son: L. tropica, Leishmania major, Leishmania aethiopica, Leishmania infantum y L. donovani; y la leishmaniasis del Nuevo Mundo es la que se produce en América, y las especies más frecuentemente implicadas son: Leishmania mexicana, Leishmania amazonensis, Leishmania braziliensis, Leishmania panamensis y Leishmania infantum chagasi (subespecie de L. infantum en el Nuevo Mundo, antes conocida como L. chagasi)2. En la tabla 1 se recogen los patrones epidemiológicos y clínicos de las especies más frecuentes de Leishmania2–5, y en la figura 1 la distribución geográfica de las principales especies, así como sus reservorios fundamentales.
Características clínicas y epidemiológicas de las principales especies de Leishmania
| Complejo | Especies principales | Reservorio principal | Distribución geográfica principal | Patrones clínicos más frecuentes y sus características principales | Progresión natural |
|---|---|---|---|---|---|
| Leishmania donovani | L. donovani | Ser humano | India, Bangladesh, Etiopía, Sudán | LV: fiebre, hepatoesplenomegalia, pérdida de peso y anemia | Mortal sin tratamiento en el plazo de 2 años |
| LCPKA: lesiones maculares, papulares o nodulares | Se resuelve sin tratamiento hasta en el 85% de los casos en África, pero raramente ocurre en Asia | ||||
| L. infantum | Perro, liebre | Cuenca mediterránea, China | LC: nódulos solitarios poco inflamatorios; LV: más frecuente en niños e inmunodeprimidos | La LC suele resolverse espontáneamente en el plazo de un año, confiriendo inmunidad | |
| L. infantum chagasi | Perro, zorro | América Central y del Sur | |||
| Leishmania tropica | L. tropica | Ser humano | Mediterráneo Oriental, Oriente Medio, India | LC:<3 úlceras, secas, la mayoría en la cabeza, con curso crónico y recidivante | La mayoría se resuelven espontáneamente en el plazo de 2 años |
| L. major | Roedores | África, Oriente Medio, Asia Central, India, China | LC: múltiples úlceras, húmedas, inflamatorias, la mayoría de curso rápido | El 70% suele resolverse en 4 meses, dejando cicatrices graves | |
| L. aethiopica | Hiracoideos (damanes) | Etiopía, Kenia | LC: nódulos o úlceras localizados; puede producir afectación difusa | Suele resolverse espontáneamente en 2-5 años, excepto la forma difusa | |
| Leishmania mexicana | L. mexicana | Roedores, marsupiales | México, América Central y del Sur, Texas | LC: lesiones ulceradas, solitarias o múltiples, en ocasiones afectación difusa. Es el agente etiológico de la úlcera del chiclero | Más del 80% de los casos se resuelven espontáneamente en 3-4 meses, aunque puede persistir hasta 20 años |
| L. amazonensis | Roedores, zarigüeyas | América del Sur | LC: lesiones ulceradas, frecuentemente afectación difusaPuede progresar a una LMC | No está bien descrita | |
| Leishmania (Viannia) braziliensis | L. braziliensis | Roedores, perro | América Central y del Sur | LC: lesiones ulceradasLMC: L. braziliensis es el principal agente etiológico de esta forma de leishmaniasis. Lesiones ulceradas en mucosa oral y nasal. Puede extenderse a la orofaringe y a la laringe | Produce infecciones graves. Frecuentemente se asocia a lesiones satélite, nódulos subcutáneos y adenopatías locorregionales. El 6% se resuelve espontáneamente en 6 meses |
| L. panamensis | Perezosos | Panamá, Costa Rica, Colombia | LC: úlceras superficiales, frecuente diseminación linfáticaLMC: afectación nasofaríngea | No cura espontáneamente. Se extiende a través de los vasos linfáticos y puede progresar a una afectación mucocutánea | |
| L. guyanensis | Zarigüeyas, perezosos y osos hormigueros | América del Sur | LC: úlceras múltiples que pueden tener una distribución esporotricoide por diseminación linfáticaLMC: la afectación cutánea puede progresar a una forma mucocutánea | Suele requerir tratamiento para resolverse y frecuentemente recidiva. Ocasionalmente pude resolverse espontáneamente en 6 meses |
LC: leishmaniasis cutánea; LCPKA: leishmaniasis cutánea post-kala-azar; LMC: leishmaniasis mucocutánea; LV: leishmaniasis visceral.
En España, la leishmaniasis es una zoonosis endémica en el territorio peninsular y en las Islas Baleares. La especie más frecuentemente identificada es L. infantum, tanto en las formas viscerales como cutáneas, y las 2 especies de flebótomos que transmiten el parásito son Phlebotomus perniciosus y Phlebotomus ariasi6. El reservorio principal de L. infantum es el perro; sin embargo, se han descrito otros reservorios, como las liebres7 o las ratas8. Además de la forma endémica, existen casos asociados a la coinfección con el virus de la inmunodeficiencia humana (VIH)9 o a otras situaciones de inmunodepresión, como por ejemplo el uso de fármacos inhibidores del factor de necrosis tumoral (anti-TNF)10; y brotes epidémicos, como el de Madrid de 2009-20137. Por último, fenómenos como la globalización, la migración humana y los viajes internacionales han aumentado su prevalencia en países desarrollados11.
PatogeniaEl flebótomo hembra infectado inyecta el parásito en su estado de promastigote en la piel del ser humano. Los promastigotes son fagocitados por los macrófagos y se transforman en amastigotes. Estos se multiplican en su interior e infectan otras células fagocíticas mononucleares. Por su parte, el flebótomo se infecta al ingerir células infectadas durante la ingestión de sangre del huésped. En el intestino de los flebótomos los amastigotes se transforman en promastigotes12. El período de incubación varía en función de la forma clínica, siendo generalmente menor o igual a 2 semanas y hasta 2 meses para la LC, de 3 a 9 meses para la LV y de hasta más de 2 años para la LMC13.
Las manifestaciones clínicas de la leishmaniasis dependerán fundamentalmente de la especie de Leishmania14 (tabla 1) y de la respuesta inmune del huésped15. El espectro inmunológico varía desde una respuesta intensa mediada por células T, con la consiguiente producción de interferón-γ, hasta una respuesta humoral con la producción de altos niveles de anticuerpos. Las especies de Leishmania son eliminadas por macrófagos activados mediante el interferón-γ, pero los anticuerpos no pueden neutralizarlas, por lo que los individuos con una intensa respuesta celular tienen pocos parásitos en las lesiones, mientras que los individuos con respuesta humoral son incapaces de controlar la infección, como ocurre en la LC difusa. No obstante, una respuesta Th1 exagerada y un incremento del número de TCD8+ están asociados a una mayor gravedad de la enfermedad, como el desarrollo de una LMC15.
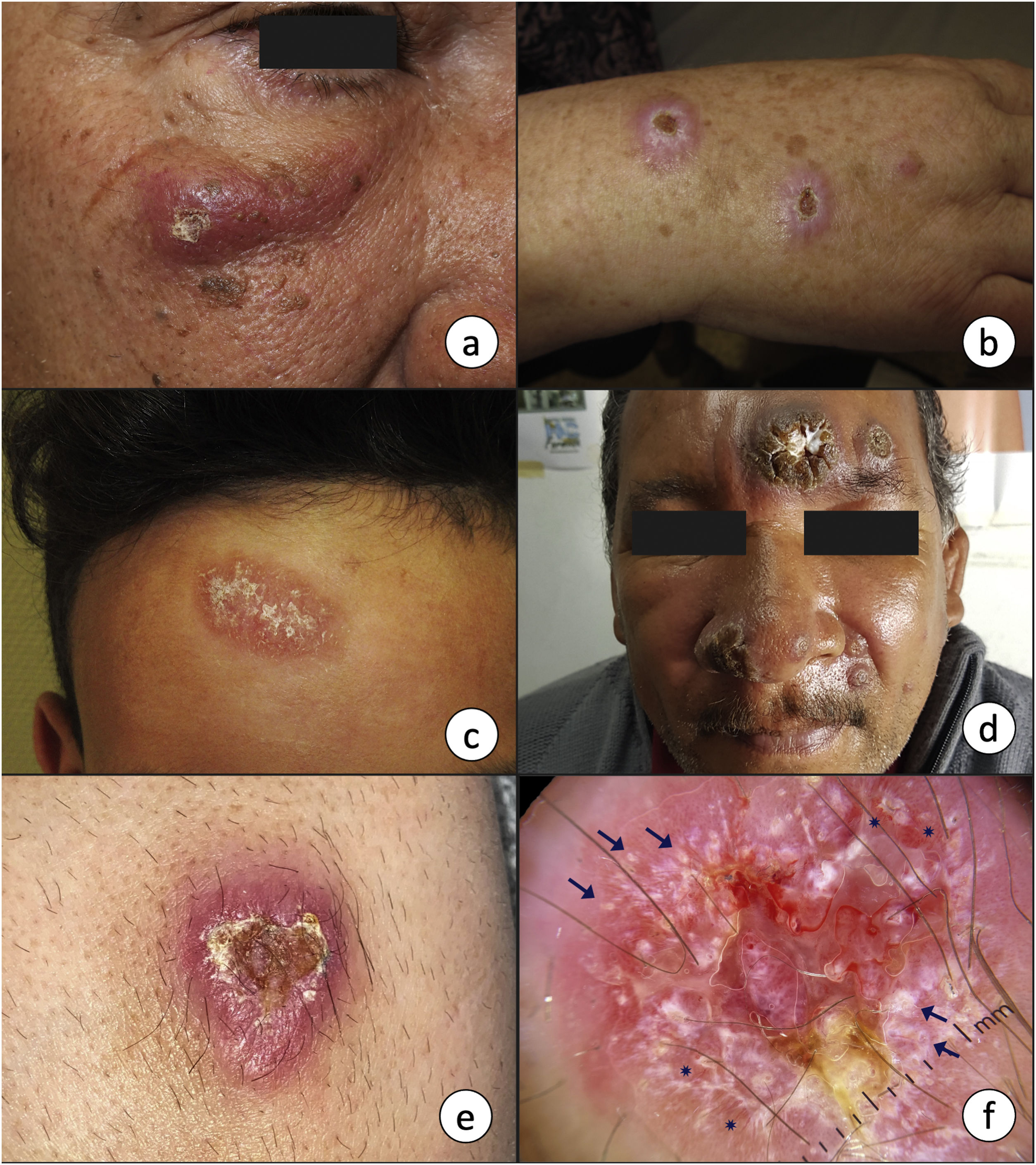
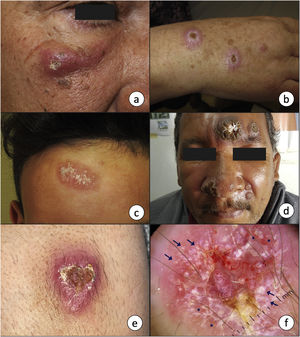
Manifestaciones clínicasLeishmaniasis cutáneaEn el sitio de inoculación del parásito se forma una pápula, que típicamente progresa a una placa o nódulo con tendencia a la ulceración (fig. 2a-e). Frecuentemente aparece en sitios expuestos, como la cara o las extremidades. Un ejemplo es la úlcera del chiclero, lesión ulcerada que aparece en el pabellón auricular de los recolectores de goma del árbol del chicle en México y América Central, producida por L. mexicana16. Las lesiones de LC pueden ser solitarias o múltiples y pueden diseminarse a través de los vasos linfáticos, ocasionando adenopatías, lesiones satélites e, incluso, lesiones de distribución esporotricoide17. Existen otras formas de presentación atípica, más frecuentes en el Nuevo Mundo, como lesiones eccematosas, erisipeloides, lupoides, anulares, verrucosas, etc.18. Las lesiones pueden ser autorresolutivas en un plazo de meses y curan dejando cicatriz. No obstante, algunas se vuelven crónicas o diseminadas. La forma crónica recidivante es típica de L. tropica, que se presenta en forma de pápulas en la periferia de la cicatriz de la úlcera previa19. La cronicidad de las lesiones se ha relacionado, entre otros factores, con una mayor actividad de la arginasa en los leucocitos polimorfonucleares20. Por otro lado, existe una forma difusa, producida por L. aethiopica, L. mexicana o L. amazonensis, que se presenta en forma de múltiples pápulas y/o nódulos, no ulcerados, que afectan a la mayor parte de la piel5. Las lesiones contienen numerosos parásitos y pueden afectar intensamente a la cara, confiriéndole un aspecto leonino, de forma análoga a la lepra lepromatosa. La afectación mucosa es frecuente21.
a-c) La presencia de una pápula o nódulo eritematoso de crecimiento progresivo y tendencia a la ulceración en zonas expuestas, como la cara o las extremidades, es la forma de presentación más característica de la leishmaniasis cutánea. d) En ocasiones es posible encontrar varias lesiones en un mismo paciente, así como presentaciones atípicas como la forma verrucosa de la imagen, que se corresponde a una leishmaniasis cutánea del Nuevo Mundo. e) Imagen clínica y f) dermatoscópica de una lesión de leishmaniasis cutánea en el antebrazo que muestra ulceración central rodeada de un área eritematosa con vasos de morfología polimorfa y en horquilla en la periferia (asteriscos), así como estructuras blanco-amarillentas «en lágrima» (flechas) (luz polarizada, ×10).
2c, por cortesía de la Dra. Ana L. Morales Moya; 2d, por cortesía del Dr. Gaston Galimberti; 2e y f, por cortesía de la Dra. Fátima Mayo Martínez.
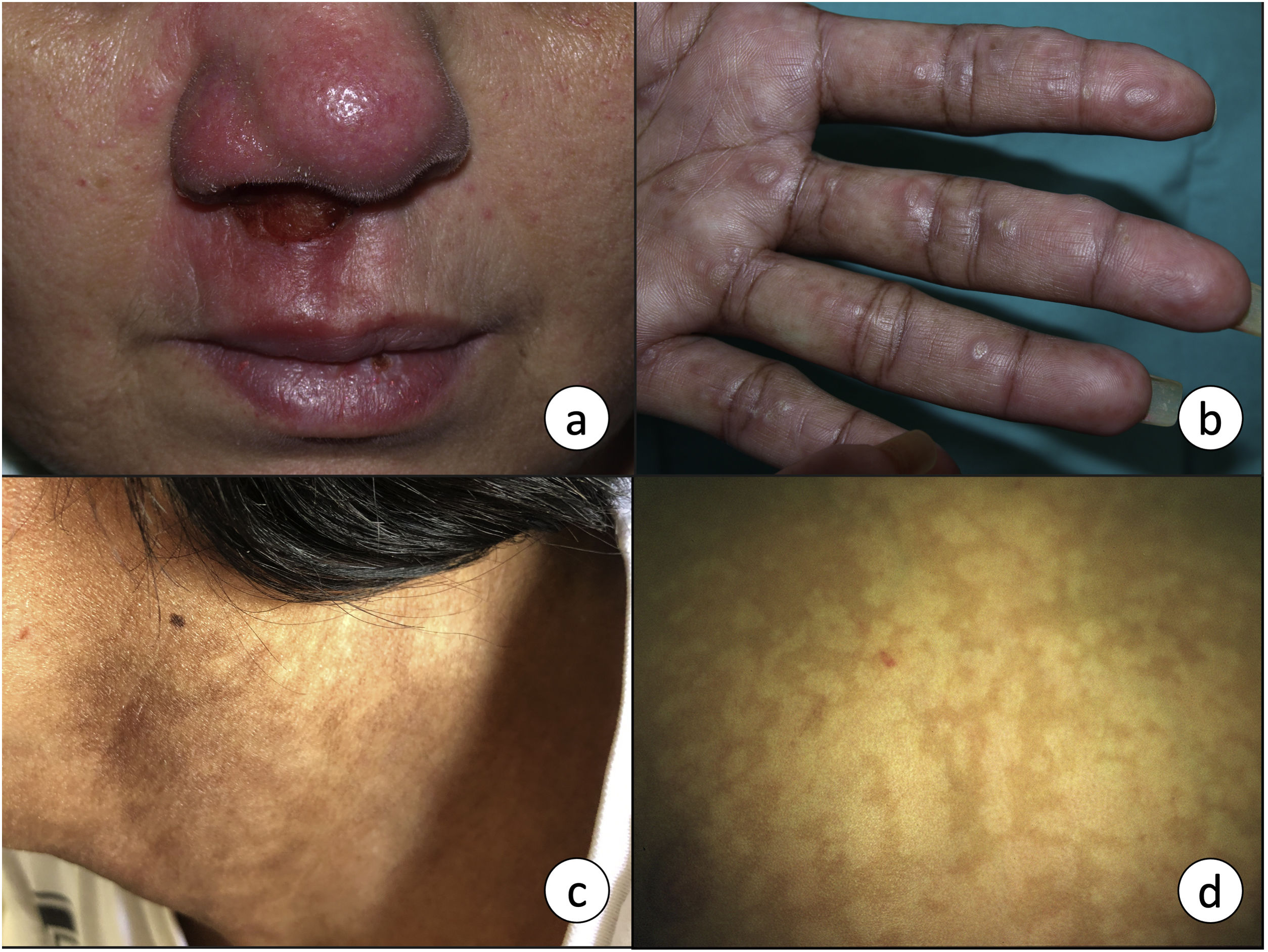
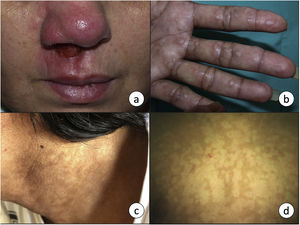
La afectación mucosa puede coexistir con la afectación cutánea o aparecer tras la resolución de esta, incluso años después. La vía de diseminación puede ser hemática o linfática. En los países endémicos, la prevalencia de afectación mucosa puede ser de hasta el 20%22. La mayoría de los casos se producen por L. braziliensis, aunque también se puede producir por L. amazonensis, L. guyanensis y L. panamensis. Las mucosas más frecuentemente afectadas son la nasal (fig. 3a) y la oral, aunque las lesiones pueden extenderse hasta la orofaringe y la laringe, con posible afectación del cartílago y las cuerdas vocales23. Aparece en forma de lesiones ulceradas, que pueden ser desfigurantes, y es potencialmente mortal, por lo que el tratamiento es fundamental para el control de la infección.
a) La leishmaniasis mucocutánea se manifiesta en forma de una úlcera crónica que frecuentemente afecta a la mucosa nasal. b) Leishmaniasis visceral en un paciente infectado por VIH con afectación cutánea en forma de pápulas firmes en palmas de las manos, y c) máculas hiperpigmentadas en zona cervical. d) Máculas hipopigmentadas como manifestación de una leishmaniasis cutánea post-kala-azar en un niño de 7 años. El diagnóstico se realizó mediante técnicas moleculares, ya que la biopsia fue negativa.
Es el resultado de la diseminación de macrófagos infectados a través del sistema reticuloendotelial, con afectación de la médula ósea, el bazo y el hígado. Se caracteriza por fiebre, pérdida de peso, hepatoesplenomegalia y adenopatías, entre otros. Está causada fundamentalmente por L. donovani en adultos y L. infantum o L. chagasi en niños e inmunodeprimidos. La LV también puede presentarse con manifestaciones cutáneas, que pueden ser específicas, como pápulas (fig. 3b), nódulos o úlceras; o inespecíficas, como púrpura o hiperpigmentación (fig. 3c), que probablemente sea el origen del término kala-azar (fiebre negra en hindi). Se ha descrito este signo en el 9,88% de los pacientes con LV24 y recientemente se ha asociado con una mayor producción de hormona adrenocorticotropa25. No obstante, en la histología de dicha hiperpigmentación puede visualizarse la presencia de amastigotes, por lo que quizás esta manifestación pueda considerarse específica de la leishmaniasis26.
Leishmaniasis cutánea post-kala-azarEste tipo de afectación cutánea es una secuela de la leishmaniasis visceral por L. donovani y ocasionalmente por L. infantum, especialmente en inmunodeprimidos27. Puede aparecer hasta 20 años tras el tratamiento28. No obstante, en los pacientes infectados por VIH las lesiones cutáneas pueden coincidir e incluso preceder a la LV29. Se manifiesta como máculas hipopigmentadas (fig. 3d), nódulos color piel y/o pápulas verrucosas, que afectan predominantemente a la cara y pueden extenderse al resto del cuerpo30. Ocurre fundamentalmente en el este de África y en la India, aunque ocasionalmente podemos verla en nuestro medio31. Existen diferencias en la forma de presentación en función de la localización geográfica y de la respuesta inmune. En Asia el 90% de los casos tienen una presentación macular, mientras que en África predomina la forma papular30. En los pacientes inmunodeprimidos es más frecuente y más grave, la forma de presentación puede ser atípica, con lesiones nodulares que no siempre afectan a la cara, y mayor abundancia del parásito en las lesiones32. El diagnóstico diferencial ha de realizarse principalmente con la lepra, en la que habría una pérdida de sensibilidad. Requiere tratamiento sistémico para su curación, aunque en la forma africana puede llegar a resolverse espontáneamente en el plazo de un año.
Coinfección con el VIHEl VIH aumenta el riesgo de desarrollar LV hasta en 2.000 veces33. Esto es así porque ambas infecciones comparten un mecanismo inmunopatogénico en relación con los macrófagos y las células dendríticas que resulta en una progresión acelerada de ambas34. De hecho, el VIH fue el responsable del resurgimiento de la LV en Europa en la década de los 90, principalmente en España, Portugal, Italia y Francia33,35. En concreto, España notificó el 80% de todos los casos de coinfección LV/VIH informados a la OMS36, y en un análisis de los diagnósticos de leishmaniasis en pacientes infectados por VIH hospitalizados en todo el territorio español entre los años 1997-2008 se encontró una prevalencia del 37%37. Clínicamente, la coinfección puede ocasionar que la LV y la LC tengan una presentación atípica18,38,39, menor respuesta terapéutica y mayor mortalidad; así como mayor carga viral y una evolución acelerada al síndrome de inmunodeficiencia adquirida. La introducción de la terapia antirretroviral de gran actividad en 1997 redujo la incidencia de nuevos casos, aumentó la tasa de supervivencia y redujo la de recaídas33. De todo esto se puede concluir que en todo paciente con LV es necesario descartar el VIH y que incluso sería recomendable descartar LV en los pacientes infectados por VIH que vivan en áreas endémicas3.
Leishmaniasis y anti-TNFLos fármacos anti-TNF son ampliamente utilizados en enfermedades inflamatorias como la psoriasis o la artritis reumatoide. El TNF-α participa en la respuesta inmune celular mediante la activación de los linfocitos T CD4+ y CD8+, por lo que es una citocina fundamental en el control inicial de la infección junto con otras citocinas como la IL-12 y el interferón-γ. En zonas endémicas, como el área mediterránea, donde hay una alta exposición a Leishmania, se ha detectado el ADN del parásito en sangre hasta en el 58% de los sujetos sanos; sin embargo, el número de casos de leishmaniasis es limitado40. Es por esto que se cree que la mayoría de los individuos inmunocompetentes son capaces de controlar la infección antes de que se manifieste. Por tanto, se ha planteado que el bloqueo del TNF-α favorecería la reactivación de leishmaniasis latente10. Así mismo, puede modificar la presentación clínica, el curso natural y la respuesta al tratamiento, por lo que, con base en los casos publicados, la mejor aproximación terapéutica parece la suspensión del anti-TNF y el tratamiento sistémico de la infección10, pudiendo reintroducirse el fármaco biológico una vez conseguida la curación, con un seguimiento estrecho. Dentro de los anti-TNF, etanercept y certolizumab parecen tener menor riesgo de reactivación de la leishmaniasis que adalimumab e infliximab41.
DiagnósticoEl diagnóstico de leishmaniasis se establece con la demostración de los amastigotes en muestras clínicas, mediante visión directa al microscopio o a través de técnicas moleculares basadas en la amplificación del ADN nuclear o del cinetoplasto. Los amastigotes tienen una forma redondeada, de 1-4μm de diámetro, con una estructura característica en forma de bastón, llamada cinetoplasto. Los diferentes métodos de toma de muestra y las principales técnicas diagnósticas se recogen en la tabla 242–45. En ocasiones, dada la sensibilidad limitada de algunas de las técnicas, es necesaria la toma de varias muestras y/o la combinación de varias técnicas para llegar al diagnóstico; por ejemplo, de una biopsia se puede utilizar la primera porción para estudio histológico, la segunda porción para la realización de una impronta y la última porción para cultivo. En el caso de la LV, la sensibilidad dependerá del tejido, siendo del 90% en muestras esplénicas (el aspirado de bazo es la prueba de referencia, aunque conlleva un alto riesgo de hemorragia intraabdominal), del 50-85% en muestras de la médula ósea e inferior en muestras ganglionares o en sangre periférica46. Y en la LC post-kala-azar, la sensibilidad del frotis o de la biopsia depende fundamentalmente del tipo de lesión, siendo de hasta el 100% en las formas nodulares, pero muy baja en las formas maculares47, por lo que se requerirán métodos moleculares de mayor sensibilidad48. Para más información acerca de la toma de muestras y las diferentes técnicas de diagnóstico, se pueden consultar las guías de los Centros para el Control y la Prevención de Enfermedades49 y de la Sociedad Americana de Enfermedades Infecciosas50.
Métodos de toma de muestra y técnicas diagnósticas en leishmaniasis cutánea y mucocutánea
| Tipo de lesión | Métodos de toma de muestra | Posibles técnicas de diagnóstico | Técnica | Consideraciones | |
|---|---|---|---|---|---|
| Úlcera | Base | Hisopo: de recolección de ADN. Pasar múltiples veces por la úlcera | PCR | PCR:En tiempo realSe pueden conservar las muestras en etanol a alta concentración o en parafina, aunque con esta última se obtiene menor sensibilidad | Ventajas: es la más sensible y específica, es relativamente rápida y permite identificar la especieInconvenientes: no siempre está disponibleSensibilidad: 100% |
| Impronta: retirar la costra y contactar la base de la úlcera con un portaobjetos | Frotis | Frotis:Tinción con Giemsa y visión directa mediante objetivo ×100 en aceite de inmersiónVisualización de amastigotes y su estructura característica, el cinetoplasto | Ventajas: rápida y barataInconvenientes: no permite identificar la especieSensibilidad: 85% | ||
| Borde | Aspirado con aguja fina: aspirar utilizando una jeringa de 1ml con una aguja de 20-25G y 0,1ml de solución salina estéril al 0,9%. Si no se obtiene material, inyectar 0,05-0,1ml de la solución salina y volver a aspirar | Frotis, cultivo, PCR | Cultivo:Toma de muestra de forma estérilMedio: Novy-MacNeal-Nicolle | Ventajas: permite identificar la especie y supone el diagnóstico definitivoInconvenientes: frecuente contaminación con flora cutánea y baja sensibilidadSensibilidad: 40%Recientemente se han desarrollado técnicas de microcultivo, con mayor sensibilidad (cercana al 100%), pero no permiten identificar la especie | |
| Raspado: obtener muestras de tejido de la dermis superior mediante el raspado con una hoja de bisturí, accediendo a través de una incisión o retirando tejido necrótico. Requiere anestesia local y limitar el sangrado para mejores resultados | Frotis, cultivo, PCR | ||||
| Biopsia: afeitado o punch | Frotis, cultivo, PCR, histología | Histología:Tinción con hematoxilina-eosina | Ventajas: permite descartar otras posibles causas, principalmente malignidadInconvenientes: técnica invasiva, no permite identificar la especie y tiene baja sensibilidadSensibilidad: 60% | ||
| Nódulo/placa | Aspirado con aguja fina | Frotis, cultivo, PCR | |||
| Biopsia | Frotis, cultivo, PCR, histología | ||||
PCR: reacción en cadena de la polimerasa.
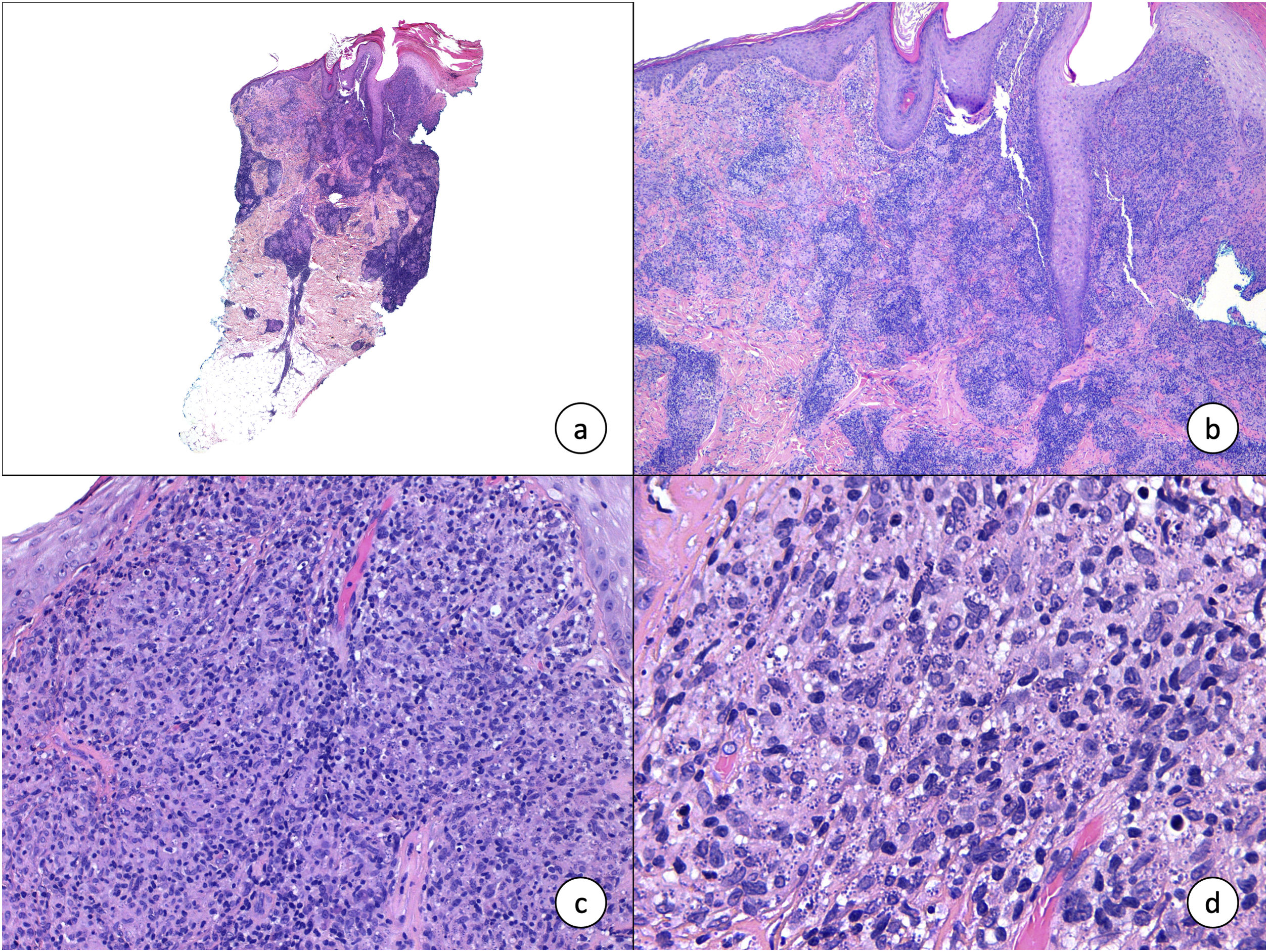
Histológicamente se pueden observar de forma inespecífica ulceración, hiperplasia pseudoepiteliomatosa y un infiltrado inflamatorio mixto, y de forma específica, la presencia de amastigotes en el interior de los macrófagos dérmicos, lo que ocurre en el 50-70% de las biopsias43 (fig. 4). Conforme evoluciona la lesión, aumenta el número de células gigantes y disminuye el de parásitos, observándose granulomas tuberculoides51 y, en estadios avanzados, fibrosis dérmica y abundantes células plasmáticas52. Se han descrito 4 patrones histológicos indicativos de leishmaniasis: 1) la presencia de abundantes amastigotes (45%); 2) una mezcla de macrófagos, neutrófilos y células plasmáticas acompañada de necrosis (27,5%); 3) granulomas incipientes con células epitelioides, linfocitos y células plasmáticas (15%), y 4) granulomas epitelioides completamente formados con células gigantes tipo Langerhans53. Los hallazgos de las diferentes formas cutáneas y la forma mucocutánea son similares, observándose un infiltrado difuso de macrófagos con un gran número de amastigotes en su interior en el caso de la LC difusa52.
a) Panorámica de biopsia tipo punch de lesión nodular eritematosa localizada en antebrazo (hematoxilina-eosina [H-E], ×5]. b) Presencia de un denso infiltrado inflamatorio dérmico superficial, junto con hiperplasia pseudoepiteliomatosa (H-E, ×10). c) Detalle del infiltrado inflamatorio compuesto mayoritariamente por macrófagos, linfocitos y algunas células epitelioides (H-E, ×20). d) Amastigotes característicos de la infección por Leishmania infestando el interior de los macrófagos (H-E, ×40).
Por cortesía de la Dra. Elisa Rios Viñuela.
Otra técnica que puede ser de ayuda en el diagnóstico de la LC es la dermatoscopia54. Las estructuras dermatoscópicas más frecuentemente descritas son: eritema (100%); estructuras vasculares (90,6%), entre las que destacan los vasos polimorfos (40,2%), los vasos en horquilla (39,4%) y los vasos arboriformes (38,6%); costra (70,1%), y erosión/ulceración (44,1%). Menos frecuentes pero más características son las estructuras en lágrima blanco-amarillentas (42,5%) y el patrón en estallido de estrellas blancas (8,6%)55 (fig. 2f).
Otras pruebas, de menor utilidad en el diagnóstico de LC, son el test de Montenegro y las pruebas serológicas. El test de Montenegro consiste en la inyección intradérmica del leishmanina y se lee e interpreta de forma similar a la prueba de la tuberculina. Es negativo en la LC difusa, en la LV activa y en la LC post-kala-azar56. No diferencia entre infección actual y pasada y su principal utilidad es epidemiológica.
Respecto a las pruebas serológicas, existen diversas técnicas: test de aglutinación directa, inmunofluorescencia, ELISA y Western blot. Tienen alta sensibilidad en la LV57, no obstante, el título de anticuerpos disminuye muy lentamente tras la curación y no permite diferenciar entre infección actual y pasada. Así mismo, puede presentar reactividad cruzada con otros anticuerpos, como los de la enfermedad de Chagas58. Además, en áreas endémicas muchos individuos infectados asintomáticos presentan anticuerpos, por lo que los resultados han de interpretarse cuidadosamente en el contexto clínico. En LC por L. tropica y L. major se ha descrito la detección de niveles elevados de anticuerpos anti-α-galactosil mediante ELISA59. También existen pruebas de diagnóstico rápido, como la rK39, que detectan anticuerpos de forma rápida y con alta sensibilidad en la LV60, aunque con las mismas limitaciones que el resto de las pruebas serológicas. Recientemente, se han desarrollado pruebas de detección de antígenos mediante aglutinación en látex61 y ELISA62 en orina en LV, e inmunocromatografía63 para la detección del antígeno peroxidoxina en LC.
Diagnóstico diferencialHa de realizarse fundamentalmente con otras infecciones, como el ectima, la esporotricosis, la tuberculosis cutánea, la miasis foruncular, las micosis subcutáneas, la sífilis terciaria o la lepra lepromatosa; con lesiones malignas, como el carcinoma espinocelular, el carcinoma basocelular o el linfoma; y con otras dermatosis, como la reacción persistente a picaduras de artrópodos, la sarcoidosis, la granulomatosis con poliangitis o el pioderma gangrenoso43.
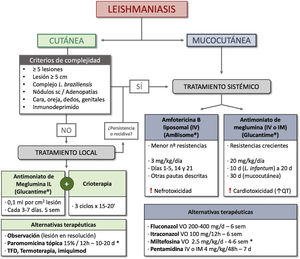
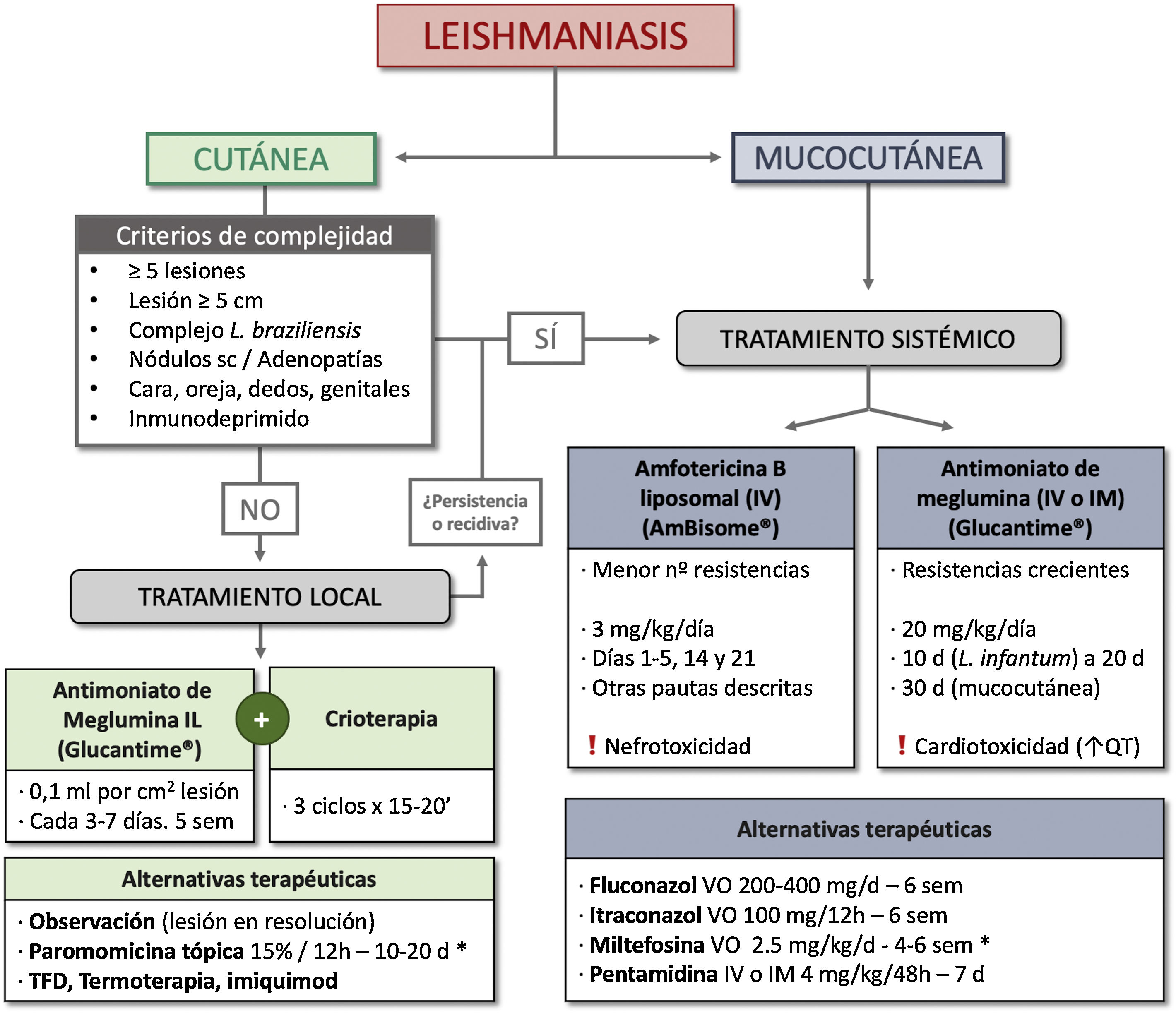
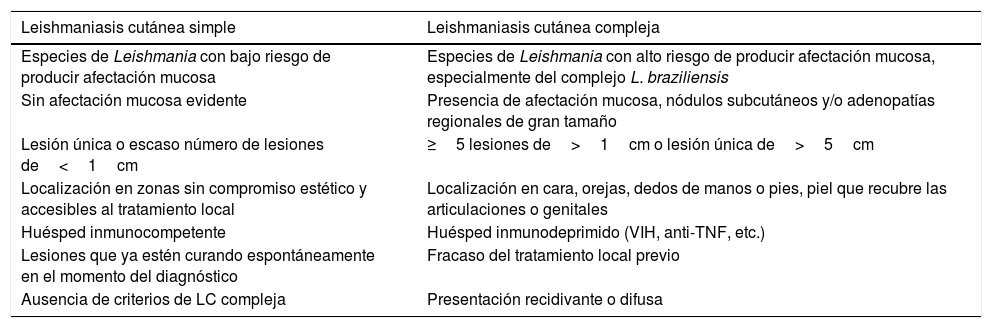
TratamientoMuchos casos de LC se resuelven de forma espontánea en menos de 2 años, fundamentalmente en función de la especie de Leishmania (tabla 1), siendo L. braziliensis y L. panamensis las de mayor riesgo de persistencia64. En función de este y otros factores, como la localización y la gravedad de la infección, así como el estado inmune del huésped, la LC se puede clasificar en simple y compleja, orientando hacia un manejo conservador o mediante tratamiento local en la primera y hacia un tratamiento sistémico en la segunda50. Las características de la LC simple y compleja se resumen en la tabla 3. Existen múltiples opciones terapéuticas, aunque la evidencia en la que se basa el tratamiento de la LC es débil65. Las principales opciones de tratamiento se recogen en la tabla 466–97.
Características de las leishmaniasis cutáneas según su complejidad
| Leishmaniasis cutánea simple | Leishmaniasis cutánea compleja |
|---|---|
| Especies de Leishmania con bajo riesgo de producir afectación mucosa | Especies de Leishmania con alto riesgo de producir afectación mucosa, especialmente del complejo L. braziliensis |
| Sin afectación mucosa evidente | Presencia de afectación mucosa, nódulos subcutáneos y/o adenopatías regionales de gran tamaño |
| Lesión única o escaso número de lesiones de<1cm | ≥5 lesiones de>1cm o lesión única de>5cm |
| Localización en zonas sin compromiso estético y accesibles al tratamiento local | Localización en cara, orejas, dedos de manos o pies, piel que recubre las articulaciones o genitales |
| Huésped inmunocompetente | Huésped inmunodeprimido (VIH, anti-TNF, etc.) |
| Lesiones que ya estén curando espontáneamente en el momento del diagnóstico | Fracaso del tratamiento local previo |
| Ausencia de criterios de LC compleja | Presentación recidivante o difusa |
LC: leishmaniasis cutánea; TNF: factor de necrosis tumoral; VIH: virus de la inmunodeficiencia humana.
Principales opciones terapéuticas para el tratamiento de la leishmaniasis cutánea y mucocutánea
| Tratamiento | Fármaco o dispositivo | Indicación | Dosis, efectos adversos y otras consideraciones | Eficacia97 | Nivel de evidencia1,a |
|---|---|---|---|---|---|
| Terapia localIntralesional | |||||
| Antimoniales pentavalentes | Estibogluconato de sodio66–68 (Pentostam® 100mg/ml, medicamento extranjero) | LCVMConsiderar en LCNM si no hay riesgo de afectación mucosa | Inyección intradérmica 0,2-0,5ml (5 sitios/lesión a 0,1ml/cm2) cada 3-7 días (hasta 5 sesiones)Puede requerir anestesia localSu eficacia mejora cuando se utiliza de forma combinada con la crioterapia70,71No suele tener efectos adversos en la administración IL salvo reacción local, aunque se ha descrito prolongación del intervalo QT hasta en el 25% de los pacientes72 | 41-98% (LCVM)77-90% (LCNM)89-91% (cuando se combina con crioterapia) | A (en combinación con crioterapia, LCVM)B (LCNM) |
| Antimoniato de meglumina69(Glucantime® 1.500mg/5ml) | |||||
| TópicaParomomicina73 | Ungüento de paromomicina74 (Leshcutan®, paromomicina 15%+MBCL 12%, medicamento extranjero) | Lesiones ulceradas por Leishmania spp. en LCVM y LCNM | Aplicar 2 veces al día durante 10-20 días | Similar a APV IL en LCVM, inferior a APV IL en LCNM | A (LCVM) |
| Crema de paromomicina 15%+gentamicina 0,5%75 (no disponible comercialmente) | Mejores respuestas en L. major y L. panamensis | B (LCNM) | |||
| La eficacia es similar entre las formulaciones con y sin gentamicinaPuede causar inflamación intensa | |||||
| Crioterapia76 | Nitrógeno líquido | Lesiones de LC de aparición recienteLesiones residuales tras el tratamiento sistémicoConsiderar en mujeres embarazadas y lactantes o con contraindicación para el tratamiento sistémico | 3 ciclos de congelación durante 15-20s, con 1-2mm de halo, y posterior descongelación. Repetir cada 3 semanas hasta la curaciónMayor eficacia si combinación con APV ILPuede ocasionar hipopigmentación permanente | 57-75% (eficacia similar a los APV IL)89-91% (si combinación con APV IL) | A (en combinación con APV IL, LCVM) |
| Termoterapia77–79 | Aplicación de calor superficial mediante radiofrecuencia (ThermoMed®) | LCVM y LCNMConsiderar en mujeres embarazadas y lactantes o con contraindicación para el tratamiento sistémico | Se aplican 50oC durante 30s en la lesión y hasta 1-2mm de piel perilesional, 1-2 sesionesSe basa en estudios que demuestran que los parásitos de Leishmania no se multiplican a Ta>39oC in vitroRequiere anestesia localProduce quemaduras de segundo grado | 48-98% (LCVM)58-90% (LCNM) | A (LCVM, LCNM) |
| Terapia fotodinámica (TFD)80 | TFD convencional con ALA o MAL | LCVM, especialmente la causada por L. major y L. tropicaConsiderar en LC resistente a otros tratamientos y en zonas con compromiso estéticoNo recomendada en LC por complejo L. braziliensis o por complejo L. donovani | Sesiones semanales, 1-7 sesiones, siendo≥3 más efectivas que 2 o menosSe cree que actúa mediante una respuesta del sistema inmune, ya que no mata directamente al parásitoLa TFD convencional con ALA (6 sesiones) parece ser al menos tan efectiva como la crioterapia (5 sesiones), con mejor resultado estético, aunque peor toleradaEfectos adversos locales (ardor, enrojecimiento, edema, dolor) | 96-100% (TFD convencional)74-82% (TFD con luz de día) | B (TFD convencional, LCVM) |
| TFD con luz de día | |||||
| TFD intralesional | |||||
| Terapia sistémicaOral | |||||
| Azoles81 | Fluconazol | Uso fuera de ficha técnica para LC con afectación linfática y para algunas LC complejas. No usar si L. braziliensis | 200-400mg/día durante 42 díasLos efectos secundarios incluyen molestias gastrointestinales y hepatotoxicidad | 44-81% (LCVM)22% (LCNM) | A (LCVM, fluconazol 200mg/día 42 días, L. major) |
| Itraconazol | 200mg/día durante 42-56 días | ||||
| Miltefosina82–84 | Miltefosina (Impavido® 50mg cápsulas, medicamento extranjero) | LC por complejo L. braziliensis. También puede utilizarse en LC por L. major,L. tropica y L. mexicana | 2,5mg/kg/día (máximo 150mg) por vía oral dividida en 3 dosis durante 28 díasEs caraEs teratogénica, puede producir trastornos gastrointestinales y hepatotoxicidad | 81% (LCVM)53-91% (LCNM) | B (LCNM)C (LCVM) |
| Parenteral | |||||
| Antimoniales pentavalentes85–88 | Estibogluconato de sodio (Pentostam® 100mg/ml) | LCVM y LCNM complejas y LMC | 20mg/kg/día en una dosis única diaria, vía IV (de preferencia) o IM (muy dolorosa), durante 10-30 díasHa aumentado el número de fracasos terapéuticos debido a resistencias87Suele asociarse a pentoxifilina 400mg 3 veces al día durante 10-20 días; y a alopurinol 20mg/kg durante 30 días en la LC recidivante por L. tropicaPuede producir cardiotoxicidad (arritmias, prolongación del intervalo QT, etc.), pancreatitis y hepatotoxicidad | 41-85% (LCVM)77-90% (LCNM)30-90% (LMC) | A (LCVM, LMC)C (LC recidivante) |
| Antimoniato de meglumina(Glucantime® 1.500mg/5ml) | |||||
| Anfotericina B89–93 | Liposomal (Ambisome® 50mg), de elección por su menor toxicidad frente a la convencional | Uso fuera de ficha técnica para LC compleja y LMC | 3mg/kg/día IV durante 7 días (días 1-5, 14 y 21) hasta una dosis total de 21mg/kgLa dosis óptima para LC no está bien definida y los regímenes de tratamiento se basan en la dosificación de la LV. Suelen requerirse mayores dosis y terapias prolongadas en pacientes inmunodeprimidosSe ha probado una formulación tópica de anfotericina al 3%, con eficacia similar a los APV IL en LC92Puede producir nefrotoxicidad, lumbalgia, hipopotasemia, escalofríos | 84-100% (LCVM, LCNM)78-100% (LMC) | C (LCNM, LMC) |
| Pentamidina94–96 | Isetionato de pentamidina 300mg (Pentacarinat®) | Alternativa en el tratamiento de la LCNM. Buenas respuestas en L. guyanensis | 4mg/kg/día IM días alternos durante una semanaTambién puede administrarse IV, con mayor eficaciaRecientemente se ha probado su administración intralesional, con eficacia similar a los APVPuede producir toxicidad grave: pancreatitis, prolongación del QT, hiperpotasemia | 58-95% (LCNM)91% (LMC, pero 25% recurrencia) | C (LCNM, LMC) |
ALA: ácido 5-aminolevulínico; APV: antimoniales pentavalentes; IL: intralesional; IM: intramuscular; IV: intravenosa; LCNM: leishmaniasis cutánea del Nuevo Mundo; LCVM: leishmaniasis cutánea del Viejo Mundo; LMC: leishmaniasis mucocutánea; LV: leishmaniasis visceral; MAL: metil aminolevulinato; MBCL: cloruro de metilbencetonio; TFD: terapia fotodinámica.
En los pacientes que cumplan criterios de LC simple se puede adoptar una conducta expectante, tras valorar los riesgos/beneficios, o un tratamiento local en aquellas lesiones que no se resuelvan espontáneamente o si queremos acelerar la curación y reducir el riesgo de cicatrización. Entre los tratamientos locales más aceptados se encuentra la inyección intralesional de antimoniales pentavalentes66–69, así como el uso de crioterapia76. La combinación de ambos tratamientos consigue una mayor eficacia terapéutica70,71. La paromomicina tópica es una alternativa especialmente utilizada en las formas de LC del Nuevo Mundo73–75.
Se han descrito además casos con buena respuesta a otras terapias locales98, como el láser de CO299, con una eficacia de hasta el 93% y escasos efectos adversos (hiperpigmentación, eritema persistente y cicatrización hipertrófica), la terapia fotodinámica80 o el imiquimod100.
En los pacientes que cumplan algún criterio de LC compleja se recomienda el tratamiento sistémico. Dentro de los tratamientos sistémicos recomendados se encuentra la anfotericina B liposomal, con una elevada eficacia pero con riesgo de nefrotoxicidad89–93. El uso tradicional de antimoniales pentavalentes sistémicos85–88 en el tratamiento de las LC complejas y LMC ha llevado al desarrollo de resistencias en determinadas zonas endémicas, lo que condiciona su uso87. Otras opciones terapéuticas son los azoles81, la miltefosina82–84 y la pentamidina94–96.
Así mismo, en un ensayo clínico en 50 pacientes con LC en Pakistán que recibieron cloroquina 250mg 2 veces al día o doxiciclina 200mg al día durante 3 meses, vieron una eficacia del 100 y del 92%, respectivamente101.
En la LC por L. braziliensis es recomendable un seguimiento anual tras el tratamiento para detectar precozmente una progresión hacia LMC, que podría manifestarse como secreción nasal persistente o epistaxis.
Respecto a la LC post-kala-azar, los casos procedentes de África no suelen tratarse, ya que la gran mayoría (85%) se resuelve espontáneamente en un año. En cambio, en la India suele requerir tratamiento sistémico con miltefosina o anfotericina B1.
Finalmente, con base en las guías actuales y en la recomendación de los expertos, proponemos un algoritmo de manejo de la LC y la LMC (fig. 5).
Prevención y controlHasta la fecha, no existe vacuna para prevenir la leishmaniasis humana. La mayoría de los pacientes que se recuperan de la infección desarrollan inmunidad frente a la reinfección, lo que facilita la investigación en el desarrollo de vacunas102. Además, una de las principales estrategias de control de la enfermedad, aparte del control de los vectores, se basa en la detección precoz y el tratamiento de los casos de leishmaniasis, tanto visceral como cutánea, ya que suponen un reservorio de los parásitos. En el caso concreto de la LC en la región del Mediterráneo oriental, la OMS marcó como objetivo para 2020 la detección del 70% de los casos y el tratamiento de al menos el 90%, lo que contrasta con las escasas opciones terapéuticas, las técnicas de diagnóstico subóptimas y la poca concienciación de la comunidad científica, especialmente en relación con la LC, que no está incluida entre las prioridades en el control de esta infección.
ConclusiónLa migración y los viajes internacionales han hecho que la LC se haya convertido en un diagnóstico relativamente frecuente en nuestro medio. Sin embargo, el manejo puede ser complejo dados el bajo índice de sospecha, la baja sensibilidad de algunas de las técnicas diagnósticas y la escasa disponibilidad de los métodos moleculares, así como las limitadas opciones terapéuticas y su toxicidad. El VIH y el uso de fármacos anti-TNF son en la actualidad los mayores factores de riesgo para presentaciones atípicas y necesidad de tratamiento sistémico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.



![a) Panorámica de biopsia tipo punch de lesión nodular eritematosa localizada en antebrazo (hematoxilina-eosina [H-E], ×5]. b) Presencia de un denso infiltrado inflamatorio dérmico superficial, junto con hiperplasia pseudoepiteliomatosa (H-E, ×10). c) Detalle del infiltrado inflamatorio compuesto mayoritariamente por macrófagos, linfocitos y algunas células epitelioides (H-E, ×20). d) Amastigotes característicos de la infección por Leishmania infestando el interior de los macrófagos (H-E, ×40). Por cortesía de la Dra. Elisa Rios Viñuela. a) Panorámica de biopsia tipo punch de lesión nodular eritematosa localizada en antebrazo (hematoxilina-eosina [H-E], ×5]. b) Presencia de un denso infiltrado inflamatorio dérmico superficial, junto con hiperplasia pseudoepiteliomatosa (H-E, ×10). c) Detalle del infiltrado inflamatorio compuesto mayoritariamente por macrófagos, linfocitos y algunas células epitelioides (H-E, ×20). d) Amastigotes característicos de la infección por Leishmania infestando el interior de los macrófagos (H-E, ×40). Por cortesía de la Dra. Elisa Rios Viñuela.](https://static.elsevier.es/multimedia/00017310/0000011200000007/v1_202107020537/S0001731021001083/v1_202107020537/es/main.assets/thumbnail/gr4.jpeg?xkr=ue/ImdikoIMrsJoerZ+w9/t1/zx4Q/XH5Tma1a/6fSs=)