Las micosis superficiales son patologías prevalentes en dermatología, causadas frecuentemente por hongos oportunistas de los géneros Candida y Malassezia. El objetivo de este trabajo es analizar, mediante qRT-PCR, la existencia de alteraciones en la expresión génica de las enzimas biosintéticas de las cadenas de glicosaminoglicanos (GAGs) tras la adhesión de dichas levaduras a líneas celulares de piel. La interacción de C.albicans y Malassezia spp. produjo las siguientes modificaciones en genes implicados en la biosíntesis del heparán y condroitín sulfato: la subexpresión de CHPF en los queratinocitos y 4 subexpresiones (EXT1, EXT2, CHSY3 y CHPF) en los fibroblastos. Las enzimas implicadas en la modificación de las cadenas de dichos GAG se ven más alteradas en los fibroblastos, produciendo 13 subexpresiones y 2 sobreexpresiones (CHST15 y CHST7). Como consecuencia, la afinidad de las cadenas de GAGs por sus ligandos puede verse afectada, pudiendo alterar su papel como receptores de microorganismos, paso clave para el inicio de su proceso infeccioso.
Superficial fungal infections are common in dermatology and are often caused by opportunistic species in the Candida and Malassezia genera. The aim of this study was to analyze changes in the expression of genes coding for enzymes involved in the biosynthesis of glycosaminoglycans (GAGs) chains following the adherence of Candida and Malassezia yeasts to skin cell lines. Gene expression was analyzed using reverse transcriptase–quantitative polymerase chain reaction assays. Interactions between the yeasts and the skin cells induced the following changes in genes involved in the biosynthesis of heparan sulfate and chondroitin sulfate: downregulation of CHPF in keratinocytes and downregulation of EXT1, EXT2, CHSY3, and CHPF in fibroblasts. Adherence to fibroblasts had an even greater effect on GAG biosynthetic enzymes, inducing the downregulation of 13 genes and the upregulation of two (CHST15 and CHST7). Interactions between yeasts and skin cells might affect the binding affinity of GAG chains, possibly changing their ability to function as receptors for pathogens and interfering with a key stage at the start of infection.
Las micosis superficiales son patologías prevalentes en dermatología, y los hongos oportunistas más frecuentes en este tipo de infecciones son las levaduras de los géneros Candida y Malassezia, seguidos por otros hongos filamentosos patógenos cutáneos primarios. El desarrollo de estas afecciones cutáneas superficiales implica la participación de receptores que permiten la adherencia y la colonización de los patógenos al tejido. Estos receptores no están solo involucrados en el anclaje del hongo al epitelio, sino también en otros aspectos del proceso infeccioso, como el tropismo por los tejidos, el desencadenamiento de la respuesta inmune o la invasión tisular1. Estudios previos han demostrado la participación de los proteoglicanos (PGs), y en concreto de sus cadenas de glicosaminoglicanos (GAGs), como receptores en el desarrollo de infecciones bacterianas2. Los GAGs más relevantes son el heparán sulfato (HS) y el condroitín sulfato (CS)3. Ambos están compuestos por un residuo de ácido glucurónico (GlcA) que se une en el HS a N-acetilglucosamina (GlcNAc) y a N-acetilgalactosamina (GalNAc) en el CS3. La síntesis del HS y el CS comprende una serie de etapas, como son la polimerización de la cadena y una posterior modificación de la misma a través de una serie de reacciones enzimáticas, como pueden ser la N-desacetilación/N-sulfatación, la epimerización y/o diversas O-sulfataciones.
Los GAGs están implicados en una gran variedad de funciones biológicas, pero también patológicas, incluyendo diferentes procesos infecciosos, en los que se han descrito alteraciones en la expresión de los genes implicados en su biosíntesis2,4. El objetivo de este trabajo es determinar si la adherencia de C.albicans y Malassezia spp. induce cambios en la expresión de estos genes en células epiteliales. Esto permitiría incrementar nuestro conocimiento sobre el proceso infeccioso de estos hongos que, bajo determinadas condiciones, son capaces de causar diferentes enfermedades.
Material y métodosEl crecimiento de las líneas celulares y los cultivos fúngicos se llevaron a cabo siguiendo el procedimiento previamente descrito5. Posteriormente, a cultivos de queratinocitos y fibroblastos crecidos en placas de 6 pocillos se añadieron 400μl de la suspensión de la levadura correspondiente a una A600 de 0,5, completando hasta 2ml con Dulbecco's Modified Eagle's minimal essential (DMEM) (Gibco), y se incubó durante 90minutos a 37°C al 5% de CO2. Los pocillos control fueron tratados de la misma manera, salvo que en el último paso se añadió únicamente DMEM. Tras dos lavados con PBS, se añadió el medio de cultivo correspondiente a cada línea celular6 y se incubaron las placas durante 16horas a 37°C al 5% de CO2. La extracción de ARN y síntesis de ADNc se llevó a cabo usando los kits RNeasy Mini Kit (Qiagen) y High Capacity cDNA Reverse Transcription (Applied Biosystems), siguiendo las instrucciones del fabricante. Las reacciones de qRT-PCR y el análisis de los datos se llevaron a cabo según el método descrito previamente7, utilizando la gliceraldehído 3fosfato deshidrogenasa (G3PDH) como gen control para normalizar las expresiones. La secuencia de los oligonucleótidos empleados se detalla en la tabla suplementaria 1.
ResultadosLa interacción de los queratinocitos y los fibroblastos con las levaduras indujo alteraciones en las transcripciones de distintos genes implicados en la biosíntesis del HS y del CS, dependientes de la línea celular y del microorganismo implicado.
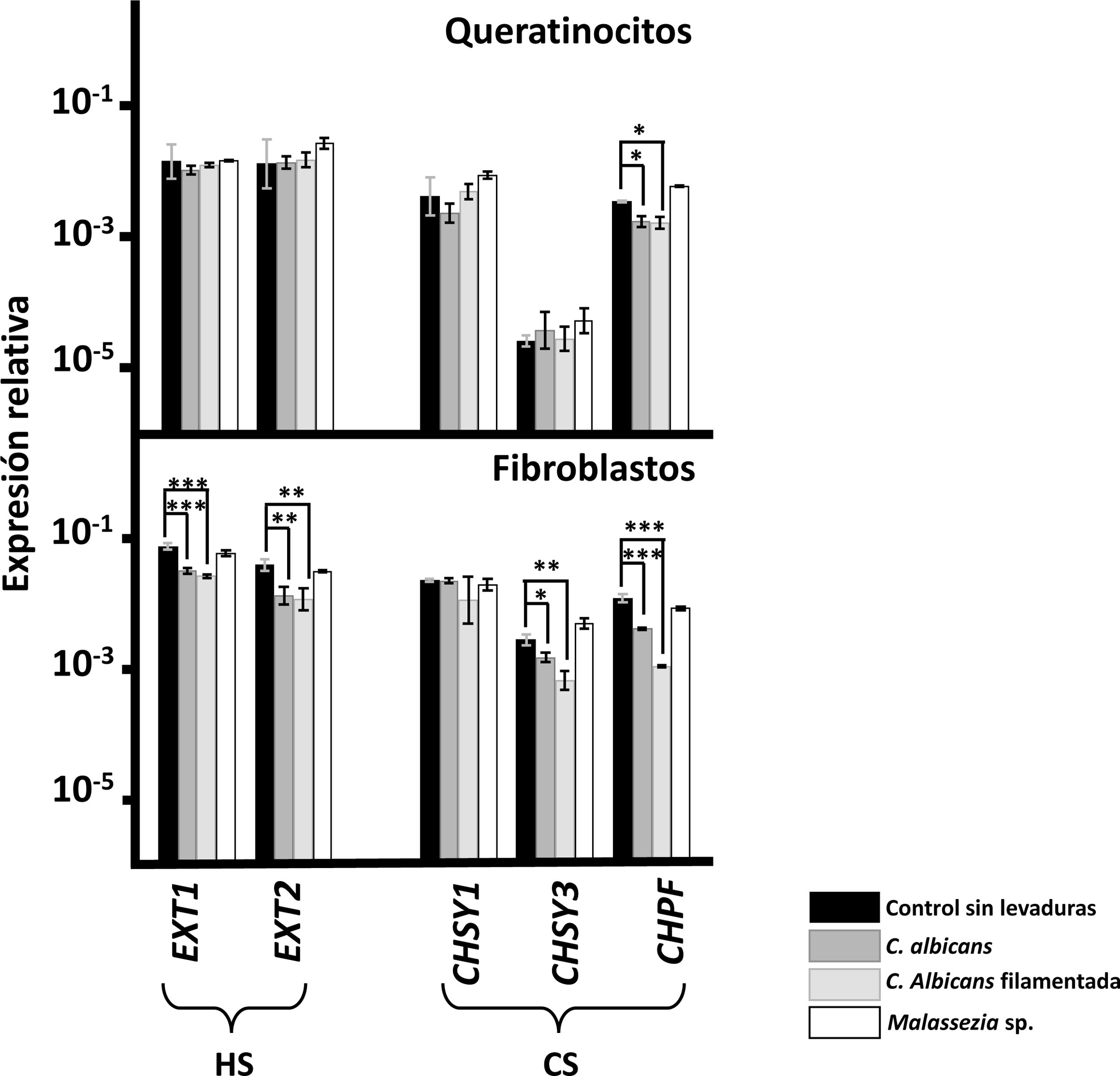
En el caso de los genes responsables de la polimerización de las cadenas de GAGs, la adherencia de Malassezia spp. a ambas líneas celulares no indujo cambios en la transcripción de ninguno de ellos (fig. 1). Por el contrario, la adherencia de C.albicans sí indujo cambios, limitados únicamente a la subexpresión del factor de polimerización del CS (CHPF) en los queratinocitos, subexpresiones que se extendieron a todos los genes, con la excepción de CHSY1 en los fibroblastos (fig. 1). Los resultados fueron en todos los casos análogos, independientemente de la morfología de C.albicans (fig. 1).
Transcripción diferencial de los genes implicados en la elongación de las cadenas de HS y CS en queratinocitos de epidermis y fibroblastos de la dermis tras la interacción con levaduras. Se representa la abundancia relativa de los transcritos de genes implicados en la polimerización de las cadenas de HS (EXT1 y EXT2) y de las cadenas de CS (CHSY1, CHSY3 y CHPF), en ausencia de levaduras (barras negras), en presencia de C.albicans (barras gris oscuro), en presencia de la forma filamentada de C.albicans (barras gris claro) y en presencia de Malassezia spp. (barras blancas).
Los resultados se expresan en escala logarítmica, y se indican las desviaciones estándar. Las diferencias significativas están representadas con * para p<0,05, ** para p<0,01 y *** para p<0,001.
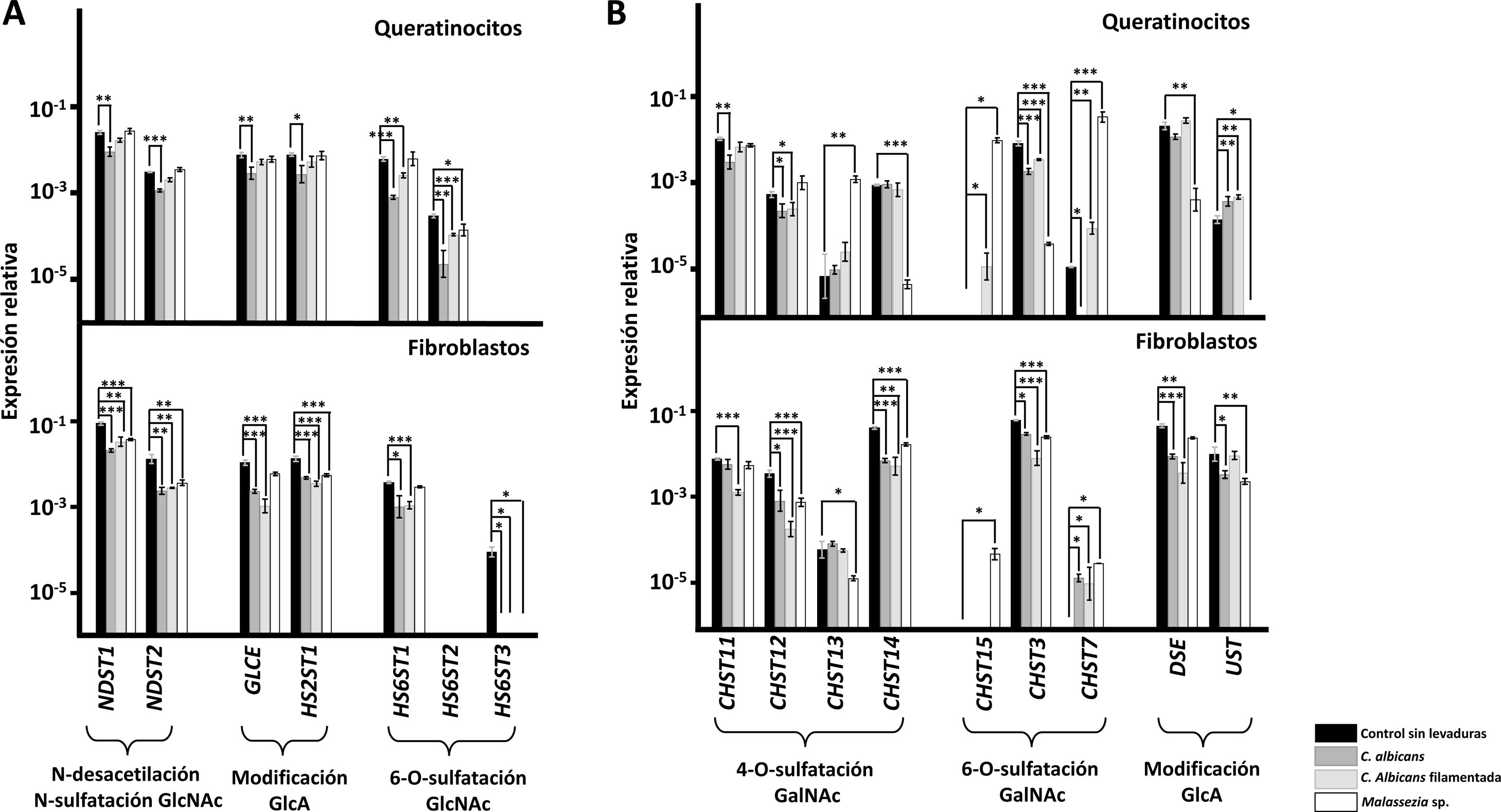
Los genes codificantes de enzimas modificadoras de las cadenas de HS experimentaron subexpresiones específicas en presencia de las levaduras (fig. 2A). En los queratinocitos, la forma de levadura de C.albicans afectó a todos los genes, mientras que la forma micelial únicamente afectó a los implicados en la 6-O-sulfatación de GlcNAc; Malassezia spp. únicamente indujo la subexpresión de la isoforma HS6ST2 (fig. 2A). En los fibroblastos, C.albicans indujo subexpresiones de todos los genes, independientemente de su forma celular, mientras que Malassezia spp. afectó a todos excepto al gen responsable de la epimerización de GlcA (GLCE) y a la isoforma mayoritaria responsable de la 6-O-sulfatación de GlcNAc (HS6ST1) (fig. 2A).
Transcripción diferencial de los genes implicados en la modificación de las cadenas de HS (A) y en la modificación de las cadenas de CS (B) en queratinocitos de la epidermis y fibroblastos de la dermis tras la interacción con levaduras. Se representa la abundancia relativa de los transcritos de genes implicados en la N-desacetilación/N-sulfatación de GlcNAc (NDST1-2), epimerización y 2-O-sulfatación de GlcA (GLCE, HS2ST1), y 6-O-sulftación de la GlcNAc (HS6ST1-3), en ausencia de levaduras (barras negras), en presencia de C.albicans (barras gris oscuro), en presencia de la forma filamentada de C.albicans (barras gris claro) y en presencia de Malassezia spp. (barras blancas).
Los resultados se expresan en escala logarítmica, y se indican las desviaciones estándar. Las diferencias significativas están representadas con * para p<0,05, ** para p<0,01 y *** para p<0,001.
Los genes codificantes de enzimas modificadores de las cadenas de CS son los que mostraron un patrón más complejo de modificaciones (fig. 2B). La adhesión de C.albicans a queratinocitos indujo la subexpresión de CHST12 y de CHST3 y la sobreexpresión de UST independientemente de la forma celular. La forma de levadura indujo además la subexpresión de CHST11 y CHST7, mientras que la forma filamentosa sobreexpresó los genes CHST15 y CHST7 (fig. 2B). Por su parte, Malassezia spp. indujo la subexpresión de CHST14, CHST13, DSE y UST, y la sobreexpresión de los genes CHST13, CHST15 y CHST7 (fig. 2B). Cuando se estudió la adherencia a fibroblastos, ambas formas celulares de C.albicans indujeron la subexpresión de CHST12, CHST14, CHST3 y DSE, y la sobreexpresión de CHST7; la forma de levadura también indujo la subexpresión adicional de UST, y la filamentada, de CHST11 (fig. 2B). Por otro lado, Malassezia spp. indujo la subexpresión de CHST12, CHST13, CHST14, CHST3 y UST, y la sobreexpresión de CHST15 y CHST7 (fig. 2B).
DiscusiónC.albicans y Malassezia spp. son microorganismos habituales de la piel y las mucosas que, bajo determinadas condiciones, aumentan en cantidad y pueden convertirse en verdaderos patógenos, generando una gran respuesta inmune. Son varias las vías por las que estas levaduras son capaces de colonizar e invadir el tejido epitelial; sin embargo, poco se sabe acerca de la unión inicial de dichos hongos a la superficie epitelial.
En este trabajo se observaron variaciones en los niveles de expresión de varios genes implicados en la polimerización y la modificación de las cadenas de HS y CS tras la interacción con C.albicans y Malassezia spp., siendo particularmente notable a nivel de los fibroblastos en comparación con los queratinocitos. Las modificaciones observadas a nivel de transcripción apuntan a cambios relevantes en el patrón de sulfatación de las cadenas, lo que podría reforzarse por la presencia de otros mecanismos post-transcripcionales adicionales o por la regulación de catálisis enzimáticas8. Como consecuencia de todo esto, la afinidad de las cadenas de GAGs por diferentes ligandos puede verse alterada, afectando a diferentes procesos biológicos y a su función como receptores de los diferentes microorganismos. Además, dichas modificaciones podrían afectar también a la capacidad de adherencia de otros microorganismos patógenos epidérmicos, como Staphylococcus aureus, Streptococcus pyogenes o Candida spp.2,9.
La capa dérmica, menos expuesta al entorno en comparación con la epidermis, mostraría diferentes receptores y composición de PGs y GAGs en la superficie celular y, por lo tanto, sería esperable que la interacción con estos microorganismos fuese distinta9,10. Este hecho se ha descrito en la unión de diferentes bacterias a diferentes células pulmonares11. Esto podría explicar el mayor número de alteraciones detectadas a nivel de los fibroblastos de la dermis, ya que los cambios podrían ser producidos por el microorganismo con el fin de desestabilizar el tejido dérmico, facilitando la invasión.
Las enzimas implicadas en la modificación de las cadenas parecen estar más afectadas que las correspondientes a la polimerización de las mismas. Los genes implicados en las modificaciones de las cadenas de HS vieron reducida su expresión en ambas capas de la piel, pero en menor cantidad en los queratinocitos, donde la mayoría de los cambios los produce la forma de levadura de C.albicans. Sin embargo, la transición de levadura a hifa parece tener un mayor efecto en los fibroblastos, donde las alteraciones son semejantes. La morfología levaduriforme de C.albicans es la responsable normalmente de las fases tempranas de la infección, como son la adhesión inicial y la posterior diseminación, y la formación de hifas se relaciona con la invasión a los tejidos subyacentes12, lo cual parece que va relacionado con que la primera produzca una mayor alteración de los genes de biosíntesis del HS a nivel de la epidermis. Además, la subexpresión de dichos genes podría relacionarse con la capacidad invasiva y con la respuesta inmune. La unión de Malassezia spp. parece inducir un mayor número de alteraciones en las capas profundas de la dermis. El papel de Malassezia spp. en las patologías dermatológicas continúa sin ser claro. Mediante la producción de ácidos grasos libres, Malassezia spp. altera la integridad de la piel, irritándola e iniciando una respuesta inflamatoria con la consecuente liberación de citoquinas proinflamatorias, lo que se asocia con las diferentes patologías, como la dermatitis seborreica o la foliculitis13-15.
Las alteraciones observadas en este trabajo indican que las cadenas de GAGs experimentan diferentes modificaciones en sus patrones de sulfatación y epimerización en función del hongo y del tipo celular en el cual inicien el proceso de adhesión y colonización. Esto se ha observado en bacterias, donde diferentes adhesinas muestran afinidad por diferentes tipos de GAGs e incluso por el tejido a infectar, indicando la existencia de cierto tropismo7,9. Además, el comportamiento diferencial de C.albicans en función de su morfología estaría explicado por una composición de la pared celular diferente16. Son necesarias más investigaciones para profundizar acerca de las implicaciones que esto tiene sobre los procesos infecciosos que causan; esto abriría la posibilidad de obtener nuevas terapias que reduzcan la incidencia de las micosis superficiales, como la elaboración de preparados tópicos que contengan GAGs que inhiban la adherencia del hongo.
FinanciaciónEl presente trabajo ha sido financiado por el premio 2019 «AEDV investiga» de la Fundación Piel Sana de la Academia Española de Dermatología y Venereología (AEDV).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.