La dermatitis atópica es la dermatosis inflamatoria más frecuente y hasta un 20% de los casos pueden clasificarse como moderados a graves. En los últimos años se ha producido un avance en el conocimiento de la patogenia, centrada en la vía Th2, pero con una participación marcada de la vía Th22 y de los ejes Th1 y Th17, de la disfunción de la barrera epidérmica, el prurito y la señalización JAK/STAT. Este progreso ha condicionado el desarrollo de nuevas terapias sistémicas, entre las que destacan fármacos biológicos dirigidos frente a la IL-4/13, como dupilumab, tralokinumab y lebrikizumab, pero también moléculas pequeñas, como los inhibidores de JAK, entre los que se incluyen baricitinib, upadicitinib y abrocitinib. Entre las innovaciones en los tratamientos tópicos se incluyen los inhibidores de la PDE4 y de JAK/STAT. Este artículo repasa los principales avances terapéuticos en dermatitis atópica, para los que son esenciales la caracterización de los subtipos clínicos y moleculares clave en su patogénesis.
Atopic dermatitis is the most common inflammatory skin disease and up to 20% of cases can be classified as moderate to severe. Our understanding of the pathogenesis of this disease has improved in recent years. The process is primarily driven by the Th2 pathway, but with significant contributions from the Th22 pathway, the Th1 and Th17 axes, epidermal barrier dysfunction, pruritus, and JAK/STAT signaling. Advances in our understanding of the pathogenesis of atopic dermatitis have led to the development of new systemic treatments. Of particular note are biologic agents targeting IL-4 and IL-13 (e. g., dupilumab, tralokinumab, and lebrikizumab) and small molecules, such as JAK inhibitors (e. g., baricitinib, upadacitinib, and abrocitinib). Novel topical treatments include phosphodiesterase 4 and JAK/STAT inhibitors. In this article, we review the main advances in the treatment of atopic dermatitis. Characterization of clinical and molecular phenotypes with a key pathogenic role is essential for driving these advances.
La dermatitis atópica (DA) es la dermatosis inflamatoria más frecuente, con una prevalencia estimada del 10-15% en niños y un 2-10% en adultos en la población occidental1. Hasta un 20% de los casos de DA pueden clasificarse como formas moderadas a graves de acuerdo con distintas escalas de medición clínicas; entre las más empleadas, se encuentran el Investigator Global Assessment (IGA), el Eczema Area and Severity Index (EASI) y el SCORing Atopic Dermatitis (SCORAD)2,3.
Desde la perspectiva clínica existe una notable variabilidad fenotípica condicionada por una compleja interacción entre la genética, la función inmunológica y el ambiente. En los últimos años ha ocurrido una auténtica revolución en la investigación traslacional que ha permitido profundizar en el conocimiento de la patogenia de la DA y en el desarrollo de nuevas moléculas dirigidas a elementos clave de la inflamación.
Este artículo revisa aquellos aspectos clave en la patogenia de la enfermedad con repercusión en potenciales dianas terapéuticas.
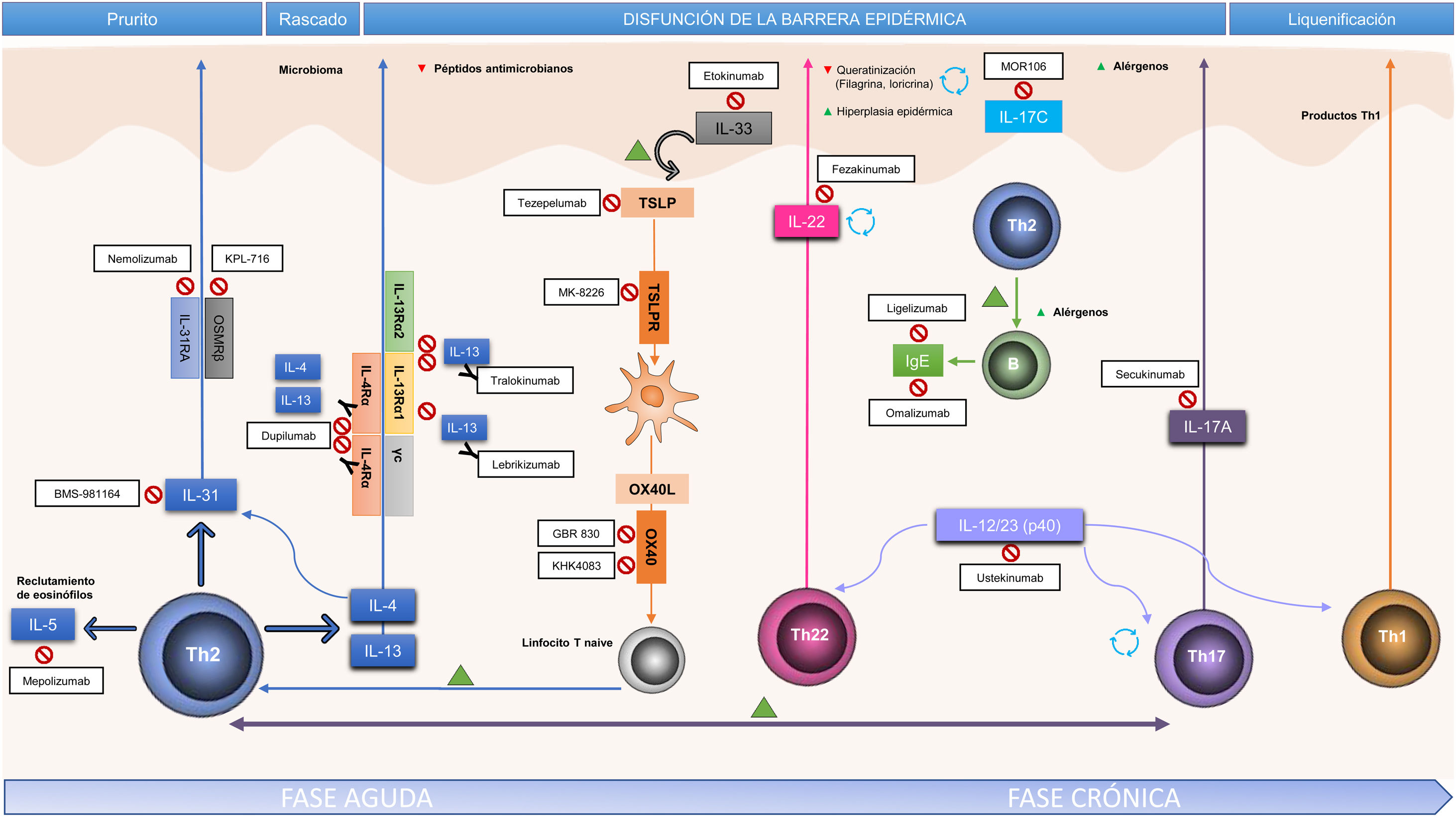
PatogeniaLa DA se ha considerado un modelo de disbalance entre las respuestas de los linfocitos T helper (Th) 1/Th2, con distorsión hacia un predominio Th2. Los linfocitos Th2 producen interleucina (IL)-4 e IL-13, que inhiben la expresión de filagrina, circunstancia que permite establecer una relación entre la disfunción inmunológica y la alteración de la función de barrera característica de la DA4. En los últimos años, diversos estudios traslacionales han centrado la patogenia de la DA en una respuesta Th2/Th22 durante todo su curso, con cierta participación de Th17, y con una contribución adicional del eje Th1 en su etapa crónica5.
Sin embargo, este esquema es una evidente simplificación, y la mayor o menor contribución de estas respuestas variará entre los subtipos de la enfermedad. En este sentido, se han caracterizado al menos 3 fenotipos inmunológicos de DA, en los que destaca la contribución de la respuesta Th17, a pesar de que mantienen una activación importante Th2/Th22: la DA pediátrica, que muestra una mayor participación de la inmunidad innata, IL-9 e IL-33; la variante intrínseca (20% de los adultos), que típicamente se presenta con niveles normales de IgE y sin antecedentes personales o familiares de atopia, y, por último, el fenotipo asiático, en el que predominan fenotipos con marcada liquenificación o psoriasiformes6–8.
Existen además otros potenciales actores relevantes en el proceso patogénico. De este modo, los queratinocitos son un elemento activo y producen citocinas, como el thymic stromal lymphopoietin (TSLP) —capaz de inducir la expresión de OX40L a través de la activación de las células dendríticas inmaduras— y la IL-33 —que induce la expresión de OX40L a través de la activación de las células linfoides innatas del grupo 2—, que amplifican la respuesta Th29. Son las llamadas alarminas, un elemento de inmunidad innata y un amplificador rápido y potente de la respuesta inflamatoria.
Las IL-4/13 están implicadas en la síntesis de IL-31, clave en la inducción del prurito, y de IL-5, que media el reclutamiento de Th2 y eosinófilos. Por otro lado, el prurito lleva al rascado, que facilita la disfunción de la barrera cutánea y la colonización por Staphylococcus aureus, capaz de perpetuar la respuesta Th2 y la sobreexpresión de IL-4, IL-13 e IL-22. Esta mayor colonización está facilitada por la menor expresión de péptidos antimicrobianos en la piel lesional y aparentemente sana de los pacientes con DA, también relacionada con la vía IL-4/13 (fig. 1)4.
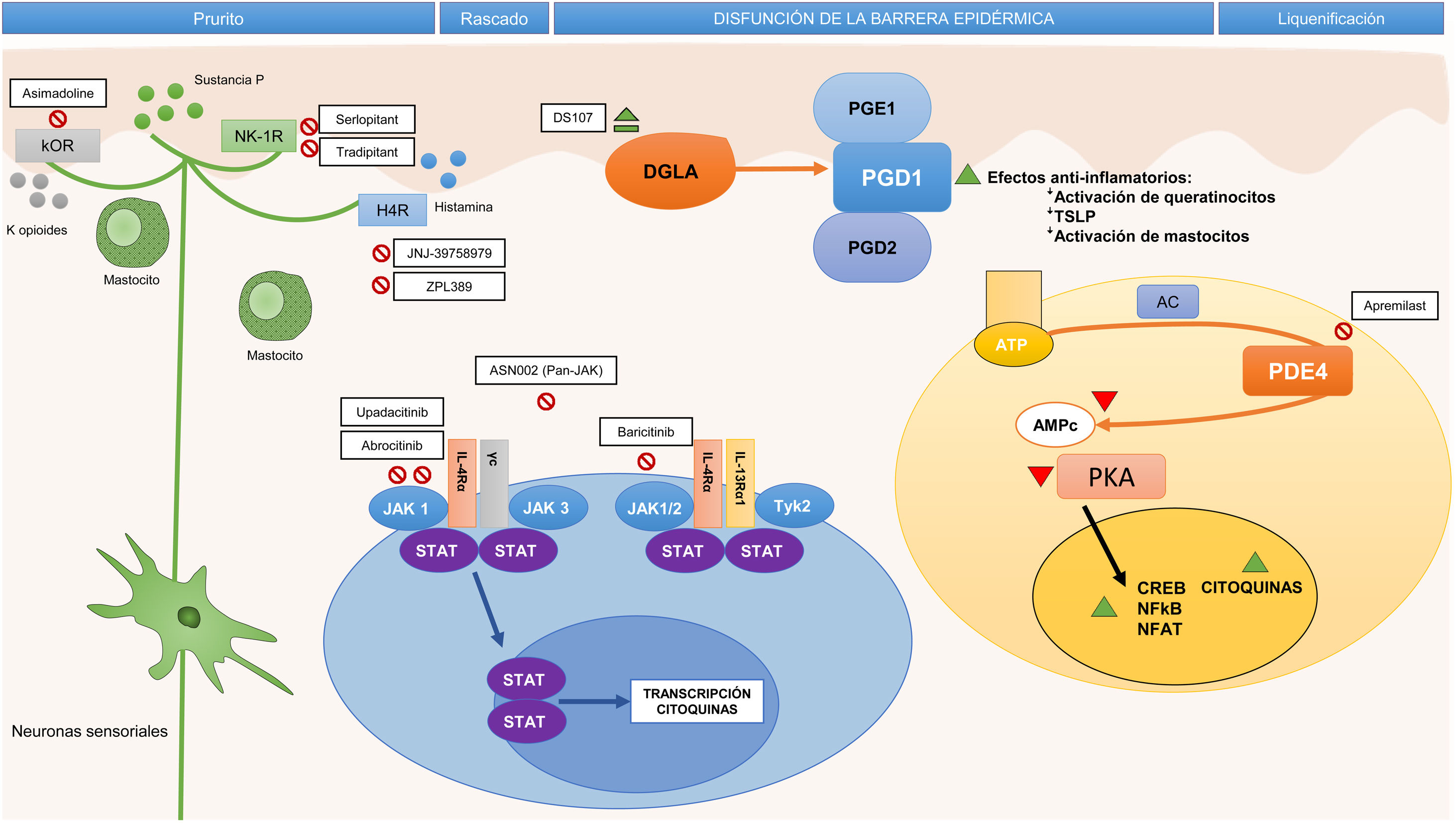
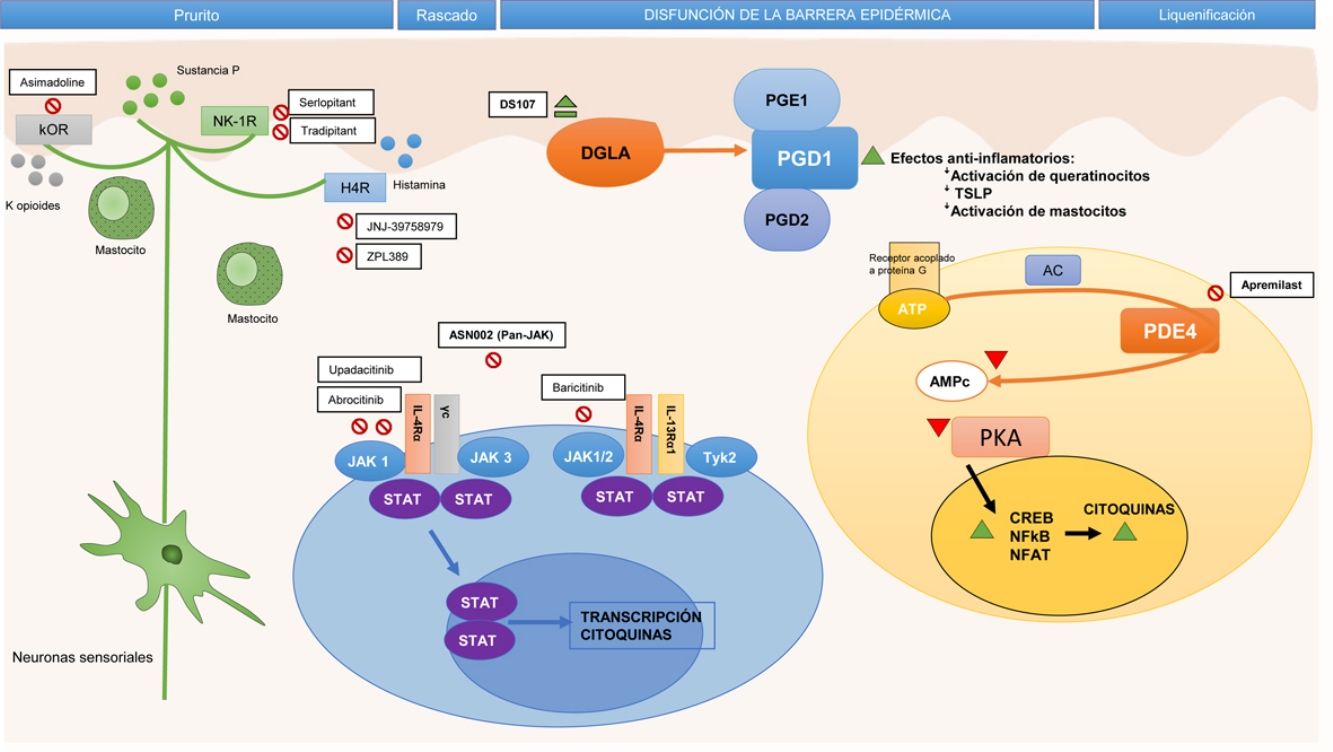
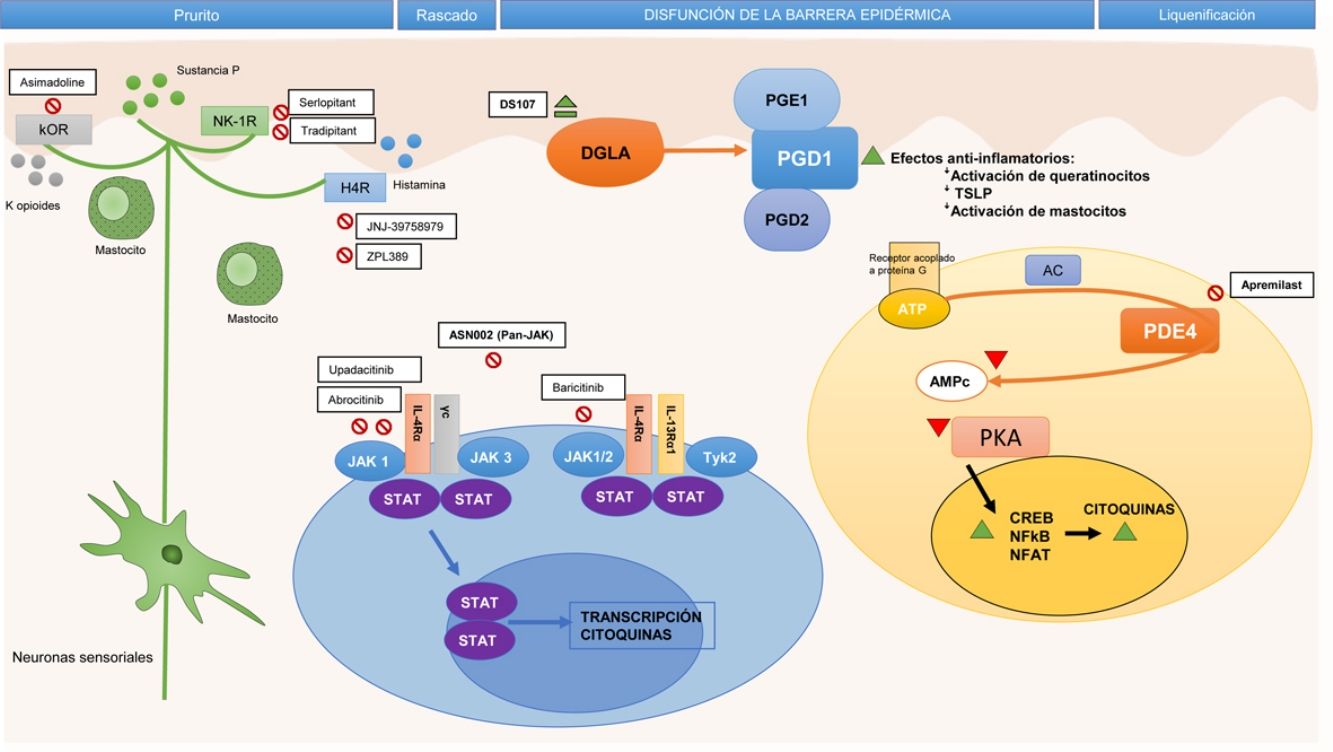
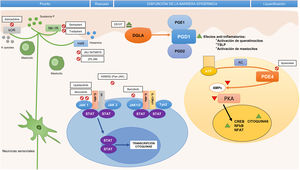
Frente a la identificación de moléculas clave en la patogenia y, por tanto, potencialmente dianas terapéuticas de anticuerpos monoclonales específicos, se ha establecido la importancia de otras moléculas implicadas de forma transversal en el proceso inflamatorio. En este apartado se ha estudiado la participación de la vía Janus kinase/signal transducer and activator of transcription (JAK-STAT), activada por la IL-4, en la desregulación inmune en la DA. La familia de las JAK está formada por 4 miembros (JAK1, JAK2, JAK3 y tirosina cinasa 2 [TYK2]) y, a diferencia de lo que ocurre en la alopecia areata o la psoriasis, los 4 intervienen en la DA10. Los distintos elementos de esta familia forman parte de los receptores citoplásmicos de numerosas IL (fig. 2). Su inhibición tendría, por lo tanto, un impacto en numerosas IL implicadas en la respuesta Th2 y la activación de los eosinófilos11.
Fármacos moléculas pequeñas y dianas específicas en la patogenia de la dermatitis atópica.
AC: adenylyl cyclase; AMPc: adenosín-monofosfato cíclico; ATP: adenosín trifosfato; CREB: cAMP response element-binging protein; DGLA: ácido dihomo-γ-linolénico; H4R: receptor de la histamina 4; IL: interleucina; JAK: Janus kinase; κOR: receptor κ-opioide; NF-κB: nuclear factor kappa-light-chain-enhancer of activated B cells; NFAT: nuclear factor of activated T-cells; NK-1R: receptor de la neuroquinina 1; PDE4: fosfodiesterasa 4; PGD1: prostaglandina D1; PGD2: prostaglandina D2; PGE1: prostaglandina E1; PKA: protein kinase A; STAT: signal transducer and activator of transcription; Th: (linfocito) T helper; TSLP: thymic stromal lymphopoietin; TYK: tyrosine-kinase.
El mayor conocimiento de las vías inflamatorias de la DA ha llevado al desarrollo de fármacos dirigidos frente a distintas citocinas de forma específica, así como en las vías del prurito, y fármacos de acción amplia, que intervienen sobre la señalización intracelular, afectando a la producción final de diversas citocinas.
Tratamientos sistémicosFármacos biológicosAntagonismo de la respuesta celular Th2 (IL-4 e IL-13)Bloqueo de la vía IL-4/IL-13La IL-4 y la IL-13, elementos clave de la respuesta Th2, inician y dirigen la respuesta inmune en la DA, de modo que el antagonismo específico frente a estas citocinas ha supuesto una revolución terapéutica en esta enfermedad.
Dupilumab es un anticuerpo monoclonal que inhibe la IL-4 y la IL-13 al bloquear la subunidad α compartida en sus receptores (IL-4Rα). En 2 ensayos clínicos (EC) fase iii (SOLO-1 y SOLO-2), de diseño idéntico, en un total de 1.379 pacientes adultos con DA moderada a grave, la administración de dupilumab 300mg cada 2 semanas durante 16 semanas fue superior a placebo en el objetivo primario (IGA de 0 o 1: 38 y 36% para dupilumab vs. 10 y 8% para placebo, respectivamente)12. También fue superior para todos los objetivos secundarios (EASI-75, reducción del prurito, síntomas de ansiedad y depresión, calidad de vida y necesidad de medicación de rescate) en comparación con placebo12,13. Otro EC fase iii ha demostrado también resultados positivos de dupilumab en combinación con corticoides tópicos frente a placebo tras un año de tratamiento (EASI-75: 65% para dupilumab 300mg cada 2 semanas vs. 22% para placebo; p=0,0001)14. Dos metaanálisis recientes muestran una eficacia superior a placebo, con beneficios similares para las pautas de 300mg semanales o cada 2 semanas. Los principales efectos adversos específicos son las reacciones a la inyección local del fármaco y la conjuntivitis15,16. En este momento se encuentran en su etapa final 2 EC fase iii en edad pediátrica17,18. En marzo de este año, la FDA ha extendido la aprobación de dupilumab a población adolescente de entre 12 y 17 años.
Tralokinumab es un anticuerpo monoclonal dirigido frente a la IL-13. Bloquea de forma competitiva la unión a 2 receptores distintos: el receptor heterodimérico, compuesto por IL-4Rα (antagonizado por dupilumab) e IL-13Rα1, y el receptor señuelo IL-13Rα2, que media la regulación endógena de IL-13. Esta vía permite evaluar, por lo tanto, en qué medida la inhibición de IL-4 puede ser redundante con respecto a IL-13 en la patogénesis de la enfermedad19. En un EC fase iib con 204 pacientes adultos con DA moderada a grave, la administración de tralokinumab a dosis de 300mg cada 2 semanas durante 12 semanas logró una reducción del EASI frente a placebo (media de cambio ajustada respecto al valor basal de −15,7 vs. −10,8; p=0,011) y un mayor porcentaje de pacientes presentó un IGA 0-1 (26,7 vs. 11,8%). Estos resultados muestran también una alta respuesta a placebo, probablemente debido al uso concomitante de corticoides tópicos en este EC. También hubo una mejoría significativa en el SCORAD, el Dermatology Life Quality Index y el prurito20. En este momento están en marcha EC de fase iii de tralokinumab en adultos21 y adolescentes22.
Lebrikizumab es otro anticuerpo monoclonal dirigido frente a la IL-13. Se une a la IL-13 soluble e inhibe su unión al IL-4Rα23. En un EC fase ii en 209 pacientes adultos con DA moderada a grave, el grupo tratado con lebrikizumab 125mg cada 4 semanas presentó un mayor porcentaje de EASI-50 que el grupo tratado con placebo (82,4 vs. 62,3%; p=0,026). De nuevo, hubo respuestas no despreciables en el grupo placebo, que podrían atribuirse al uso concomitante de corticoides tópicos24. En este momento se encuentra activo un ensayo que evalúa su eficacia a dosis de 250mg cada 2 y 4 semanas25.
El bloqueo específico de la IL-13 también ha sido evaluado en el asma, con mejorías modestas para tralokinumab y lebrikizumab26,27. Al igual que en la DA, la respuesta podría ser mayor en aquellos pacientes con concentraciones más elevadas de marcadores relacionados con la IL-1320. Sin embargo, se necesitan EC en monoterapia para evaluar la utilidad del bloqueo exclusivo de IL-13.
Bloqueo de la inducción a la respuesta Th2: TSLP, OX40L e IL-33El eje Th2 también incluye la vía de la TSLP, clave en la interacción entre la epidermis y la activación inmune innata y adaptativa, al derivar la respuesta inflamatoria a un fenotipo alérgico a través de la activación de las células dendríticas inmaduras, que expresan OX40L, lo que permite la polarización hacia una respuesta Th228. De forma parecida, IL-33, producida por las células epiteliales, puede regular positivamente el eje TSLP-célula dendrítica-OX40L, participando en la inducción y el mantenimiento de la respuesta Th229,30. La inhibición de esta vía podría ser interesante desde el punto de vista del tratamiento temprano, debido a su participación en el inicio de la respuesta Th2.
Tezepelumab es un anticuerpo monoclonal frente a TSLP, recientemente evaluado en un EC fase iia, sin presentar una eficacia superior a placebo a las 16 semanas31. En este momento se encuentra en marcha otro EC de búsqueda de dosis con tezepelumab (NCT03809663). Otra molécula, la MK-8226, antagonista del receptor del TSLP, fue evaluada en un EC fase i a distintas dosis, por vía IV, con resultados que muestran un descenso significativo del EASI a dosis de 3mg/kg en comparación con placebo a las 12 semanas (10,20 vs. 0,38; p=0,015)32.
Un anticuerpo monoclonal frente a OX40, el GBR 830, ha sido evaluado frente a placebo a dosis de 10mg/kg/4s IV durante 2 meses, con resultados positivos33. En este momento están en marcha EC con otro inhibidor del OX40, la molécula KHK4093 (NCT03096223 y NCT03703102), así como con etokimab/ANB020, un anticuerpo monoclonal anti-IL-33 (NCT03533751).
Antagonismo de la respuesta celular Th22Los linfocitos Th22 son los principales productores de IL-22 y participan tanto en las formas agudas como crónicas de la DA. La IL-22 puede aumentar la disfunción de barrera, inducir hiperplasia epidérmica e inhibir proteínas clave en la queratinización normal, como la filagrina34.
En un EC fase iia, el uso de fezakinumab (ILV-094), un anti-IL-22, a dosis de 300mg cada 2 semanas, consiguió una mejoría, aunque no significativa frente a placebo en la disminución del SCORAD en pacientes con DA moderada a grave. El subanálisis de pacientes con DA grave sí mostró diferencias significativas en la reducción del Body Surface Area (BSA) y el IGA35. El beneficio de este fármaco podría estar limitado a pacientes con peor respuesta al bloqueo de la vía Th2 y con mayor expresión de Th2236, aunque la evidencia hasta la fecha es limitada.
Antagonismo de la respuesta celular Th17Como se ha mencionado, en la etapa crónica de la DA y en determinados grupos de pacientes se mantiene una respuesta Th2 y Th22, pero existe una activación paralela del eje Th1/Th1737. Recientemente, se ha estudiado el bloqueo de la IL-17A y la IL-17C. Aunque los datos sobre la inhibición de este eje en la DA son aún muy preliminares, resulta interesante su desarrollo, dado el potencial terapéutico en determinados subfenotipos de DA.
Secukinumab, un inhibidor selectivo de la IL-17A, aprobado en la psoriasis, ha sido evaluado recientemente en un EC de fase ii en la DA (NCT02594098), con la pauta de inducción empleada en la psoriasis y con un mantenimiento a dosis de 300mg/4 semanas o intensificado 300mg/2 semanas. Los resultados se encuentran pendientes de publicación38.
Por otro lado, están en marcha estudios (NCT03568071, NCT03689829, NCT03864627) con un anticuerpo dirigido frente a la IL-17C, MOR106, que podría mediar una disminución en los niveles de IgE y citocinas Th239.
Bloqueo de la vía IL-31 y OSMRβ (señalización del prurito)La IL-31 es una citocina producida principalmente por los linfocitos Th2, muy relacionada con el prurito, en distintos tipos celulares, incluyendo las neuronas periféricas40,41. La IL-31 se une a un receptor heterodimérico compuesto por el receptor α de la IL-31 (IL-31Rα) y el receptor β de oncastatina M (OSMRβ). Su bloqueo, por tanto, podría también romper el círculo vicioso de prurito-rascado y el compromiso de la función de barrera epidérmica.
Nemolizumab bloquea el receptor α de la IL-31 (IL-31Rα). Hasta la fecha, un EC fase ii controlado con placebo en adultos tratados con nemolizumab (dosis de 0,1mg/kg, 0,5mg/kg o 2mg/kg cada 4 semanas durante 12 semanas) ha demostrado reducciones del prurito; sin embargo, la mejoría en escalas clínicas no alcanzó la significación estadística40,42. Nemolizumab podría ser efectivo en la reducción del prurito, así como en la actividad cotidiana y la productividad laboral43, con un perfil de seguridad adecuado. En este momento está pendiente la finalización de un EC de búsqueda de dosis (NCT03100344).
El EC fase i (NCT01614756) que investigaba el uso de un anti-IL-31 (BMS-981164) finalizó en una etapa temprana y no se han publicado los resultados. Aún se desconoce, por tanto, si los efectos del bloqueo sobre la IL-31 serían solo sintomáticos sobre el prurito, dado que estos no se han asociado a mejoras significativas en los índices de inflamación cutánea.
Por otro lado, se ha realizado un EC fase ia/ib con KPL-716, un anticuerpo anti-OSMRβ que ha demostrado una mejoría del EASI y en las escalas de prurito comparado con placebo44.
Antagonismo de la IgEOmalizumab, un anti-IgE, aprobado en el tratamiento del asma, ha sido evaluado en un metaanálisis, sin evidencia de efectividad global en adultos con DA45. Está en investigación su uso en población pediátrica (NCT02300701).
Moléculas pequeñasSe incluyen agentes de administración oral que generan una reducción amplia, menos específica, de la liberación de mediadores. Esta estrategia tiene ventajas en la DA, ya que, a diferencia de la psoriasis, no existe evidencia de la implicación fundamental de una molécula clave en la patogénesis de la enfermedad. Por el contrario, esta menor especificidad podría relacionarse con potenciales problemas de seguridad.
Inhibición de la vía de señalización JAK-STATEn este momento existen 4 inhibidores de JAK por vía oral en estudio11. Baricitinib antagoniza a JAK 1 (asociada con la modulación de las citocinas IL-4, IL-6, IL-10, IL-13, IL-31 e IFN-γ) y JAK2 (que modula las citocinas IL-5, IL-6, IL-23, IL-31 e IFN-γ)11,46. En el primer EC fase ii la administración de baricitinib, a dosis de 4mg una vez al día por vía oral, en pacientes con DA moderada a grave, se asoció a una mayor consecución de EASI-50 en comparación con placebo (61 vs. 37%; p=0,027) a las 16 semanas, con buena tolerancia. Entre los efectos adversos reportados se encuentra la elevación asintomática de la creatina cinasa, pero no hubo casos de eventos trombóticos ni de herpes zóster47.
Upadacitinib (ABT-494) y abrocitinib (PF-04965842) son inhibidores selectivos de JAK1, de los que se dispone de resultados iniciales prometedores. Un EC fase iib evaluó el uso de upadacitinib a dosis de 7,5/15/30mg frente a placebo durante 16 semanas. La reducción en el EASI frente al valor basal fue del 74/62/39% para las dosis de 30/15/7,5mg, respectivamente, mejorías que podrían ser similares a las obtenidas con dupilumab. En este momento se encuentra activo un EC fase iii de evaluación de la eficacia de upadacitinib en adultos y adolescentes (NCT03607422). Otro EC fase iib evaluó el uso de abrocitinib a dosis de 10/30/100/200mg al día frente a placebo, con reducciones del EASI que solo fueron significativas para las dosis de 200mg (82,6%; p<0,001) y de 100mg (59%; p=0,009) frente a placebo (35,2%)46. Están en marcha numerosos EC fase iii de abrocitinib a dosis de 100 y 200mg frente a placebo (NCT03349060, NCT03575871, NCT03627767 y NCT03422822), así como un EC fase iii comparado con dupilumab (NCT03720470). Por último, ASN002 es un inhibidor dual de las vías JAK y SYK. La inhibición PAN-JAK afecta a la señalización de diversas citocinas en la DA (IL-4, IL-13, IL-31 e IL-33), mientras que la inhibición de SYK suprime la señalización de citocinas proinflamatorias (IL-1β, IL-10, IL-17). En el primer EC de fase ib de ASNN002, el porcentaje de pacientes que alcanzó un EASI-50 a los 28 días fue superior a placebo para las dosis de 40 y 80mg48.
En la actualidad, están activos EC de fase iii con estos 4 fármacos.
Antagonismo de la fosfodiesterasa 4Recientemente, se ha evaluado el tratamiento con inhibidores de la fosfodiesterasa (PDE4), de administración tópica y oral. En la DA la actividad de la PDE4 en distintas células inflamatorias está aumentada en comparación con la piel sana. La PDE degrada el AMPc, que normalmente inhibe la producción de diversas citocinas proinflamatorias, como la IL-4, la IL-31 y la PGE-2. El antagonismo de la PDE4 actúa de forma amplia y no específica, ya que eleva el AMPc intracelular y permite reducir la liberación de citocinas y quimiocinas49.
En un estudio fase ii, apremilast 40mg/12h logró una reducción del EASI superior a placebo (31,57 vs. 10,98%; p=0,034). Sin embargo, no hubo diferencias estadísticamente significativas en el EASI-50 ni en el prurito50. En este momento no hay nuevos EC con apremilast en DA.
Antagonismo del receptor de la histamina 4En los últimos años se ha estudiado el papel del antagonismo del receptor de la histamina 4, que no solo lograría un efecto antipruriginoso, sino también antiinflamatorio, dado que la activación del receptor en el queratinocito interfiere en su proliferación y en la función de barrera51.
Un EC fase iia con un antagonista del receptor de la histamina 4, JNJ-39758979, mostró diferencias significativas en la reducción del prurito, no así del EASI. Sin embargo, este EC fue interrumpido debido a 2 casos de neutropenia grave52. Recientemente se han publicado los resultados de EC en fase ii con otro antagonista del receptor de la histamina 4, ZPL-3893787, con disminuciones significativas frente a placebo del EASI y, en cambio, no significativas en el prurito53.
Bloqueo del receptor de la neuroquinina 1La sustancia P, mediadora del prurito, se une principalmente al receptor de la neuroquinina 1, que se expresa tanto en el sistema nervioso central como en la piel. En este sentido, antagonistas del receptor de la neuroquinina 1 de administración oral, como aprepitant, podrían mejorar el prurito54. Sin embargo, su uso en la DA no parece aportar beneficios55. Otros inhibidores del receptor de la neuroquinina 1, tradipitant y serlopitant, están siendo evaluados, aunque también con resultados modestos.
En la tabla 1 se resumen los principales EC de los nuevos fármacos sistémicos, y en las figuras 1 y 2 se señalan sus dianas terapéuticas.
Resumen de los tratamientos sistémicos de nuevo desarrollo y en fases de investigación para dermatitis atópica
| Fármaco | Diana | Vía administración | Gravedad | Fase | Estado | Intervención | Eficacia | Seguridad | Ensayos clínicos (ID) |
|---|---|---|---|---|---|---|---|---|---|
| Fármacos biológicos | |||||||||
| Antagonismo del eje TH2 | |||||||||
| Antagonismo específico de IL-4/IL-13 | |||||||||
| Dupilumab | IL-4, IL-13 (IL-4Rα) | SC | Moderada a grave | IIIa | Completado | Aleatorización 1:1:1 (dupilumab 300mg/7d vs. 300mg/15d vs. placebo)Durante 16 semanas*Grupos con dupilumab: dosis de carga de 600mg el día 1 | Dupilumab 300mg/7d vs. 300mg/15d vs. placeboObjetivo primario: IGA 0-1SOLO-1: 37 vs. 38 vs. 10%SOLO-2: 36 vs. 36 vs. 8%Mejoría significativa del EASI-75, BSA, SCORAD, GISS, prurito y calidad de vida | Reacciones en el lugar de inyecciónConjuntivitis | NCT02277743(SOLO-1)NCT02277769(SOLO-2)NCT02612454NCT03054428 |
| Tralokinumab | IL-13 (IL-13Rα1 e IL-13Rα2) | SC | Moderada a grave | IIbIII | Completado | Aleatorización 1:1:1:1 (tralokinumab 45, 150 y 300mg/15d vs. placebo)Uso concomitante de corticoides tópicos | Tralokinumab 300mg: reducción del EASI (diferencia media ajustada, −4,94; IC 95% −8,76 a −1,13; p=0,01). IGA 0-1: 26,7 vs. 11,8% para placebo. Mejoría significativa del SCORAD, DLQI y prurito | Reacciones en el lugar de inyección | NCT02347176NCT03131648NCT03160885NCT03363854NCT03526861 |
| Lebrikizumab | IL-13 | SC | Moderada a grave | II | Completado | Aleatorización 1:1:1:1 (lebrikizumab 125mg (DU) vs. 250mg (DU) vs. 125mg/4s vs. placebo)Uso concomitante de corticoides tópicos | Objetivo primarioEASI-50: lebrikizumab 125mg/4s (82,4%) vs. placebo (62,3%); p=0,026 | Reacciones en el lugar de inyecciónInfecciones herpéticas leves, eosinofilia periférica | NCT02340234NCT03443024 |
| Antagonismo de la polarización Th2: TSLP, OX40L e IL-33 | |||||||||
| Tezepelumab | TSLP | SC | Moderada a grave | IIaIIb | Completado | Aleatorización 1:1 (tezepelumab 280mg/2s vs. placebo)Uso concomitante de corticoides tópicos | EASI-50 (tezepelumab 64,7% vs. placebo 48,2%; p=0,091)No diferencias estadísticamente significativas | Reacciones en el lugar de inyección | NCT02525094NCT03809663 |
| MK-8226 | TSLP-R | IV | Moderada a grave | I | Suspendido | - | - | - | NCT01732510 |
| GBR 830 | OX40 | IVSC | Moderada a grave | IIaIIb | Completado | Aleatorización 3:1GBR 830 10mg/kg vs. placebo días 1 y 29 | Porcentaje de pacientes que alcanzan EASI-50 con GBR 830 superior a placebo, pero no diferencias estadísticamente significativas (44 vs. 20%) | Buena tolerancia | NCT02683928NCT03568162 |
| KHK4083 | OX40 | IV | Moderada a grave | III | Completado | KHK-4083 0,003 y 0,001mg/kg y dosis ascendentes hasta 10mg/kg | Tolerancia, seguridad | Buena tolerancia. Se ha descrito el desarrollo de anticuerpos anti-KHK4083 | NCT03096223NCT03703102 |
| Etokinab (ANB020) | IL-33 | SC | Moderada a grave | II | Activo | Etokinab vs. placebo | - | - | NCT03533751 |
| Antagonismo de la respuesta TH22 | |||||||||
| Fezakinumab | IL-22 | IV | Moderada a grave | II | Completado | Aleatorización 2:1Fezakinumab 600mg (día 0), seguido de 300mg/2s (última administración la semana 10) vs. placebo | Reducción del SCORAD solo en el subgrupo de DA grave a las 12 semanas (36,4 vs. 22,3%; p=0,05) y a las 20 semanas (46,2 vs. 22,6%; p<0,01). No significación estadística en el total (incluyendo DA moderada) | Nasofaringitis | NCT01941537 |
| Antagonismo de la respuesta TH17 e IL-23 | |||||||||
| Secukinumab | IL-17A | SC | Moderada a grave | II | Completado | Estudio paralelo con secukinumab (misma posología que en psoriasis) vs. placebo | Evaluación a las 16 semanas. Pendiente de publicación de resultados | Buena tolerancia | NCT02594098NCT03568136 |
| MOR106 | IL-17C | IV | Moderada a grave | II | Activo | MOR106 a distintas dosis vs. placebo | - | - | NCT03568071NCT03689829NCT03864627 |
| Ustekinumab | IL-12, IL-23 (p40) | SC | Moderada a grave | II | Completado | Estudio cruzado con ustekinumab (misma posología que en psoriasis) vs. placebo | Mayor porcentaje de pacientes lograron una respuesta SCORAD-50 vs. placebo, pero no estadísticamente significativa | Buena tolerancia | NCT01806662 |
| Bloqueo de la vía IL-31 y OSMRβ | |||||||||
| Nemolizumab | IL-31RA | SC | Moderada a grave | II | Completado | Aleatorización 1:1:1:1Nemolizumab (0,1, 0,5 o 2mg/kg, placebo) | Reducciones significativas del prurito dependientes de dosis para nemolizumab (−63,1% para dosis de 0,5mg/kg vs. −20,9%). Mejoría del EASI y SCORAD | Reacciones en el lugar de inyección, nasofaringitis | NCT01986933NCT03100344 |
| BMS-981164 | IL-31 | SC | Moderada a grave | I | Suspendido | Sin resultados | NCT01614756 | ||
| KPL-716 | OSMRβ | IV/SC | Moderada a grave | Ia | Completado | Dosis de 0,3, 1,5 y 7,5mg/kg vs. placebo | Mejores resultados en reducción del EASI y del prurito para las dosis de 7,5mg/kg vs. placebo | Buena toleranciaCefalea, hiporexia | Mikhak et al.44 |
| Antagonismo de la IgE o de IL-5 | |||||||||
| Omalizumab (aprobado en asma) | IgE | IV | Moderada a graveGrave | IIIV | CompletadoActivo | OmalizumabOmalizumab vs. placebo en pacientes de 4-19 años con IgE>300KU/l | Resultados no publicados- | Resultados no publicados- | NCT01179529NCT02300701 |
| Ligelizumab (QGE031) | IgE (mayor afinidad que omalizumab) | SC | Moderada a grave | II | Completado | Aleatorización 1:1:1 (ligelizumab/2s vs. placebo vs. CsA) | Resultados no publicados | Resultados no publicados | NCT01552629 |
| Mepolizumab (aprobado en asma) | IL-5 | SC | Moderada a grave | II | Suspendido (futilidad) | Mepolizumab 100mg/4s vs. placebo | Finalización prematura del ensayo tras análisis estadístico intermedio | No se ha demostrado eficacia. | NCT03055195 |
| Fármacos molécula pequeña | |||||||||
| Inhibición de la vía de señalización JAK-STAT | |||||||||
| Baricitinib | JAK1, JAK2 | VO | Moderada a grave | IIIII | CompletadoActivo | Aleatorización 1:1:1 (baricitinib 2mg, 4mg, placebo) 1v/dJunto a aplicación tópica de corticoides | EASI-50: mayor proporción de pacientes para baricitinib 4mg/d vs. placebo (61 vs. 37%; p=0,027) a las 16 semanas | Buena tolerancia (no casos de neoplasia,eventos trombóticos ni cardiovasculares), ni herpes zóster | NCT02576938NCT03334396NCT03334422NCT03334435NCT03428100NCT03435081NCT03559270NCT03733301NCT03952559 |
| Upadacitinib (ABT-494) | JAK1 | VO | Moderada a grave | IIbIII | CompletadoActivo | Aleatorización 1:1:1:1 (upadacitinib 7,5, 15 y 30mg vs. placebo) | Reducción media del EASI a las 16 semanas a dosis de 30/15/7,5mg fue del 74/62/39% vs. placebo (23%); p<0,05 | Buena tolerancia. Infecciones respiratorias de vías altas y acné. | NCT02925117NCT03607422NCT03568318NCT03738397NCT03661138 |
| Abrocitinib (PF-04965842) | JAK1 | VO | Moderada a grave | IIbIII | CompletadoActivo | Aleatorización 1:1:1:1:1 (abrocitinib 10, 30, 100 y 200mg, placebo) 1v/d | Porcentaje IGA 0-1 y mejoría de≥2 puntos respecto el basal, significativamente mayor para abrocitinib 200mg/d vs. placebo (44,5 vs. 6,3%) a las 12 semanas | Buena tolerancia, un caso de eccema herpeticum y uno de neumonía | NCT02780167NCT03349060NCT03422822NCT03575871NCT03627767NCT03720470 |
| ASN002 | PAN-JAK (JAK1, JAK2, JAK3, TYK), SYK | VO | Moderada a grave | III | Completado | Aleatorización 1:1:1:1 (ASN002 20, 40 y 80mg vs. placebo)Durante 28 días | Proporción de pacientes que alcanzan EASI-75 significativamente superior para ASN002 40mg (71,4%; p=0,06) y para ASN002 80mg (33,3%; p=0,65) vs. placebo (22,2%) | Buena tolerancia | NCT03139981NCT03531957 |
| Antagonismo de la PDE4 | |||||||||
| Apremilast | PDE4 | VO | Moderada a grave | II | Completado | Diseño paralelo 1:1:1:1 (apremilast 30mg/12h, 40mg/12h vs. placebo/apremilast 30mg/12h vs. placebo/apremilast 40mg/12h) | Reducción significativa del EASI respecto al basal a las 12 semanas de apremilast 40mg/12h vs. placebo (31,57 vs. 10,98%; p=0,034). No ventajas respecto a EASI-50 ni prurito. No diferencias significativas a 30mg/12h | Diarrea, náuseas, molestias abdominales | NCT02087943 |
| Antagonismo del H4R | |||||||||
| JNJ-39758979 | H4R | VO | Moderada | II | Suspendido (efectos adversos) | JNJ-39758979 300 o 100mg vs. placebo 1v/d | Terminación temprana del ensayo clínico | Dos casos de neutropenia | NCT01497119 |
| ZPL389 | H4R | VO | Moderada a grave | II | Completado | ZPL-389 30mg vs. placebo 1v/d | Mejoría significativa del EASI (50 vs. 27%). No diferencias significativas en cuanto al prurito | Buena tolerancia | NCT02424253NCT03517566 |
| Bloqueo del NKR1 | |||||||||
| Serlopitant | NKR1 | VO | Leve, moderada o grave | II | Completado | Aleatorización 1:1:1 (serlopitant 1 y 5mg vs. placebo)6 semanas | Reducción del prurito no significativa frente a placebo (−2,25 vs. −2,32 vs. −2,01) | Buena tolerancia | NCT02975206 |
| Tradipitant | NKR1 | VO | Leve, moderada o grave | IIIIIII | CompletadoCompletadoActivo | Aleatorización 1:1 (tradipitant 100mg/24h vs. placebo) | Reducción del prurito no significativa frente a placeboSin otros resultados | Buena tolerancia | NCT02004041NCT02651714NCT03568331 |
| Agonismo del kOR | |||||||||
| Asimadolina | Agonista del kOR | VO | Leve, moderada o grave | II | Completado | Aleatorización 1:1 (amisadolina 2,5mg/12h vs. placebo/12h) | Sin resultados | Sin resultados | NCT02475447 |
| Otras moléculas | |||||||||
| DS107 | DGLA | VO | Moderada a grave | II | Completado | Aleatorización 1:1:1 (DS107 1g vs. 2g vs. placebo)1v/d | Resultados no publicados | Resultados no publicados | NCT02864498 |
BSA: Body Surface Area; CsA: ciclosporina A; DA: dermatitis atópica; DGLA: ácido dihomo-γ-linoleico; DLQI: Dermatology Life Quality Index; GISS: Global Individual Signs Score; DU: dosis única; EASI: Eczema Area and Severity Index; H4R: receptor de la histamina 4; IGA: Investigator Global Assessment; IL: interleucina; IV: intravenoso; JAK: Janus kinase; kOR: receptor opioide kappa; NKR1: receptor de la neuroquinina 1; PDE4: fosfodiesterasa 4; SC: subcutáneo; SCORAD: SCORing Atopic Dermatitis; TH: (linfocito) T helper; TSLP: thymic stromal lymphopoietin; TYK: tyrosine-kinase; VO: vía oral.
Los datos mencionados específicamente en la tabla pertenecen a los ensayos clínicos (ID) señalados mediante subrayado.
De forma independiente a los avances en los fármacos sistémicos, las terapias tópicas siguen siendo esenciales tanto en la reparación de la función de barrera como en el transporte de moléculas antiinflamatorias. Más allá de los emolientes, los corticoides y los inhibidores de la calcineurina, se han desarrollado nuevas moléculas de pequeño tamaño que permiten considerar su uso tópico.
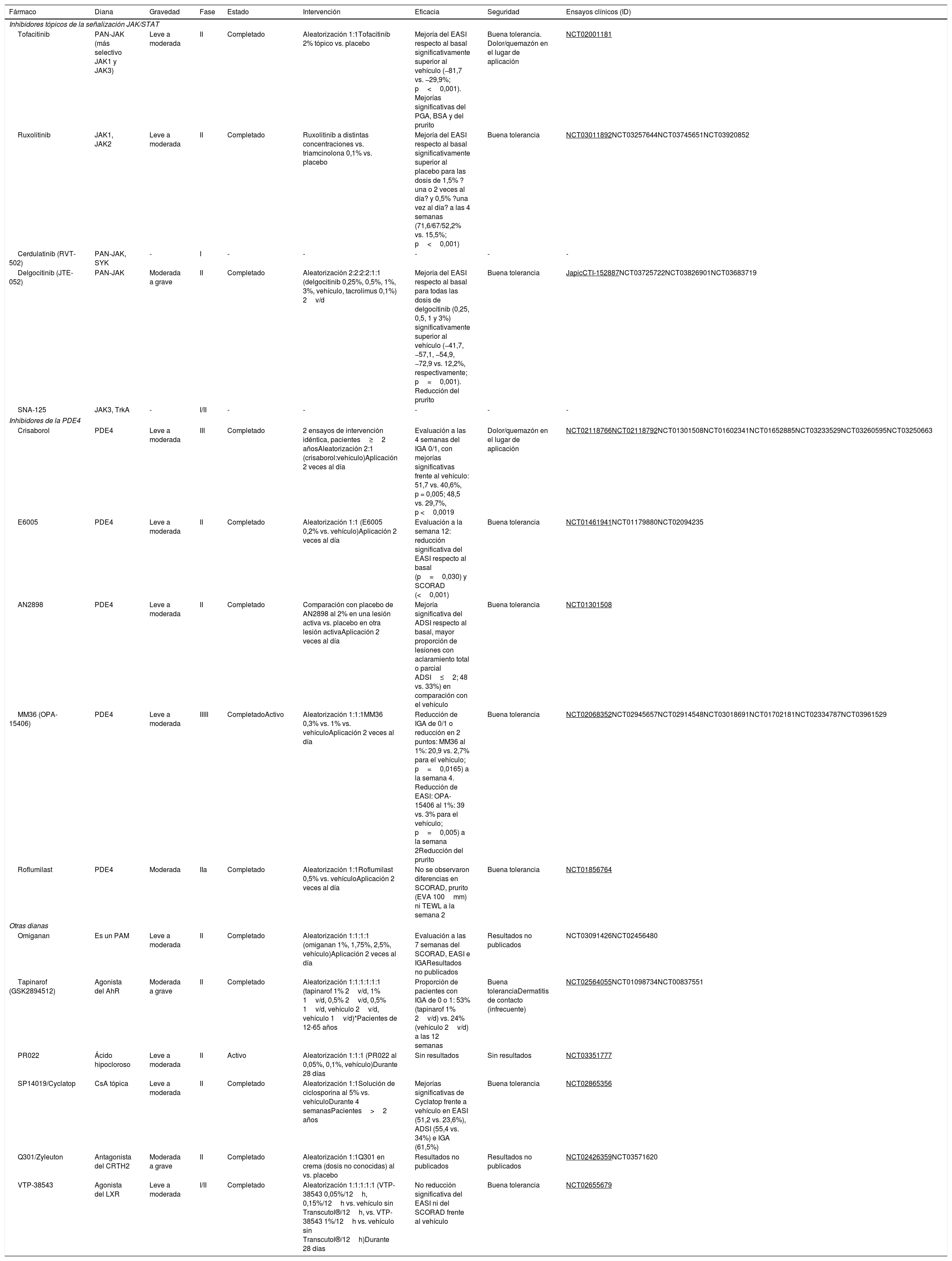
Inhibidores tópicos de la señalización JAK/STATEn el momento actual se encuentran en investigación inhibidores tópicos de la vía JAK/STAT. Entre estos, tofacitinib tópico al 2% y ruxolitinib al 1,5% parecen tener eficacia en la reducción del EASI y del prurito46. En un EC japonés, delgocitinib, un inhibidor PAN-JAK, también ha demostrado mejorías del EASI superiores al vehículo, sin efectos adversos significativos56.
Inhibidores tópicos de la PDE4El crisaborol tópico al 2% es el primer inhibidor de la PDE4 aprobado en adultos y niños mayores de 2 años con DA leve a moderada. En los EC de fase iii se demostró una eficacia estadísticamente significativa en términos de IGA-0 (51,7%) e IGA-1 (48,5%) frente a vehículo (40,6 y 29,7%, respectivamente) a las 4 semanas57. Se han descrito reacciones adversas leves, como dolor o quemazón en el lugar de aplicación. Están en marcha EC con otros inhibidores de la PDE4, como las moléculas E6005 y AN289858.
OminaganLa menor producción de péptidos antimicrobianos en la DA facilita la colonización y la infección microbiana e incrementa la respuesta inflamatoria. En este sentido, se ha desarrollado ominagan en gel, un péptido antimicrobiano evaluado en 2 EC fase ii; aunque se desconocen sus resultados, existen publicaciones que indican buena tolerancia59.
TapinarofTapinarof es un antiinflamatorio no esteroideo que actúa como agonista del receptor de hidrocarburo arilo, pudiendo mejorar la función de barrera y limitar la respuesta Th260. En un EC fase ii el uso de tapinarof al 1% 2 veces al día demostró diferencias significativas en el IGA 0-1 y en la reducción del EASI, el SCORAD y el BSA frente al vehículo, con buena tolerancia y desarrollo de 2 casos de dermatitis de contacto sobre 165 pacientes tratados61.
PR022 (ácido hipocloroso)En una serie de casos de pacientes con DA, el uso al 0,008 y 0,002% de ácido hipocloroso tópico, en hidrogel, se asoció a una reducción del prurito. Se cree que el ácido hipocloroso podría disminuir las concentraciones de distintas citocinas, como el TNF-α, la IL-2, el IFN-γ o la histamina59. Está en marcha un EC fase ii en adultos con DA leve-moderada (NCT03351777).
SP14019/CyclatopSP14019/Cyclatop es una formulación tópica en espray de ciclosporina al 5%, evaluada en un EC fase ii en pacientes>2 años (NCT02865356). Sus resultados fueron presentados en el congreso europeo de dermatología del 2018, con mejorías significativas del EASI y el IGA frente al vehículo a las 4 semanas, con buena tolerancia y escasa absorción sistémica62.
En la tabla 2 se resumen los fármacos tópicos en vías de investigación.
Resumen de los tratamientos tópicos de nuevo desarrollo y en fases de investigación para dermatitis atópica
| Fármaco | Diana | Gravedad | Fase | Estado | Intervención | Eficacia | Seguridad | Ensayos clínicos (ID) |
|---|---|---|---|---|---|---|---|---|
| Inhibidores tópicos de la señalización JAK/STAT | ||||||||
| Tofacitinib | PAN-JAK (más selectivo JAK1 y JAK3) | Leve a moderada | II | Completado | Aleatorización 1:1Tofacitinib 2% tópico vs. placebo | Mejoría del EASI respecto al basal significativamente superior al vehículo (−81,7 vs. −29,9%; p<0,001). Mejorías significativas del PGA, BSA y del prurito | Buena tolerancia. Dolor/quemazón en el lugar de aplicación | NCT02001181 |
| Ruxolitinib | JAK1, JAK2 | Leve a moderada | II | Completado | Ruxolitinib a distintas concentraciones vs. triamcinolona 0,1% vs. placebo | Mejoría del EASI respecto al basal significativamente superior al placebo para las dosis de 1,5% ?una o 2 veces al día? y 0,5% ?una vez al día? a las 4 semanas (71,6/67/52,2% vs. 15,5%; p<0,001) | Buena tolerancia | NCT03011892NCT03257644NCT03745651NCT03920852 |
| Cerdulatinib (RVT-502) | PAN-JAK, SYK | - | I | - | - | - | - | - |
| Delgocitinib (JTE-052) | PAN-JAK | Moderada a grave | II | Completado | Aleatorización 2:2:2:2:1:1 (delgocitinib 0,25%, 0,5%, 1%, 3%, vehículo, tacrolimus 0,1%) 2v/d | Mejoría del EASI respecto al basal para todas las dosis de delgocitinib (0,25, 0,5, 1 y 3%) significativamente superior al vehículo (−41,7, −57,1, −54,9, −72,9 vs. 12,2%, respectivamente; p=0,001). Reducción del prurito | Buena tolerancia | JapicCTI-152887NCT03725722NCT03826901NCT03683719 |
| SNA-125 | JAK3, TrkA | - | I/II | - | - | - | - | - |
| Inhibidores de la PDE4 | ||||||||
| Crisaborol | PDE4 | Leve a moderada | III | Completado | 2 ensayos de intervención idéntica, pacientes≥2 añosAleatorización 2:1 (crisaborol:vehículo)Aplicación 2 veces al día | Evaluación a las 4 semanas del IGA 0/1, con mejorías significativas frente al vehículo: 51,7 vs. 40,6%, p = 0,005; 48,5 vs. 29,7%, p <0,0019 | Dolor/quemazón en el lugar de aplicación | NCT02118766NCT02118792NCT01301508NCT01602341NCT01652885NCT03233529NCT03260595NCT03250663 |
| E6005 | PDE4 | Leve a moderada | II | Completado | Aleatorización 1:1 (E6005 0,2% vs. vehículo)Aplicación 2 veces al día | Evaluación a la semana 12: reducción significativa del EASI respecto al basal (p=0,030) y SCORAD (<0,001) | Buena tolerancia | NCT01461941NCT01179880NCT02094235 |
| AN2898 | PDE4 | Leve a moderada | II | Completado | Comparación con placebo de AN2898 al 2% en una lesión activa vs. placebo en otra lesión activaAplicación 2 veces al día | Mejoría significativa del ADSI respecto al basal, mayor proporción de lesiones con aclaramiento total o parcial ADSI≤2; 48 vs. 33%) en comparación con el vehículo | Buena tolerancia | NCT01301508 |
| MM36 (OPA-15406) | PDE4 | Leve a moderada | IIIII | CompletadoActivo | Aleatorización 1:1:1MM36 0,3% vs. 1% vs. vehículoAplicación 2 veces al día | Reducción de IGA de 0/1 o reducción en 2 puntos: MM36 al 1%: 20,9 vs. 2,7% para el vehículo; p=0,0165) a la semana 4. Reducción de EASI: OPA-15406 al 1%: 39 vs. 3% para el vehículo; p=0,005) a la semana 2Reducción del prurito | Buena tolerancia | NCT02068352NCT02945657NCT02914548NCT03018691NCT01702181NCT02334787NCT03961529 |
| Roflumilast | PDE4 | Moderada | IIa | Completado | Aleatorización 1:1Roflumilast 0,5% vs. vehículoAplicación 2 veces al día | No se observaron diferencias en SCORAD, prurito (EVA 100mm) ni TEWL a la semana 2 | Buena tolerancia | NCT01856764 |
| Otras dianas | ||||||||
| Omiganan | Es un PAM | Leve a moderada | II | Completado | Aleatorización 1:1:1:1 (omiganan 1%, 1,75%, 2,5%, vehículo)Aplicación 2 veces al día | Evaluación a las 7 semanas del SCORAD, EASI e IGAResultados no publicados | Resultados no publicados | NCT03091426NCT02456480 |
| Tapinarof (GSK2894512) | Agonista del AhR | Moderada a grave | II | Completado | Aleatorización 1:1:1:1:1:1 (tapinarof 1% 2v/d, 1% 1v/d, 0,5% 2v/d, 0,5% 1v/d, vehículo 2v/d, vehículo 1v/d)*Pacientes de 12-65 años | Proporción de pacientes con IGA de 0 o 1: 53% (tapinarof 1% 2v/d) vs. 24% (vehículo 2v/d) a las 12 semanas | Buena toleranciaDermatitis de contacto (infrecuente) | NCT02564055NCT01098734NCT00837551 |
| PR022 | Ácido hipocloroso | Leve a moderada | II | Activo | Aleatorización 1:1:1 (PR022 al 0,05%, 0,1%, vehículo)Durante 28 días | Sin resultados | Sin resultados | NCT03351777 |
| SP14019/Cyclatop | CsA tópica | Leve a moderada | II | Completado | Aleatorización 1:1Solución de ciclosporina al 5% vs. vehículoDurante 4 semanasPacientes>2 años | Mejorías significativas de Cyclatop frente a vehículo en EASI (51,2 vs. 23,6%), ADSI (55,4 vs. 34%) e IGA (61,5%) | Buena tolerancia | NCT02865356 |
| Q301/Zyleuton | Antagonista del CRTH2 | Moderada a grave | II | Completado | Aleatorización 1:1Q301 en crema (dosis no conocidas) al vs. placebo | Resultados no publicados | Resultados no publicados | NCT02426359NCT03571620 |
| VTP-38543 | Agonista del LXR | Leve a moderada | I/II | Completado | Aleatorización 1:1:1:1:1 (VTP-38543 0,05%/12h, 0,15%/12h vs. vehículo sin Transcutol®/12h, vs. VTP-38543 1%/12h vs. vehículo sin Transcutol®/12h)Durante 28 días | No reducción significativa del EASI ni del SCORAD frente al vehículo | Buena tolerancia | NCT02655679 |
ADSI: Atopic Dermatitis Severity Index; AhR: aryl hydrocarbon receptor; BSA: Body Surface Area; CRTH2: receptor transmembrana de la prostaglandina 2; CsA: ciclosporina A; EASI: Eczema Area and Severity Index; EVA: escala visual analógica; IGA: Investigator Global Assessment; LXR: liver X receptors; JAK: Janus kinase; PAM: péptido antimicrobiano; PDE4: fosfodiesterasa 4; PGA: physician global assessment; SCORAD: SCORing Atopic Dermatitis; SYK: spleen tyrosine kinase; TEWL: transepidermal water loss; TrkA: tyrosine receptor kinase-A.
Los datos mencionados específicamente en la tabla pertenecen a los ensayos clínicos (ID) señalados mediante subrayado.
En los últimos años, el mayor conocimiento de la patogenia de la DA, más allá del eje Th2, ha permitido el desarrollo de nuevos fármacos, tópicos y sistémicos —biológicos y moléculas pequeñas—, dirigidos frente a elementos clave de la inflamación. Aunque la psoriasis representa una referencia de medicina traslacional por sus similitudes con la DA, los resultados todavía están lejos de los obtenidos en aquella enfermedad. En la actualidad, todavía está en discusión si la mejor estrategia pasa por la inhibición de elementos concretos del proceso inflamatorio a través de anticuerpos monoclonales —por ejemplo, dupilumab— o moléculas más transversales y menos específicas —por ejemplo, upadicitinib—. El avance en la investigación de las nuevas terapias y la estratificación en los distintos subtipos o subfenotipos de DA en los próximos años parece esencial para llegar a tratamientos efectivos, a largo plazo, con un perfil de seguridad aceptable, especialmente en las formas moderadas a graves.
Conflicto de interesesJ.M. Carrascosa ha recibido honorarios como ponente y asesor para Sanofi y como IP/SI en ensayos clínicos para Sanofi, Lilly, Leo-Pharma, Pfizer, Amgen. M. Munera-Campos ha participado y recibido honorarios como SI en ensayos clínicos para Lilly, Leo-Pharma y Pfizer.