La vía de señalización de citocinas Janus cinasa/transductor de señal y activador de transcripción (JAK/STAT) es un área de interés emergente en dermatología, con evidencia creciente del papel clave en la patogénesis de las enfermedades inflamatorias cutáneas. Debido a que algunas citocinas proinflamatorias usan la vía JAK/STAT para la transducción de señales, esta se convierte en una diana terapéutica prometedora para el tratamiento de dichas enfermedades, al modular de forma selectiva el sistema inmune.
El objetivo de esta revisión es conocer la vía de señalización JAK/STAT y su papel en distintas enfermedades dermatológicas inmunomediadas. En esta primera parte, se revisará la eficacia y seguridad de los inhibidores de JAK –en formulación oral o tópica– para el tratamiento del vitíligo y la alopecia areata.
Dermatologists’ interest in the Janus-associated kinase/signal transducers and activators of transcription (JAK/STAT) pathway has been growing as evidence builds to support its key role in the pathogenesis of inflammatory skin diseases. Because certain proinflammatory cytokines use the JAK/STAT pathway for signal transduction, it has become a promising therapeutic target in diseases where selective modulation of the immune system can be useful.
We aim to review current knowledge of the JAK/STAT signaling pathway and its role in immune-mediated skin diseases. In the first part of the review we cover the efficacy and safety of oral and topical JAK inhibitors in the treatment of vitiligo and alopecia areata.
La vía de señalización intracelular Janus kinase/signal transducer and activator of transcription (JAK/STAT) se activa por la unión de un ligando extracelular a diversos receptores transmembrana, lo que determina la fosforilación de moléculas intracelulares, iniciando así una cascada de señalización intracelular y la eventual regulación de la transcripción de numerosos genes. Las Janus cinasas (JAK) son una familia de tirosincinasas que actúan intracelularmente como transductores de señal, e incluye las moléculas JAK1, JAK2, JAK3 y TYK2.
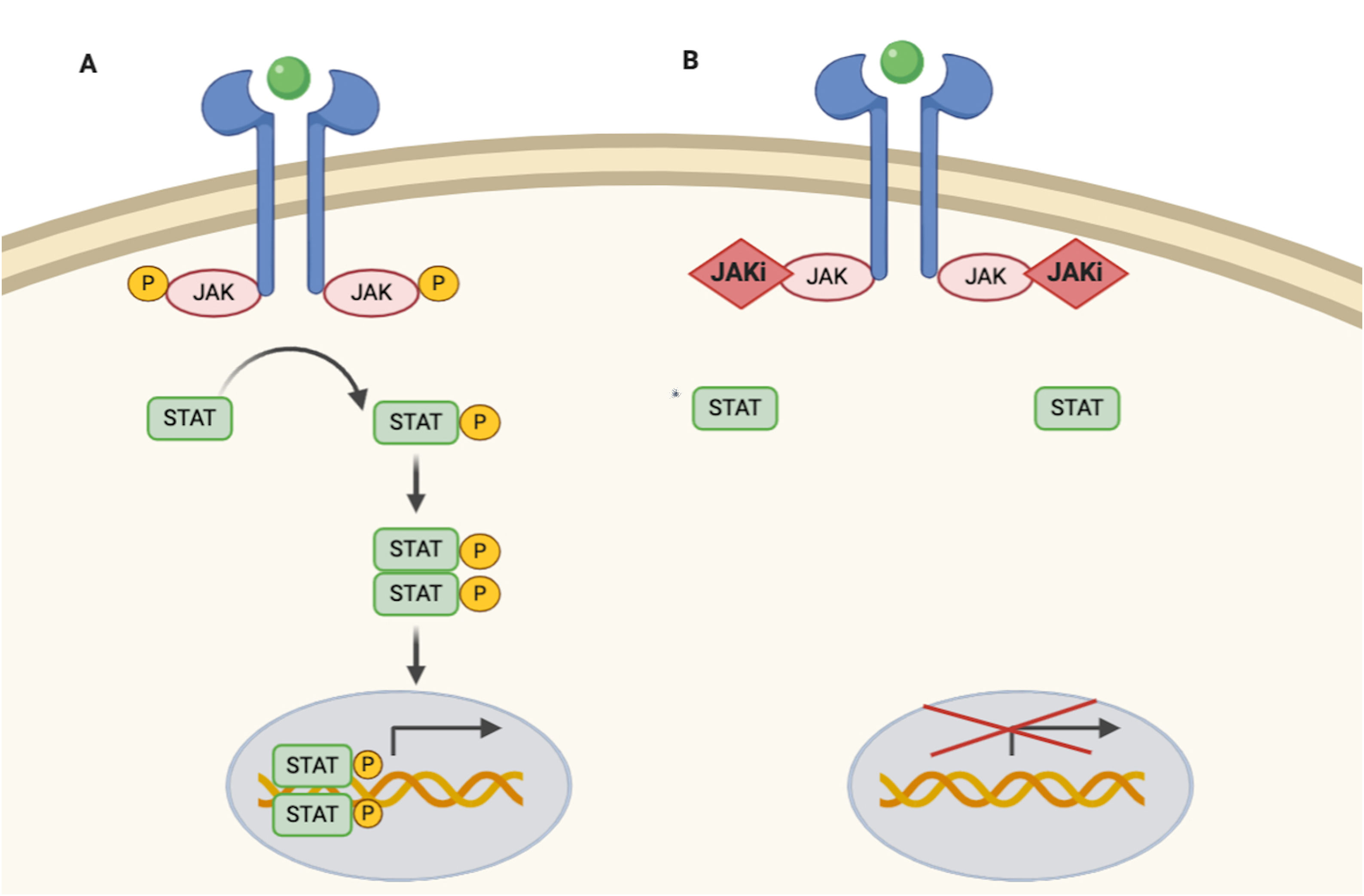
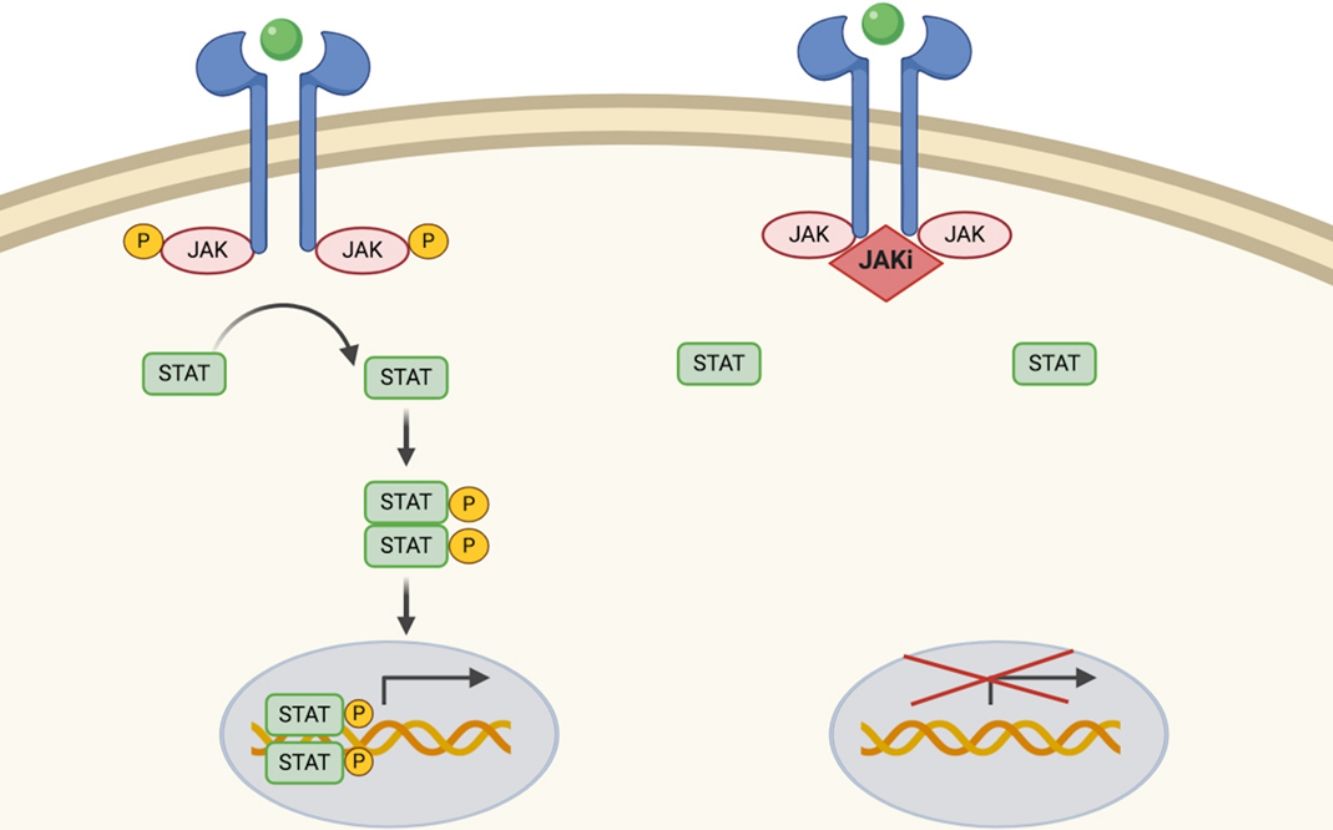
Las JAK actúan formando dímeros en la porción intracitoplasmática de los receptores de citocinas. Estos dímeros de JAK se pueden asociar a múltiples receptores y ser activados por diferentes citocinas y a su vez activar distintas proteínas STAT –STAT1, STAT2, STAT3, STAT4, STAT5a, STAT5b, STAT61– con lo que participarán en funciones biológicas concretas (tabla 1). Al activarse, las proteínas STAT se asocian formando dímeros y son capaces de translocarse al núcleo de la célula. Allí pueden actuar como factores de transcripción –regulando al alza los genes responsables de la producción de citocinas proinflamatorias y factores de crecimiento– o regular el comportamiento de otras proteínas intracelulares2 (fig. 1A).
Familia de Janus cinasas (JAK)
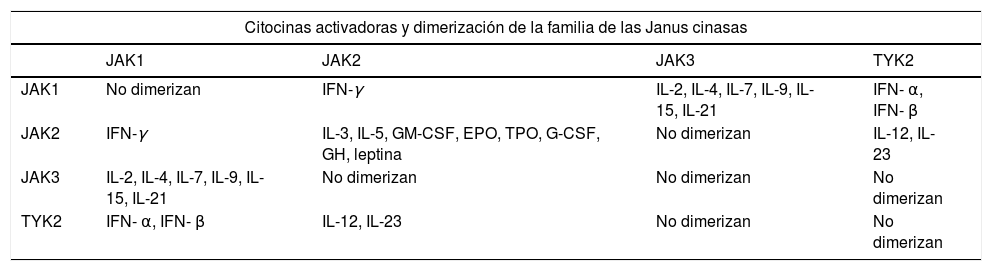
| Citocinas activadoras y dimerización de la familia de las Janus cinasas | ||||
|---|---|---|---|---|
| JAK1 | JAK2 | JAK3 | TYK2 | |
| JAK1 | No dimerizan | IFN-γ | IL-2, IL-4, IL-7, IL-9, IL-15, IL-21 | IFN- α, IFN- β |
| JAK2 | IFN-γ | IL-3, IL-5, GM-CSF, EPO, TPO, G-CSF, GH, leptina | No dimerizan | IL-12, IL-23 |
| JAK3 | IL-2, IL-4, IL-7, IL-9, IL-15, IL-21 | No dimerizan | No dimerizan | No dimerizan |
| TYK2 | IFN- α, IFN- β | IL-12, IL-23 | No dimerizan | No dimerizan |
EPO: eritropoyetina; G-CSF: factor estimulante de colonias de granulocitos; GH: hormona de crecimiento; GM-CSF: factor estimulante de las colonias de granulocitos macrófagos; IFN-α: interferón-alfa; IFN-β: interferón-beta; IFN-γ: interferón-gamma; TPO: trombopoyetina.
Todos los miembros de la familia JAK se expresan de forma ubicua en mamíferos, excepto JAK3 que se expresa principalmente en tejido linfoide y hematopoyético. Cada miembro de la familia JAK dimeriza con otro miembro de la misma familia, y es activado tras la unión de determinadas citocinas a los receptores transmembrana. IFN-γ, por ejemplo, es dependiente de la señalización JAK1/JAK2 y participa en la diferenciación de células T, la función efectora de linfocitos y la activación de macrófagos. JAK2/JAK2 participan en la diferenciación mieloide y linfoide, proliferación y supervivencia de células T, función efectora de los linfocitos, hematopoyesis, crecimiento y metabolismo anabólico. JAK2/ TYK2 intervienen en la diferenciación de células T y la función efectora de los linfocitos. JAK1/JAK3 participan en la proliferación y supervivencia de células T y células T de memoria y la función de las células T reguladoras.
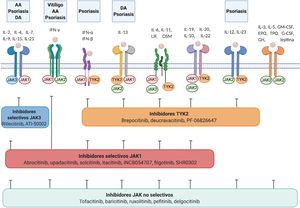
Vía JAK/STAT y mecanismo de acción de los inhibidores JAK.
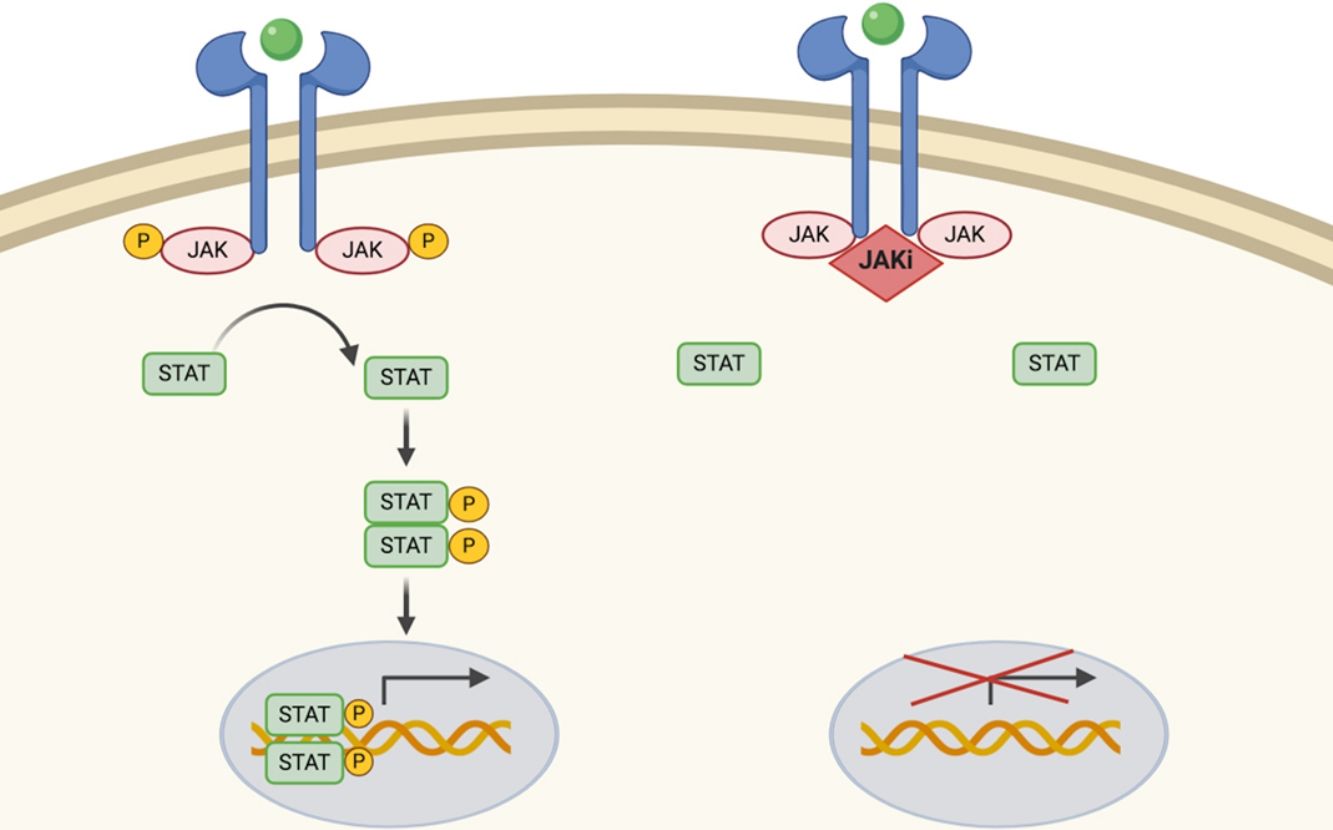
A) Vía JAK/STAT. La citoquina se une al receptor activando las proteínas JAK mediante fosforilación. El JAK activado fosforila proteína STAT, activándola. STAT activado se transloca al núcleo. La proteína STAT activada actúa como un factor de transcripción y se une al ADN, regulando la transcripción de una gran variedad de genes afectando el crecimiento celular y la apoptosis. B) Mecanismo de acción de los inhibidores de JAK (JAKi). Los inhibidores de JAK se unen al sitio de unión del adenosín trifosfato del dímero JAK impidiendo su autofosforilación y activación. Sin la activación de JAK, la proteína STAT tampoco se puede activar ni translocar al núcleo, resultando en una menor transcripción de genes proinflamatorios. Figura creada con ayuda de Biorender.com.
Dado que la respuesta inmune está coordinada y regulada por mediadores solubles que en su mayoría son citocinas proinflamatorias, la vía JAK/STAT es una diana terapéutica en diferentes enfermedades inflamatorias inmunomediadas. Los inhibidores de JAK (JAKi) son moléculas pequeñas que inhiben la actividad cinasa de las JAK y disminuyen de forma efectiva la transducción intracelular de la vía JAK/STAT (fig. 1B).
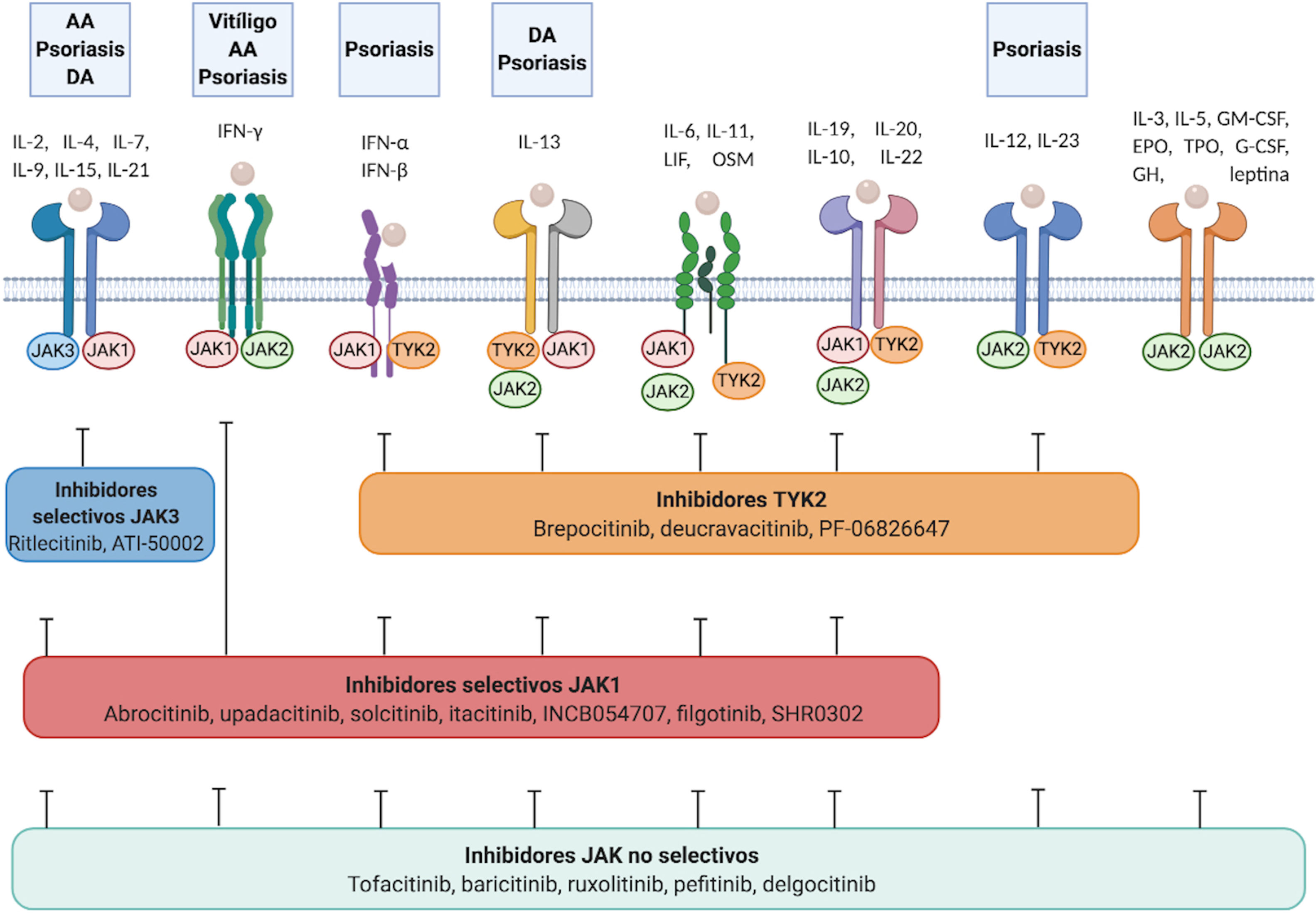
En los últimos años, múltiples JAKi han demostrado su eficacia en enfermedades como la artritis reumatoide, la mielofibrosis o la policitemia vera. Los JAKi de primera generación –como ruxolitinib, baricitinib, delgocitinib y tofacitinib– son escasamente selectivos e inhiben diferentes JAK, mientras que los de segunda generación –como ritlecitinib, deucravacitinib, upadacitinib y abrocitinib– son más selectivos y bloquean predominantemente (en ocasiones de forma exclusiva) un solo miembro de la familia JAK, inhibiendo así la señalización de un rango más estrecho de citocinas (tabla 2, fig. 2).
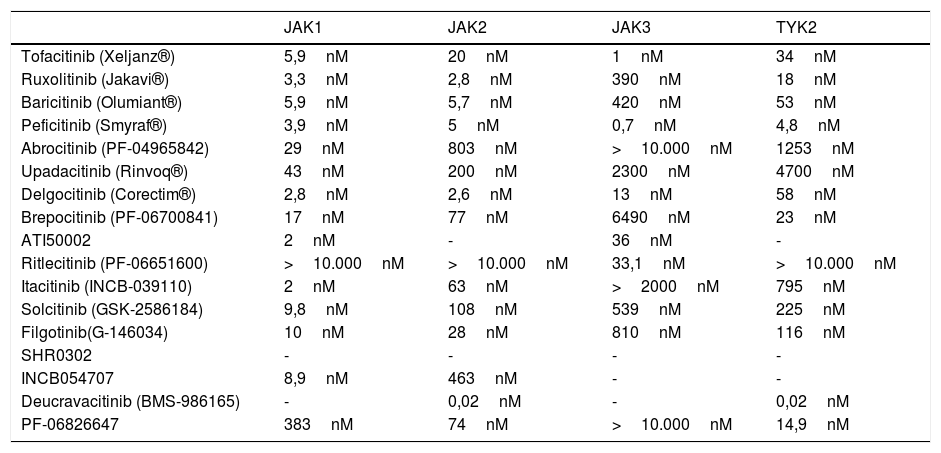
Selectividad de los diferentes inhibidores de JAK usados en dermatología (IC50)
| JAK1 | JAK2 | JAK3 | TYK2 | |
|---|---|---|---|---|
| Tofacitinib (Xeljanz®) | 5,9nM | 20nM | 1nM | 34nM |
| Ruxolitinib (Jakavi®) | 3,3nM | 2,8nM | 390nM | 18nM |
| Baricitinib (Olumiant®) | 5,9nM | 5,7nM | 420nM | 53nM |
| Peficitinib (Smyraf®) | 3,9nM | 5nM | 0,7nM | 4,8nM |
| Abrocitinib (PF-04965842) | 29nM | 803nM | >10.000nM | 1253nM |
| Upadacitinib (Rinvoq®) | 43nM | 200nM | 2300nM | 4700nM |
| Delgocitinib (Corectim®) | 2,8nM | 2,6nM | 13nM | 58nM |
| Brepocitinib (PF-06700841) | 17nM | 77nM | 6490nM | 23nM |
| ATI50002 | 2nM | - | 36nM | - |
| Ritlecitinib (PF-06651600) | >10.000nM | >10.000nM | 33,1nM | >10.000nM |
| Itacitinib (INCB-039110) | 2nM | 63nM | >2000nM | 795nM |
| Solcitinib (GSK-2586184) | 9,8nM | 108nM | 539nM | 225nM |
| Filgotinib(G-146034) | 10nM | 28nM | 810nM | 116nM |
| SHR0302 | - | - | - | - |
| INCB054707 | 8,9nM | 463nM | - | - |
| Deucravacitinib (BMS-986165) | - | 0,02nM | - | 0,02nM |
| PF-06826647 | 383nM | 74nM | >10.000nM | 14,9nM |
IC50: concentración del fármaco que produce un 50% de inhibición; JAK: Janus cinasa.
En la tabla se muestran los valores IC50 para la inhibición de JAK1, JAK2, JAK3 y TYK2 por los diferentes inhibidores JAK con aplicaciones dermatológicas2,96,97. Gusacitinib (ASN002) al ser un inhibidor de SYK, JAK1, JAK2, JAK3 y TYK2 no se representa en la tabla; tiene valores IC50 de 5, 46, 4, 11 y 8nM, respectivamente98,99.
Receptores de citoquinas y selectividad de los inhibidores de JAK en dermatología.
Los diferentes receptores de citocinas se asocian a diferentes JAK, las cuales transducen intracelularmente las señales del ligando extracelular. Los JAKi tienen diferentes capacidades de bloquear la señalización de los receptores de citocinas: los inhibidores no selectivos inhiben muchas citocinas a la vez, mientras que los JAKi más selectivos inhiben una función biológica específica pero permiten la señalización de otras citocinas por otras vías dependientes de JAK.
AA: alopecia areata; DA: dermatitis atópica; EPO: eritropoyetina; G-CSF: factor estimulante de colonias de granulocitos; GH: hormona de crecimiento; GM-CSF: factor estimulante de las colonias de granulocitos macrófagos; IFN-α: interferón-alfa; IFN-β: interferón-beta; IFN-γ: interferón-gamma; TPO: trombopoyetina.
Figura creada con ayuda de Biorender.com.
Los JAKi podrían ampliar las opciones terapéuticas en distintas enfermedades inflamatorias cutáneas (tabla 3, fig. 2). Al disminuir el efecto de todas las citocinas que activan la vía JAK/STAT correspondiente podrían ser más eficaces que los biológicos clásicos que solo van dirigidos a una citocina3. Otra de las ventajas de los JAKi es su pequeño tamaño, lo que hace que las moléculas penetren fácilmente la barrera epidérmica y se puedan usar en formulaciones tópicas4.
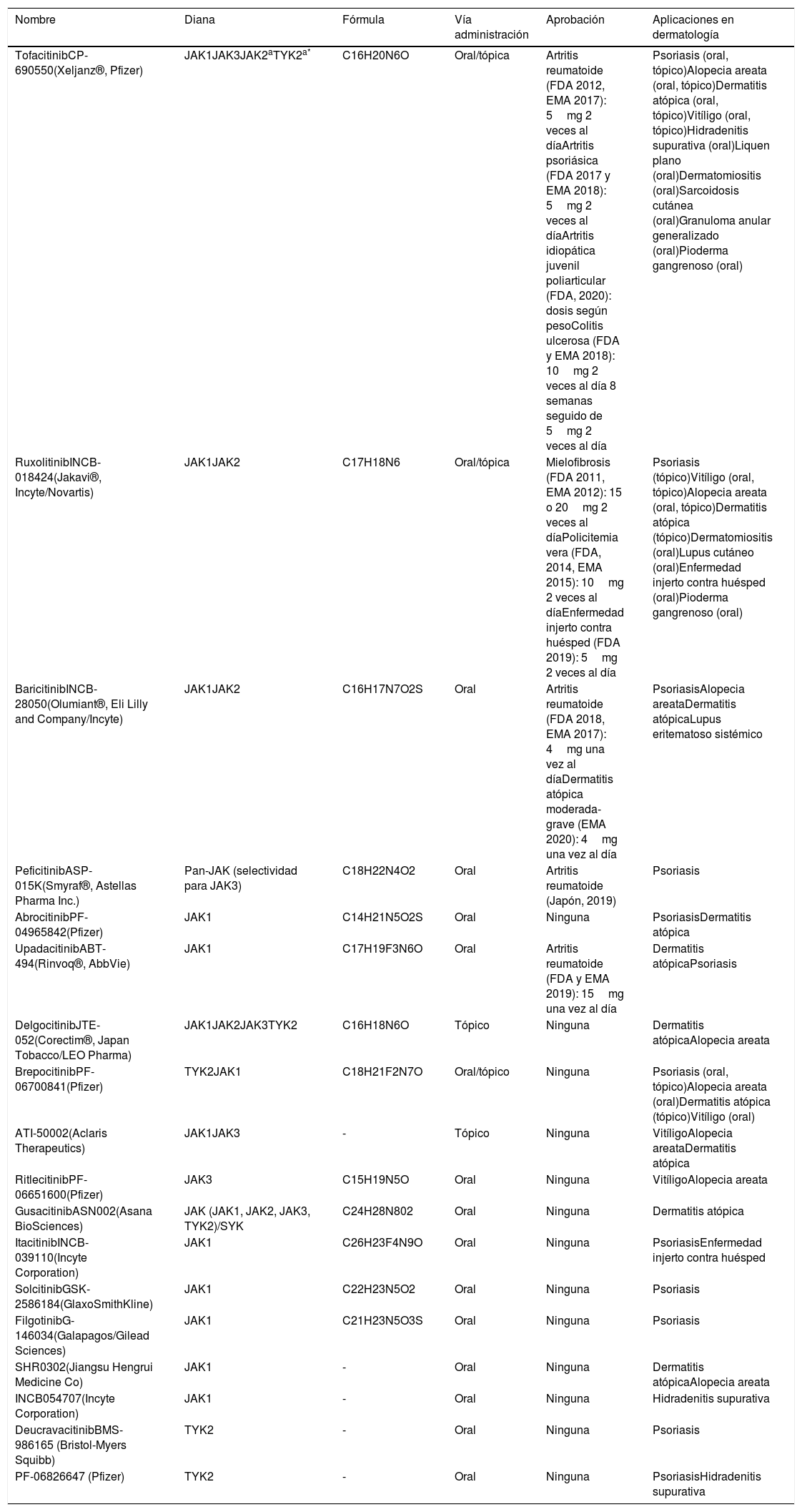
Principales inhibidores de JAK y aplicaciones en dermatología
| Nombre | Diana | Fórmula | Vía administración | Aprobación | Aplicaciones en dermatología |
|---|---|---|---|---|---|
| TofacitinibCP-690550(Xeljanz®, Pfizer) | JAK1JAK3JAK2aTYK2a* | C16H20N6O | Oral/tópica | Artritis reumatoide (FDA 2012, EMA 2017): 5mg 2 veces al díaArtritis psoriásica (FDA 2017 y EMA 2018): 5mg 2 veces al díaArtritis idiopática juvenil poliarticular (FDA, 2020): dosis según pesoColitis ulcerosa (FDA y EMA 2018): 10mg 2 veces al día 8 semanas seguido de 5mg 2 veces al día | Psoriasis (oral, tópico)Alopecia areata (oral, tópico)Dermatitis atópica (oral, tópico)Vitíligo (oral, tópico)Hidradenitis supurativa (oral)Liquen plano (oral)Dermatomiositis (oral)Sarcoidosis cutánea (oral)Granuloma anular generalizado (oral)Pioderma gangrenoso (oral) |
| RuxolitinibINCB-018424(Jakavi®, Incyte/Novartis) | JAK1JAK2 | C17H18N6 | Oral/tópica | Mielofibrosis (FDA 2011, EMA 2012): 15 o 20mg 2 veces al díaPolicitemia vera (FDA, 2014, EMA 2015): 10mg 2 veces al díaEnfermedad injerto contra huésped (FDA 2019): 5mg 2 veces al día | Psoriasis (tópico)Vitíligo (oral, tópico)Alopecia areata (oral, tópico)Dermatitis atópica (tópico)Dermatomiositis (oral)Lupus cutáneo (oral)Enfermedad injerto contra huésped (oral)Pioderma gangrenoso (oral) |
| BaricitinibINCB-28050(Olumiant®, Eli Lilly and Company/Incyte) | JAK1JAK2 | C16H17N7O2S | Oral | Artritis reumatoide (FDA 2018, EMA 2017): 4mg una vez al díaDermatitis atópica moderada-grave (EMA 2020): 4mg una vez al día | PsoriasisAlopecia areataDermatitis atópicaLupus eritematoso sistémico |
| PeficitinibASP-015K(Smyraf®, Astellas Pharma Inc.) | Pan-JAK (selectividad para JAK3) | C18H22N4O2 | Oral | Artritis reumatoide (Japón, 2019) | Psoriasis |
| AbrocitinibPF-04965842(Pfizer) | JAK1 | C14H21N5O2S | Oral | Ninguna | PsoriasisDermatitis atópica |
| UpadacitinibABT-494(Rinvoq®, AbbVie) | JAK1 | C17H19F3N6O | Oral | Artritis reumatoide (FDA y EMA 2019): 15mg una vez al día | Dermatitis atópicaPsoriasis |
| DelgocitinibJTE-052(Corectim®, Japan Tobacco/LEO Pharma) | JAK1JAK2JAK3TYK2 | C16H18N6O | Tópico | Ninguna | Dermatitis atópicaAlopecia areata |
| BrepocitinibPF-06700841(Pfizer) | TYK2JAK1 | C18H21F2N7O | Oral/tópico | Ninguna | Psoriasis (oral, tópico)Alopecia areata (oral)Dermatitis atópica (tópico)Vitíligo (oral) |
| ATI-50002(Aclaris Therapeutics) | JAK1JAK3 | - | Tópico | Ninguna | VitíligoAlopecia areataDermatitis atópica |
| RitlecitinibPF-06651600(Pfizer) | JAK3 | C15H19N5O | Oral | Ninguna | VitíligoAlopecia areata |
| GusacitinibASN002(Asana BioSciences) | JAK (JAK1, JAK2, JAK3, TYK2)/SYK | C24H28N802 | Oral | Ninguna | Dermatitis atópica |
| ItacitinibINCB-039110(Incyte Corporation) | JAK1 | C26H23F4N9O | Oral | Ninguna | PsoriasisEnfermedad injerto contra huésped |
| SolcitinibGSK-2586184(GlaxoSmithKline) | JAK1 | C22H23N5O2 | Oral | Ninguna | Psoriasis |
| FilgotinibG-146034(Galapagos/Gilead Sciences) | JAK1 | C21H23N5O3S | Oral | Ninguna | Psoriasis |
| SHR0302(Jiangsu Hengrui Medicine Co) | JAK1 | - | Oral | Ninguna | Dermatitis atópicaAlopecia areata |
| INCB054707(Incyte Corporation) | JAK1 | - | Oral | Ninguna | Hidradenitis supurativa |
| DeucravacitinibBMS-986165 (Bristol-Myers Squibb) | TYK2 | - | Oral | Ninguna | Psoriasis |
| PF-06826647 (Pfizer) | TYK2 | - | Oral | Ninguna | PsoriasisHidradenitis supurativa |
SYK: tirosin-cinasa esplénica.
Los JAKi tienen un perfil de riesgo-beneficio aceptable, aunque los resultados en su mayoría proceden de estudios realizados en enfermedades inflamatorias como la artritis reumatoide. La mayoría de los efectos adversos descritos son leves a moderados5–10; los más frecuentes son las infecciones de vías respiratorias altas, urinarias y gastrointestinales. En pacientes tratados con baricitinib se ha observado un aumento en el riesgo de reactivación del virus herpes zóster11, que duplica el riesgo de los biológicos inhibidores del factor de necrosis tumoral12,13. Tofacitinib se ha asociado con el desarrollo de herpes zóster en el 1-3% de los casos14–16. Además se han descrito casos de reactivación de tuberculosis con tofacitinib y baricitinib5,12,14–16.
Los resultados de un ensayo en artritis reumatoide comparando tofacitinib 5mg o 10mg 2 veces al día con etanercept –un inhibidor del factor de necrosis tumoral– identificaron un riesgo aumentado de trombosis en el grupo de 10mg 2 veces al día con respecto al grupo placebo, aunque se precisan estudios adicionales para confirmar este hallazgo17. Diversos metaanálisis y revisiones sistemáticas no han encontrado un incremento en la incidencia de neoplasias para tofacitinib18–20. Otros estudios describen una incidencia de neoplasias similar a la de los biológicos19,21. Sin embargo, se han observado linfomas B agresivos en pacientes con neoplasias mieloproliferativas tratados con ruxolitinib22.
La inhibición de JAK2 interfiere con la eritropoyesis, la mielopoyesis y la activación plaquetaria, por lo que confiere riesgo de anemia, neutropenia y trombocitopenia7,8,23–26. Ruxolitinib, debido a su elevada potencia como inhibidor de JAK2, produce más mielosupresión que otros inhibidores de JAK. La inhibición de JAK1 se ha asociado a un incremento en los niveles de colesterol total, LDL, HDL, y triglicéridos8,24,27–30, aunque se normalizan al cabo de 1-3 meses. También se puede observar incremento transitorio en los niveles de enzimas hepáticas, CPK y creatinina, reversibles tras la suspensión del fármaco24,27,28,31. La pérdida de actividad de TYK2 puede incrementar el riesgo de infecciones cutáneas severas por herpesvirus, estafilococo y micobacterias32.
El perfil de seguridad de los JAKi tópicos es mejor que el de los orales, como corresponde a su escasa absorción sistémica9,33–35. Se han empleado en crema, en pomada y en base liposomal, presentando irritación cutánea y foliculitis en función del vehículo utilizado. En un estudio con ruxolitinib en crema, se ha descrito la aparición de eritema (72%), hiperpigmentación y acné transitorio33.
Inhibidores de JAK en dermatologíaSe ha demostrado una disregulación de la vía de señalización JAK/STAT en distintas enfermedades inflamatorias dermatológicas, con diferencias de expresión de JAK en biopsias de piel sana y enferma36.
En psoriasis, lupus eritematoso cutáneo, pioderma gangrenoso, dermatitis atópica (DA) y alopecia areata (AA) se ha demostrado sobreexpresión de moléculas JAK en la epidermis y/o la dermis36. La expresión de JAK3 está muy aumentada en la epidermis de dichas enfermedades excepto en el lupus, con posibles implicaciones terapéuticas en cuanto al empleo de inhibidores tópicos de JAK3. Por ejemplo, se ha empleado tofacitinib tópico para el tratamiento de la psoriasis, la AA37–39 y la DA9, mientras que se ha ensayado delgocitinib tópico para el tratamiento de la DA40,41. En cambio, en el lupus eritematoso cutáneo se ha demostrado un aumento de actividad JAK1 en la dermis y los inhibidores selectivos de JAK1 podrían ser de utilidad para su tratamiento42. JAK1, JAK2, JAK3 se encuentran sobreexpresados en la dermis de pioderma gangrenoso y DA, lo que indica la posible utilidad terapéutica de los inhibidores pan-JAK, como por ejemplo tofacitinib.
A continuación, se describe de forma detallada el papel de la vía JAK-STAT en vitíligo y AA y los resultados obtenidos con los JAKi en diferentes estudios. Asimismo, en la parte 2 de esta revisión se profundizará en la patogénesis y el papel de los JAKi en psoriasis, DA y otras dermatosis.
VitíligoSe ha observado que en la piel humana con vitíligo hay niveles elevados de interferón gamma (IFN-γ) y sus citocinas asociadas, CXCL9 y CXCL10. El IFN-γ activa, a través de JAK1/243, la transcripción de CXCL9 y CXCL10, necesarios para el reclutamiento de los linfocitos T citotóxicos, que son los efectores finales de la destrucción melanocítica (fig. 2). Inhibir las JAK podría ser una estrategia terapéutica efectiva para el tratamiento del vitíligo, reduciendo así la producción de CXCL9 y CXCL1044,45.
En un reciente metaanálisis que incluyó a 45 pacientes con vitíligo tratados con JAKi, se observó repigmentación superior al 50% en el 57,8% de los pacientes, llegando al 70% en el caso del vitíligo facial y al 88,9% cuando se usaba fototerapia concomitante46.
Sin embargo, se ha observado que al interrumpir el tratamiento con JAKi se producen recaídas, que podrían ser determinadas por la presencia de células autorreactivas de memoria residentes en la piel (Trm). Se cree que la IL-15 –cuya expresión se encuentra incrementada en la epidermis de vitíligo47– desempeña un papel fundamental en el mantenimiento de los Trm CD8+, lo que sugiere que podría ser un tratamiento dirigido efectivo en los pacientes con vitíligo48.
Tofacitinib oralTofacitinib (Xeljanz®, Pfizer) es un inhibidor JAK1/3 cuya eficacia se ha observado en casos clínicos o series de casos con vitíligo. Con la dosis de 5mg al día se obtuvo repigmentación casi completa de cara y manos en una paciente con vitíligo progresivo a los 5 meses, sin efectos adversos, pero la mejoría no se mantuvo al suspender el tratamiento49. En otra paciente con vitíligo no segmentario multifocal en la que se inició tofacitinib 5mg 2 veces al día durante 6 meses para el tratamiento de una DA concomitante, se consiguió una mejoría discreta del vitíligo (reducción del Vitiligo Area Scoring Index –VASI score– de 4,68 basal a 3,95 a los 5 meses). Presentó 2 episodios de infección de vías respiratorias altas y uno de diarrea que no requirieron la interrupción del tratamiento50.
La repigmentación de pacientes con vitíligo en tratamiento con JAKi podría requerir fotoestimulación para inducir la migración de melanocitos a la epidermis. En una serie retrospectiva de 10 pacientes, el tratamiento con tofacitinib 5-10mg una o 2 veces al día, únicamente llevó a la repigmentación cuando se daba concomitantemente con la exposición a luz solar o UVB banda estrecha (nb-UVB)51. Otro estudio multicéntrico retrospectivo determinó que los pacientes tratados con nb-UVB junto con tofacitinib 10mg al día presentaron mejores tasas de repigmentación en comparación con la fototerapia sola (92 vs. 77%)52.
Se ha demostrado la supresión de la respuesta autoinmune tanto en las áreas expuestas a la luz (respondedoras) como en las no expuestas (no respondedoras). Esto sugiere un modelo en el que los JAKi suprimen la respuesta inflamatoria Th1 y la fototerapia activa la regeneración melanocitica51. Esta combinación requeriría de una menor dosis de exposición lumínica.
Tofacitinib tópicoEn un estudio piloto, presentan 16 pacientes con vitíligo no segmentario tratados con tofacitinib 2% en crema con un tiempo medio de seguimiento de 153 días (rango 63-367), de los cuales 13 experimentaron repigmentación. Las respuestas fueron más marcadas en lesiones faciales y en fototipos Fitzpatrick IV-VI, mientras que el promedio de repigmentación en lesiones no faciales fue del 16%53. Uno de los pacientes presentó acné como efecto adverso.
Parece que tofacitinib tópico también resultaría en mayor repigmentación con la exposición a la luz. En una serie de 11 pacientes con vitíligo facial tratados con tofacitinib 2% tópico en crema 2 veces al día junto con nb-UVB 3 veces a la semana entre 2 y 4 meses se observó una mejoría del 70% en el VASI facial. Los resultados indican una relación sinérgica aunque se necesitan estudios en vitíligo extrafacial54.
Ruxolitinib oralRuxolitinib (Jakavi®, Incyte/Novartis), un inhibidor JAK1/2, se utilizó para tratar a un varón con AA y vitíligo a dosis de 20mg 2 veces al día durante 20 semanas. Inició repigmentación facial a las 12 semanas, alcanzando un 51% de pigmentación facial a las 20 semanas (respecto al 0,8% basal)55.
Ruxolitinib tópicoJoshipura et al.56 describieron tasas de repigmentación superiores en los pacientes tratados con ruxolitinib 1,5% en crema 2 veces al día en áreas fotoexpuestas en comparación con las áreas no fotoexpuestas. Los pacientes con vitíligo que usaron ruxolitinib 1,5% en crema 2 veces al día con nb-UVB opcional mostraron una mejoría estadísticamente significativa en el VASI score global a las 52 semanas, con una respuesta especialmente pronunciada en el vitíligo facial. La respuesta se mantuvo a los 6 meses de interrumpir el tratamiento57.
Actualmente, existen ensayos clínicos en curso que evalúan la eficacia y seguridad de ruxolitinib tópico 1,5% en crema 2 veces al día para tratamiento del vitíligo (NCT0405242558 y NCT0405757359), y también se está evaluando la respuesta con diferentes dosis (NCT0309930460).
Otros inhibidores de JAKHay un ensayo en curso con un inhibidor JAK1/3 tópico (ATI-50002) en pacientes con vitíligo facial no segmentario (NCT0346885561). También se están estudiando ritlecitinib (inhibidor JAK3) y brepocitinib (inhibidor JAK1 y TYK2) en pacientes con vitíligo no segmentario activo en combinación con fototerapia (NCT0371582962).
Alopecia areataLa patogénesis de la AA es compleja. Las células T Vδ1+ podrían estar involucradas en los estadios precoces de la AA, ya que se ha observado que tanto en los folículos pilosos afectos como en los que aún no están dañados el número de células T Vδ1+ es muy superior63. Además existe evidencia de que las células T citotóxicas CD8+NKG2D+ podrían ser clave en la patogénesis de la AA en modelos animales; su objetivo serían los folículos que pierden el privilegio inmune durante la fase anágena64. Las células T CD8+NKG2D+ producen IFN-γ que se une a su receptor en la superficie de los folículos pilosos y activa la vía JAK1/2-STAT1. Esto promueve la producción de IL-15, que al unirse a su receptor en la superficie de las células T activa JAK1/3-STAT5, generando la producción de IFN-γ y perpetuando así la respuesta inflamatoria (fig. 2)65. Se ha visto sobreexpresión de JAK3 y en menor medida de JAK1 y JAK2 en biopsias cutáneas de pacientes con AA36. De forma concomitante hay una sobrerregulación de diferentes citocinas –incluyendo IL-2, IL-7 e IL-21– que señalizan a través de JAK1/JAK3 y promueven la activación y la supervivencia de las células T CD8+NKG2D+64.
Dado el papel de los JAK en la patogénesis de la AA, los JAKi podrían ser efectivos para su tratamiento. Además, los JAKi podrían tener un efecto directo en los folículos en fase telógena, promoviendo la reentrada en fase anágena64.
En un metaanálisis reciente66 que incluye a 289 pacientes con AA se describe una tasa de respondedores del 72,4% con JAKi, con un tiempo medio hasta el crecimiento completo de 6,7 ± 2,2 meses. La vía oral fue más efectiva que la tópica, con una probabilidad de respuesta 4 veces superior. Los pacientes con enfermedad de más larga evolución presentarían menor respuesta a los JAKi67, y la AA recidiva a los 3 meses de abandonar el tratamiento. Se ha observado que algunas áreas, como las pestañas, cejas, barba y vello corporal, presentan un recrecimiento más rápido68–70.
Tofacitinib oralLa eficacia de tofacitinib oral en AA se describió por primera vez en un paciente con alopecia universal (AU) que inició tratamiento con tofacitinib 15mg al día para una psoriasis concomitante y experimentó recrecimiento completo del pelo a los 8 meses de tratamiento71. Desde entonces, se han publicado respuestas en otros pacientes con AA72, algunos de ellos con psoriasis73, DA o vitíligo concomitantes50,74, con mejoría simultánea de ambas enfermedades.
Posteriormente en un estudio abierto de 66 pacientes con AA y pérdida superior al 50%, alopecia total (AT) o AU, tofacitinib 5mg 2 veces al día durante 3 meses consiguió cambios en la puntuación Severity of Alopecia Tool (SALT) comprendidos entre el 5% y el 50% en el 32% de los pacientes y de>50% de puntuación SALT en un 32%. Sin embargo, la duración promedio de la respuesta hasta la recaída tras suspender el tratamiento era de 8,5 semanas. El 25,8% de los pacientes desarrollaron infecciones, la mayoría del tracto respiratorio superior aunque describen 2 pacientes con infecciones del tracto urinario, un paciente desarrolló una bronquitis y otro un herpes zóster. Ninguno de ellos requirió hospitalización75.
Cheng et al.76 publicaron los casos de 11 pacientes con AT/AU tratados con tofacitinib a dosis de entre 5mg al día a 11mg –con un preparado de liberación prolongada– 2 veces al día durante una media de 14,4 meses (rango 4,5-27 meses), consiguiendo una mejoría promedio del SALT del 61,2% con respecto al valor basal. La mitad de los pacientes consiguieron una resolución completa de la enfermedad y algunos se beneficiaron de la combinación con triamcinolona intralesional en áreas refractarias. Como efectos adversos observaron dislipidemia, síntomas gastrointestinales y acné leve.
Liu et al.67 incluyeron en un estudio retrospectivo a 90 pacientes con AA afectando un 40% o más del cuero cabelludo, AT o AU, a los que trataron con tofacitinib por lo menos 5mg 2 veces al día en monoterapia o combinado con prednisona durante un mínimo de 4 meses. De los 65 de estos pacientes que se consideraron respondedores potenciales por padecer AT/AU menos de 10 años o AA, el 20% mostraron una reducción superior al 90% en la puntuación SALT, un 38,4% presentaron una reducción del 51-90% en el SALT y el 18,5% presentaron una reducción en SALT de 6-50%. El efecto adverso más frecuente fueron las infecciones del tracto respiratorio superior que se dieron en el 28,9% de los pacientes, aunque también describen a un paciente con bronquitis y 3 con infecciones del tracto urinario.
Recientemente, en otro estudio en 12 pacientes con AA moderada-severa, AT o AU, en la mayoría de los casos fue preciso aumentar la dosis de tofacitinib de 5mg/12h a 10mg/12h para conseguir respuesta, sin que se observara un aumento de los efectos adversos. El 91,7% de los pacientes tuvieron respuesta, con un promedio de reducción del SALT del 56,8% a las 32 semanas. Sin embargo, al retirar el tratamiento en los pacientes respondedores, el 50% empeoraron con respecto a los valores basales tras 6 meses de observación77. Se han publicado múltiples ejemplos de pacientes con respuesta inicial pero sin mantenimiento de la respuesta al interrumpir el tratamiento68,78,79, volviendo a niveles de alopecia similares o incluso peores al basal80. No queda claro si se trata de un aumento de actividad de la enfermedad o si la retirada del tratamiento desencadena un efluvio telógeno, ya que los JAKi promueven el pase de los folículos a la fase anágena81.
Por lo que respecta a la población pediátrica y adolescentes, se han publicado casos de AT y AU tratados satisfactoriamente con tofacitinib 5mg/12h, sin efectos adversos destacables82,83.
Actualmente se está llevando a cabo un estudio de cohorte para evaluar la eficacia y seguridad de tofacitinib 5mg 2 veces al día junto con el impacto económico que supondría el cambio en la calidad de vida del paciente con AA extensa (NCT0380097984).
Tofacitinib tópicoLos inhibidores de JAK tópicos podrían ser útiles especialmente para el tratamiento de la AA localizada. Se ha observado crecimiento casi completo del pelo después de usar tofacitinib 2% tópico cada 12h durante 7 meses76, y de las pestañas tras una media de 7 meses de tratamiento (rango 3-11 meses)39, sin efectos adversos. Sin embargo, en un estudio piloto con 10 pacientes tratados con tofacitinib pomada 2% 2 veces al día la respuesta fue pobre, con únicamente 3 respondedores con una disminución media del SALT del 34,6% a las 24 semanas37. Los efectos adversos observados fueron irritación local (40%), foliculitis (10%) y elevación del colesterol (40%).
También se ha descrito la eficacia de tofacitinib en pomada al 1-2% en un grupo de niños y adolescentes usado durante 3-9 meses, sin efectos adversos destacables34. Además, con tofacitinib al 2% en base liposomal se obtuvo una respuesta variable en 11 pacientes pediátricos, aunque la mayoría consiguió una respuesta cosméticamente aceptable, por lo que se podría usar como tratamiento adyuvante o como tratamiento de segunda línea en estos pacientes38.
Ruxolitinib oralUna mujer tratada con ruxolitinib oral 15mg 2 veces al día por trombocitopenia experimentó repoblamiento casi completo de su AU a los 10 meses, manteniendo la respuesta con el tratamiento a los 50 meses85. Otro paciente con AA y vitíligo mostró mejoría de las 2 condiciones con ruxolitinib 20mg 2 veces al día, con inicio del crecimiento del pelo a las 4 semanas y mejoría significativa a las 12 semanas55.
En un estudio realizado con 12 pacientes tratados con ruxolitinib 20mg/12h durante 3-6 meses, el 75% consiguieron respuesta, pasando de un SALT inicial promedio del 65,8% a un SALT del 7,3% a los 6 meses de tratamiento. La mayoría de los respondedores tuvieron un recrecimiento del 95%, que fue notorio a las 4 semanas del tratamiento86. Sin embargo, a las 3 semanas de suspender el tratamiento se perdió la respuesta. Los efectos adversos más frecuentes fueron las infecciones de vías respiratorias altas, aunque describen un caso de neumonía leve. Se ha empleado la misma dosis para el tratamiento de un varón preadolescente con AT87. A los 4 meses, presentó prácticamente recrecimiento completo de cejas y cuero cabelludo por lo que se pudo disminuir la dosis hasta alcanzar 10mg a días alternos sin pérdida de eficacia. Ruxolitinib 30mg diarios también se ha asociado a recrecimiento completo del pelo a los 8 meses en una paciente con AT, con disminución progresiva de la dosis sin pérdida de respuesta y con desarrollo de anemia transitoria al inicio del tratamiento88.
A pesar de que ruxolitinib 20mg 2 veces al día y tofacitinib 5mg 2 veces al día no muestran diferencias significativas por lo que respecta al recrecimiento a los 6 meses del tratamiento o la tasa de recaída, el recrecimiento inicial con ruxolitinib parece ser más precoz89.
Ruxolitinib tópicoSe han observado respuestas variables con ruxolitinib 0,6-2% tópico35,90. En un ensayo prospectivo en fase i a las 28 semanas se observó recrecimiento parcial en 5 pacientes con AU en las áreas tratadas con ruxolitinib 1% tópico91.
Una adolescente con AA universal aplicó crema 0,6% 2 veces al día, consiguiendo crecimiento completo de las cejas a los 3 meses pero con únicamente 10% de recrecimiento en cuero cabelludo, sin presentar efectos adversos. En pacientes pediátricos, se ha visto que la formulación liposomal es más efectiva, pero la no liposomal es cosméticamente más aceptable34.
Baricitinib oralBaricitinib (Olumiant®, Eli Lilly and Company) es un inhibidor JAK1/2. Se ha observado crecimiento completo del pelo en un paciente con AA ofiásica a los 9 meses del inicio de baricitinib oral 7mg por la mañana y 4mg por la noche para el tratamiento de un síndrome de CANDLE concomitante92.
Otros inhibidores de JAKUn estudio que comparaba el uso de pomada de delgocitinib (inhibidor pan-JAK) 30mg/g 2 veces al día con vehículo para el tratamiento de AA no encontró diferencias estadísticamente significativas en la reducción del SALT a las 12 semanas (NCT02561585)93.
Un ensayo fase IIA evaluó la eficacia de ritlecitinib y de brepocitinib en 142 pacientes con AA moderada a severa (NCT0297486894). A las 6 semanas de tratamiento con brepocitinib y ritlecitinib la diferencia media en el SALT score respecto al basal era de 12,44% y 19,36%, respectivamente, comparado con 1,32% del grupo placebo. A las 24 semanas de tratamiento, los respondedores presentaron un recrecimiento completo.
Se está ensayando otro inhibidor JAK1 (SHR0302) en adultos con AA moderada a severa (NCT04346316)95.
ConclusionesExiste evidencia de que la disregulación de la vía JAK-STAT podría desempeñar un papel en muchas enfermedades dermatológicas, incluyendo el vitíligo y la AA.
Los inhibidores de JAK orales y tópicos podrían ser una opción prometedora para el tratamiento del vitíligo, aunque los resultados apuntan a que es preciso el tratamiento adyuvante con nb-UVB o la luz solar para obtener resultados satisfactorios.
Existe evidencia creciente de que los JAKi podrían ser eficaces para el tratamiento de la AA, con un perfil riesgo-beneficio aceptable. Se han estudiado tofacitinib, ruxolitinib y baricitinib, con resultados variables. Sin embargo, los JAKi serían un tratamiento sintomático en AA ya que las recaídas al interrumpir el tratamiento son habituales. El tratamiento tópico con JAKi podría ser una alternativa en caso de enfermedad localizada, de aparición de efectos adversos con el tratamiento oral o en pacientes pediátricos.
Los JAKi se han empleado también para el tratamiento de otras patologías dermatológicas como la psoriasis o la DA, que se desarrollarán en detalle en la parte 2 de esta revisión.
Conflicto de interesesC. Garcia-Melendo y X. Cubiró declaran no tener conflicto de intereses. L. Puig ha recibido honorarios de/ha participado en ensayos clínicos patrocinados por Abbvie, Almirall, Amgen, Baxalta, Biogen, Boehringer Ingelheim, Celgene, Gebro, Janssen, JS BIOCAD, Leo-Pharma, Lilly, Merck-Serono, MSD, Mylan, Novartis, Pfizer, Regeneron, Roche, Sandoz, Samsung-Bioepis, Sanofi y UCB.