Existe una ausencia de estudios centrados en el recuento de nevus melanocíticos adquiridos (NMA) interdigitales de los pies (NIDp). Nuestro objetivo fue estudiar la relación de la presencia de NIDp con el número total de NMA de los pies y del resto del cuerpo, las características fenotípicas raciales y otros factores de riesgo de melanoma.
Material y métodosSe realizó un estudio observacional transversal que incluyó a 255 pacientes, ≥18 años, que acudieron a nuestro servicio de Dermatología desde septiembre de 2020 a febrero de 2021. Se registraron todos los NMA ≥1mm de los pies y ≥2mm del resto del cuerpo. Se estudió la asociación entre las variables mediante un modelo de regresión logística uni- y multivariante.
ResultadosLa presencia de NIDp se asoció de manera estadísticamente significativa e independiente con la presencia de NMA plantares y con recuentos de ≥50 NMA en el cuerpo. Sin embargo, no se observaron diferencias significativas respecto al sexo, la edad, los antecedentes personales de melanoma, la presencia de nevus en el dorso de los pies, antecedentes de quemaduras solares o rayos UVA, ni con características fenotípicas raciales.
ConclusionesLa presencia de NIDp se relaciona con un mayor recuento de nevus plantares y NMA totales del cuerpo, lo que puede significar que los espacios interdigitales son una expansión anatómica de la planta del pie y que otras causas, posiblemente genéticas, serían responsables del número de NMA en esta localización, al ser zonas nada fotoexpuestas.
No studies focused on counting the interdigital acquired melanocytic nevi (AMN) of the foot (IDNf) have ever been conducted. Therefore, our objective was to study the relationship between the presence of IDNf and the total number of AMN in the feet and the rest of the body, the racial phenotypic characteristics, and other risk factors for melanoma.
Material and methodsWe conducted a cross-sectional observational study with 255 patients ≥18 years old who attended our Dermatology Unit from September 2020 through February 2021, and included all AMN ≥1mm from the feet and ≥2mm from the rest of the bod. The association between the variables was studied using univariate and multivariate logistic regression models.
ResultsThe presence of IDNf was significantly and independently associated with the presence of plantar AMN and body counts ≥50 AMN. However, no significant differences were observed regarding sex, age, personal history of melanoma, presence of nevi on the dorsum of the foot, history of sunburn or UV rays, or racial phenotypic characteristics.
ConclusionsThe presence of IDNf is associated with a higher count of plantar nevi and total AMN in the body, meaning that interdigital spaces of the foot—anatomical expansions of the sole and other possibly genetic causes—could be responsible for the number of AMN found in this location, as these regions are not photoexposed.
Los nevus melanocíticos adquiridos (NMA) son unas tumoraciones benignas de los melanocitos, consideradas como las neoplasias benignas más frecuentes de la población blanca1. Es bien conocido que el número de NMA es uno de los factores de riesgo más importantes para desarrollar un melanoma2.
Aunque la mayoría de NMA suelen localizarse en las zonas expuestas a la radiación solar (RS), también aparecen en otras zonas que lo son menos, como las palmas o las plantas, y se conocen como NMA acrales3. Las publicaciones de recuentos de estos NMA son más bien escasas3–13. Su patogenia es desconocida y presentan un perfil mutacional diferente respecto a los nevus no acrales y al melanoma lentiginoso acral (ALM)14. Por otra parte, la posible asociación entre el ALM y los NMA acrales es controvertida13,15,16.
No existen, sin embargo, estudios que caractericen los NMA en los espacios interdigitales, una zona especialmente oculta a la RS. Esta localización es una zona de transición entre el dorso y la planta de los pies, por lo que se desconoce si la presencia de NMA en las zonas interdigitales se puede equiparar con los localizados en alguna de estas dos áreas, o si existe relación con el número de nevus del resto del cuerpo.
El objetivo del presente estudio fue observar si el recuento de los nevus interdigitales de los pies (NIDp) se asociaba con el número total de NMA del pie, y con otros factores de riesgo de desarrollar melanoma, como el número de NMA totales del cuerpo (NMA-C), las características fenotípicas raciales y los antecedentes de exposición a la radiación ultravioleta (RUV)15.
Material y métodoSe diseñó un estudio observacional transversal de todos los pacientes adultos (≥18 años) que acudieron a la consulta de lesiones pigmentadas de Dermatología del Hospital General Universitario de Alicante (HGUA) durante el periodo comprendido entre septiembre de 2020 y febrero de 2021. Se seleccionaron los pacientes que tuvieran un fototipo según la escala de Fitzpatrick de I al IV5, y que no presentaran alguno de los siguientes criterios de exclusión: presencia de nevus congénitos gigantes, enfermedades mentales graves y/o malas condiciones higiénicas que impidieran la exploración de los pies.
El protocolo del estudio fue realizado de acuerdo con los principios de la Declaración de Helsinki y fue aprobado por el CEIm del HGUA (Acta 2021-03).
Variables del estudioLa variable de resultado fue el número de NMA ≥1mm interdigitales en los pies.
Se consideraron las siguientes variables explicativas: sexo, edad, color de ojos (claros [azules o verdes] y oscuros [marrones o negros]); color de pelo a los 20 años de edad (claro [pelirrojo, rubio o castaño claro], oscuro [castaño oscuro o negro]); fototipo (claro [I y II] u oscuro [III y IV]), presencia de efélides, antecedentes personales de quemaduras solares graves (definidas como presencia de ampollas tras exposición solar), antecedentes personales de melanoma, de cáncer cutáneo no melanoma (CCNM) y de cáncer no cutáneo, uso de lámpara UVA, número de NMA-C ≥2mm (≤50 y >50), número de NMA ≥1mm en la planta (NMA-P) y en el dorso de los pies (NMA-D), tomando como punto de referencia aquellos que se encontraran por debajo de los maléolos.
Respecto al punto de corte para considerar NMA acrales, incluidos los NIDp, elegimos los ≥1mm por ser el tamaño mínimo para no confundirlas con otras lesiones, especialmente lentigos solares en el dorso. Respecto al punto de corte en los NMA-C, escogimos los ≥2mm, ya que está ampliamente establecido16,17 y nuestro grupo tenía experiencia de un estudio anterior18.
Método de recogida de datos y variables de estudioLa recogida de datos se realizó en dos fases. La primera fue de entrevista, donde se revisaron los criterios de inclusión y de exclusión. En la segunda se les examinó en ropa interior para contabilizar los NMA-C y de los pies, incluyendo los espacios interdigitales y excluyendo las áreas cubiertas por la ropa interior y el cuero cabelludo. A todos los pacientes se les asignó un número de identificación para asegurar la anonimización. Se realizó un examen dermatoscópico de todas las lesiones dudosas.
Todos los datos fueron recogidos por una residente de dermatología entrenada previamente (V.S.G.), supervisada por un dermatólogo experto en lesiones pigmentadas (J.B.).
Análisis estadísticoSe estudió la normalidad de las variables cuantitativas (edad y número de NMA) mediante la prueba de Kolmogorov-Smirnov. Dado que el número de NMA-D y NMA-P no seguían una distribución normal, se utilizaron la mediana y el rango intercuartílico [RI]. Para estudiar la relación entre variables cualitativas y cuantitativas se utilizó la prueba U de Mann-Whitney. Por último, para estudiar la relación entre las variables cuantitativas se realizó la prueba de correlación de Spearman.
Las variables categóricas se expresaron como frecuencias absolutas y relativas. Las variables continuas se categorizaron para el posterior análisis estadístico: la edad se categorizó en terciles y los NMA de los pies (dorso, planta e interdigitales) en presencia y ausencia de los mismos. En el estudio bivariante se utilizó la regresión logística binaria. Para cuantificar la magnitud de asociación, se utilizó la odds ratio (OR) con un intervalo de confianza al 95% (IC 95%). Las asociaciones estadísticamente significativas se analizaron posteriormente en un análisis multivariante, calculando la OR ajustada (aOR), con un IC 95%. Adicionalmente se realizó un análisis del número crudo de los NIDp y el número de NMA-D y NMA-P.
El nivel de significación utilizado para el contraste de hipótesis fue de p<0,05. Para analizar los datos del estudio se utilizó el programa estadístico SPSS (versión 25.0, IBM Corp, Armonk, NY, EE.UU.).
ResultadosDe los 257 sujetos a los que se propuso el estudio, 2 de ellos (0,8%) fueron excluidos por una higiene deficiente de los pies. Finalmente, se incluyeron 255 pacientes que cumplían los criterios de selección, siendo el 51,4% mujeres, con una mediana de 53 años (tabla 1).
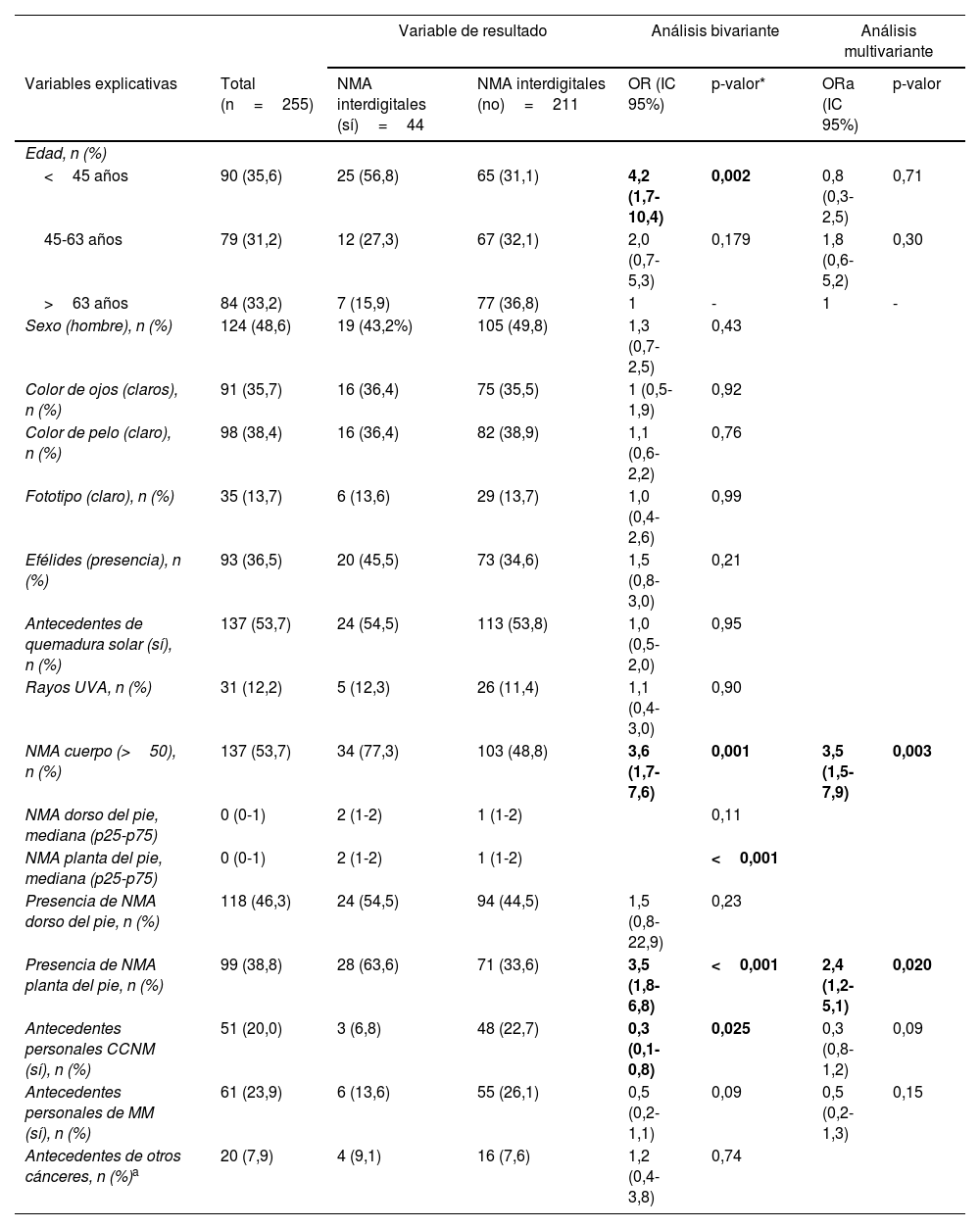
Análisis descriptivo, bivariante y multivariante de la muestra de pacientes (n=255)
| Variable de resultado | Análisis bivariante | Análisis multivariante | |||||
|---|---|---|---|---|---|---|---|
| Variables explicativas | Total (n=255) | NMA interdigitales (sí)=44 | NMA interdigitales (no)=211 | OR (IC 95%) | p-valor* | ORa (IC 95%) | p-valor |
| Edad, n (%) | |||||||
| <45 años | 90 (35,6) | 25 (56,8) | 65 (31,1) | 4,2 (1,7-10,4) | 0,002 | 0,8 (0,3-2,5) | 0,71 |
| 45-63 años | 79 (31,2) | 12 (27,3) | 67 (32,1) | 2,0 (0,7-5,3) | 0,179 | 1,8 (0,6-5,2) | 0,30 |
| >63 años | 84 (33,2) | 7 (15,9) | 77 (36,8) | 1 | - | 1 | - |
| Sexo (hombre), n (%) | 124 (48,6) | 19 (43,2%) | 105 (49,8) | 1,3 (0,7-2,5) | 0,43 | ||
| Color de ojos (claros), n (%) | 91 (35,7) | 16 (36,4) | 75 (35,5) | 1 (0,5-1,9) | 0,92 | ||
| Color de pelo (claro), n (%) | 98 (38,4) | 16 (36,4) | 82 (38,9) | 1,1 (0,6-2,2) | 0,76 | ||
| Fototipo (claro), n (%) | 35 (13,7) | 6 (13,6) | 29 (13,7) | 1,0 (0,4-2,6) | 0,99 | ||
| Efélides (presencia), n (%) | 93 (36,5) | 20 (45,5) | 73 (34,6) | 1,5 (0,8-3,0) | 0,21 | ||
| Antecedentes de quemadura solar (sí), n (%) | 137 (53,7) | 24 (54,5) | 113 (53,8) | 1,0 (0,5-2,0) | 0,95 | ||
| Rayos UVA, n (%) | 31 (12,2) | 5 (12,3) | 26 (11,4) | 1,1 (0,4-3,0) | 0,90 | ||
| NMA cuerpo (>50), n (%) | 137 (53,7) | 34 (77,3) | 103 (48,8) | 3,6 (1,7-7,6) | 0,001 | 3,5 (1,5-7,9) | 0,003 |
| NMA dorso del pie, mediana (p25-p75) | 0 (0-1) | 2 (1-2) | 1 (1-2) | 0,11 | |||
| NMA planta del pie, mediana (p25-p75) | 0 (0-1) | 2 (1-2) | 1 (1-2) | <0,001 | |||
| Presencia de NMA dorso del pie, n (%) | 118 (46,3) | 24 (54,5) | 94 (44,5) | 1,5 (0,8-22,9) | 0,23 | ||
| Presencia de NMA planta del pie, n (%) | 99 (38,8) | 28 (63,6) | 71 (33,6) | 3,5 (1,8-6,8) | <0,001 | 2,4 (1,2-5,1) | 0,020 |
| Antecedentes personales CCNM (sí), n (%) | 51 (20,0) | 3 (6,8) | 48 (22,7) | 0,3 (0,1-0,8) | 0,025 | 0,3 (0,8-1,2) | 0,09 |
| Antecedentes personales de MM (sí), n (%) | 61 (23,9) | 6 (13,6) | 55 (26,1) | 0,5 (0,2-1,1) | 0,09 | 0,5 (0,2-1,3) | 0,15 |
| Antecedentes de otros cánceres, n (%)a | 20 (7,9) | 4 (9,1) | 16 (7,6) | 1,2 (0,4-3,8) | 0,74 | ||
Resaltados en negrita los resultados estadísticamente significativos.
CCNM: cáncer cutáneo no melanoma; IC: intervalo de confianza; NMA: nevus melanocíticos adquiridos; MM: melanoma; OR: odds ratio cruda; ORa: odds ratio ajustada; UVA: ultravioleta A.
Tipos de cánceres: carcinoma de mama (n=7), carcinoma de próstata (n=2), linfoma de Hodgkin (n=2), carcinoma de vulva (n=1), carcinoma de colon (n=1), leucemia aguda (n=1), liposarcoma (n=1), carcinoma de pulmón (n=1), carcinoma de recto (n=1), carcinoma renal (n=1), carcinoma de vías urinarias (n=1), carcinoma vesical (n=1).
En la tabla 1 se presentan las diferencias de las variables explicativas según la presencia o ausencia de NIDp y los resultados del análisis bivariante. El análisis crudo mostró que solo los pacientes <45 años se asociaban significativamente con la presencia de NIDp. Por otra parte, no se observaron diferencias significativas respecto al sexo, el color de los ojos, de pelo, fototipo, presencia de efélides, antecedentes de quemaduras solares, exposición a RUV, antecedentes personales de melanoma, ni con los de cáncer no cutáneo. Sin embargo, los antecedentes personales de CCNM presentaron una asociación negativa o «protectora» respecto a la presencia de NIDp.
La relación de presencia de NIDp respecto a las variables que se referían al número de nevus fue la siguiente: se observó una asociación con la presencia y número de NMA-P. Por el contrario, no se observó una asociación con la presencia ni el número de NMA-D. Asimismo, el número elevado de NMA-C (≥50 NMA) se asoció con la presencia de NIDp.
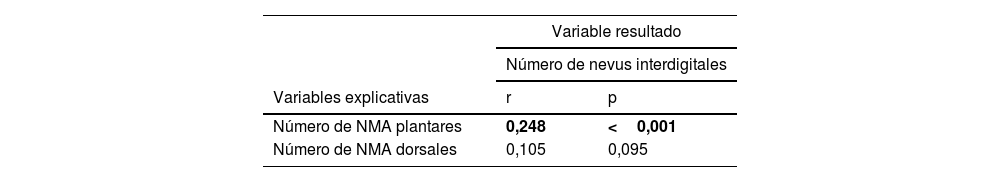
Por otra parte, observamos que el recuento de NMA-P aumentaba de manera significativa con el recuento de NIDp, con un coeficiente de correlación de 0,248 (p<0,001) (véase tabla 2). Por el contrario, no existía una correlación significativa entre los recuentos de NMA-D y NIDp.
Estudio de correlación entre el número de nevus interdigitales (variable de resultado) y el número de nevus de la planta y del dorso de los pies (variables explicativas)
| Variable resultado | ||
|---|---|---|
| Número de nevus interdigitales | ||
| Variables explicativas | r | p |
| Número de NMA plantares | 0,248 | <0,001 |
| Número de NMA dorsales | 0,105 | 0,095 |
Resaltados en negrita los resultados estadísticamente significativos.
NMA: nevus melanocíticos adquiridos; p: p-valor; r: coeficiente de correlación.
Tras el análisis multivariante, las variables que se asociaron de forma independiente con NIDp fueron las siguientes: la presencia de NMA-P (ORa=2,4; IC 95% 1,2-5,1; p=0,020) y la presencia de >50 NMA-C (ORa=3,5; IC 95% 1,5-7,9; p=0,003) (tabla 1).
DiscusiónEste estudio ha demostrado que la presencia de NIDp se relaciona con el número de NMA-P, y también con los NMA-C.
El número de NMA de la piel es un factor de riesgo conocido de melanoma cutáneo2 y se ha asociado con rasgos fenotípicos raciales y con la RS19–21. Los recuentos de NMA acrales, zonas mínimamente expuestas a la RUV, han sido poco referidos en la literatura y, en esos casos, casi exclusivamente a las plantas y palmas, no estudiándose el dorso3–13. Por otra parte, los espacios interdigitales son todavía más ocultos.
Finalmente se incluyeron 255 pacientes, de los cuales el 17,3% presentaron NIDp. Respecto a la edad, observamos que los pacientes con <45 años presentaban un mayor riesgo de tener NIDp. No existen estudios respecto a recuentos de NIDp, por lo que la información que tenemos es indirecta de los NMA-C. Se ha observado que los NMA acrales aumentan con la adolescencia hasta la edad media y disminuyen en la edad avanzada5,22. Palicka y Rhodes9 y Kogushi-Nishi et al.13 encuentran prevalencias superiores de NMA acrales en menores de 50 años (tabla 3). En el mismo sentido, el número de NMA-C sigue una evolución parecida1. Si bien no hay estudios específicos en relación con recuentos de NIDp, en nuestro estudio el mayor riesgo de tener NIDp se observaba en pacientes con menos de 45 años.
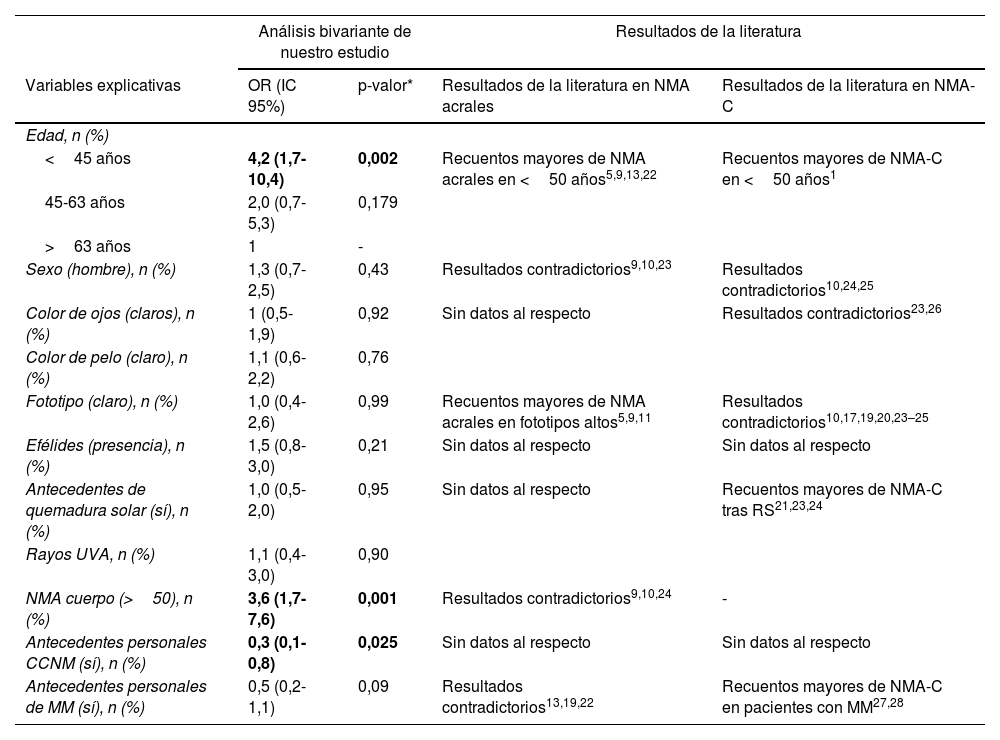
Comparación de los resultados del análisis bivariante de nuestro estudio con los hallazgos de la literatura
| Análisis bivariante de nuestro estudio | Resultados de la literatura | |||
|---|---|---|---|---|
| Variables explicativas | OR (IC 95%) | p-valor* | Resultados de la literatura en NMA acrales | Resultados de la literatura en NMA-C |
| Edad, n (%) | ||||
| <45 años | 4,2 (1,7-10,4) | 0,002 | Recuentos mayores de NMA acrales en <50 años5,9,13,22 | Recuentos mayores de NMA-C en <50 años1 |
| 45-63 años | 2,0 (0,7-5,3) | 0,179 | ||
| >63 años | 1 | - | ||
| Sexo (hombre), n (%) | 1,3 (0,7-2,5) | 0,43 | Resultados contradictorios9,10,23 | Resultados contradictorios10,24,25 |
| Color de ojos (claros), n (%) | 1 (0,5-1,9) | 0,92 | Sin datos al respecto | Resultados contradictorios23,26 |
| Color de pelo (claro), n (%) | 1,1 (0,6-2,2) | 0,76 | ||
| Fototipo (claro), n (%) | 1,0 (0,4-2,6) | 0,99 | Recuentos mayores de NMA acrales en fototipos altos5,9,11 | Resultados contradictorios10,17,19,20,23–25 |
| Efélides (presencia), n (%) | 1,5 (0,8-3,0) | 0,21 | Sin datos al respecto | Sin datos al respecto |
| Antecedentes de quemadura solar (sí), n (%) | 1,0 (0,5-2,0) | 0,95 | Sin datos al respecto | Recuentos mayores de NMA-C tras RS21,23,24 |
| Rayos UVA, n (%) | 1,1 (0,4-3,0) | 0,90 | ||
| NMA cuerpo (>50), n (%) | 3,6 (1,7-7,6) | 0,001 | Resultados contradictorios9,10,24 | - |
| Antecedentes personales CCNM (sí), n (%) | 0,3 (0,1-0,8) | 0,025 | Sin datos al respecto | Sin datos al respecto |
| Antecedentes personales de MM (sí), n (%) | 0,5 (0,2-1,1) | 0,09 | Resultados contradictorios13,19,22 | Recuentos mayores de NMA-C en pacientes con MM27,28 |
Resaltados en negrita los resultados estadísticamente significativos.
CCNM: cáncer cutáneo no melanoma; IC: intervalo de confianza; NMA: nevus melanocíticos adquiridos; NMA-C: nevus melanocíticos adquiridos del cuerpo; MM: melanoma; RS: radiación solar; OR: odds ratio cruda; ORa: odds ratio ajustada; UVA: ultravioleta A.
No hemos encontrado diferencias significativas entre en la presencia de NIDp y el sexo. En relación con los nevus acrales, Palicka y Rhodes9 encuentran que las prevalencias de NMA acrales en sujetos de raza blanca es mayor en mujeres que en hombres, mientras que otros autores no encuentran diferencias10,23. Respecto al número de NMA-C, los resultados son dispares, observándose recuentos mayores en hombres24, en mujeres25, y sin diferencias entre sexos10.
No hemos observado en nuestro estudio relación de los recuentos de NIDp con el color de ojos ni de pelo. No hemos encontrado publicaciones que relacionen el número de NMA acrales con estas características. Respecto al número de NMA-C, los resultados son dispares, así algunos autores no encuentran relación26, mientras que otros concluyen que los sujetos con ojos y pelo claro presentan más NMA23.
Tampoco hemos encontrado diferencias con relación a la presencia de NIDp y el fototipo y la presencia de efélides. Respecto a los recuentos de nevus acrales y el color de la piel, algunos autores observan que los sujetos de color tienen más nevus palmares que los blancos, sin diferencias en los NMA-P5,11, mientras que otros autores encuentran que, tanto la prevalencia de nevus palmares como plantares, aumenta con el grado de pigmentación9. En cuanto a los recuentos de NMA-C, si bien hay estudios que encuentran mayor número de NMA en sujetos con fototipos claros que en oscuros17,19,20,23, otros no hallan relación10,24,25.
No hemos observado asociación de NIDp con la exposición a RUV. Dado que los espacios interdigitales son zonas especialmente cubiertas a la RS, y que los NMA suelen aparecer en zonas fotoexpuestas1, parece lógica esta falta de asociación. Aunque se han descrito diferentes patrones de ALM según la localización y la exposición relativa al sol26, no se ha publicado nada sobre los NMA acrales en este sentido. En general, los NMA-C se ha descrito que aumentan tras la RS21,23,24.
La presencia de NIDp se asoció significativamente con un mayor riesgo de recuento elevado de NMA-C. Los recuentos de NMA acrales se han asociado con un mayor recuento de NMA-C9,24, aunque en otros estudios esta asociación no se ha encontrado10. Respecto a la relación con el recuento de NMA acrales, los resultados del estudio bivariante muestran como la presencia de NIDp se asocia con un riesgo mayor de tener un NMA-P, sin embargo, los NIDp no se relacionaron con los NMA-D.
La presencia de NIDp se asoció con un riesgo negativo de tener CCNM. Este papel protector podría explicarse debido a que los NIDp, al estar en zonas cubiertas, a diferencia de la mayoría de los CCNM, presentan factores patogénicos diferentes. Por otra parte, no hemos encontrado en la literatura relación entre recuentos de nevus acrales y CCNM.
Otro hallazgo destacable es que la presencia de NIDp no se asoció con los antecedentes personales de melanoma. La relación del número de NMA-P y la historia de melanoma es variable en la literatura. Algunos estudios no observan diferencias en la prevalencia de NMA-P entre el grupo de melanoma plantar y el control13; otros autores han asociado el ALM con recuentos elevados de NMA-P16, y otros concluyen que el recuento de NMA es un factor de riesgo importante para el melanoma no acral, pero no para el ALM22. En general, se ha demostrado que los altos recuentos de NMA-C se han asociado con un alto riesgo de melanoma27,28.
Finalmente, en el estudio multivariante, observamos que las dos únicas variables que explicaron de manera independiente la presencia de NIDp fueron la presencia de NMA-P y la presencia de >50 NMA en el cuerpo. Esta asociación de los NIDp y la presencia de los nevus de la planta hipotetizamos que podría deberse a la similitud anatómica de los espacios interdigitales con las plantas de los pies, de forma que estos serían una expansión de la planta. La no relación con la presencia de NMA-D indicaría que probablemente otros factores anatómicos, genéticos, e incluso de fotoexposición, influirían en la aparición de NMA-D, y no en los NMA-P ni NIDp.
El recuento de nevus lugar específico y su relación con los NMA-C se ha descrito en diversas ocasiones29. Las mejores correlaciones han sido encontradas en el número de nevus del antebrazo y del muslo. No hemos hallado trabajos que estudien específicamente los NIDp. Sin embargo, Papageorgiou et al.10 detectaron una relación entre la presencia de nevus acrales y elevados recuentos de NMA-C, lo que concuerda con los resultados de nuestro estudio entre la presencia de NIDp y los NMA-C.
Por otro lado, los NMA acrales y el ALM parecen no presentar una relación directa30. Ambas entidades presentan características clínicas e histopatológicas independientes, así como un perfil mutacional diferente, lo que sugiere que los ALM surgen en su mayoría de novo, no a partir de NMA.
Respecto a la exploración de los espacios interdigitales, pensamos que no se realiza en la práctica habitual de manera rutinaria, lo que retrasaría el diagnóstico de una patología maligna. De hecho, en nuestro estudio detectamos un ALM in situ interdigital que el paciente no refería31.
Respecto a las limitaciones del estudio, se trata de un estudio unicéntrico, con un pequeño tamaño muestral, lo cual limita su validez externa.
En conclusión, la presencia de NIDp se relaciona con un mayor número de NMA-P y de NMA-C. Hasta donde sabemos, este es el primer estudio publicado sobre NIDp, lo que ofrece una nueva perspectiva de los nevus acrales desde el punto de vista epidemiológico de una zona corporal sin RS, como son los espacios interdigitales. Por otra parte, la relación que hemos observado entre la presencia de NIDp y el número de NMA-C posiblemente se deba a que factores genéticos y no solo ambientales, como la RS, influyen en el número de NMA.
FinanciaciónEl estudio no ha recibido financiación externa.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.