Imatinib es un inhibidor de tirosina-quinasa empleado para el tratamiento de la leucemia mieloide crónica (LMC), los tumores del estroma gastrointestinal (GIST) y el dermatofibrosarcoma protuberans metastásico1–5. Su mecanismo de acción consiste en la inhibición competitiva del sitio de unión del adenosín trifosfato (ATP) que, a su vez, impide la fosforilación de las proteínas BCR-ABL, c-kit y del receptor del factor de crecimiento derivado de plaquetas (PDGFR)1,5–8.
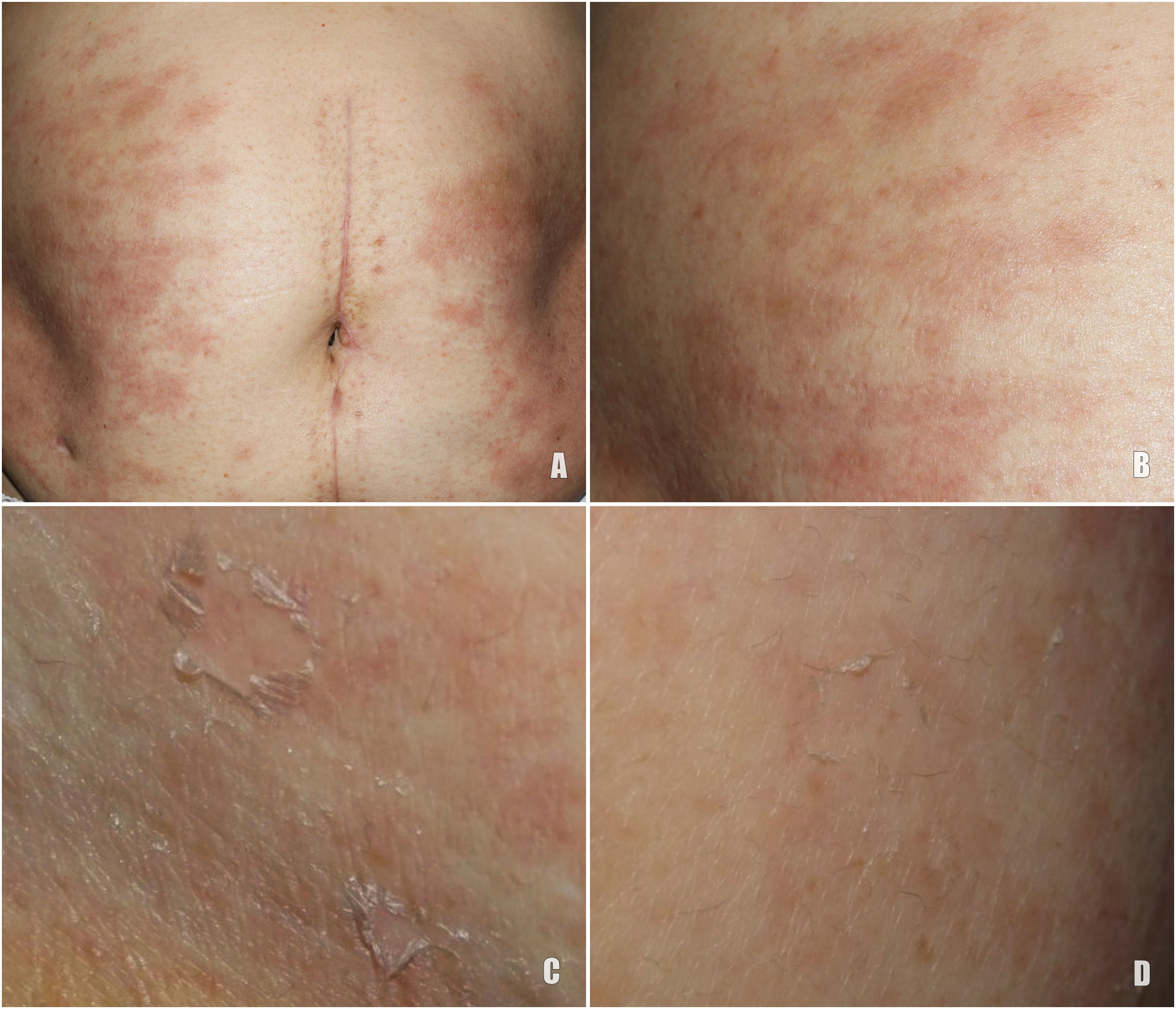
Una mujer de 78 años, diagnosticada de un GIST metastásico y en tratamiento con imatinib 400mg/día desde hacía un mes y medio, consultó por una erupción cutánea abdominal ligeramente pruriginosa de una semana de evolución. A la exploración se observaban unas máculas rosadas ovaladas con un collarete de descamación, de distribución simétrica en ambos flancos (fig. 1). El estudio analítico realizado fue normal, incluyendo una serología para treponema negativa. La histología reveló una dermatitis espongiótica con un infiltrado perivascular de predominio linfocitario, con ocasionales eosinófilos y una paraqueratosis focal, compatible con pitiriasis rosada (PR) (fig. 2). Debido al inicio reciente del tratamiento con imatinib y las características histológicas, se diagnosticó de erupción PR-like inducida por imatinib.
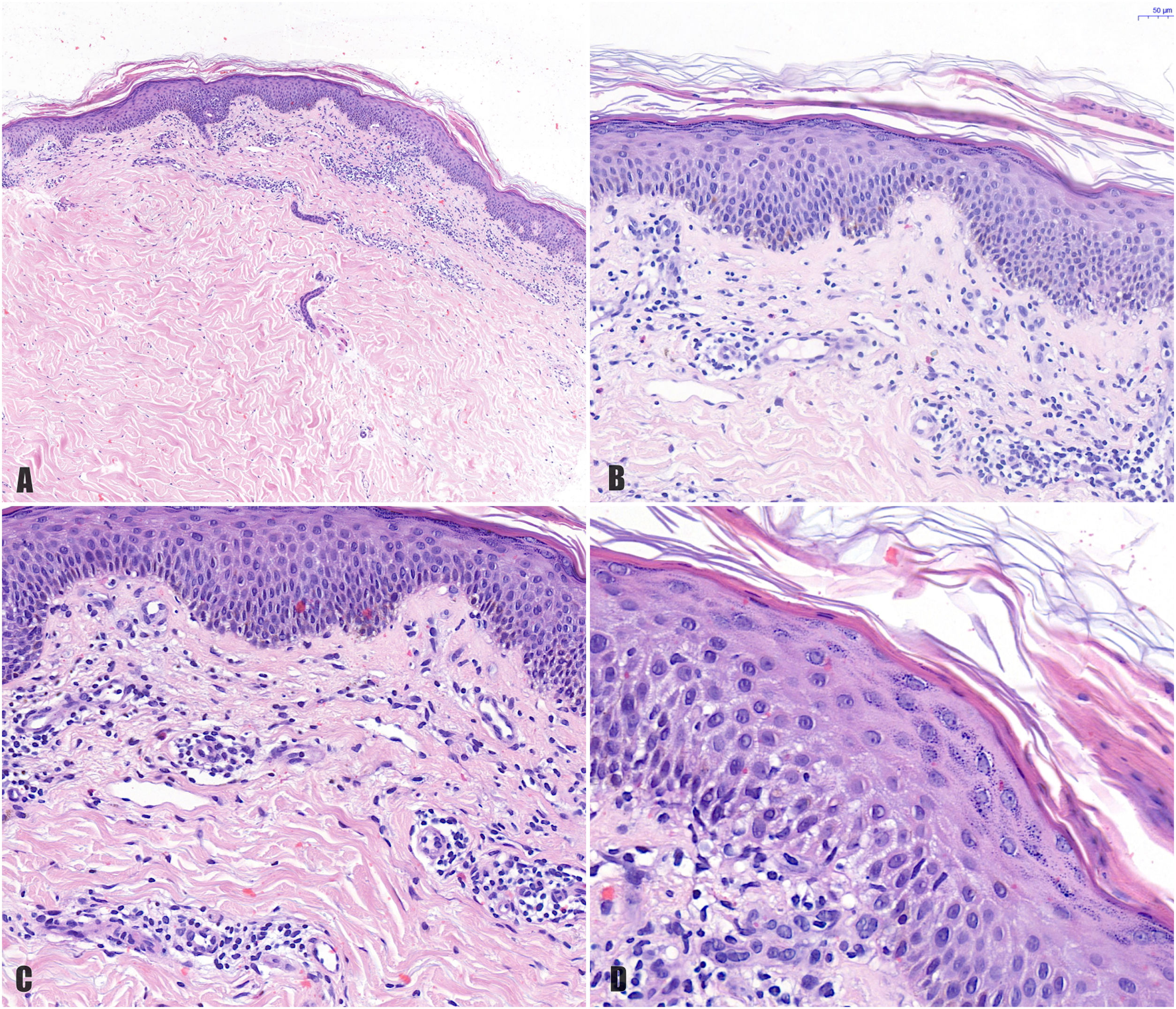
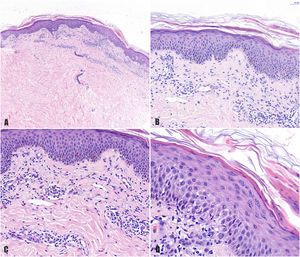
A) Imagen histológica en la que destaca un infiltrado en dermis superficial. B) A mayor aumento se observa una dermatitis espongiótica con infiltrado perivascular y paraqueratosis focal. C) Detalle del infiltrado perivascular de predominio linfocitario. D) Detalle de la dermatitis espongiótica con un foco de paraqueratosis.
Se suspendió imatinib y se instauró tratamiento con betametasona tópico y loratadina oral, 20mg cada 12h, con una resolución completa de la clínica a las 2 semanas. Dada la buena evolución, se reanudó el tratamiento con imatinib a dosis de 100mg cada 12h, aumentándose progresivamente hasta alcanzar de nuevo los 400mg diarios a las 3 semanas, sin presentar nuevas lesiones cutáneas.
Los efectos adversos de imatinib se clasifican en hematológicos y no hematológicos1,8. Dentro de los efectos adversos no hematológicos los más frecuentes son los cutáneos (7-88,9% según series)1,4,8, que suelen ser de intensidad leve-moderada, dosis dependientes y no requieren la suspensión permanente del fármaco2,4,6–9. Para su tratamiento pueden emplearse antihistamínicos orales, corticoides tópicos o corticoterapia oral a dosis bajas3,8.
Las reacciones cutáneas más frecuentes son las inespecíficas, aunque se han descrito casos de pustulosis exantemática aguda generalizada, síndrome de Stevens-Johnson, micosis fungoide-like, erupciones psoriasiformes, liquen erosivo oral, dermatitis exfoliativas o dermatosis neutrofílicas1–4,6–8. La erupción PR-like es infrecuente y existen pocos casos en la literatura1.
La PR se caracteriza por la presencia de unas máculas eritematosas con una descamación fina periférica en collarete, asintomáticas o ligeramente pruriginosas, que se resuelven espontáneamente en varias semanas9,10. Su etiología es desconocida, relacionándose con infecciones como el virus herpes tipo 6 y 76,9,10. Existen también casos descritos de PR-like inducida por fármacos, como omeprazol, metronidazol, terbinafina, captopril, D-penicilamina, isotretinoína, nortriptilina, sales de oro, litio, anti-TNFα e imatinib2,3,6,9,10.
El primer caso de PR-like inducida por imatinib fue descrito por Konstantopoulos et al.9. Todos los casos descritos de PR-like por imatinib mostraron lesiones típicas de PR en el tronco y las extremidades1–3,6,9,10. Histológicamente presentaron un infiltrado linfocitario perivascular superficial con ocasionales eosinófilos, espongiosis, paraqueratosis focal y queratinocitos necróticos, en consonancia con nuestros hallazgos1–3,6,10. Algunos mostraban además acantosis y extravasación de hematíes1–3. En nuestra muestra no se realizó inmunohistoquímica para linfocitos CD4/CD8 (podría observarse predominio de linfocitos CD8 en epidermis y CD4 en dermis) ni se apreciaban queratinocitos necróticos o extravasación de hematíes, que reforzarían el origen farmacológico. Sin embargo, la histología compatible unida a la relación temporal entre el inicio del fármaco y la aparición de la clínica (mes y medio), así como la rápida resolución (2 semanas) tras la suspensión del mismo, apoyan el diagnóstico de PR-like inducida por imatinib. Dichos intervalos de tiempo fueron en consonancia con los recogidos en los otros casos descritos.
La PR-like inducida por imatinib suele remitir con la suspensión del fármaco, pudiendo reaparecer si este se reintroduce a dosis elevadas (300-400mg diarios)1–3,6, lo cual apoya el diagnóstico en estos casos. La relación entre prevalencia y dosis sugiere que es debida a sus efectos sobre la inhibición de c-kit y/o PDGFR, los cuales se expresan en queratinocitos, melanocitos, mastocitos y glándulas sudoríparas1,4,6–8. La clínica de nuestra paciente se resolvió a las 2 semanas de suspender imatinib. Sin embargo, su reintroducción no provocó que las lesiones volvieran a aparecer. Ello podría explicarse, como afirman Cho et al.1, por un incremento progresivo de dosis, la cual se retomó en nuestra paciente con 100mg cada 12h, alcanzando los 400mg diarios tras 3 semanas libres de lesiones.
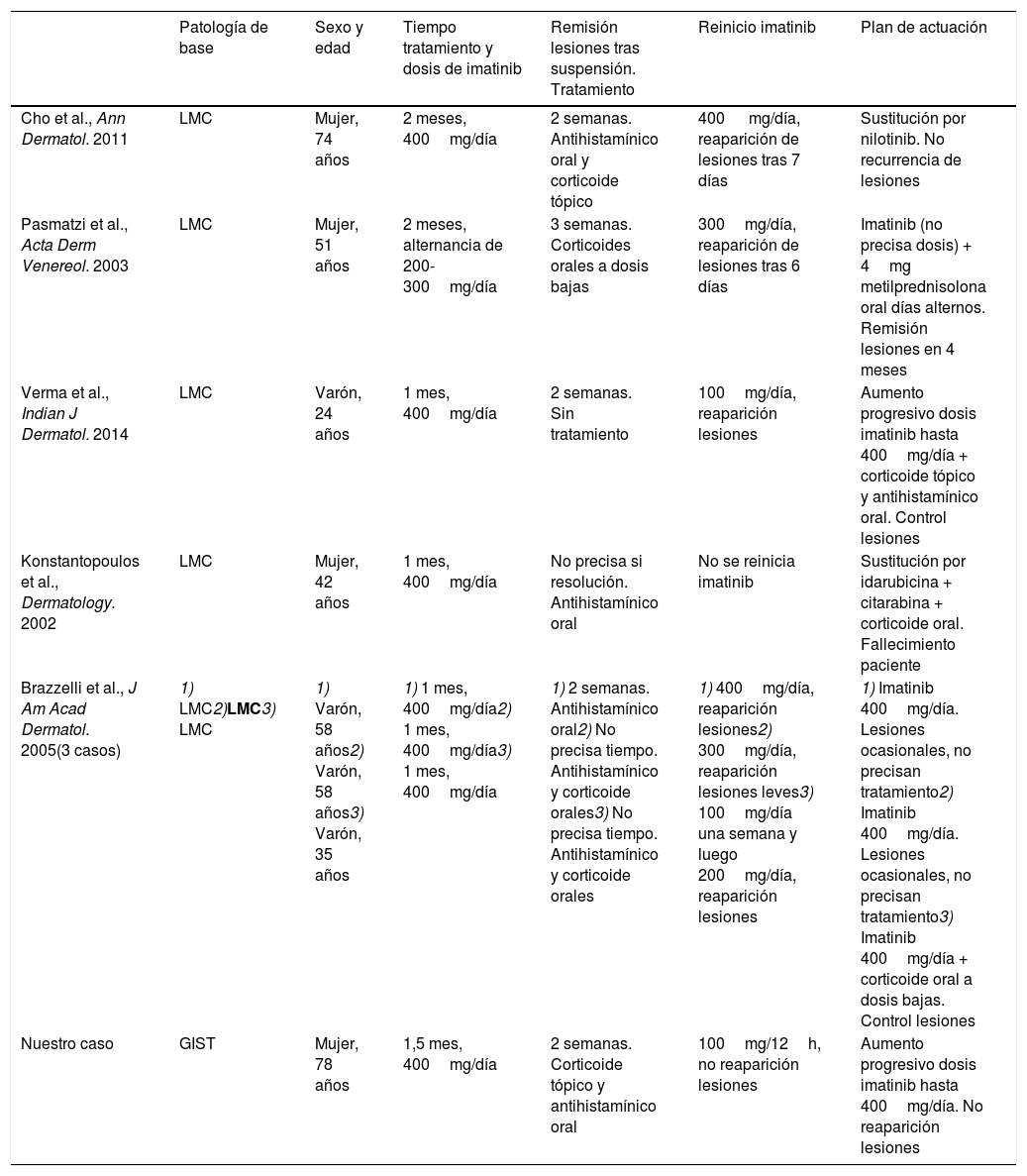
Presentamos el que, para nuestro conocimiento, es el primer caso descrito de erupción PR-like inducida por imatinib en una paciente con GIST. Existen casos publicados de PR-like por imatinib en pacientes con leucemia mieloide crónica (tabla 1). Se trata de una reacción poco frecuente y, generalmente, de carácter leve/moderado que se resuelve al suspender el fármaco. Para prevenir la recidiva del cuadro se plantea la reintroducción progresiva de imatinib o, en el caso de GIST, la sustitución del mismo por sunitinib, con el que no se han descrito casos.
Casos de pitiriasis rosada-like inducida por imatinib en la literatura científica
| Patología de base | Sexo y edad | Tiempo tratamiento y dosis de imatinib | Remisión lesiones tras suspensión. Tratamiento | Reinicio imatinib | Plan de actuación | |
|---|---|---|---|---|---|---|
| Cho et al., Ann Dermatol. 2011 | LMC | Mujer, 74 años | 2 meses, 400mg/día | 2 semanas. Antihistamínico oral y corticoide tópico | 400 mg/día, reaparición de lesiones tras 7 días | Sustitución por nilotinib. No recurrencia de lesiones |
| Pasmatzi et al., Acta Derm Venereol. 2003 | LMC | Mujer, 51 años | 2 meses, alternancia de 200-300mg/día | 3 semanas. Corticoides orales a dosis bajas | 300mg/día, reaparición de lesiones tras 6 días | Imatinib (no precisa dosis) + 4mg metilprednisolona oral días alternos. Remisión lesiones en 4 meses |
| Verma et al., Indian J Dermatol. 2014 | LMC | Varón, 24 años | 1 mes, 400mg/día | 2 semanas. Sin tratamiento | 100mg/día, reaparición lesiones | Aumento progresivo dosis imatinib hasta 400mg/día + corticoide tópico y antihistamínico oral. Control lesiones |
| Konstantopoulos et al., Dermatology. 2002 | LMC | Mujer, 42 años | 1 mes, 400mg/día | No precisa si resolución. Antihistamínico oral | No se reinicia imatinib | Sustitución por idarubicina + citarabina + corticoide oral. Fallecimiento paciente |
| Brazzelli et al., J Am Acad Dermatol. 2005(3 casos) | 1) LMC2)LMC3) LMC | 1) Varón, 58 años2) Varón, 58 años3) Varón, 35 años | 1) 1 mes, 400mg/día2) 1 mes, 400mg/día3) 1 mes, 400mg/día | 1) 2 semanas. Antihistamínico oral2) No precisa tiempo. Antihistamínico y corticoide orales3) No precisa tiempo. Antihistamínico y corticoide orales | 1) 400mg/día, reaparición lesiones2) 300mg/día, reaparición lesiones leves3) 100mg/día una semana y luego 200mg/día, reaparición lesiones | 1) Imatinib 400mg/día. Lesiones ocasionales, no precisan tratamiento2) Imatinib 400mg/día. Lesiones ocasionales, no precisan tratamiento3) Imatinib 400mg/día + corticoide oral a dosis bajas. Control lesiones |
| Nuestro caso | GIST | Mujer, 78 años | 1,5 mes, 400mg/día | 2 semanas. Corticoide tópico y antihistamínico oral | 100mg/12h, no reaparición lesiones | Aumento progresivo dosis imatinib hasta 400mg/día. No reaparición lesiones |
Los autores declaran no tener ningún conflicto de intereses.