El lentigo maligno es un melanoma cutáneo in situ que asienta en zonas con daño solar acumulado. Su presentación más habitual es como una mancha irregularmente pigmentada de crecimiento lento y progresivo localizada en la cara de un paciente añoso. Aunque el porcentaje real de casos de lentigo maligno que evoluciona a formas invasoras es desconocido, se calcula que supone entre un 2 y un 5% de los casos. Tanto el diagnóstico clínico como histopatológico del lentigo maligno puede suponer un reto, especialmente en casos precoces o atípicos. Su tratamiento también puede suponer un desafío por su localización en áreas muy visibles y por su tamaño frecuentemente considerable, lo que tiene implicaciones estéticas y ocasionalmente también funcionales derivadas de la cirugía. En este trabajo revisamos las claves clínicas e histopatológicas para facilitar el diagnóstico del lentigo maligno. También revisamos las opciones de tratamiento con especial atención a la cirugía.
Lentigo maligna is an in situ cutaneous melanoma that arises in sun-damaged skin. Its most common presentation is a progressive, slow-growing, irregularly pigmented spot on the face of older patients. Although the exact percentage of Lentigo maligna that progresses to invasive tumors is unknown, it is thought to lie between 2% and 5%. Both the clinical and histologic diagnosis of Lentigo maligna can be challenging, especially in patients with early-stage or atypical disease. Treatment also holds challenges, because lesions are located in highly visible areas and are often large. Surgery can thus compromise cosmetic and sometimes functional outcomes. We review clinical and histopathological findings that can facilitate the diagnosis of Lentigo maligna. We also examine treatment options, with a focus on surgery.
El lentigo maligno (LM) es una variedad de melanoma cutáneo in situ que típicamente aparece en zonas con un daño solar evidente, especialmente en la nariz y las mejillas de personas de edad avanzada. Cuando el LM infiltra la dermis o más allá, es decir, cuando deja de ser in situ, pasa a llamarse lentigo maligno melanoma (LMM) y, entonces, su pronóstico es dependiente del Breslow, la ulceración y otras características histológicas y clínicas, similar al de otras variedades de melanoma1. El LM supone aproximadamente 10% de los melanomas y se caracteriza por una fase de crecimiento in situ más larga que la de otros tipos de melanoma, de modo que pueden pasar décadas antes de que se haga invasivo. Según un estudio de 1987, solo 5% de todos los LM llegan a hacerse invasivos, un porcentaje que disminuye a 2,2% cuando el diagnóstico es a partir de los 65 años2. No obstante, este dato puede no ser fiable, dado que fue calculado basándose en estudios de prevalencia de LM y de LMM. En un estudio similar reciente, se ha observado que 2-2,6% de los pacientes diagnosticados de un LM presentan un LMM durante los 25 años siguientes, 90% de los cuales se desarrollan en la misma área del LM previo3. Otros autores han estimado que existe un riesgo de 3,5% anual y un tiempo medio hasta la progresión de 28,3 años4. No obstante, el riesgo real de evolución de un LM a LMM es muy difícil de conocer, pero está claro que existe y no se debe infraestimar.
El diagnóstico del LM suele retrasarse por diferentes motivos. En primer lugar, con frecuencia es el propio paciente el que no consulta porque habitualmente es una persona de edad avanzada con daño solar evidente y considera que el LM es «una más de sus manchas», hasta que un cambio de color, de tamaño, o la aparición de una ulceración o de sangrado lo llevan a hacerlo. Otras veces es el médico, bien el médico de cabecera o incluso el dermatólogo, el que no diagnostica la lesión, dado que el aspecto clínico en sus fases iniciales puede confundirse con facilidad con un lentigo solar, entre otros. Y, por último, en ocasiones, es el patólogo el que no diagnostica el LM. Esto es debido a que, en fases muy iniciales, los cambios histológicos son sutiles y pueden ser difíciles de diferenciar de la hiperplasia melanocítica actínica propia de las zonas con daño solar, y en fases más avanzadas porque si no hay una correlación clínico-patológica, se puede confundir con un nevus juntural displásico5.
En este trabajo revisaremos y actualizaremos los aspectos más importantes del LM y enfatizaremos las claves clínicas y, sobre todo, histopatológicas que nos ayudarán a minimizar en lo posible el retraso en el diagnóstico.
Epidemiología y etiopatogenia del lentigo malignoDe acuerdo con los datos procedentes del Surveillance, Epidemiology, and End Results (SEER) de EE. UU., el LM/LMM es la segunda variedad clínico-patológica clásica de melanoma, tras el melanoma de extensión superficial con una incidencia de 1,37 casos al año por cada 100.000 habitantes6. En la población de raza blanca, excluidos los hispánicos, la incidencia es de 1,87/100.000 habitantes. Las cifras son mucho menores en las poblaciones hispánica, asiática y negra donde la incidencia es, respectivamente, de 0,23, 0,06, y 0,02 casos por 100.000 habitantes al año6. Dada la relación con el daño actínico acumulado a lo largo de la vida, la incidencia es mucho mayor en pacientes de más de 65 años. Según la misma fuente (SEER), la incidencia anual en este grupo de edad era de 10,11 en blancos no hispánicos, 1,38 en blancos hispánicos, 0,16 en asiáticos, 0,33 en raza negra y 7,69 en población global por 100.000 habitantes6. En España se ha observado un aumento de la incidencia que varió del 0,25 para hombres y 0,18 en mujeres en 2000 al 0,68 y 0,637. Por otra parte, según datos del Registro nacional de melanoma de la Academia Española de Dermatología y Venereología, a partir de los datos recogidos en diferentes hospitales de 10.581 pacientes con melanoma invasor, el LMM es el tercero en frecuencia (8,9%) tras el melanoma de extensión superficial (65,1%) y el melanoma nodular (19,8%)8.
Whiteman propuso que existen al menos dos posibles mecanismos etiopatogénicos para el desarrollo de un melanoma cutáneo9. El primero de ellos está relacionado con una susceptibilidad individual a la proliferación de los melanocitos, expresado fenotípicamente por la presencia de un número elevado de nevus melanocíticos, sobre la que intervendría el daño cutáneo debido a exposiciones intensas intermitentes a la radiación ultravioleta. El segundo se produce como consecuencia de una acumulación de daño cutáneo producida por una exposición crónica a la radiación ultravioleta. Este mecanismo se expresa en la presencia de un grado importante de elastosis solar en la piel sobre la que se desarrolla el melanoma, así como a un fenotipo en el que existe un aumento de la prevalencia de queratosis actínicas y de cáncer cutáneo no melanoma. El grado de elastosis solar determina los tipos de melanoma en la nueva clasificación de la Organización Mundial de la Salud (OMS) de las neoplasias melanocíticas cutáneas10. El LM representa el tipo histológico predominante de esta vía. Consecuentemente, el LM se localiza preferentemente en la piel de la cabeza o el cuello y, en menor medida, en los brazos. Los factores de riesgo que se han asociado de forma más acentuada al LM en comparación con el melanoma de extensión superficial son la presencia de lentigos solares y la historia personal de cáncer cutáneo. Para el LM, la influencia de los nevus melanocíticos y de los antecedentes de quemaduras es significativamente menor que en el melanoma de extensión superficial y, en ambos tipos, tanto la presencia de queratosis actínicas como el tipo de piel clara y sensible a la radiación solar aumentan el riesgo11–13. El riesgo de desarrollar un melanoma también aumenta cuando se vive en zonas geográficas con un grado elevado de radiación solar14 y con la cantidad de radiación solar acumulada, fundamentalmente en los hombres15.
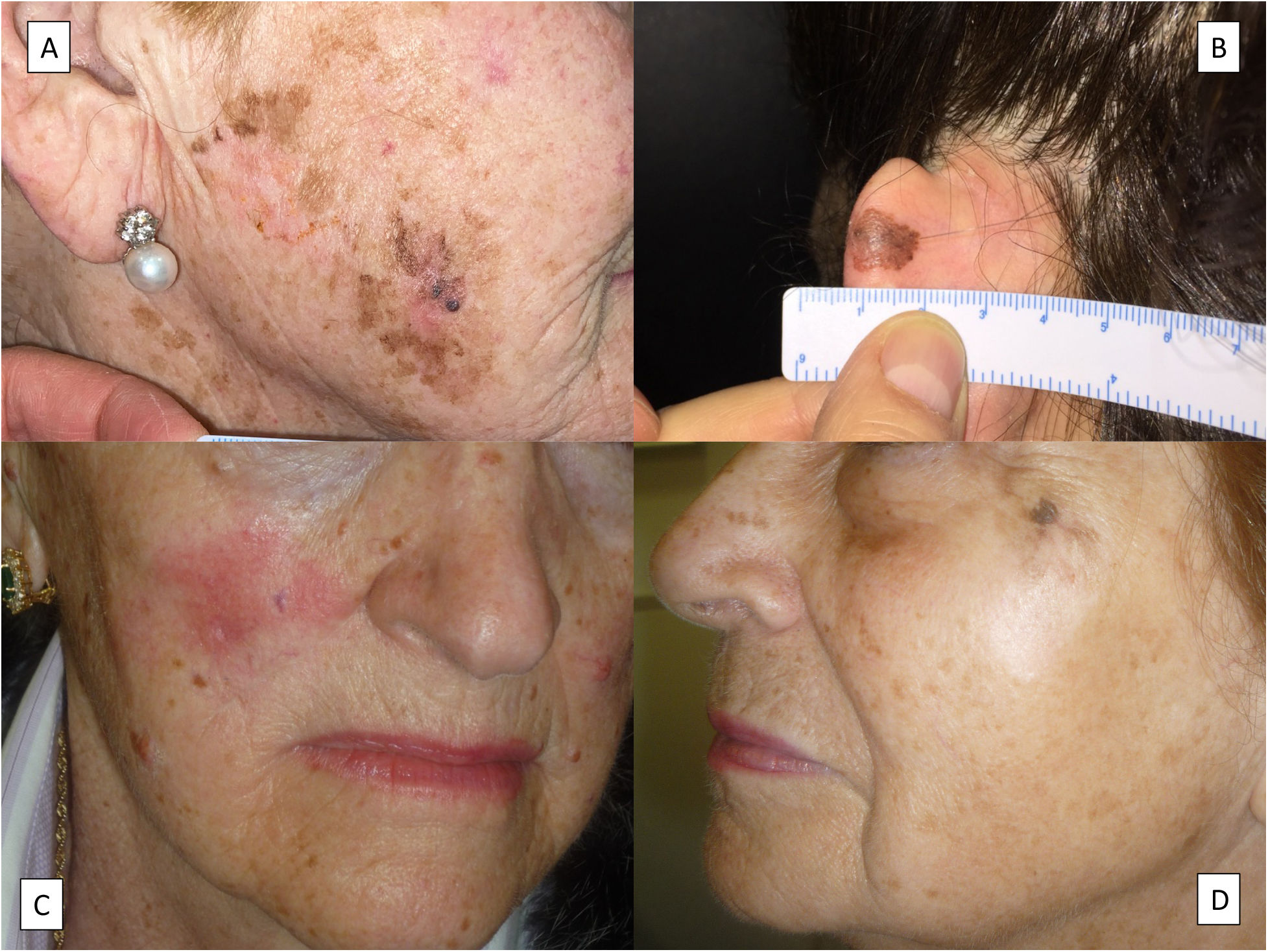
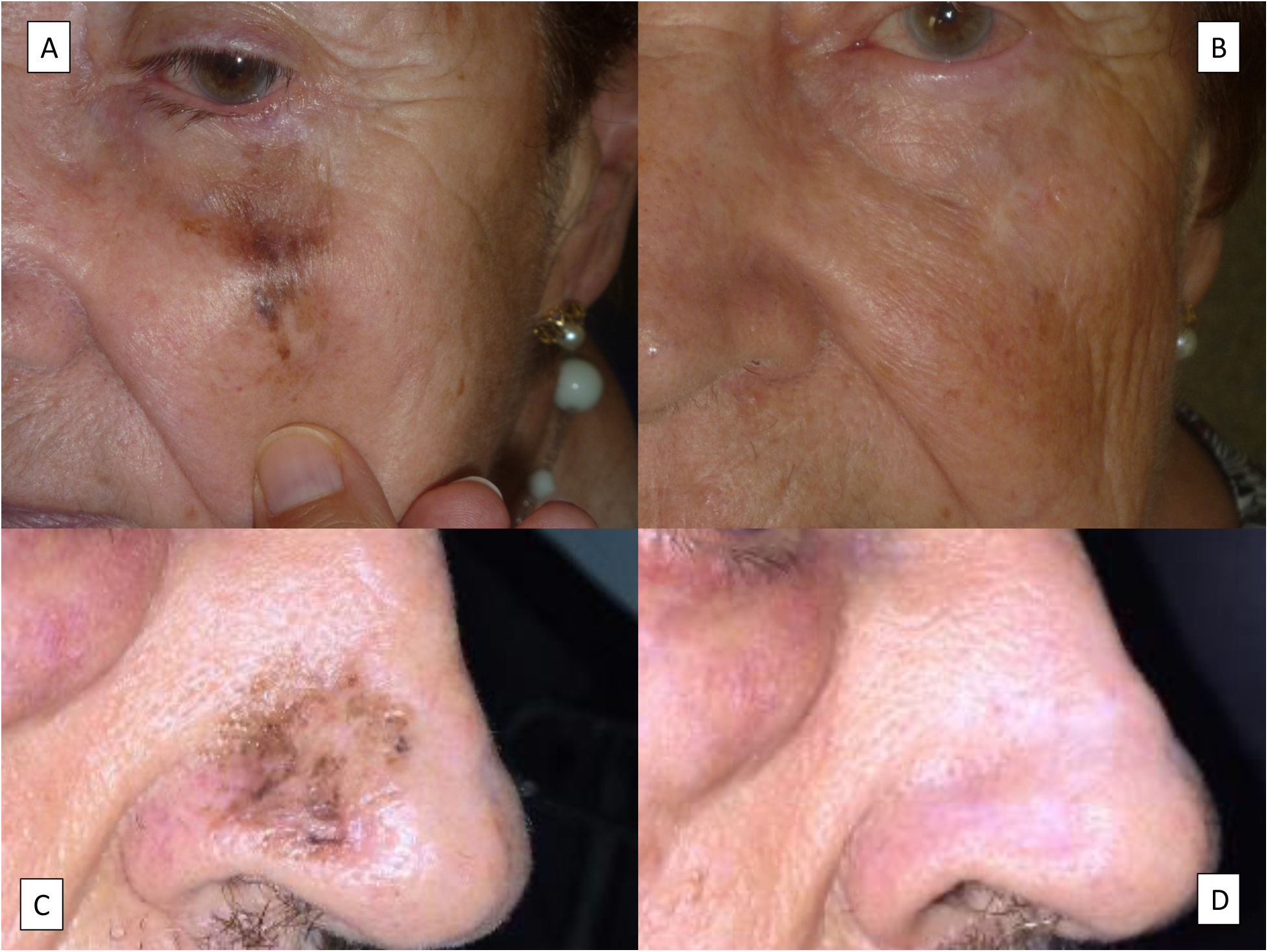
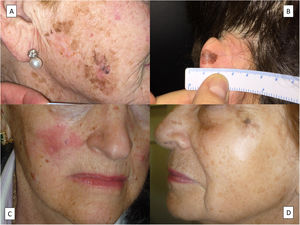
ClínicaEl LM cursa como una mancha habitualmente pigmentada y no homogénea localizada en la cabeza y el cuello de pacientes ancianos, más comúnmente en la mejilla. Su color más habitual es el marrón, que varía de distintos tonos entre el marrón claro y el negro, se distribuye de forma heterogénea y sus bordes son con frecuencia mal definidos (fig. 1A), aunque no siempre es así (fig. 1B). Otros colores como el rosado, rojizo o blanquecino no son excepcionales –como en otras formas de melanoma–, generalmente en el contexto de regresión16. No obstante, hay formas de LM que son un reto diagnóstico clínico debido a que en ellas predominan las zonas blancas o rojizas (fig. 1C,D), sin una regresión histológica evidente17–19. Tales casos se pueden confundir con un vitíligo, una enfermedad de Bowen o un eccema5. En estos casos, la proximidad de áreas más características de LM puede ser la clave para considerar este diagnóstico clínico. Además, esta circunstancia hace muy recomendable la biopsia de cualquier área discrómica vecina a un LM, aunque sea blanca o rojiza y nada sugerente de melanoma, porque en este contexto existe la probabilidad de que se trate de una extensión del LM20. En los casos en los que todo el LM es rojizo o blanco, sin áreas típicas de LM, el diagnóstico es muy difícil, pero debe considerarse ante el crecimiento de un área hipopigmentada o eritematosa localizada en la cara de un paciente con mucho daño solar cutáneo. Característicamente, el LM puede alcanzar tamaños relativamente grandes sin hacerse invasivo y, cuando afecta a zonas periorificiales como la boca o los ojos, puede extenderse a la mucosa vecina5.
Distintos aspectos clínicos del lentigo maligno. A) Gran mancha de bordes mal delimitados y en distintos tonos de marrón, con áreas rojizas y negruzcas localizada en la mejilla derecha. B) Mancha marronácea con áreas negruzcas de bordes bien definidos en el pabellón auricular izquierdo. C) Mancha roja de límites poco netos en la mejilla derecha. Nótese una cicatriz en el surco nasogeniano derecho correspondiente a la extirpación previa de un lentigo maligno convencional. D) Mancha blanca en la mitad inferior de un lentigo maligno de la zona malar izquierda. El aspecto histológico de las lesiones C y D correspondieron a lentigos malignos sin regresión.
El diagnóstico diferencial clínico más común del LM se plantea con el lentigo solar, pero este suele ser de un color más uniforme y de un crecimiento más lento que el LM. La dermatoscopia puede ser de utilidad, puesto que existen unos rasgos dermatoscópicos que son más característicos de un LM, como la pigmentación asimétrica de los orificios foliculares, la obliteración de los orificios foliculares, la presencia de estructuras romboidales, la observación de estructuras anulares-granulares o de un pseudorretículo gris21, estas dos últimas de forma menos específica. Otros rasgos propios del LM en el examen dermatoscópico son la presencia de estructuras romboidales rojizas, la presencia de una red vascular y la imagen descrita como «círculo sobre círculo»22. En caso de duda, el estudio histológico es imprescindible y permite establecer un diagnóstico de certeza. Aunque es menos habitual, otro diagnóstico diferencial clínico del LM es la queratosis actínica pigmentada, pero el tacto áspero de la queratosis actínica es muy característico, y también nos servirá de ayuda la dermatoscopia23,24, aunque en caso de duda deberemos nuevamente recurrir al estudio histológico. Se ha propuesto que se debe sospechar un LM cuando no encontramos características histológicas de las lesiones benignas mencionadas25.
Aunque lo característico es que el LM aparezca en ancianos, no son excepcionales los casos que se presentan en la zona centrofacial de pacientes en torno a los 50 años, especialmente en aquellos que tienen una piel clara y un gran daño solar acumulado. Aunque es menos habitual, los LM también pueden aparecer en el dorso de los antebrazos o en la porción superior de la espalda26.
La adquisición de relieve o la aparición de lesiones palpables sobre un LM indica que el tumor se ha hecho invasivo (LMM), hecho que es impredecible, aunque ocurre con una frecuencia mayor en el cuero cabelludo (al menos 3,4 veces más respecto a la cara o la frente) y en las lesiones en las que los cambios clínicos son perceptibles por el paciente (al menos 1,8 veces respecto a la no percepción de cambios)4.
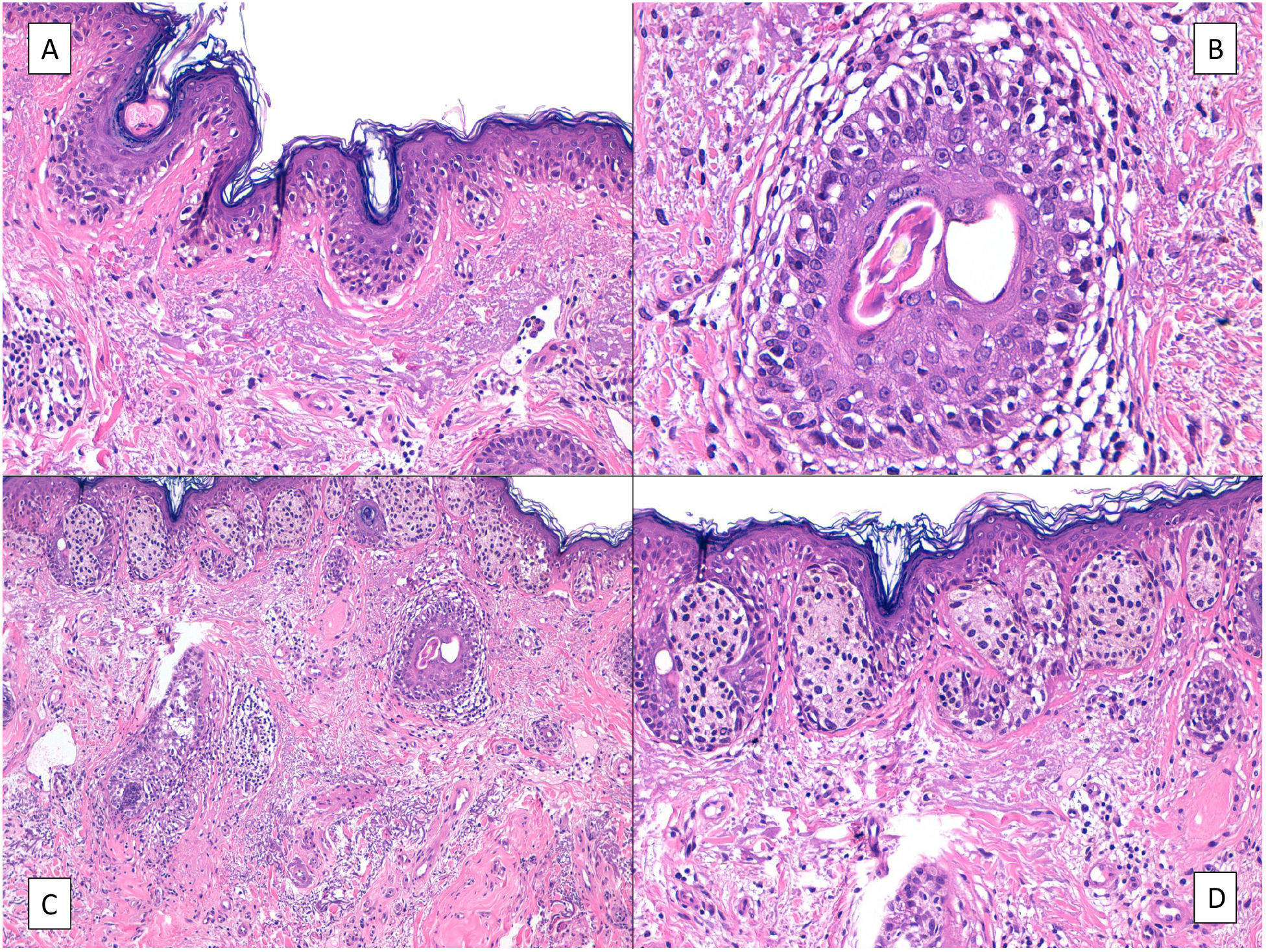
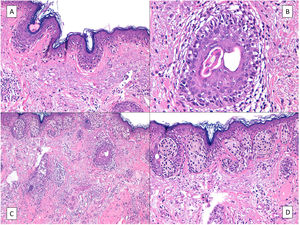
HistologíaEl diagnóstico histológico de un LM es muy sencillo la mayoría de las veces. Esto es así salvo en fases muy precoces de su evolución, en las que los hallazgos histológicos son más sutiles y requieren de un alto índice de sospecha y de un estudio histológico cuidadoso de la biopsia para poder hacer el diagnóstico. Inicialmente, cuando la proliferación de melanocitos tumorales es aún muy escasa, casi el único dato que nos puede orientar es la distribución irregular de los melanocitos en la capa basal, que se distribuyen en un número discretamente superior al habitual y de forma no equidistante, sobre una dermis con elastosis solar evidente5 (fig. 2A). También puede ayudar la aparición ocasional de filas de melanocitos en la capa basal de la epidermis y la extensión al epitelio folicular de los mismos (fig. 2B), cuando están presentes27. Habitualmente en estas fases la atipia aún no es muy llamativa y puede haber un pleomorfismo nuclear discreto. Tras esta fase inicial sutil, aparece una fase con una proliferación de melanocitos mucho más evidente, con frecuentes hileras de melanocitos sustituyendo a los queratinocitos basales, a veces acompañados de grietas de retracción junturales. Los melanocitos tumorales infiltran también la capa basal del epitelio folicular y no es raro que los melanocitos neoplásicos rebasen el infundíbulo folicular para alcanzar porciones más profundas del folículo, como las glándulas sebáceas o el segmento inferior28. Todo ello desarrollado sobre una dermis con elastosis solar, a veces muy evidente, y con un cierto infiltrado linfocitario. La atipia de melanocitos, cuando está presente, puede ser también de ayuda, a veces con melanocitos epitelioides atípicos, pero otras veces la atipia no es llamativa y los melanocitos son linfocitoides o angulados o fusiformes, pero en casi cualquiera de estas variedades morfológicas los núcleos suelen mostrar algún pleomorfismo, con tamaños y formas diferentes, un grado variable de picnosis nuclear y nucléolos eosinófilos evidentes.
A) Los melanocitos de la capa basal son más numerosos de lo normal y se distribuyen de forma irregular y no equidistante en la capa basal epidérmica, sobre una dermis con elastosis solar evidente. B) Apolillamiento de un folículo piloso por los melanocitos neoplásicos de un lentigo maligno. C) Predominio de nidos junturales irregulares y confluentes en un lentigo maligno con aspecto simulador de nevus juntural displásico. D) La atipia de los melanocitos, el aspecto irregular de los nidos, y sobre todo la elastosis solar, facilitan el diagnóstico de lentigo maligno.
En nuestra experiencia, en esta fase diagnóstica del LM es bastante habitual encontrar nidos junturales de melanocitos atípicos (fig. 2C,D). En estos casos, por desgracia, si no se tienen en cuenta las características clínicas de la lesión, no es raro el diagnóstico histológico de tales lesiones como «nevus junturales con atipia» o «nevus displásicos» o similares5. Esto conlleva innecesarios retrasos en el diagnóstico del LM, con el riesgo de demorarlo hasta fases invasivas y, por tanto, de mucho peor pronóstico para el paciente. Sin embargo, en tales casos, llegar al diagnóstico correcto es fácil apoyándonos en sencillos rasgos clínicos e histológicos. En primer lugar, cuando un dermatólogo biopsia un LM en la cara, generalmente el diagnóstico diferencial que se plantea es con un lentigo solar, o menos veces con una queratosis actínica pigmentada o con una queratosis liquenoide, pero casi nunca con un nevus melanocítico. El diagnóstico histológico de nevus melanocítico ante una sospecha clínica de LM suele deberse a una falta de correlación clínico-patológica, lo que subraya la importancia de aportar tanto la localización de la lesión como un diagnóstico diferencial clínico claro al patólogo para que haga una interpretación correcta de los hallazgos histológicos. De hecho, los nevus melanocíticos displásicos prácticamente no existen en la cara, y se debe dudar más aún de este diagnóstico en pacientes con un daño solar intenso, que suelen ser la mayoría de los que padecen el LM5,29. Además, aunque histológicamente puede haber nidos de melanocitos en la unión tanto en el LM como en el nevus melanocítico displásico, estos suelen ser irregulares en forma y tamaño en el LM, mientras que suelen ser más uniformes en el nevus melanocítico. Por otro lado, en el LM prácticamente siempre se encuentran zonas con una proliferación lentiginosa atípica de melanocitos en la capa basal que se suelen extender al folículo piloso incluso hasta el segmento inferior, mientras que este hecho no se da en los nevus melanocíticos. La presencia de elastosis solar prominente subyacente en el LM es también es muy útil para poner en duda el diagnóstico de nevus juntural. En los auténticos nevos melanocíticos los melanocitos aún ejercen su misión de proteger del daño solar a modo de paraguas con un efecto conocido como «umbrella sign», por lo que la elastosis solar es virtualmente inexistente en ellos30. En la práctica y a modo de resumen, si nos planteamos un diagnóstico clínico de lentigo solar vs. lentigo maligno, recibir un informe histológico de nevus melanocítico hace altamente probable el diagnóstico de melanoma.
Probablemente, el diagnóstico diferencial histológico más difícil del LM sea con la hiperplasia melanocítica actínica propia de zonas con mucho daño solar. A diferencia del LM, en la hiperplasia melanocítica actínica los melanocitos se tienden a distribuir de modo equidistante, si alcanzan el folículo piloso, nunca afectan más allá del infundíbulo, de modo que no alcanzan a la glándula sebácea ni al segmento inferior. Además, la hiperplasia melanocítica actínica nunca contiene nidos de melanocitos ni tampoco presenta melanófagos en la dermis superficial, que no son raros en el LM5.
En relación con la presencia de elastosis solar en el LM existe una cierta controversia en la actualidad. Si bien en la descripción clásica del LM se indica que la presencia de elastosis solar evidente es un rasgo definitorio, en ningún texto se especifica el grado de elastosis necesario. La última clasificación de la OMS de los tumores cutáneos incluye los LM en los melanomas CSD, definidos como tales exclusivamente aquellos en los que existe un grado de elastosis elevado, con agregados o masas homogéneas de elastosis, y considera una forma lentiginosa de melanoma de extensión superficial a aquellos en los que, si existe elastosis, no llega a ese grado10. Sin embargo, no existen trabajos que avalen esta diferenciación desde el punto de vista biológico o clínico y a efectos del tratamiento no se ha demostrado que tenga relevancia.
Si bien el diagnóstico histológico de los melanomas, como norma, debe realizarse a partir de la exéresis completa de la lesión, para el LM se suele realizar a partir de una biopsia parcial, dado que la sospecha diagnóstica de LM se da con frecuencia en lesiones con un tamaño considerable. La biopsia parcial requiere técnicas que obtengan un material que ofrezca una visión histológica amplia para una valoración adecuada de la arquitectura y de las alteraciones anteriormente descritas. Por ello, se prefiere la biopsia amplia por afeitado/rebanado o una biopsia incisional en huso a la biopsia en sacabocados, especialmente con la inclusión de piel clínicamente no afectada por el LM31. Conviene tener presente que cuando se diagnostica un LM en una biopsia parcial puede haber un componente invasor en el resto de la lesión. Según los resultados de un metaanálisis, se demostró que esto ocurre en 22% de todos los melanomas diagnosticados en la biopsia inicial como in situ32. Más recientemente, en una serie extensa de 255 casos, se ha constatado que ocurre en 9% de las lesiones inicialmente diagnosticadas como de LM33. La existencia de un componente invasor se encuentra significativamente asociada a la presencia de melanocitos formando hileras o una hendidura artefacta, sobre todo si más de 25% de los melanocitos se encuentran formando nidos34, también si se encuentra extensión pagetoide y hay un infiltrado inflamatorio prominente35. Clínicamente, también puede sospecharse un componente invasor si se observa mediante dermatoscopia la presencia de manchas irregulares, orificios foliculares obliterados y color negro36.
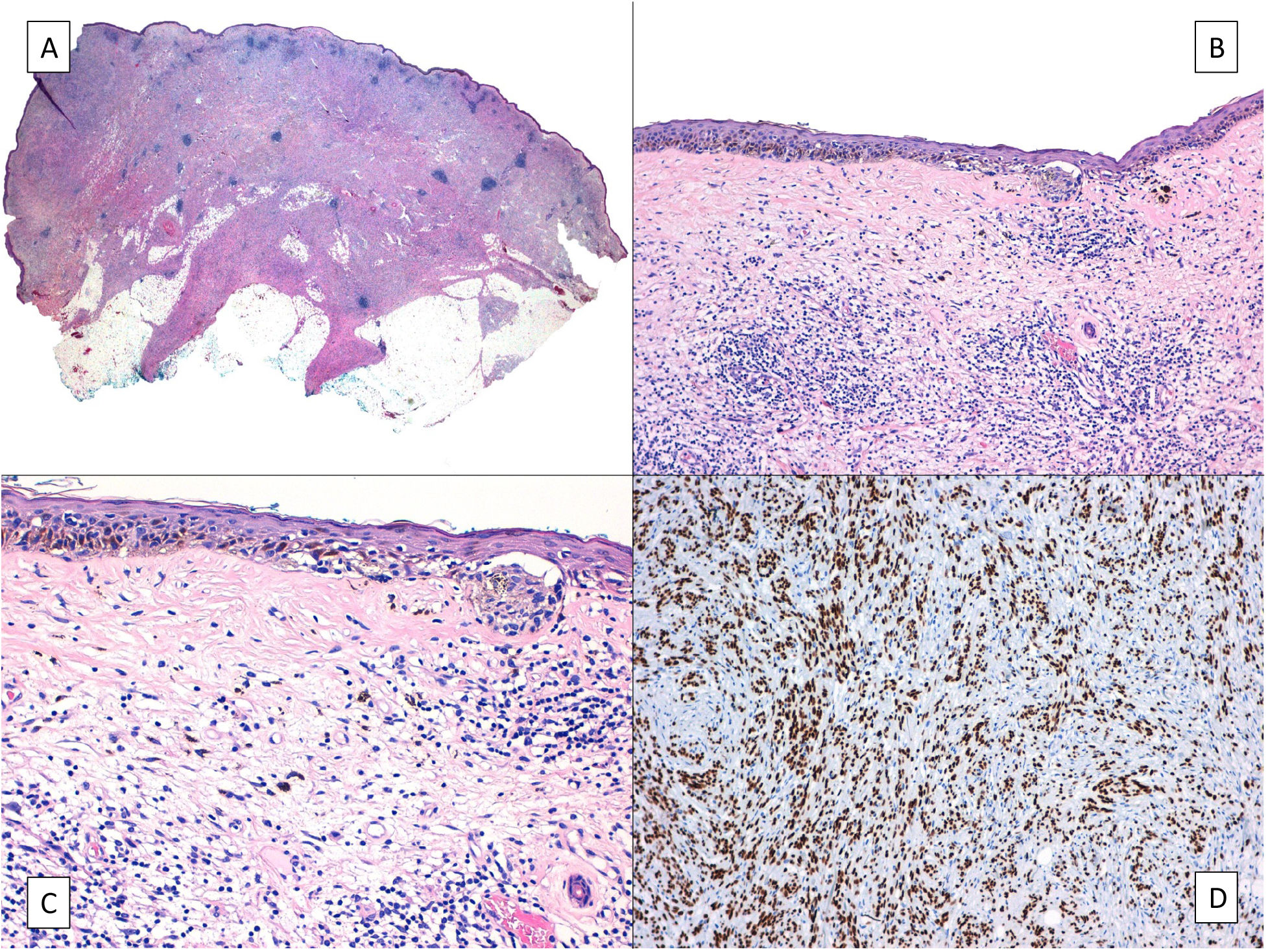
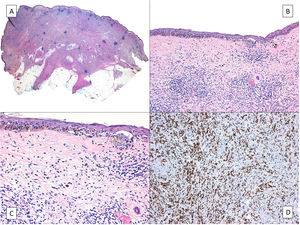
Además, aunque infrecuentemente, el LM puede ocultar un melanoma desmoplásico subyacente (fig. 3), con las consecuencias lógicas en el pronóstico y el tratamiento37. Esto justifica la necesidad de palpar la lesión antes de la biopsia, especialmente si se opta por una biopsia por afeitado.
Melanoma desmoplásico. A) Aspecto característico en la panorámica de un tumor que infiltra todo el espesor de la dermis con infiltración de la hipodermis salpicado de nódulos linfoides. B) El componente in situ del melanoma desmoplásico es idéntico a un lentigo maligno. C) Detalle del componente juntural con melanocitos apolillando las capas basales de la epidermis y un nido juntural de melanocitos atípicos a la derecha de la imagen. D) Tinción inmunohistoquímica positiva para SOX-10 en los núcleos del componente dérmico del melanoma desmoplásico.
Como norma, debido al riesgo de progresar a un melanoma invasor y su potencial compromiso vital, es fundamental tratar el LM. El LM suele suponer un reto terapéutico. Por un lado, la delimitación de los bordes de la lesión es frecuentemente muy poco clara debido a la extensión subclínica, difícil de valorar con métodos convencionales, lo que dificulta establecer el margen quirúrgico deseado o la valoración de la respuesta a los tratamientos no quirúrgicos. Por otro lado, los LM suelen asentarse en la cara, lo que unido al tamaño considerable con el que generalmente se diagnostican, hacen que el tratamiento quirúrgico pueda producir importantes repercusiones estéticas.
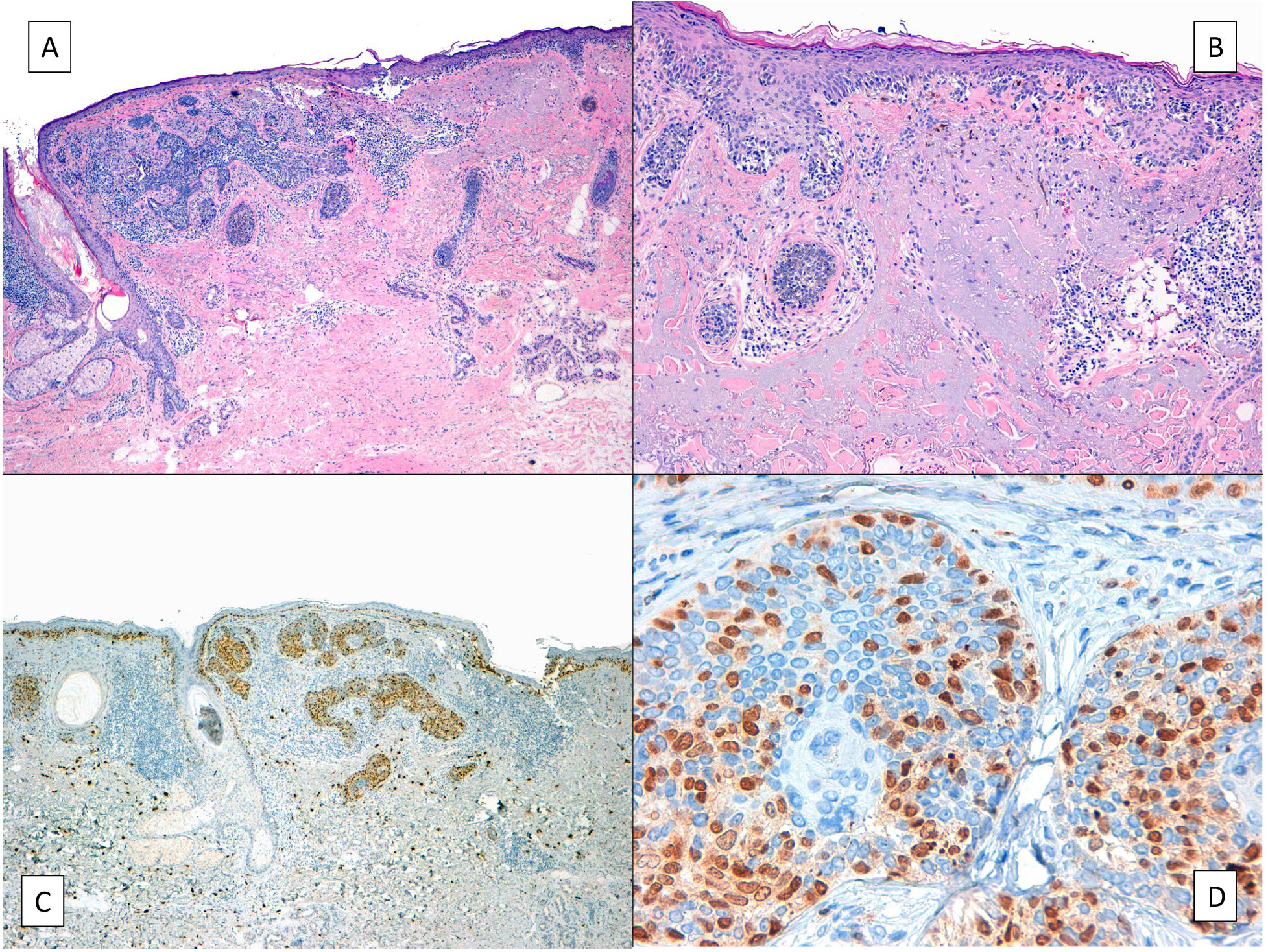
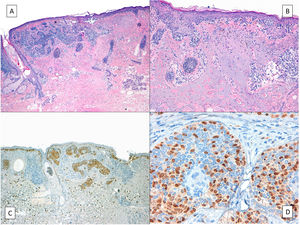
A pesar de que en una revisión sistemática se constató que no existen estudios que muestren con el máximo nivel de evidencia la eficacia de los tratamientos quirúrgicos y no quirúrgicos38, el tratamiento de elección en todas las guías es la cirugía39,40. Ello es debido, esencialmente, a que es la única técnica terapéutica que permite estudiar histológicamente toda la pieza y su menor tasa de recurrencias. La principal ventaja de disponer de toda la pieza para su estudio anatomopatológico es que permite identificar la posible presencia de un componente invasor en casos en los que una biopsia parcial diagnóstica ha informado de LM32,41. Además, el estudio de la pieza completa permite diagnosticar tumores asociados –si los hubiera– que hayan podido pasar clínicamente desapercibidos. Esto puede ocurrir, por ejemplo, con carcinomas basocelulares (fig. 4), aunque en la literatura no hay muchos casos descritos42,43. En general, se asume que en la colonización del carcinoma basocelular por el LM, si este no infiltra más allá del componente epitelial, sigue siendo in situ, del mismo modo que cuando un melanoma in situ se extiende por los anejos sigue considerándose un melanoma in situ. Sin embargo, los casos publicados de melanoma infiltrando un carcinoma basocelular son escasos y hay cierta controversia, por lo que no se puede excluir completamente el potencial metastásico de tales casos.
A) Lentigo maligno (mitad derecha de la imagen) que infiltra un carcinoma basocelular (mitad izquierda). B) Detalle del lentigo maligno con formación de nidos irregulares de melanocitos atípicos en la unión dermo-epidérmica y marcada elastosis solar. C) y D) Tinción inmunohistoquímica positiva nuclear para MITF que realza los melanocitos del lentigo maligno in situ que salpican también profusamente los islotes epiteliales del carcinoma basocelular.
La superioridad de la cirugía como el tratamiento de elección del LM está sustentada en varios metaanálisis32,40. En estos, se han comparado los diferentes tipos de tratamientos quirúrgicos y no quirúrgicos y los porcentajes de recaída local son muy superiores en los no quirúrgicos40. Así, se ha establecido que las recurrencias son de 11,5% para la radioterapia, de 24,5% para el imiquimod al 5% tópico y de 34,4% para el láser, mientras que son de 2,8% para los tratamientos quirúrgicos con un control exhaustivo de márgenes (cirugía de Mohs o cirugía por etapas)44. La dificultad para delimitar clínicamente los márgenes y la necesidad de ahorrar tejido sano para minimizar la repercusión estética hacen que, si está disponible, la cirugía con un control exhaustivo de márgenes sea la técnica quirúrgica de elección para el LM32. Si no está disponible, el margen para la cirugía convencional debe incluir al menos un centímetro20,45. Esto es así pese a que la última versión de la guía de la National Comprehensive Cancer Network (NCCN) admite como adecuada una ampliación de entre 0,5 y 1 cm de margen, aunque indica la necesidad de utilizar una cirugía con un control exhaustivo de los márgenes en el LM. Existen varios estudios con series extensas de pacientes que han demostrado que un margen de 0,5 cm es inadecuado, puesto que hay una afectación de los márgenes en al menos 14% de los casos y se obtienen unas tasas de resección completa superiores a 95% solo a partir de 0,9 cm de margen20,45.
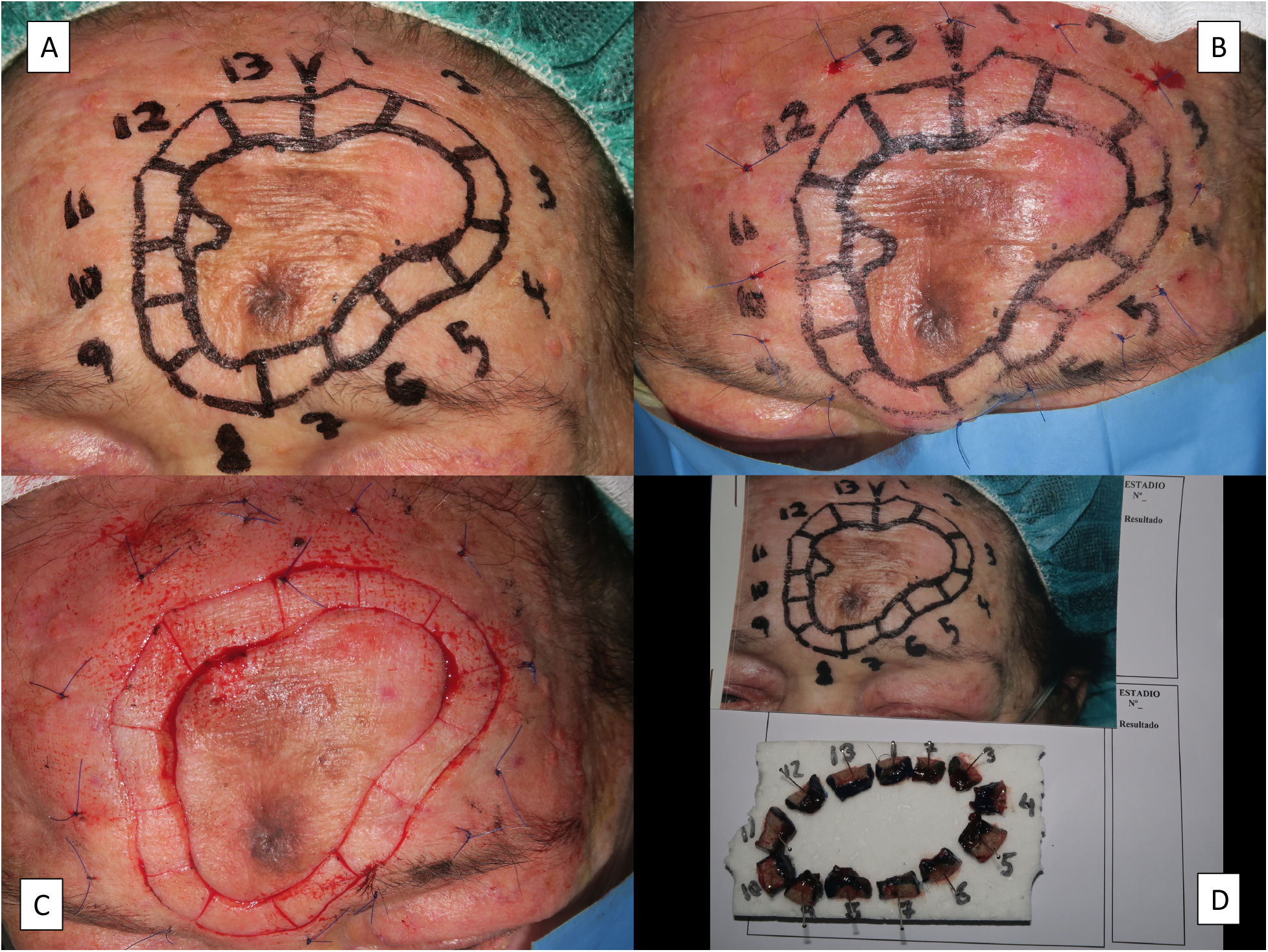
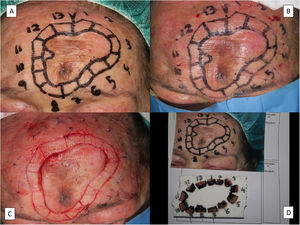
Existen diferentes técnicas quirúrgicas que evalúan todos los márgenes laterales para asegurar, en un número variable de etapas, que el LM ha sido totalmente extirpado. Existen múltiples trabajos con resultados buenos con la cirugía de Mohs en congelación. Sin embargo, el procesamiento en diferido de la pieza, con cortes permanentes fijados en formol, debe considerarse de elección para la valoración de los márgenes en cualquier lesión melanocítica46. Esta se realiza generalmente de forma modificada con un corte de 90̊ en lugar de 45̊, dado que facilita la valoración del margen lateral, que es el objetivo fundamental de la técnica para este tumor. En este procedimiento de cirugía de Mohs en diferido es habitual referenciar el lecho quirúrgico con puntos de sutura que se corresponden con las suturas que se envían con la pieza quirúrgica a analizar. La inflamación que inducen estas suturas puede dificultar la interpretación de potenciales futuros estadios de Mohs47. Es por ello por lo que, actualmente, realizamos una modificación a esta técnica colocando los puntos de referencia del lecho quirúrgico al menos a un centímetro del borde quirúrgico (fig. 5).
Técnica de la extirpación del lentigo maligno mediante cirugía de Mohs diferida. A) Marcado prequirúrgico de los límites clínicos del tumor, el margen de 5mm y diseño de los fragmentos del margen a analizar. B) Referencia de las secciones a analizar con suturas de nylon a 1cm de distancia del margen quirúrgico. C) Secciones ya realizadas y punto de sutura de referencia de la sección número uno para el procesamiento posterior. D) Secciones ya dispuestas numeradas y fijadas con alfileres a un corcho. Todos los márgenes se pintan con tinta china excepto el margen quirúrgico que es el que interesa estudiar en el Mohs diferido.
Dada la dificultad para diferenciar la piel afectada por el LM de la circundante, frecuentemente con hiperplasia melanocítica atípica, es importante el uso de la inmunohistoquímica. Las tinciones más utilizadas son el MART-1/Melan-A, MiTF y SOX-1048,49. Con las dos últimas, por su tinción nuclear selectiva de los melanocitos, se pueden identificar y cuantificar los melanocitos. Por el contrario, MART-1/Melan-A es una tinción menos específica, de modo que en las zonas con un daño actínico pronunciado puede teñir también los queratinocitos cargados de melanina. Las claves para distinguir la hiperplasia melanocítica actínica del LM son que en la primera: 1) los melanocitos se distribuyen regularmente en la capa basal de forma equidistante; 2) los melanocitos pueden afectar el infundíbulo folicular, pero no a las glándulas sebáceas ni al segmento inferior del folículo; 3) nunca hay nidos; y 4) nunca hay melanófagos. Por el contrario, la presencia de nidos de al menos tres melanocitos, la confluencia de al menos 10 melanocitos en la capa basal epidérmica, la extensión pagetoide a la mitad superior de la epidermis, la atipia melanocitaria importante (con núcleos grandes atípicos o pleomorfismo) y la extensión folicular más allá del infundíbulo, son los criterios más relevantes para definir un margen positivo. En ausencia de ellos, una densidad elevada de melanocitos también es indicativo de afectación del margen. Este último hallazgo debe considerarse en el contexto de la localización dado que la densidad de melanocitos varía según la zona anatómica, por lo que se ha propuesto la utilización de piel contralateral como control negativo50. Aunque se han descrito técnicas de inmunohistoquímica rápidas tanto para MART-1/Melan-A como MiTF para muestras procesada en congelación, es más frecuente el uso de técnicas quirúrgicas que evalúen el tejido procesado de forma convencional. Manteniendo el objetivo de evaluar los márgenes laterales de forma completa para asegurar la exéresis de toda la lesión y el centro de la pieza para descartar la presencia de componente invasor, se han propuesto dos tipos de técnicas. Con todas ellas se obtienen tasas de recidiva inferiores a 5% a cinco años. Una de ellas propone extirpar la lesión de forma completa, mapeando y referenciando los márgenes laterales para ubicar la eventual presencia de tumor en algún margen y procesando de forma independiente y simultánea el centro de la pieza51,52. La segunda consiste en la extirpación inicial de los márgenes para su mapeo y análisis, dejando la exéresis completa de la lesión para el último tiempo quirúrgico en el que se incluye la reconstrucción del defecto ocasionado, una vez obtenidos los márgenes negativos. Esta técnica ha recibido diferentes nombres en la literatura debido a mínimas diferencias en el procedimiento. El más aceptado es la técnica del espagueti53, también conocida como técnica del cuadrado de Johnson, Tübingen o Contoured54–56. Para la primera opción, dado que se deja una herida quirúrgica abierta que no debe movilizarse para la ubicación posterior de un eventual margen positivo, se pueden utilizar medidas para el control del dolor y la prevención de infecciones. Una posibilidad es el uso de coberturas biosintéticas que disminuyen tanto el dolor como la frecuencia de infecciones.
Cualquiera de las técnicas descritas puede ayudarse del uso de la luz de Wood57, la dermatoscopia58, sistemas de imagen hiperespectral59 o la microscopia confocal in vivo60–64, o con la combinación de dos de ellas, con las que se puede delimitar de una forma más precisa los márgenes y disminuir el número de etapas y el tiempo quirúrgico total.
Una vez obtenidos unos márgenes quirúrgicos negativos, el defecto debe resolverse mediante sutura directa o, si no es factible, mediante un injerto o con una cicatrización por segunda intención. Es recomendable evitar los colgajos o plastias en la medida de lo posible para facilitar la detección y el tratamiento de una potencial recaída local. En este punto conviene recordar que las recaídas del LM consisten habitualmente en recidivas locales tardías, de modo que se desarrollan entre 57 y 71 meses de media tras la cirugía según distintas series65,66. Por ello, los seguimientos postquirúrgicos del LM deben ser largos, y no terminarse a los cinco años.
Existen diferentes alternativas al tratamiento quirúrgico del LM. La decisión de optar por alguna de ellas debe tener en cuenta su eficacia, la posibilidad de progresión a LMM, el tamaño de la lesión, su localización y, fundamentalmente, las condiciones de salud del paciente. No existen unos criterios establecidos que permitan indicar en qué pacientes se debe utilizar cada una de las opciones terapéuticas disponibles, pero algunas características pueden ayudar a elegir. Así, la abstención terapéutica es una alternativa válida para pacientes con un mal estado general y una mala expectativa de vida, especialmente si el LM es de gran tamaño. Cuando la expectativa de vida es suficientemente larga, pero el estado general no es adecuado para una cirugía con las características descritas anteriormente, parece razonable realizar un tratamiento no quirúrgico de la lesión.
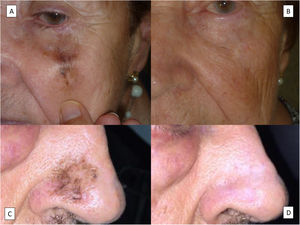
De las modalidades no quirúrgicas, la radioterapia es la que presenta una tasa de respuesta mejor y una frecuencia menor de recaídas (fig. 6A,B) y, por ello, es el tratamiento de elección para los casos en los que se descarta la cirugía67–69. Una de las grandes ventajas de la radioterapia frente a otros tratamientos no quirúrgicos es la capacidad de tratar el posible componente invasor. El tipo de radioterapia, la dosis total y el fraccionamiento varía según las series. Se han utilizado dosis de radioterapia de entre 42 y 160 Gy en 3-13 fracciones, administradas diariamente o hasta cada cuatro días70. Para la radioterapia superficial, se han utilizado dosis de entre 35 y 57 Gy en 5-23 fracciones también diariamente o hasta cada cuatro días70. Es útil extirpar el componente invasor, si se ha identificado, y cubrir entre 0,5 y 2 cm de piel perilesional71. Para la delimitación del campo de tratamiento se pueden usar las técnicas de imagen mencionadas anteriormente o incluso realizar un mapeo histológico con biopsias parciales alrededor de la lesión clínica. En el trabajo más completo publicado hasta la fecha de tratamiento con radioterapia del LM, se obtuvo una tasa de respuesta completa de 97% tras 10 años de seguimiento. Hubo solo dos recurrencias de 70 lesiones tratadas y un resultado cosmético valorado por los pacientes sin diferencias significativas respecto al resultado quirúrgico69.
La segunda modalidad terapéutica médica es el imiquimod (fig. 6C,D). Se trata de un tratamiento muy popular entre los dermatólogos por su excelente resultado cosmético y un uso del fármaco bien conocido por la larga experiencia en el tratamiento de las queratosis actínicas y los carcinomas basocelulares. Se ha establecido que la pauta más eficaz es la aplicación seis a siete días a la semana hasta completar un mínimo de 60 aplicaciones, aunque la pauta puede modificarse según la respuesta inflamatoria, al igual que se hace en las queratosis actínicas o los carcinomas basocelulares72,73. Se debería, no obstante, usar con cautela dado que se administra fuera de ficha técnica y se han descrito varios casos que progresan a un LMM durante el tratamiento. Este hecho se ha constatado en al menos 2% de los casos, teniendo en cuenta que las series descritas no tienen más de 22 meses de media de seguimiento y que, aunque la mayoría progresan durante el primer año, un caso lo hizo a los 25 meses72. Las recaídas con el tratamiento deben sospecharse ante la presencia de una pigmentación marronácea que se desarrolle durante los primeros dos años de seguimiento, especialmente cuando tiene un patrón de distribución perifolicular74. Por otra parte, se ha propuesto también su uso adyuvante o para complementar un tratamiento quirúrgico en el que la cirugía se complica y no puede obtener márgenes libres de tumor. Se ha observado una tasa de recurrencias similar en los dos escenarios que oscilan entre 6 y 9% tras 21-35 meses de seguimiento medio75.
Por último, conviene recordar que el seguimiento del LM debe ser largo, probablemente de al menos 10 años, porque muchas recidivas son tardías (> 5 años). En un trabajo reciente en el que se siguieron cien LM y LMM de < 1 mm de Breslow tratados mediante extirpación por estadios, encontraron cuatro recidivas locales desarrolladas a los 71 meses de media, por lo que consideraron que su estudio –y la mayor parte de los publicados– probablemente subestiman el índice de recurrencias del LM/LMM.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.