El desarrollo y comercialización de los sensores de glucosa y las bombas de insulina han supuesto una revolución en el control de los pacientes diabéticos. En los últimos años se han detectado múltiples casos de dermatitis de contacto relacionados con estos dispositivos médicos, con el creciente interés sobre los alérgenos responsables de la sensibilización. Isobornil acrilato fue sin duda el alérgeno principal del dispositivo FreeStyle, motivando al fabricante a modificar la composición eliminando este alérgeno. Curiosamente, este alérgeno está presente en casi todos los sensores comercializados. La colofonia y derivados del ácido abiético desempeñan un papel relevante en cuanto al adhesivo. Recientemente aparecen nuevos componentes identificados como alérgenos, no comercializadas, como el dipropilene glicol diacrilato, la N,N-dimetilacrilamida, o el metacrilato de trietilenglicol, que están siendo foco de estudio. El impacto positivo que tiene el uso de estos dispositivos puede verse mermado por la sensibilización a uno de sus ingredientes, obligando en ocasiones a abandonar el dispositivo, y por ende, restando calidad de vida. El dermatólogo debe posicionarse respecto al estudio dirigido de estos pacientes, dando soporte a los servicios de endocrinología, con la finalidad de orientar tanto el cuidado de la piel como las alternativas posibles, especialmente con la colaboración de los fabricantes.
The development and commercialization of glucose sensors and insulin pumps has revolutionized the management of diabetes. These devices have been linked to multiple cases of contact dermatitis in recent years, however, giving rise to a growing interest in identifying the sensitizing allergens. Isobornyl acrylate was clearly identified as one of the main allergens responsible for contact dermatitis among users of the FreeStyle glucose sensor and was subsequently removed from the product ingredients. Remarkably, however, it is still used in most other sensors on the market. The common adhesive ingredients colophony and abietic acid derivatives have also been shown to be sensitizing agents. New components under study, such as dipropylene glycol diacrylate, N,N-dimethylacrylamide, and triethylene glycol methacrylate have recently been identified as allergens, though they are not commercially available for clinical testing. The benefits offered by glucose sensors and insulin pumps may be offset by sensitization to product ingredients, in some cases forcing discontinuation and diminishing quality of life. Dermatologists should play a role in this clinical and research scenario, offering case-by-case guidance to endocrinologists on skin care and possible alternatives for patients with glucose sensors and insulin pumps who develop contact dermatitis. They should also collaborate with the manufacturers developing these devices.
La diabetes mellitus (DM) es una enfermedad crónica donde la hiperglucemia mantenida asocia un impacto negativo en múltiples órganos, principalmente el sistema nervioso y vascular. En 2019, según los datos de la Organización Mundial de la Salud, 1,5 millones de defunciones fueron por la DM, y casi la mitad de ellas antes de los 70 años de edad. Después del desarrollo de la insulina y los hipoglucemiantes orales, aparecen los sensores de glucosa y las bombas de insulina, cambiando por completo la situación del paciente diabético tipo 1. Aunque están sujetos al reglamento 2017/745 (UE) del parlamento europeo y consejo para la fabricación de dispositivos médicos, en los últimos años se han publicado numerosos casos de dermatitis de contacto alérgica a distintos alérgenos. Esta situación justifica el conocimiento y actualización por parte del dermatólogo, se dedique o no a la dermatitis de contacto.
La incidencia de la DM sigue aumentando en Europa, en 2015 se estimó un incremento del 5% en DM tipo 1 y del 8,8% de la DM tipo 2. Concretamente en España, la prevalencia de la diabetes ha alcanzado el 14,8%1. El diagnóstico precoz y el seguimiento periódico de los pacientes son esenciales para evitar complicaciones, como la hipoglucemia y la cetoacidosis diabética. Actualmente existen dispositivos médicos diseñados para facilitar el seguimiento y manejo de la diabetes, evitando complicaciones de la enfermedad1,2. Entre ellos, destacan los denominados sistemas de monitorización continua de glucosa o sensores de glucosa y sistemas de infusión continua subcutánea de insulina o bombas de insulina1,2. En España, en el momento actual están financiados por el Sistema Nacional de Salud solo algunos modelos, en determinadas comunidades autónomas y en algunos grupos de riesgo1.
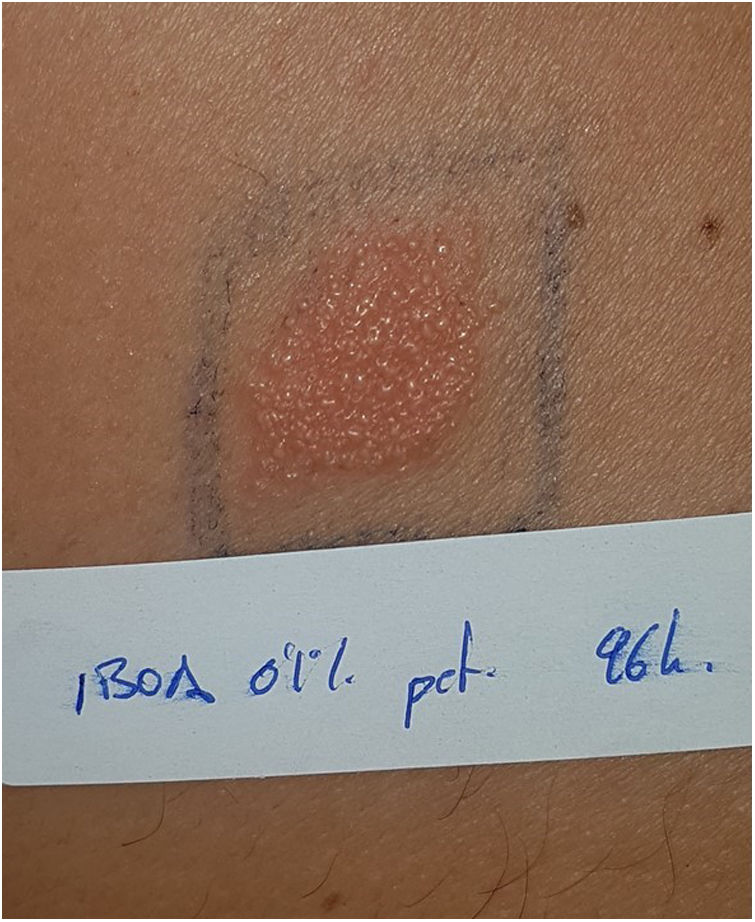
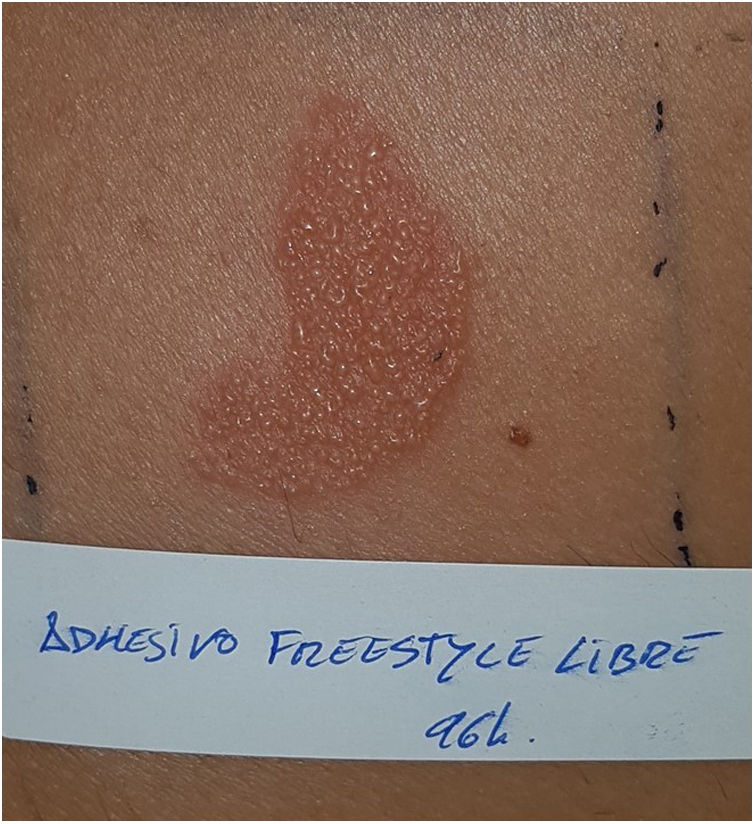
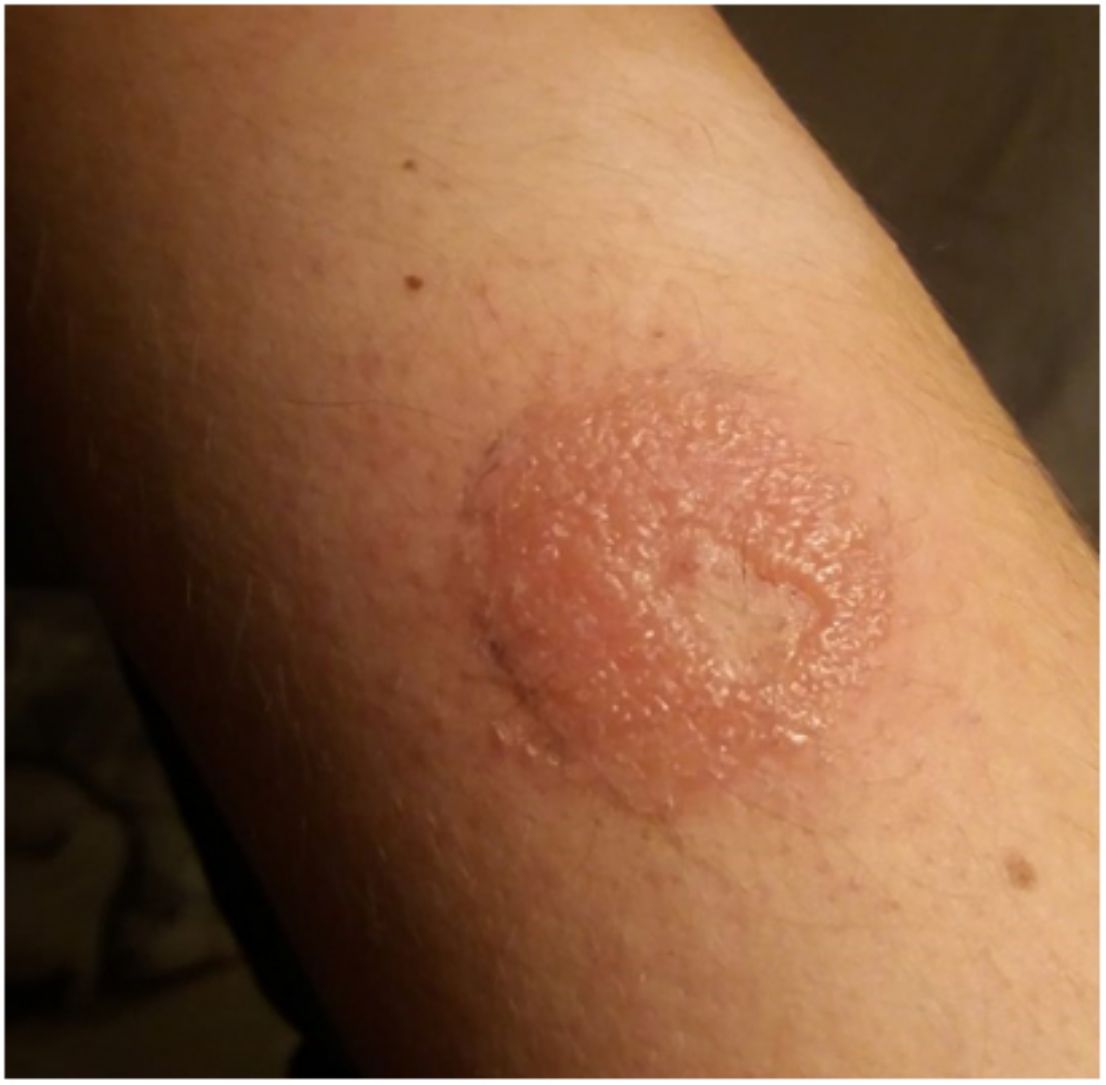
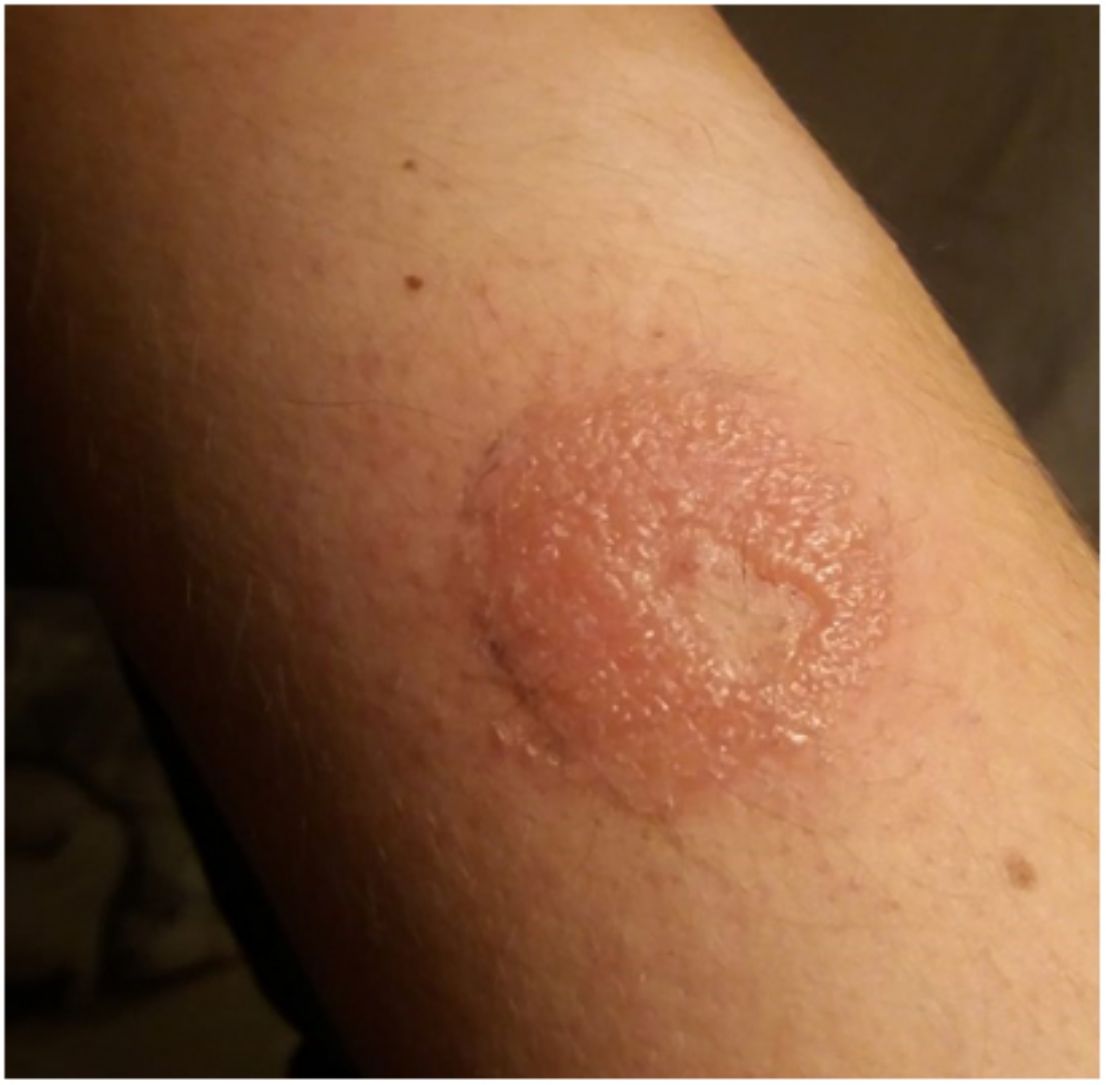
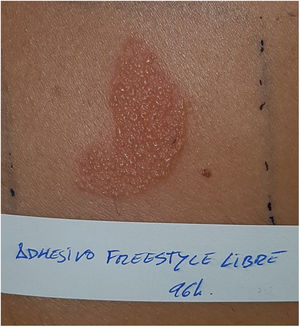
Sistemas de monitorización continua de glucosaFreeStyle Libre®FreeStyle Libre® (Abbot Laboratories) fue el primer sensor de glucosa comercializado. Este dispositivo médico, que se aplica con un adhesivo sobre la piel durante un máximo de 14 días, mide de forma continua los niveles de glucosa1,3. Poco tiempo después de su lanzamiento al mercado se notificaron reacciones cutáneas al dispositivo compatibles con cuadros de dermatitis alérgica de contacto (DAC). Estudios posteriores confirmaron el isobornil acrilato (IBOA; n.o CAS 5888-33-5) como principal alérgeno relevante (fig. 1) y causante de la DAC asociado al FreeStyle Libre®3,4. Hay estudios que estiman que un 5,5% de los pacientes que portan FreeStyle Libre® presentan DAC, y el 3,8% la presentaron debido a IBOA5. Para su diagnóstico, es necesario realizar la prueba del parche con el propio adhesivo (fig. 2) y con IBOA en vaselina a una concentración del 0,1%, siendo la reactividad cruzada escasa o nula con otros acrilatos1,6,7. La principal opción terapéutica es evitar el alérgeno, es decir, cambiar a otro sistema de medición de glucosa continua. Algunos autores sugieren reemplazar el sensor de glucosa en sangre por Eversense® (Ascensia) o Dexcom® (Medtronic) para eliminar las reacciones cutáneas2,6. Sin embargo, el uso de estos dispositivos no nos asegura eliminar el riesgo de desarrollar dermatitis de contacto ya que también contienen alérgenos potencialmente sensibilizantes7. Existen comercializados otras variantes de FreeStyle® como es FreeStyle Navigator® I y II, los cuales también contienen IBOA entre sus componentes.
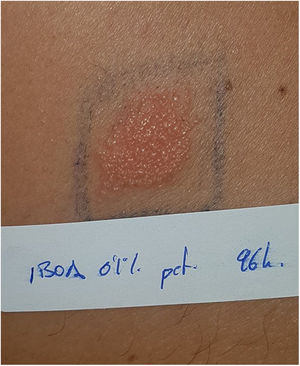
Reacción positiva a las 96h al adhesivo del sensor FreeStyle Libre® (mismo paciente de la figura 1).
Análisis posteriores mediante cromatografía de gases-espectrometría de masas (GC-MS) han indicado la presencia de N,N-dimetilacrilamida (DMAA; n.o CAS 2680-03-7) en el sensor FreeStyle Libre®, considerándose el segundo alérgeno relacionado con la dermatitis de contacto a este dispositivo8,9.
Es probable que el IBOA y el DMAA encontrados en el sensor FreeStyle Libre® procedan de un adhesivo utilizado para unir la parte superior e inferior de la cubierta de plástico del sensor. El alto grado de reacciones concomitantes a DMAA e IBOA se explica probablemente por una exposición simultánea a estas sustancias al utilizar el sensor FreeStyle Libre®8. Debido a las diferencias estructurales, las reacciones cruzadas entre IBOA y DMAA parecen improbables8. Según un artículo multicéntrico publicado recientemente, la frecuencia de sensibilización a IBOA y DMAA en España es menor que en otras series europeas10. Además, no podemos descartar la posibilidad de que otros sensibilizantes desconocidos hasta ahora también podrían desempeñar un papel importante. Dado que tanto el IBOA como el DMAA son componentes de adhesivos utilizados para dispositivos médicos, como sensores de glucosa y bombas de insulina, deben realizarse pruebas de parche cuando se sospechen DAC a dispositivos médicos10.
Hay casos publicados que describen que pacientes alérgicos al Freestyle Libre® también reaccionaron positivamente a la mezcla de lactona sesquiterpénica, que contiene concentraciones equimolares de alantolactona (0,033%; n.o CAS 546-43-0), costunolida (0,033%; n.o CAS 553-21-9) y lactona dehidrocostus (0,033%; n.o CAS 477-43-0)9,11,12. La presencia de los 3 componentes en el sensor de glucosa no pudo demostrarse con el análisis de GC-MS11. A pesar de que sus grupos funcionales químicos son muy similares, parece poco probable que se produzcan reacciones cruzadas entre la lactona sesquiterpénica y el IBOA, debido a sus diferentes estructuras espaciales1,11. Por lo tanto, en la actualidad, la cosensibilización, más que la reactividad cruzada, sigue siendo la explicación más probable debido a que IBOA y la lactona sesquiterpénica tienen un precursor común, el canfeno9.
FreeStyle Libre 2®En 2019, se realizó un cambio en el proceso de fabricación del Freestyle Libre® que parecía eliminar el IBOA del plástico de la carcasa del sensor. Esta segunda generación se denomina Freestyle Libre 2® 13. A pesar de que se observó que los pacientes con una DAC conocida al IBOA podían tolerar Freestyle Libre 2®, se siguieron notificando casos de DAC13. Posteriormente, se detectó un nuevo alérgeno, el 2,6-Di-tert-butil-4-cresol (n.o CAS 128-37-0) que forma parte del nuevo adhesivo y que no contenía el Freestyle Libre® original13. Esta sustancia química actúa como antioxidante en alimentos, productos derivados del petróleo, caucho, plásticos y cosméticos. Se han descrito reacciones alérgicas al 2,6-Di-tert-butil-4-cresol tras el uso de medicamentos y cosméticos. A pesar del uso generalizado del 2,6-Di-tert-butil-4-cresol, se consideraba un antioxidante seguro en las concentraciones normalmente utilizadas. Sin embargo, hay que tener en cuenta que los dispositivos permanecen en la piel de los pacientes con diabetes durante varios días e incluso semanas, lo que provoca un contacto más intenso de lo habitual1,2,14. Por lo tanto, aumenta la probabilidad de desarrollar una alergia de contacto. En 2022, la FDA aprobó una nueva versión del FreeStyle Libre®, conocido como FreeStyle Libre 3®, del cual aún no existen casos reportados de dermatitis de contacto y del que desconocemos su composición.
Dexcom G4 / G5 MobileExisten casos descritos de DAC asociados al sensor de glucosa Dexcom G4® Platinium / G5 Mobile. Entre los componentes de estos sistemas de monitorización continua de glucosa se encuentran los adhesivos a base de cianoacrilato15. En 2016, se publicó el primer caso de un niño que desarrolló DAC a un Dexcom G4®16. Las pruebas epicutáneas revelaron una reacción positiva al hidroxicianoacrilato. En trabajos posteriores, se notificaron 2 casos en los que la DAC fue causada por el 2-etil cianoacrilato (n.o CAS: 7085-85-0) considerándose como el principal alérgeno causante de DAC asociado al Dexcom G4® Platinium/G5 Mobile16. El 2-etil cianoacrilato se utiliza como adhesivo del sensor, el cual es ampliamente utilizado como adhesivo doméstico e industrial y se encuentra en cosméticos para uñas, en pegamentos para fijar uñas artificiales o en productos de restauración dental. Los pacientes, principalmente, se sensibilizan por la exposición prolongada; sin embargo, la exposición a los acrílicos contenidos en las uñas de gel, los esmaltes y los pegamentos también pueden desencadenar estas reacciones cutáneas17. Por el contrario, se ha informado de que la carcasa del Dexcom G4® Platinium / G5 Mobile y su adhesivo no contienen IBOA y son bien tolerados por los pacientes alérgicos al Freestyle Libre® por este alérgeno15.
Dexcom G6®Desde 2020, se han publicado casos DAC grave por el sensor de glucosa Dexcom G6®, la nueva versión de Dexcom que elimina el 2-etil cianoacrilato de su composición18. Sin embargo, se han notificado nuevos alérgenos causantes de DAC, entre los que se encuentran el monoacrilato de 2,20-metilenobis (6-terc-butil-4-metilfenol; n.o CAS 128-37-0), IBOA y derivados de la colofonia18–20.
El monoacrilato de 2,20-metilenobis es un estabilizador térmico y un antioxidante utilizado en una amplia gama de materiales adhesivos y plásticos18. A diferencia de los estabilizantes y antioxidantes tradicionales, esta sustancia es un eficaz eliminador de radicales alquílicos. Esta propiedad es especialmente útil en procesos a altas temperaturas y en entornos con poco oxígeno, como durante la mezcla inicial de adhesivos. Se recomienda realizar la prueba del parche con una concentración al 1,5% para establecer el diagnóstico18.
En 2022, se comercializó la última versión denominada Dexcom G7®. Se trata de un dispositivo desechable de un solo uso que presenta un tamaño más pequeño que los sistemas anteriores de sexta, quinta y cuarta generación (G6, G5 y G4)21. El sistema G7 también difiere de estos sistemas anteriores en que el transmisor y el sensor se suministran como una unidad integrada20. Dada su reciente comercialización, no hay casos descritos de DAC asociada a su uso, desconociéndose si se han realizado cambios en cuanto a sus componentes.
Enlite/Guargian connect sensorEl sensor de glucosa Enlite® es un dispositivo médico desarrollado como sistema de monitorización continua de la glucosa para pacientes diabéticos. Se compone del catéter asociado a la película adhesiva que se adhiere a la piel22. El Guardian Connect (Medtronic)®, reutilizable y recargable, se conecta al sensor de glucosa Enlite® y envía los datos al lector (a menudo un teléfono móvil). Passanisi et al. describieron una DAC del sensor de glucosa Enlite causada por derivados de la colofonia, cuya presencia fue confirmada por el fabricante23. Al igual que en el sensor de glucosa FreeStyle Libre® y en la bomba de insulina OmniPod®, en el sensor de glucosa Enlite® también se encuentra IBOA23. Hay estudios publicados que demuestran la presencia de IBOA en los extractos de los sensores Enlite® pero no en los extractos de los parches adhesivos, sin embargo, es probable que también haya pequeñas cantidades de IBOA en estos23. Además, en los extractos del sensor Enlite había indicios de la presencia de DMAA, al igual que el FreeStyle Libre®, y hidroxiciclohexilfenilcetona.
MicroagujasUno de los componentes más importantes de los dispositivos de monitorización continua de glucosa son las microagujas (MA). Su composición debe tenerse en cuenta en los pacientes que presenten DAC. El metal es el material más común para la preparación de las MA debido a su facilidad de fabricación24. Entre ellos destacan el acero inoxidable y el titanio por su resistencia. Además, algunos metales nobles como el oro y la plata se suelen aplicar en MA para mejorar el rendimiento del sensor24,25. El silicio es otro de los materiales más utilizados que destaca por su excelente resistencia mecánica, sin embargo, el precio de su fabricación es un factor clave que limita su uso24. En los últimos años las MA de polímero han centrado mucho interés, ya que son biocompatibles, biodegradables, mecánicamente resistentes para la inserción cutánea y fáciles de fabricar24. Se ha descrito una amplia variedad de polímeros para la preparación de MA, como el poli metacrilato de metilo, el poliácido láctico-co-glicólico, el ácido poliglicólico, el copolímero de olefina cíclica, el poli vinilpirrolidona, el polialcohol vinílico, el ácido hialurónico metacrilato y el SU-824.
Bombas de insulinaLas bombas de insulina son sistemas que permiten una administración continua y controlada de insulina. Habitualmente, constan de un reservorio conectado a una cánula o aguja que se fija con adhesivos a la piel, y su recambio se lleva a cabo cada 2 o 3 días para evitar principalmente las complicaciones por obstrucción al flujo de insulina, pero también otras como la DAC que, debido al recambio frecuente, así como a la posibilidad de alternar su localización, suele tener menor relevancia clínica1,26. Por esto mismo, es posible que la prevalencia real de DAC se encuentre infraestimada, confundiéndose con dermatitis irritativas por el plástico de los componentes y reforzando la importancia de realizar las pruebas del parche ante la sospecha clínica27.
Auto siringe®Diseñada en 1976, disponía de un tubo de plástico que conectaba con la aguja. Como pegamento para unir ambos componentes, se utilizaban resinas epoxi lo que llevó a la aparición de casos de DAC desde un día después de su implantación que se describen en reportes ya en la década de los 80, algunos asociados sensibilizaciones concomitantes frente a resina de formaldehído de p-terc-butilfenol (n.o CAS: 98-54-4) y fragancias28.
Cliniset, Clini Softs, Set per microinfusione®Poco después de la anterior, empezaron a describirse casos de DAC en otra serie de bombas de insulina producidas por Pharmaplast en Dinamarca. Concretamente, se detectaron positividades relevantes frente a IBOA, y múltiples acrilatos incluso a diluciones de 0,001% en el caso del fenoxipoli(etilenoxi)etilacrilato (n.o CAS 92-50-2)29–31. De nuevo, los casos descritos estaban mayormente en relación con los pegamentos y adhesivos utilizados, aunque también con el catéter de plástico en el caso del acrilato de metilo y la g-butirolactona32. La presencia de estos compuestos se verificó mediante GC-MS 33.
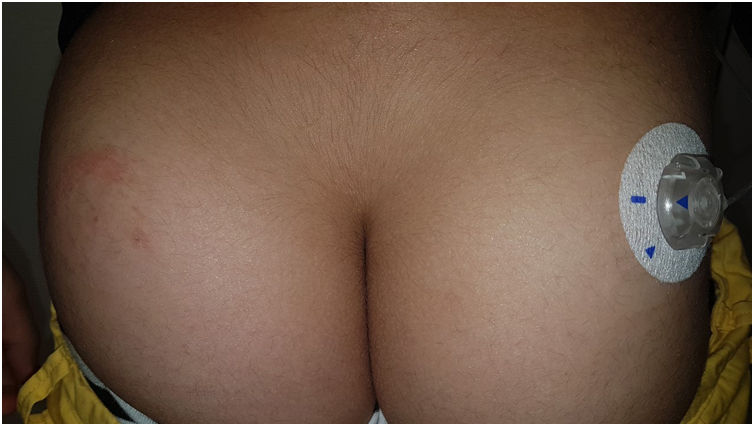
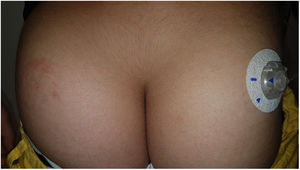
OmniPod (Ypsomed)®La primera bomba con parche de insulina que se introdujo en el mercado europeo en 2010 fue OmniPod (Ypsomed)®. El primer alérgeno relacionado con su desarrollo fue el IBOA, más en relación con la unión de las distintas piezas entre sí, mecanismo que se realiza con ayuda de calor, que con su adhesión a la piel34. Adicionalmente, una paciente fue positiva para níquel, dicromato potásico y colofonia23, y otra, que había utilizado previamente esmaltes permanentes, fue positiva a otros alérgenos incluidos otros 3 acrilatos (hidroxietilacrilato, etilacrilato, hidroxietilmetacrilato) habitualmente presentes en los esmaltes3536. En un reciente estudio observacional la colofonia ha vuelto a reportarse como uno de los principales alérgenos a considerar en estos dispositivos (fig. 3), especialmente si se usaba concomitantemente Enlite®37.
Paradigm MiniMed Quick-set®En los últimos años se han desarrollado nuevas bombas de insulina como Paradigm MiniMed Quick-set® del que recientemente se han publicado varios casos de DAC relacionados con su uso. Los 2 primeros pacientes habían utilizado el sensor FreeStyle Libre® y fueron positivos de forma relevante a IBOA que se detectó en el propio dispositivo, hecho que ha sido corroborado por otros autores38.
Medtrum A6 TouchCare®Se trata de una bomba reservorio comercializado recientemente y que se adhiere a la piel directamente, careciendo de catéter para conectar con la aguja. En 2020, se reportó el primer caso de dermatitis alérgica en una mujer diabética de tipo 1 que mostró reactividad al parche adhesivo, y de forma desglosada, al IBOA 0,3%, hydroabietyl alcohol, resina Myroxylon pereirae, mezcla de fragancias, extracto de acetona 1%. La GC-MS evidenció también la presencia de otros compuestos incluidos derivados del colofonio que fueron también confirmados por el fabricante39.
Alérgenos no incluidos en los sensores o bombasA la hora de estudiar a pacientes con dispositivos de medición continua de glucosa o con bombas de insulina no solo debemos tener en cuenta los componentes de los dispositivos, sino que hay que tener en cuenta otros posibles causantes de DAC y que son frecuentemente utilizados por estos pacientes como es la clorhexidina, betadine, antibióticos tópicos, metales, conservantes, fragancias o acrilatos de los esmaltes. Sin embargo, es difícil determinar la posible asociación entre estos alérgenos y la exposición a los sensores de glucosa o bombas de insulina ya que los pacientes no suelen tener clara la relación, presente o pasada, con estas alergias de contacto identificadas.
Por otro lado, es frecuente que los pacientes utilicen toallitas adhesivas para impedir la caída de los sensores de glucosa. Entre los componentes de algunas de estas toallitas adhesivas como Skin Tac Wipe® encontramos posibles alérgenos como isopropanol y colofonia; o en el caso de Conveen Prep® en cuya composición encontramos alcohol isopropílico, éster butílico de copolímero PVM/MA e isobutirato de acetato de sacarosa.
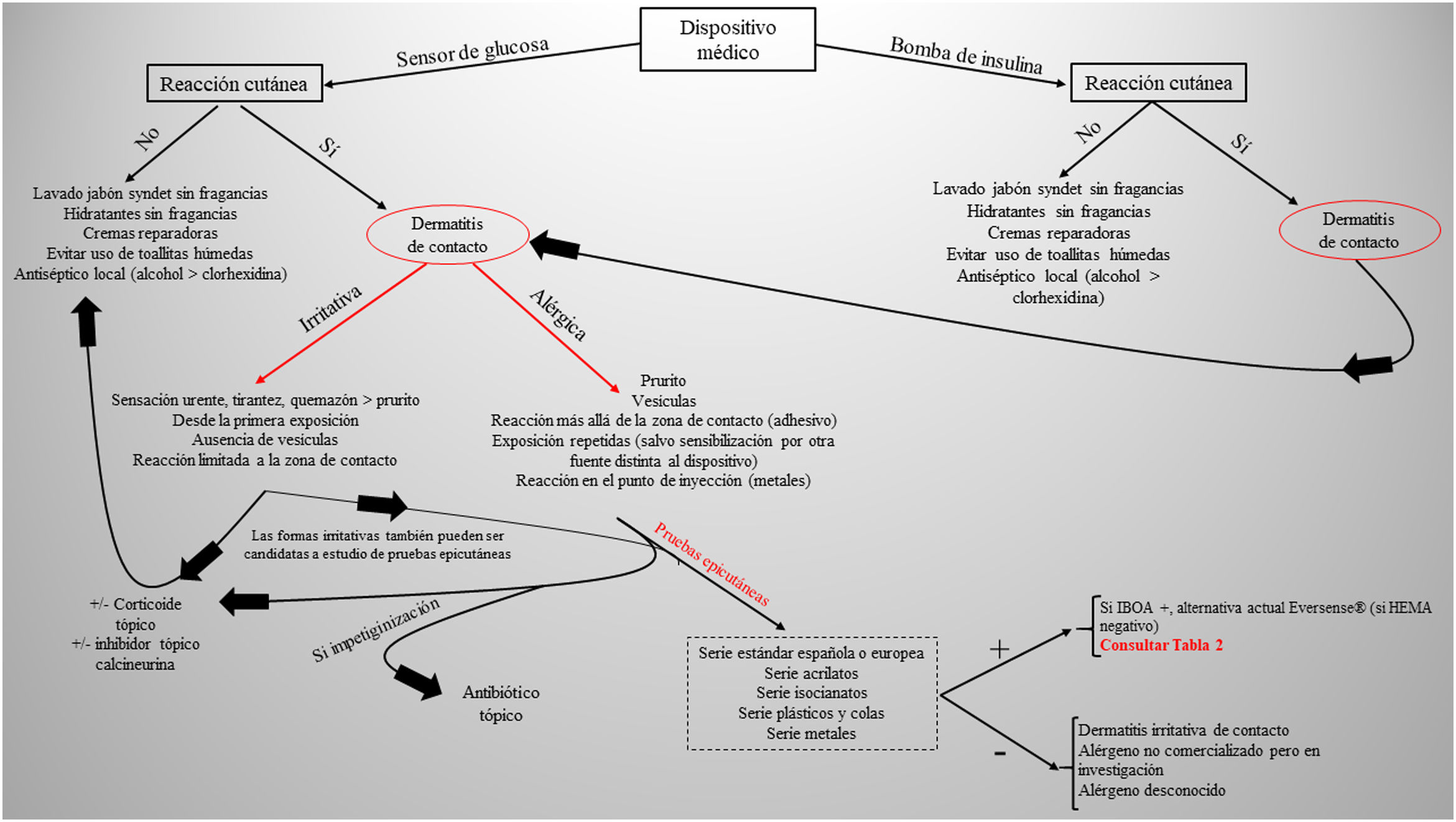
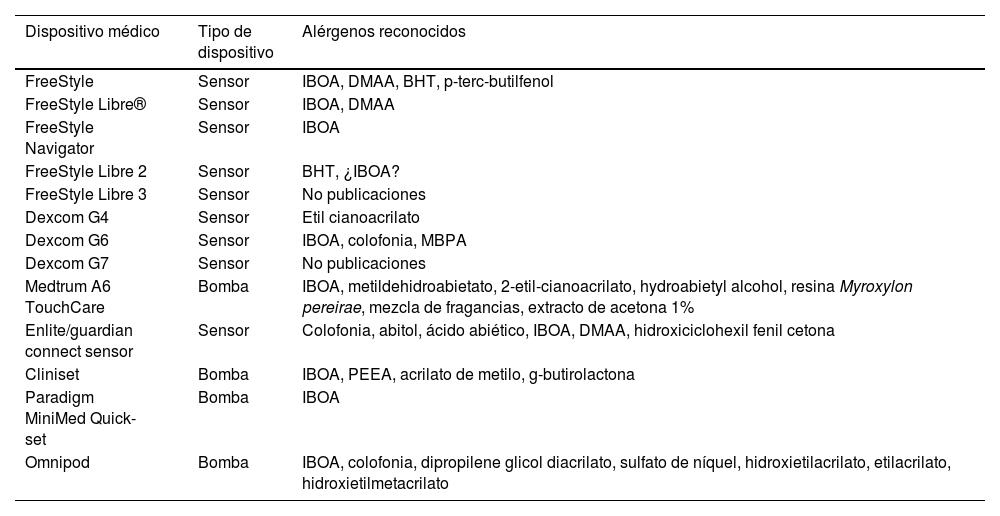
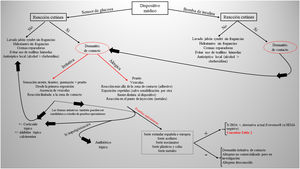
Situación actual y reflexionesEl uso de sensores de glucosa y las bombas de insulina va a crecer exponencialmente con su nueva indicación, la DM tipo 2, que además representa el 95% de los pacientes diabéticos. Evidentemente tendrá un impacto positivo en la calidad de vida de estos pacientes y disminuirá las complicaciones asociadas a esta enfermedad por un mejor control de la glucemia, pero también aumentará la incidencia de nuevos casos de dermatitis de contacto. Actualmente desconocemos la prevalencia de la DAC a estos dispositivos médicos en nuestro país, de igual forma que desconocemos todos los alérgenos implicados. La colaboración y transparencia de los fabricantes respecto a la composición de cada sensor es clave para facilitar el estudio de pruebas epicutáneas. Posiblemente nos encontramos en un punto de inflexión donde la creación de baterías específicas para el estudio de reacciones a los sensores de glucosa puede ser interesante (incluyendo los alérgenos reflejados en la tabla 1), homogeneizar el método con los mismos alérgenos facilitará conocer realmente el impacto de cada uno de ellos en nuestros pacientes. Sin embargo, esto actualmente es prácticamente imposible dado que la mayoría de los alérgenos implicados hasta la fecha no están comercializados (en la tabla 2 se incluyen aquellos publicados hasta la fecha). La decisión de retirar o cambiar el dispositivo en cada paciente será individualizada, aunque con potenciales limitaciones actuales por desconocer la composición exacta de cada dispositivo. Recientemente se ha publicado la presencia de IBOA en uno sensor de glucosa que no había informado de contener dicho alérgeno. Es obvio que nos encontramos en un momento importante, y a la vez delicado, donde el papel del dermatólogo, dedicado o no a la dermatitis de contacto, participará de forma activa en la toma de decisiones respecto a qué hacer en cada caso (fig. 4).
Alérgenos recomendados por los autores para incluir en la batería de dispositivos médicos (sensores de glucosa y bombas de insulina) de los pacientes diabéticos con dermatitis de contacto
| 1. Serie estándar (incluye colofonia, lactona sesquiterpénica mix)2. Serie metales3. Serie acrilatos (incluido isobornil acrilato)4. Hidroabietil alcohol5. Metil dehidroabietato (no comercializado)6. Isocianatos (batería específica)7. Peróxido benzoilo8. N,N-dimetilacrilamida (no comercializado)9. Hidroquinona y derivados (si leucoderma)10. 2-etil-cianoacrilato11. 2,6-di-tert-butil-4-cresol (BHT)12. Hydroxietil metacrilato (no comercializado)13. Metacrilato de trietilenglicol (no comercializado)14. N,N-dimetilacrilamida (no comercializado) |
Dispositivos comercializados y alérgenos reconocidos/publicados en la literatura
| Dispositivo médico | Tipo de dispositivo | Alérgenos reconocidos |
|---|---|---|
| FreeStyle | Sensor | IBOA, DMAA, BHT, p-terc-butilfenol |
| FreeStyle Libre® | Sensor | IBOA, DMAA |
| FreeStyle Navigator | Sensor | IBOA |
| FreeStyle Libre 2 | Sensor | BHT, ¿IBOA? |
| FreeStyle Libre 3 | Sensor | No publicaciones |
| Dexcom G4 | Sensor | Etil cianoacrilato |
| Dexcom G6 | Sensor | IBOA, colofonia, MBPA |
| Dexcom G7 | Sensor | No publicaciones |
| Medtrum A6 TouchCare | Bomba | IBOA, metildehidroabietato, 2-etil-cianoacrilato, hydroabietyl alcohol, resina Myroxylon pereirae, mezcla de fragancias, extracto de acetona 1% |
| Enlite/guardian connect sensor | Sensor | Colofonia, abitol, ácido abiético, IBOA, DMAA, hidroxiciclohexil fenil cetona |
| Cliniset | Bomba | IBOA, PEEA, acrilato de metilo, g-butirolactona |
| Paradigm MiniMed Quick-set | Bomba | IBOA |
| Omnipod | Bomba | IBOA, colofonia, dipropilene glicol diacrilato, sulfato de níquel, hidroxietilacrilato, etilacrilato, hidroxietilmetacrilato |
BHT: 2,6-Di-tert-butil-4-cresol; DMAA: N, N-dimetilacrilamida; IBOA: isobornil acrilato; MBPA: 2,2’-metilenebis(6-tert-butil-4-metilfenol) monoacrilato; PEEA: fenoxipoli(etilenoxi)etilacrilato.
La dermatitis de contacto a dispositivos médicos para diabéticos ha cobrado especial interés en los últimos años. La nueva indicación aumentará su uso, por lo que sospechamos una incidencia al alza que obligará a estar familiarizados con este tema para ofrecer el estudio y posterior recomendación de la forma más acertada y actualizada posible.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.