El liquen escleroso (LiE) es una enfermedad crónica escleroatrófica que afectará generalmente el área anogenital y ocasionalmente a localizaciones extragenitales. Las células dendríticas dérmicas CD34 positivas (DDC) contribuyen al mantenimiento de la microarquitectura dérmica y a la modulación de la respuesta inmunitaria. El p53 es un gen supresor de tumores importante para la regulación del ciclo celular y de la apoptosis. De manera similar a lo que ocurre en la morfea (una condición escleroatrófica estrechamente relacionada con el LiE), la esclerosis dérmica, las alteraciones de las DDC y de la microvasculatura dérmica pueden ser mecanismos patogénicos subyacentes importantes en el LiE.
ObjetivosExaminar el perfil de las DDC positivas para el CD34, la densidad de microvasos (MVD) y la proteína p53 en el LiE.
Materiales y métodosSe evaluaron los perfiles inmunohistológicos de las DDC, de la MVD y del p53 en 19 casos de LiE y en la piel normal de pacientes emparejados por edad y sexo (10 muestras), utilizando los anticuerpos contra el CD34 y el p53.
ResultadosHubo una marcada disminución de los recuentos (1,7±0,5/mm2) o pérdida completa de DDC CD34+en el LiE en comparación con su elevada expresión en la piel normal (23,4±2,1/mm2, p =0,000). La MVD estaba notablemente aumentada en las lesiones de LiE (20±0,47) en comparación con la de la piel normal (5,50±0,20, p =0,000). Se observó una tinción nuclear discontinua, de células aisladas, débilmente positiva para el p53, localizada en los queratinocitos de las capas basales epidérmicas de la piel sana y de la piel afectada por el LiE.
ConclusionesHasta donde tenemos conocimiento, este es el primer estudio que analiza los perfiles de las DDC, de la MVD y del p53 de manera simultánea en el LiE. Los hallazgos sugirieron que las alteraciones de las DDC y de la MVD tienen papeles en la patogénesis del LiE.
Lichen sclerosus (LiS) is a chronic scleroatrophic condition that usually affects the anogenital area and occasionally the extragenital sites. CD34-positive dermal dendritic cells (DDCs) contribute to the maintenance of the dermal microarchitecture and modulation of the immune response. p53 is a tumor suppressor gene important for the regulation of the cell cycle and apoptosis. Similar to morphea (a LiS-closely related scleroatrophic condition), dermal sclerosis, alterations of DDCs, and dermal microvasculature may be important underlying pathogenetic mechanisms in LiS.
ObjectivesTo examine the profile of CD34-positive DDCs, microvessel density (MVD), and p53 protein in LiS.
Materials and methodsThe immunohistological profiles of DDCs, MVD, and p53 were examined in 19 cases of LiS and their age- and sex-matched normal skin (10 specimens), using antibodies against CD34 and p53.
ResultsThere was a markedly decreased counts (1.7±0.5/mm2) or complete loss of CD34-positive DDCs in LiS against their abundance in the normal skin (23.4±2.1/mm2, p=0.000). MVD was markedly increased in LiS lesions (20±0.47) as compared to normal skin (5.50±0.20, p=0.000). Discontinuous single-cell p53 weakly positive nuclear staining was seen in the epidermal basal cell keratinocytes in normal skin and LiS lesions.
ConclusionsTo the best of this author's knowledge, this is the first study analyzing DDCs, MVD, and p53 profiles together in LiS. The findings suggest that alterations of DDCs and MVD have roles in the pathogenesis of LiS.
El liquen escleroso (LiE) es una enfermedad inflamatoria escleroatrófica crónica de etiología desconocida. Afectará tanto al área anogenital como a la vulva (LiE vulvar), los genitales masculinos (LiE de los genitales masculinos o balanitis xerótica obliterante) y ocasionalmente a algunos sitios extragenitales, como son las nalgas, la cara interna del muslo y el área submamaria (LiE extragenital). El LiE de los genitales masculinos suele afectar al glande, al prepucio, a la uretra anterior y al meato, por lo general de los varones no circuncidados, lo que provocará una fimosis y estenosis del meato1. El carcinoma de células escamosas es la neoplasia maligna más común de la vulva. Dentro de las lesiones precursoras se incluyen los tipos habituales y diferenciados de neoplasia intraepitelial vulvar (VIN). La VIN diferenciada se asocia con dermatosis crónicas como el LiE y puede progresar a carcinoma de células escamosas invasivo. El ADN del virus del papiloma humano (VPH) estará ausente en estas lesiones. El tipo habitual de afectación del VIN se asocia con una infección por VPH de alto riesgo2.
En 1984, se descubrió por primera vez el antígeno CD34 en células madre y progenitoras hematopoyéticas. Es una fosfoglucoproteína transmembrana que se conforma de un dominio extracelular glicosilado unido a «O», intensamente sialilado, una hélice transmembrana única y de una cola citoplasmática. Las células dendríticas (DC) son células presentadoras de antígenos profesionales. En la piel, se encontrarán DC dérmicas (DDC) CD34 positivas en la dermis. El CD34 también se expresa en progenitores del endotelio vascular y en grupos de células endoteliales recién formadas (microvasos) y, por lo tanto, la expresión de CD34 es un indicador de densidad de microvasos (MVD) y de vascularización tisular3,4.
El LiE está relacionado de manera estrecha con otras alteraciones escleroatróficas como son la morfea y la esclerodermia. Algunos textos consideran el LiE como una morfea superficial o subepidérmica, o como una esclerodermia de la dermis papilar5,6. Estos puntos de vista están respaldados por varias observaciones que incluyen la coexistencia de la morfea y del LiE en algunos pacientes, las características clínico-patológicas superpuestas y las posibles causas subyacentes comunes (infección por Borrelia y autoinmunidad)5,7. Histológicamente, tanto la morfea como el LiE se caracterizan por la atenuación de la epidermis, que se deberá a las secuelas causadas por los cambios del estroma dérmico que incluyen una hialinización dérmica, una esclerosis con vascularización disminuida y una perfusión tisular alterada5-7.
A pesar de que hasta la fecha actual se desconoce el papel exacto y el origen de las DDC, algunos estudios han sugerido que las DDC serán importantes para mantener la microarquitectura dérmica y la modulación de la respuesta inmunitaria y, como tales, contribuyen al desarrollo de alteraciones escleroatróficas como el LiE, la morfea y la esclerodermia8-11. En la morfea y en la esclerodermia, trabajos previos han demostrado una disminución de DDC CD34 positivas en la dermis8-12. Aiba et al. estudiaron las biopsias cutáneas provenientes de 27 casos con esclerodermia, así como las biopsias de piel normal de 17 individuos utilizando anticuerpos contra el CD34. En la piel afectada por la esclerodermia, las DDC positivas para el CD34 fueron escasas o estaban completamente ausentes. Los autores sugirieron que las células CD34 positivas pueden representar células diana primarias en el fenómeno autorreactivo en la esclerodermia8. De manera similar, Gilmour et al. examinaron el número de DDC positivas para CD34 en 33 biopsias cutáneas de morfea y encontraron una disminución progresiva en el número de estas células con relación a su progresión, desde las etapas inflamatorias a las etapas más escleróticas de la morfea11. Además, hubo un aumento de la MVD, tanto en la morfea como en la esclerodermia13,14. En conjunto, las DDC positivas para CD34 parecen contribuir al desarrollo de la esclerodermia y de la morfea. Hasta la fecha actual, estudios similares en el LiE son limitados13,14.
El gen supresor de tumores p53 codifica para una proteína nuclear de 53 KD que desempeña un papel importante en la regulación del ciclo celular y de la apoptosis15. En la mayoría de las células benignas, incluidos los queratinocitos del prepucio del pene y la piel de la vulva16,17, la expresión de la proteína p53 está ausente o es débil. La sobreexpresión de la proteína p53 es frecuente en las células epiteliales escamosas malignas y displásicas18. En el LiE, la expresión de la proteína p53 es de débil a moderada, nuclear, discontinua, y se localiza en los queratinocitos de las células basales (patrón 0)17,19.
En la actualidad, el conocimiento que tenemos acerca de los perfiles de las DDC positivas para CD34, de la DMV y de la expresión de la proteína p53 en el LiE es limitado. En el presente estudio se utilizaron diversas técnicas de inmunohistoquímica para poder abordar estas cuestiones.
Materiales y métodosEn el presente estudio se analizó una serie retrospectiva de casos, utilizando muestras de tejidos fijados en formol e incluidos en parafina de 19 casos de LiE (estadio esclerótico), provenientes del Servicio de Anatomía Patológica, de los Hospitales Universitarios de Assuit, así como de los archivos de consulta del autor del presente trabajo. Todas las muestras fueron codificadas (bloques de tejido incluidos en parafina, portaobjetos e informes de anatomía patológica). La información obtenida fue analizada y registrada de tal forma que se mantuvo el anonimato de los participantes. El presente estudio no incluyó ningún tipo de interacción o de intervención sobre los sujetos, así como tampoco se tuvo acceso a información privada identificable de los pacientes. Por este motivo, el estudio no requirió la aprobación por ningún comité de ética institucional20. Este estudio se realizó de acuerdo con los principios de la Declaración de Helsinki. Se obtuvieron muestras de vulva (11 casos), LiE extragenital (2 casos) y LiE de los genitales masculinos (6 casos). El grupo control (piel normal) incluyó a 10personas sanas con la misma edad y sexo, a quienes se les había extirpado piel por presentar alguna lesión benigna cutánea. Se realizaron cortes de los tejidos incluidos en parafina y tinciones histológicas de rutina (tinciones de hematoxilina y eosina), así como tinciones especiales (fibras elásticas, tinción de Verhoeff-van Gieson [VVG]). Las características que se estudiaron en los cortes histológicos fueron aquellas de los tipos usuales y diferenciados de VIN. Las tinciones de los cortes se hicieron siguiendo las pautas indicadas por otros grupos previamente3,18. Se utilizó una técnica de recuperación de epítopo antigénico inducida por calor (Dako Target Retrieval Solution, S1699; Dako, Carpinteria, California, EE. UU.) a 95°C por 30 min, seguida posteriormente de un minuto de enfriamiento. La actividad de la peroxidasa endógena se bloqueó con el peróxido de hidrógeno al 10%. A cada corte se le aplicó el anticuerpo anti-CD34 (DakoCytomation [Glostrup, Dinamarca; anticuerpo anti-CD34 humano]), diluido en solución salina tamponada con fosfato (PBS). De manera similar, se aplicaron anticuerpos anti-p53 (a una dilución de 1: 200, Thermo Scientific, Lab Vision Corporation, Fermont, Clone SP5, RM-9105-S1, EE. UU.) en cada corte. Estos se dejaron incubando, usando anticuerpos primarios a 4°C durante toda la noche. Posteriormente, los cortes se trataron utilizando la técnica de la peroxidasa polimérica marcada (DAKO EnVisionTM+Peroxidase Kit, Dako, Carpinteria, CA, EE. UU.) durante 60 min siguiendo las instrucciones del fabricante. Las proteínas se visualizaron utilizando un kit de sustrato de diaminobencidina líquido (Zymed Laboratories, San Francisco, CA, EE. UU.). Los cortes se contratiñeron con hematoxilina de Mayer. Muestras de hemangiomas y carcinomas de células escamosas se utilizaron como controles positivos para los anticuerpos anti-CD34 y anti-p53, respectivamente. Las secciones con PBS en sustitución del anticuerpo primario se utilizaron como controles negativos3. Todos los portaobjetos fueron codificados y posteriormente evaluados por 2observadores ciegos tanto para los detalles clínicos como para la identidad de los pacientes21.
Evaluación inmunohistoquímica de la MVD, de las DDC positivas para CD34 y de la expresión de la proteína p53. Los cortes con tinciones inmunohistoquímicas fueron valoradas. Tanto en las muestras de piel sana como en las muestras de las lesiones, la tinción inmunohistoquímica de CD34 estaba ausente en la epidermis. Las DDC positivas para CD34 localizadas en la dermis fueron contadas en 3campos elegidos al azar (1 mm2), siguiendo lo realizado por otros grupo21. La valoración de la MVD se realizó conforme a lo que se había hecho en estudios previos. Los cortes se examinaron a un bajo aumento (× 40) para identificar los «hot spots» de los microvasos en la dermis. Las células endoteliales individuales o las células endoteliales reactivas agrupadas (tinción de membrana/citoplasma) para CD34 en la membrana/citoplasma se contabilizaban como un microvaso único. El número de microvasos se contó a un mayor aumento (× 400). La luz del vaso y los glóbulos rojos, aunque con frecuencia están presentes, no fueron características indispensables para definir la presencia de un microvaso3,22. Los valores de expresión de la proteína p53 se calificaron y se recogieron de acuerdo con lo descrito por otros grupos18. Únicamente la tinción nuclear fue considerada como positiva. Inicialmente, la distribución de las células positivas para p53 se clasificó en basales y suprabasales. La intensidad de la tinción se puntuó de la siguiente forma: débil 1+, moderado 2+ o fuerte 3+. El porcentaje de células positivas se calculó determinando el número de células positivas por cada 100 células consecutivas (0-25%, 26-50%, 51-75% o>75%)17,18. Los perfiles de tinción del p53 incluían 3patrones. El patrón 0 indicaba la presencia de una tinción de p53 nuclear discontinua, de débil a moderada, localizada predominantemente en los queratinocitos de células basales (en ausencia de una extensión suprabasal). El patrón 1 indicaba la presencia de una tinción de p53 nuclear moderada a fuerte, significativamente aumentada en la capa de células basales, pero en ausencia de una extensión suprabasal prominente. El patrón 2 indicaba la presencia de una reactividad nuclear de p53 de moderada a fuerte, significativamente aumentada en la capa de células basales, y que se asociaba además a una extensión suprabasal prominente23.
Análisis estadístico. Las diferencias entre los grupos (piel normal versus LiE) se determinaron, como en estudios previos12,24, utilizando la prueba no paramétrica de Wilcoxon-Mann-Whitney. Valores de p menores de 0,05 fueron considerados como estadísticamente significativos. Los resultados se presentaron utilizando la media y el error estándar de la media (SEM). Las pruebas estadísticas se realizaron con el SPSS versión 23 (IBM Corp, Nueva York, EE. UU.).
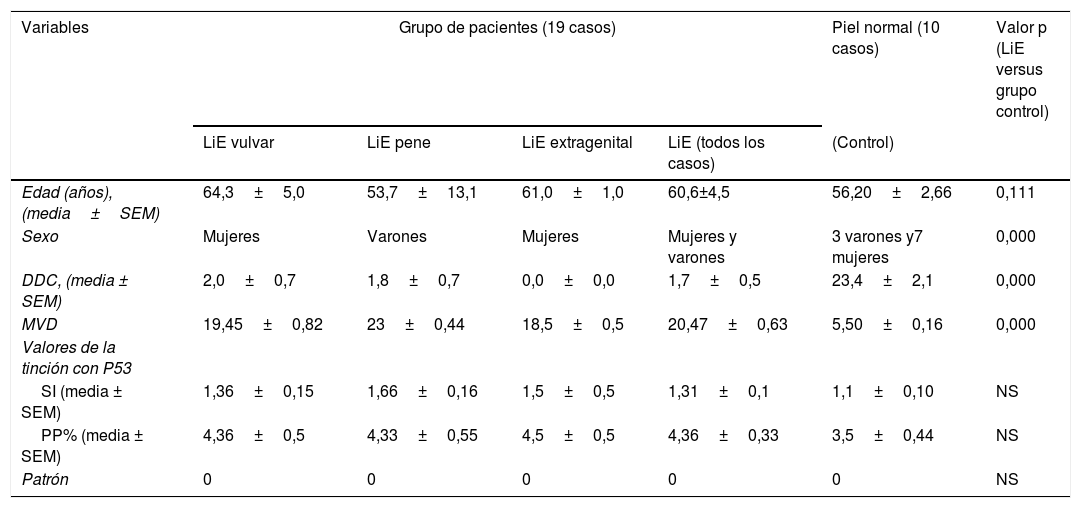
ResultadosHallazgos clínico-patológicos. El estudio incluyó 19 casos con LiE, con una edad media de 60,6±4,5 años y 11 casos de LiE vulvar (media±SEM de edad: 64,3±3,2 años). Los sitios de las lesiones vulvares fueron: labios menores (9 casos), perineo y horquilla posterior (un caso cada uno). El estudio también incluyó 6 casos de LiE de genitales masculinos que afectaban al prepucio (media±SEM: 53,7±13,1 años) y 2casos de LiE extragenital (mama derecha y región paraumbilical, un caso cada una, media±SEM: 60,0±1,0 años). Se examinaron los cortes histológicos para obtener el diagnóstico de LiE y descartar neoplasia escamosa. En un caso de LiE se observaron características diagnósticas de VIN de tipo diferenciado precoz/carcinoma de células escamosas diferenciado. Histológicamente, los cortes de LiE genital y extragenital mostraban un adelgazamiento de la epidermis asociado a la pérdida del patrón regular de las crestas. La capa granular estaba presente. No se objetivó atipia nuclear en el área basal y tampoco la presencia de acantosis. Se evidenció edema dérmico papilar y homogeneización del colágeno dérmico, fragmentación y disposición al azar (orientación horizontal, vertical y aleatoria) de las fibras elásticas dérmicas (tinción VVG). Así mismo, se encontró una condensación y ondulación de las fibras elásticas en la dermis circundante. No se detectaron elementos que hicieran sospechar de una infección fúngica (se usó ácido periódico-Schiff con y sin diastasa). En la dermis se observaron escasos linfocitos dispersos. En 18 de los casos no se pudo identificar evidencia de una neoplasia escamosa. En las figuras 1-4 se muestra un resumen de estos hallazgos.
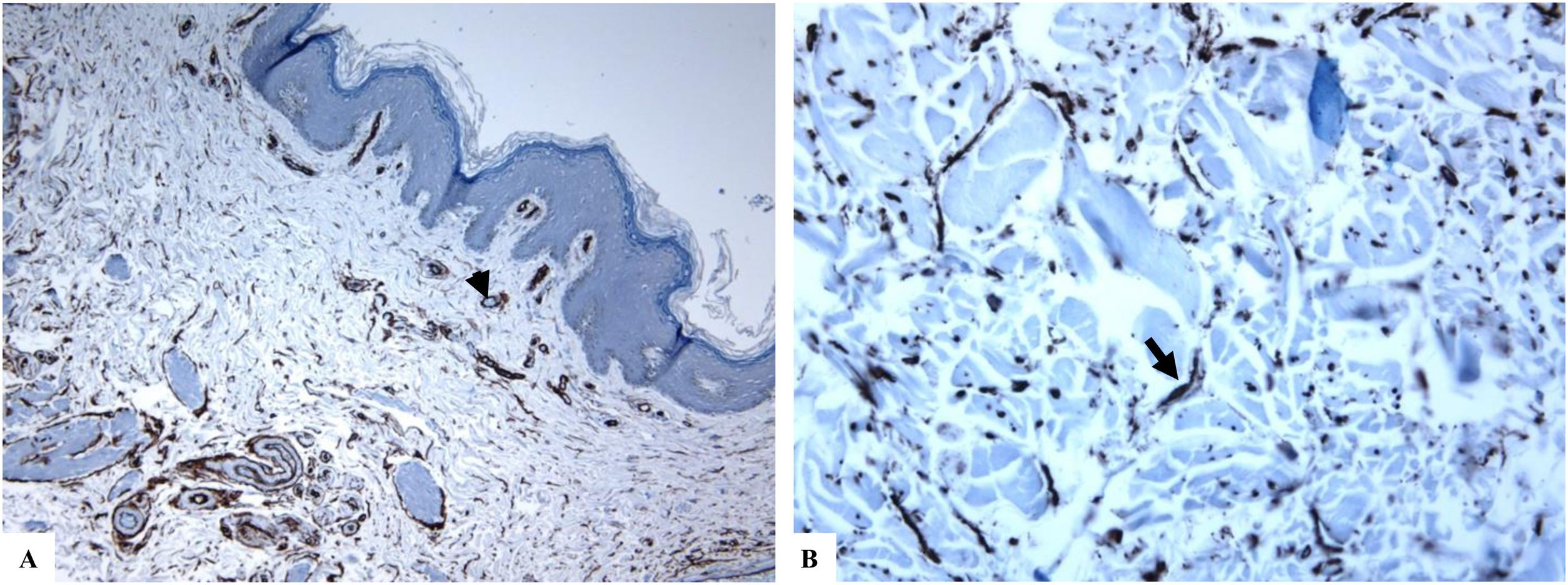
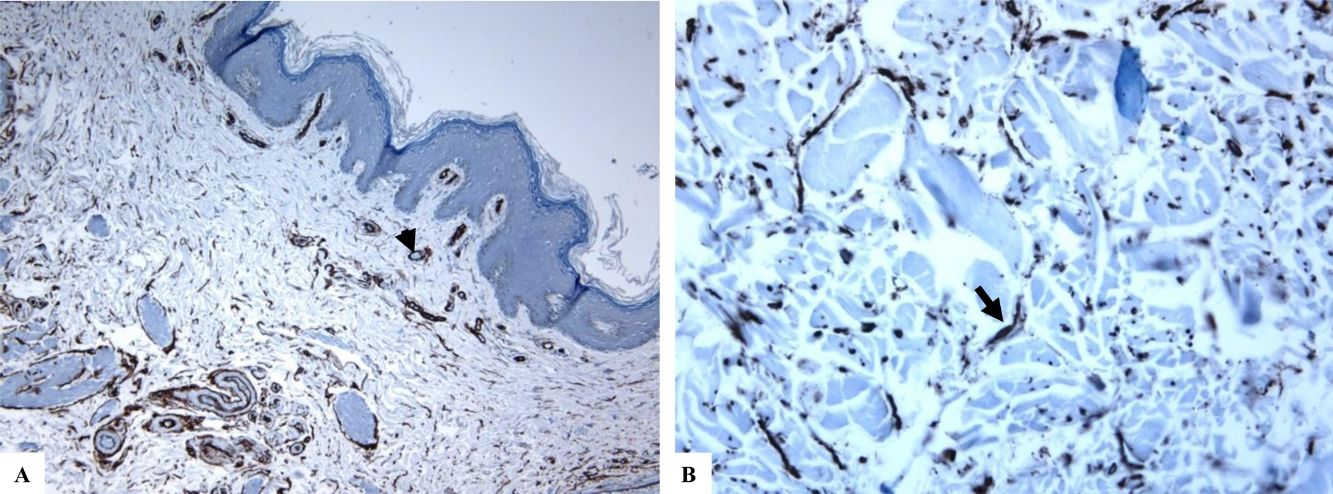
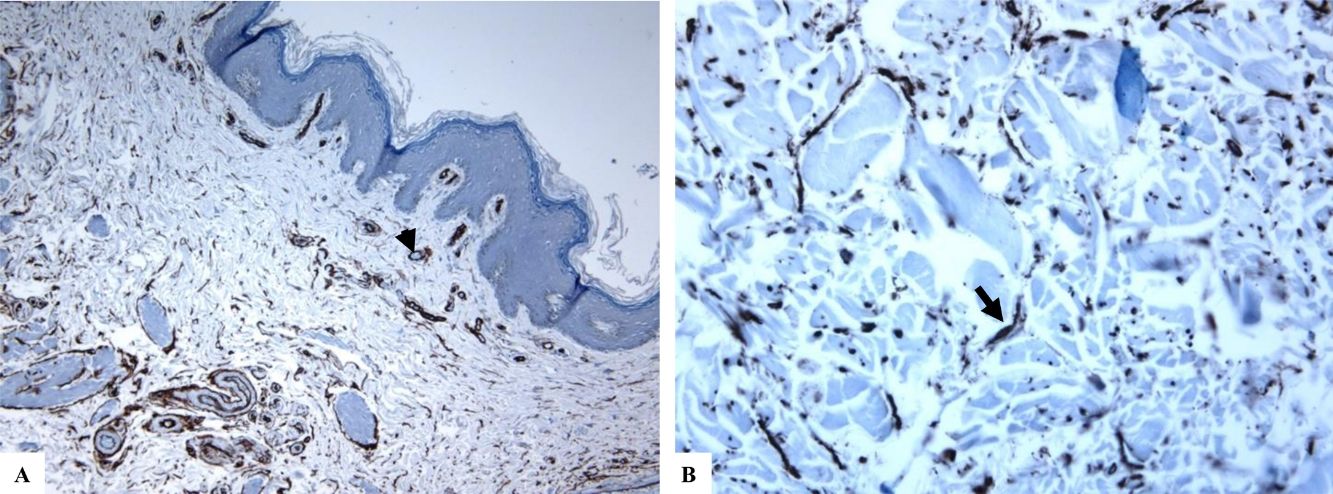
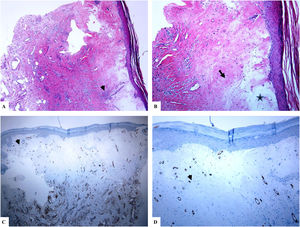
Liquen escleroso genital (vulvar). A y B) Las características de LiE incluyen la epidermis notablemente atenuada con una transición de la dermis papilar edematosa (estrella) al colágeno dérmico hialinizado homogeneizado (flecha) y un infiltrado sutil de células inflamatorias (punta de flecha). C y D) La tinción de CD34 muestra la pérdida de células dendríticas dérmicas marcadas con CD34 y un aumento de la densidad de microvasos (puntas de flecha). (Ampliaciones originales. A:×40; B:×100; C:×40, y D:×100).
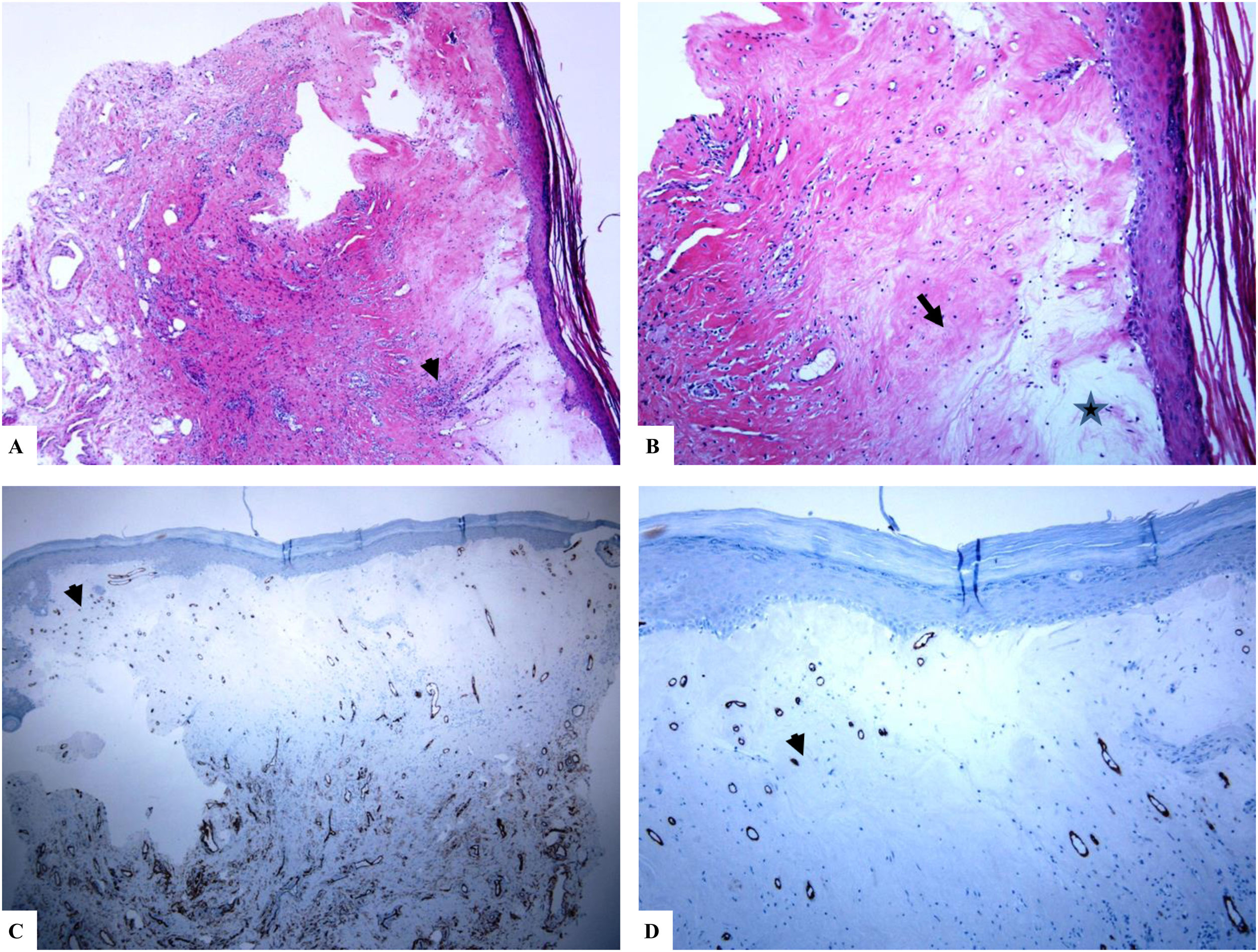
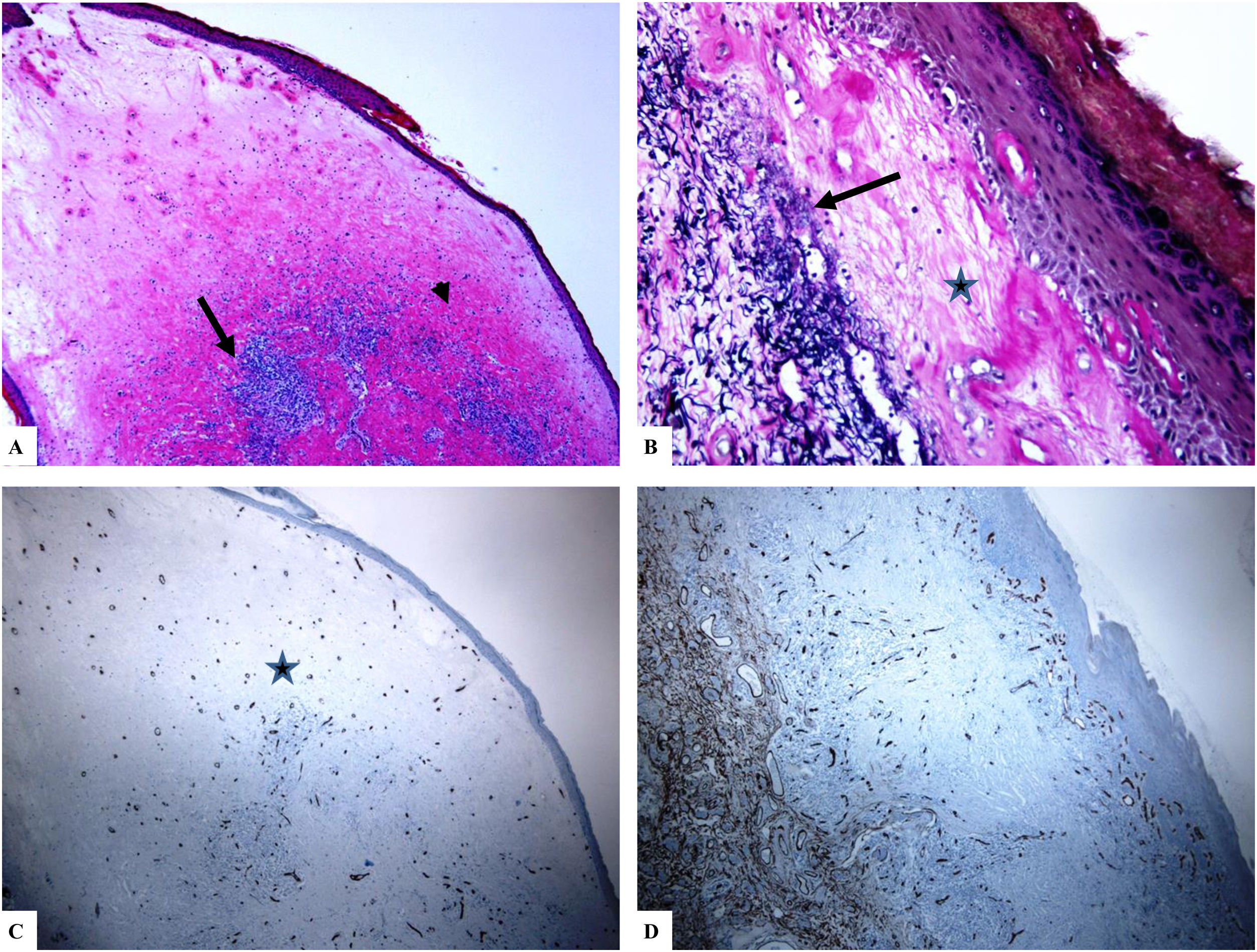
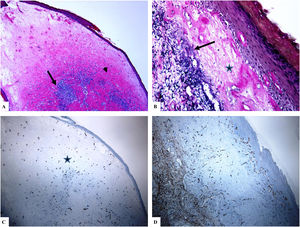
Liquen escleroso genital (pene) (balanitis xerótica obliterans del prepucio). A) Las características del LiE peneano incluyen el adelgazamiento de la epidermis con pérdida del patrón normal de las crestas, amplia condensación del colágeno dérmico papilar homogéneo y hialinizado de manera masiva (punta de flecha) y el infiltrado linfocítico dérmico denso y parcheado (flecha). B) Edema, condensación y ondulación de las fibras elásticas (tinción de Verhoeff-van Gieson para fibras elásticas, flecha) en la base del colágeno homogeneizado (estrella). C y D) La tinción de CD34 muestra la pérdida de células dendríticas dérmicas CD34 y un aumento de la densidad de microvasos (estrella). (Ampliaciones originales. A:×20; B:×200; C:×20, y D:×100).
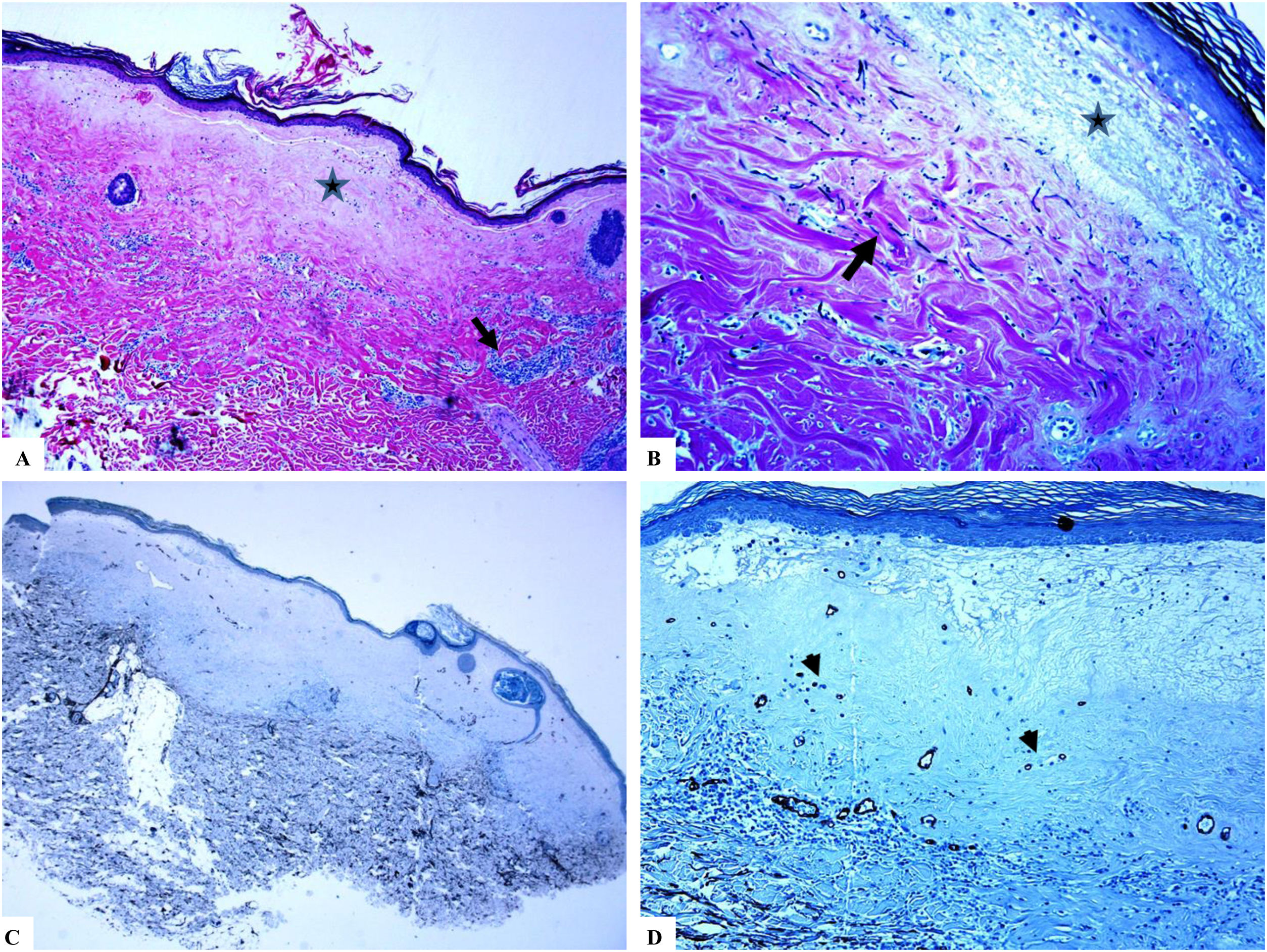
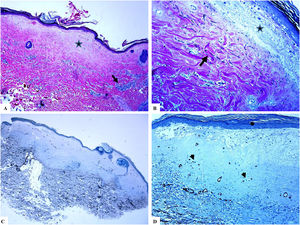
Liquen escleroso extragenital (lesiones mamarias). A) Las características del LiE incluyen la presencia de hiperqueratosis focal, adelgazamiento de la epidermis, hialinización del colágeno dérmico papilar (estrella) y edema. B) Fragmentación y disposición al azar (orientación horizontal, vertical y aleatoria) de las fibras elásticas dérmicas (tinción de Verhoeff-van Gieson para fibras elásticas, flecha). C y D) La tinción CD34 muestra pérdida de células dendríticas dérmicas CD34– y un aumento de la densidad de microvasos (puntas de flecha). (Ampliaciones originales. A:×20; B:×40; C:×20, y D:×40).
Se encontró un número notablemente reducido o la pérdida completa de DDC positivas para CD34 en el LiE frente a su presencia en la piel normal. Las DDC positivas para CD34 muestran una tinción citoplásmica pardusca. La dermis de la piel afectada (LiE) mostró la ausencia completa de DCC positivas para CD34 o una presencia escasa de DCC positivas para CD34, si se compara con el grupo de piel sana. Los valores medios de la expresión de DDC fueron de 1,7±0,5/mm2 frente a 23,4±2,1/mm2 para el LiE (casos genitales y extragenitales) frente a la piel normal, respectivamente. Los valores medios de los recuentos de DCC positivos para CD34 fueron de 2,0±0,7/mm2 (LiE vulvar), 1,8±0,7/mm2 (LiE de los genitales masculinos) y de 0,0±0,0/mm2 (LiE extragenital). Las diferencias entre la piel afectada (LiE) y la piel normal fueron estadísticamente significativas (p <0,000). En la tabla 1 y en las figuras 1-4 se muestra un resumen de estos hallazgos.
Los hallazgos clínicos e inmunohistoquímicos en pacientes con LiE
| Variables | Grupo de pacientes (19 casos) | Piel normal (10 casos) | Valor p (LiE versus grupo control) | |||
|---|---|---|---|---|---|---|
| LiE vulvar | LiE pene | LiE extragenital | LiE (todos los casos) | (Control) | ||
| Edad (años), (media±SEM) | 64,3±5,0 | 53,7±13,1 | 61,0±1,0 | 60,6±4,5 | 56,20±2,66 | 0,111 |
| Sexo | Mujeres | Varones | Mujeres | Mujeres y varones | 3 varones y7 mujeres | 0,000 |
| DDC, (media ± SEM) | 2,0±0,7 | 1,8±0,7 | 0,0±0,0 | 1,7±0,5 | 23,4±2,1 | 0,000 |
| MVD | 19,45±0,82 | 23±0,44 | 18,5±0,5 | 20,47±0,63 | 5,50±0,16 | 0,000 |
| Valores de la tinción con P53 | ||||||
| SI (media ± SEM) | 1,36±0,15 | 1,66±0,16 | 1,5±0,5 | 1,31±0,1 | 1,1±0,10 | NS |
| PP% (media ± SEM) | 4,36±0,5 | 4,33±0,55 | 4,5±0,5 | 4,36±0,33 | 3,5±0,44 | NS |
| Patrón | 0 | 0 | 0 | 0 | 0 | NS |
DDC CD34+: células dendríticas dérmicas positivas para CD34; LiE: liquen escleroso; MVD: densidad de microvasos; NS: no estadísticamente significativo; PP%: porcentaje de células positivas; SEM: error estándar de la media; SI: intensidad de tinción; VLiE: liquen escleroso vulvar, LiE peneano.
Un aumento marcado de la MVD en la dermis del LiE en comparación con la de la piel normal. La reactividad del marcador CD34 en los microvasos se observó como una coloración pardusca citoplasmática con o sin la presencia de la tinción de la membrana. Las áreas que tenían vasos con calibres superiores a 8glóbulos rojos fueron excluidas. Así mismo, se excluyeron del recuento final aquellos vasos sanguíneos de gran y mediano tamaño con paredes musculares gruesas o aquellos vasos con un diámetro luminal superior a 50mM. Los valores de la MVD en la piel afectada por el LiE genital y extragenital (20,47±0,63, p =0,000) presentaron una significación estadística elevada (p <0,000) en comparación con los valores en la piel normal (5,50±0,2). Los valores medios de la MVD fueron de 19,45±0,82 (LiE vulvar), de 23±0,44 (LiE de los genitales masculinos) y de 18,50±0,50 (LiE extragenital). En la tabla 1 y en las figuras 1-4 se muestra un resumen de estos hallazgos.
Patrones de tinción de la proteína p53 en la piel normal y en el LiE. La piel afectada y la piel sana mostraron valores y patrones de tinción de la proteína p53 prácticamente similares. La reactividad se evidenció en forma de tinción nuclear p53+de células aisladas de forma discontinua (intensidad de tinción débil a moderada) en los queratinocitos de las células basales de la epidermis (en menos del 10% de los queratinocitos basales). Una tinción basal lineal suprabasal o continua no se observó en todos los casos de LiE. Los valores de la expresión de la proteína p53 han sido resumidos en la tabla 1 y las figuras 1-4. La tinción con Ki67 se localizó en los queratinocitos de células basales tanto en el LiE como en la piel sana.
DiscusiónHasta la fecha, los conocimientos acerca del recuento de las DDC positivas para CD34, de la MVD y de los patrones de expresión del p53 en el LiE son limitados. Este estudio tuvo como objetivo recoger información sobre estos puntos observándose los siguientes hallazgos: 1) un número marcadamente reducido o incluso la ausencia completa de las DDC CD34-positivas en la piel con el LiE en comparación con su presencia en la piel sana; 2) una MVD notablemente aumentada en la dermis del LiE en comparación con la de la piel sana, y 3) la falta de la acumulación de la proteína p53 en estas lesiones.
Un número notablemente reducido o la pérdida completa de las DDC positivas para CD34 en el LiE frente a su presencia en la piel sana: Las DDC positivas para CD34 están presentes en la dermis de la piel normal y desempeñan un papel en el desarrollo de las células mesenquimales y epiteliales circundantes y en la modulación de la respuesta inmunitaria21. De acuerdo con estudios previos realizados en piel con morfea8-12 y cicatrices dérmicas21, el presente estudio ha demostrado una disminución marcada del número de DDC CD34 positivas o su pérdida completa en la dermis de piel afectada por LiE. Skobieranda y Helm examinaron la expresión de células progenitoras positivas para CD34 en 26 biopsias de piel con lesiones de morfea junto con 11 biopsias adicionales de piel sana. Estos encontraron una cantidad disminuida de células que expresaban CD34 en la piel afectada en comparación con las de piel sana. Los autores propusieron funciones reguladoras para las DDC CD34 positivas en la síntesis de colágeno y, por lo tanto, en el desarrollo de la morfea9. Lee et al. examinaron la distribución de las DDC CD34 positivas y de los miofibroblastos positivos para actina de músculo liso (SMA) tanto en biopsias cutáneas de pacientes con morfea como en individuos sanos (piel normal). Los miofibroblastos positivos para SMA estaban principalmente aumentados en aquellas localizaciones dérmicas donde las DDC positivas para CD34 estaban disminuidas o habían desaparecido12. Los autores propusieron que la falta de DDC positivas para CD34 en la morfea era compatible con hallazgos similares al proceso de cicatrización de las heridas12,25, ambos asociados a la diferenciación fenotípica de las DDC positivas para CD34 en miofibroblastos positivos para SMA. Vistos en conjunto, estos hallazgos sugieren que las DDC contribuyen a la regulación de la producción de colágeno en la piel.
Los miofibroblastos son células positivas para la actina del músculo liso que pueden desempeñar un papel importante en la patogenia de la fibrosis. Estas células pueden desarrollarse a partir de los fibrocitos positivos para CD34 bajo la estimulación de citocinas fibrogénicas26,27. Lee et al. utilizaron métodos de tinción inmunohistoquímica para examinar el perfil de expresión de CD34, factor xiiia, SMA, CD31 y molécula de adhesión de células vasculares-1 en la morfea. Estos autores encontraron una tinción estromal de CD34 disminuida en estas lesiones, mientras que la expresión del factor xiiia, la actina del músculo liso y la molécula de adhesión de células vasculares-1 estaban incrementadas en comparación con las de la piel normal. Se objetivó una correlación inversa entre la tinción del estroma de CD34 y el patrón de expresión espacial con la tinción de actina del músculo liso. Los autores señalaron que los patrones de las tinciones del estroma con CD34 y SMA mutuamente excluyentes sugieren un cambio fenotípico de las DDC CD34+hacia miofibroblastos positivos para la SMA evidenciados en la morfea12. Por lo tanto, resulta interesante realizar estudios futuros en los que se busque comparar el patrón de expresión de estas proteínas en el LiE.
Una MVD marcadamente aumentada presente en la dermis del LiE en comparación con la de la piel sana. En el presente estudio, los hallazgos de una MVD aumentada en el LiE apoyan los hallazgos evidenciados previamente en piel afectada por morfea y en la esclerodermia13,14,28. Olejek et al. examinaron la MVD (usando anticuerpos CD34) en biopsias cutáneas de LiE vulvar en 28 mujeres13 y en 100 casos de LiE anogenital y encontraron un aumento significativo de la MVD después de realizar la terapia fotodinámica14. En 2009, Dziankowska-Bartkowiak et al. examinaron los cambios endoteliales vasculares de la esclerodermia (esclerosis sistémica y morfea). Se analizaron tanto el factor de crecimiento endotelial vascular sérico (VEGF) y su receptor soluble 2 (sVEGFR2) mediante el método ELISA, así como la expresión inmunohistoquímica del antígeno CD34 en la piel afectada. Se observó una proporción sérica media de VEGF/sVEGFR2 más elevada en aquellos pacientes con esclerosis sistémica en comparación con el grupo de control. Además, también se observaron algunas variaciones en la expresión del CD34 en las células endoteliales vasculares28. De manera general, el incremento de la MVD en el LiE podría deberse a la liberación de factores angiogénicos que buscan mejorar la neoangiogénesis28. Las células positivas para CD34 también pueden diferenciarse en células progenitoras que se incorporaran a los vasos sanguíneos recientemente formados29.
La expresión de la proteína p53 en el LiE. De manera similar a lo descrito en estudios previos, en este también se evidenció que el LiE mostraba una tinción de la p53 de tipo nuclear, discontinua, de débil a moderada y localizada en los queratinocitos de las células basales, lo que indica la falta de acumulación de la proteína p5317,19. Este patrón nuclear de tinción de la p53 refleja una respuesta relacionada con el estrés secundario a la inflamación dérmica y a la isquemia, más que una mutación del gen p53 subyacente19. Yang y Hart examinaron el perfil de expresión de la p53 en 12 casos de VIN diferenciado utilizando métodos de tinción inmunohistoquímica19. En el VIN diferenciado, se observó una expresión de la proteína p53 en los queratinocitos de las células basales con una extensión suprabasal. Por el contrario, la tinción suprabasal de la p53 no se observó en los casos de LiE19. Hantschmann et al. examinaron la expresión de la proteína p53 en pacientes con carcinoma de células escamosas, VIN, LiE e hiperplasia escamosa. En el LiE y en la piel vulvar normal, la expresión de la proteína p53 se localizó en los queratinocitos de células basales. Los tipos habituales y diferenciados de VIN mostraron reactividad nuclear de p53 basal y suprabasal. La mayoría de los carcinomas de células escamosas mostraron una tinción de p53 nuclear difusa de moderada a intensa17.
En conclusión, este es el primer estudio que analiza los perfiles de las DDC, de la MVD y del p53 de manera simultánea en LiE. En el se ha mostrado que los recuentos de DDC positivas para CD34 fueron significativamente más bajos en el LiE que en la piel normal (controles), mientras que la MVD fue significativamente más alta en los pacientes que en los controles. Estos hallazgos sugieren que las alteraciones de las DDC y de la MVD pueden jugar un papel en la patogénesis de la fibrosis en estas lesiones. Se necesitan investigaciones futuras no solo para comprender los mecanismos subyacentes a estas alteraciones sino también para analizar la correlación entre la expresión del CD34, el factor xiiia, la SMA, CD31 y la molécula de adhesión celular vascular-1 en la morfea.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.