El microbioma incluye microorganismos como virus, bacterias y hongos. Se ha evidenciado que el cuero cabelludo tiene su propio microbioma dado por factores únicos como la humedad, la protección de luz ultravioleta y el pH; adicionalmente hay diferencias entre distintas áreas corporales, etnias y sexos. Existen pocas publicaciones o datos sobre el microbioma folicular y se ha denotado el rol de la microbiota en la patogénesis de varias enfermedades, siendo un área de investigación emergente. Algunos estudios demuestran la influencia de esta composición en enfermedades capilares como la alopecia areata y la alopecia androgenética. Finalmente, se ha postulado que la manipulación del microbioma puede representar una opción terapéutica innovadora para muchas enfermedades.
The human microbiome includes viruses, bacteria, and fungi. There is evidence that in addition to microbiome variation in different areas of the body or according to ethnicity and sex, the microbiome specific to the scalp is conditioned by such factors as humidity, protection from UV light, and pH. Although little information has yet been published about the microbiome of hair follicles and its role in the pathogenesis of diseases, interest in this area of research is emerging. Studies have shown that components of the follicular microbiome influence such disorders as androgenetic alopecia and alopecia areata. A current hypothesis is that interventions that target the microbiome may lead to innovative therapies for many diseases.
El microbioma describe el genoma de todos los organismos comensales, simbióticos y patogénicos encontrados en el cuerpo humano, e incluye microorganismos como virus, bacterias y hongos. Su composición está influida por factores como la edad, nutrición, género y estilo de vida. La prevalencia de enfermedades autoinmunes ha sufrido un aumento especialmente en países occidentales y se ha considerado que los estilos de vida modernos pueden afectar la flora normal y una consecuente disregulación del sistema inmune. Un estado de disbiosis puede llevar a la disregulación de células T y provocar diversos trastornos tanto locales como a distancia. Estos cambios en la microbiota intestinal o cutánea pueden producir cambios en la diferenciación celular del sistema inmune innato y adaptativo. La microbiota también modula la secreción epitelial de quimiocinas que atraen células del sistema inmune1. Se está explorando cómo el microbioma intestinal puede influenciar la inmunidad en sitios distales como la piel, proponiendo la existencia de un «eje intestino-piel»2.
En el año 1843, David Gruby demostró la presencia de Microsporum audouini a nivel perifolicular en pacientes con alopecia areata (AA), con su consecuente hipótesis infecciosa como clave en su patogénesis3. Asimismo se han dado reportes de AA en epidemias en escuelas y orfanatos3. Por otro lado, algunos investigadores han aislado diversas especies fúngicas en estos pacientes, aunque otros dermatólogos no encontraron asociación con agentes infecciosos y esto ha desviado la hipótesis infecciosa3; sin embargo, puede existir un posible rol para los superantígenos patogénicos y su actividad aumentada en el sistema inmune que puede llevar a la inducción de AA por similitud con un epítopo (antigénico)3. Adicionalmente se ha descrito el rol del microbioma intestinal sobre la diferenciación de los linfocitos periféricos, ya que algunas células T reguladoras después de salir del timo migran a nivel intestinal en donde moléculas y señales microbianas llevan a la conversión de células T reguladoras CD4+ Foxp3− hacia el subtipo de células T reguladoras Foxp3+4.
El rol de la microbiota en la patogénesis de varias enfermedades es un área de investigación emergente1. Todavía existen dudas de si la disbiosis representa un proceso primario desencadenando la enfermedad o secundario por alteraciones desencadenadas por el mecanismo patológico1,5, y se ha mencionado que la manipulación terapéutica del microbioma puede representar una opción terapéutica innovadora para muchas enfermedades como la AA5. Este artículo de revisión tiene como objetivo reunir y exponer la evidencia reciente sobre la asociación entre la microbiota, el proceso de disbiosis, su relación con la alopecia y las implicaciones que esto trae a nivel terapéutico. Adicionalmente, se discute la composición y diferencias entre el microbioma de sujetos sanos en comparación con pacientes con diversos tipos de alopecia.
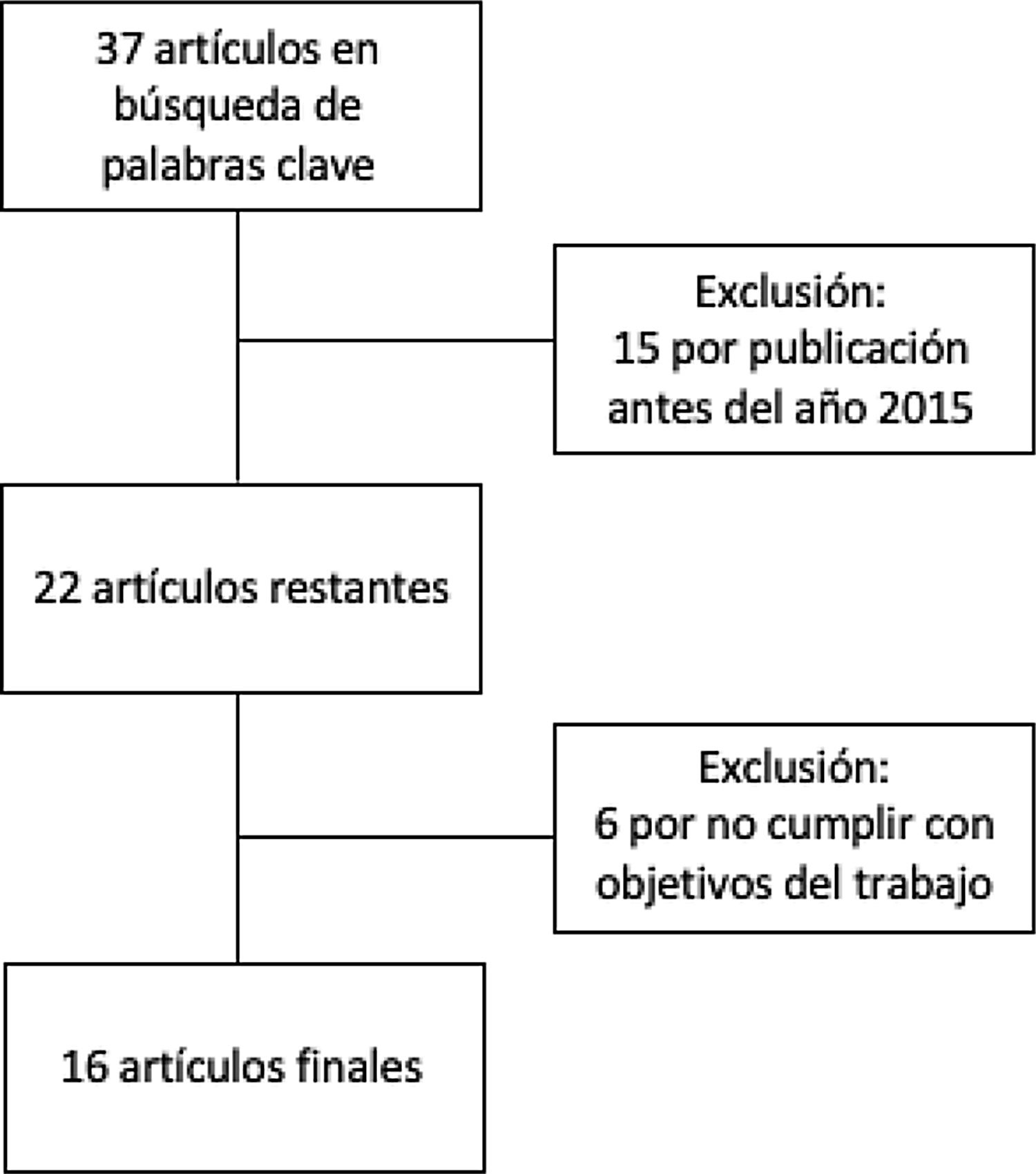
MetodologíaSe realizó una revisión narrativa sobre el tema. Se obtuvieron artículos con fecha de publicación entre 2015 y 2020 en las bases de datos: Cochrane Library Plus, Scielo, DynaMed y PubMed y Google Scholar. Para ello, se utilizaron términos de búsqueda «Microb*», «AND» y «Alopecia». Posteriormente, se filtraron con el fin de utilizar los artículos necesarios para cumplir con los objetivos de la revisión (fig. 1). Se revisaron los resúmenes, resultados y en los casos necesarios, los artículos completos, teniendo en cuenta finalmente todos los documentos que incluían información necesaria para el cumplimiento de los objetivos mencionados.
ResultadosMicrobioma normal en folículos pilosos/cutáneoEl cuero cabelludo tiene su propio microbioma6, crea un ambiente húmedo, protegido de la luz ultravioleta y con un pH favorable para el crecimiento microbiano en comparación con la superficie cutánea (seca, expuesta a radiación UV y bajo pH). Adicionalmente existen diferencias entre distintas áreas corporales, etnias, sexo e influencias ambientales1.
Existen pocos estudios y datos sobre el microbioma folicular; sin embargo, se documenta que a nivel del cuero cabelludo (superficial) predominan las Actinobacteria, Firmicutes y Proteobacteria1, siendo el géneroCutibacterium spp. el más frecuente (con Cutibacterium acnes como la bacteria más prevalente) y Staphylococcus spp. (con predominancia de Staphylococcus epidermidis). Otras también presentes son Corynebacterium spp., Streptococcus spp., Acinetobacter spp. y Prevotella spp.7,8. También se identifican especies de Malassezia globosa y Malasseziarestricta, siendo las especies fúngicas más predominantes. Existen otras especies como Ascomycota (Acremonium spp. Incluido Didymella bryoniae), Basidiomycota (Cryptococcus liquefaciens y Cryptococcusdiffluens), Coniochaeta spp., Rhodotorula spp.7,8.
Se ha visto colonización de virus DNA eucariotas como virus adeno-asociado subtipo 21 y virus de papiloma humano1,7. Por otro lado, también se documenta la presencia de Demodex folliculorum a nivel del infundíbulo folicular y Demodex brevis en glándulas sebáceas. Adicionalmente, Naspitz et al. encontraron la presencia de Dermatophagoides spp. y Euroglyphus spp. en la superficie del cuero cabelludo7; sin embargo, no se conoce cómo estos contribuyen a la fisiología del folículo piloso pero sí se conoce que pueden generar tanto respuestas proinflamatorias como inmunosupresoras1.
Disbiosis y enfermedadAlopecia areataUn estudio que determinó el microbioma en pacientes sanos y sujetos con AA encontró los siguientes porcentajes de bacterias a nivel de cuero cabelludo: Actinobacteria (56,3% control vs. 57,4% en AA), Firmicutes (35,2% control vs. 29,2% en AA), Propionibacterium (45,6% control vs. 55,1% en AA), Staphylococcus (32,6% control vs. 27,4% en AA)6. Algunos pacientes con AA pueden presentar sobrecolonización con P. acnes1. Por otro lado, la diversidad alfa fue mayor en el subgrupo de pacientes con AA en donde se encontró una disminución de S. epidermidis, sin cambios significativos en S. aureus6. No se encontró diferencias en el ratio S. epidermidis/S. aureus, un aumento del ratio P. acnes/S. epidermidis y P. acnes/S. aureus6. Es posible que los superantígenos, proteasas, toxinas del S. aureus e interacciones directas entre las células inmunitarias y las bacterias puedan contribuir a la inflamación y alteración de la función de barrera afectando el área del folículo piloso7.
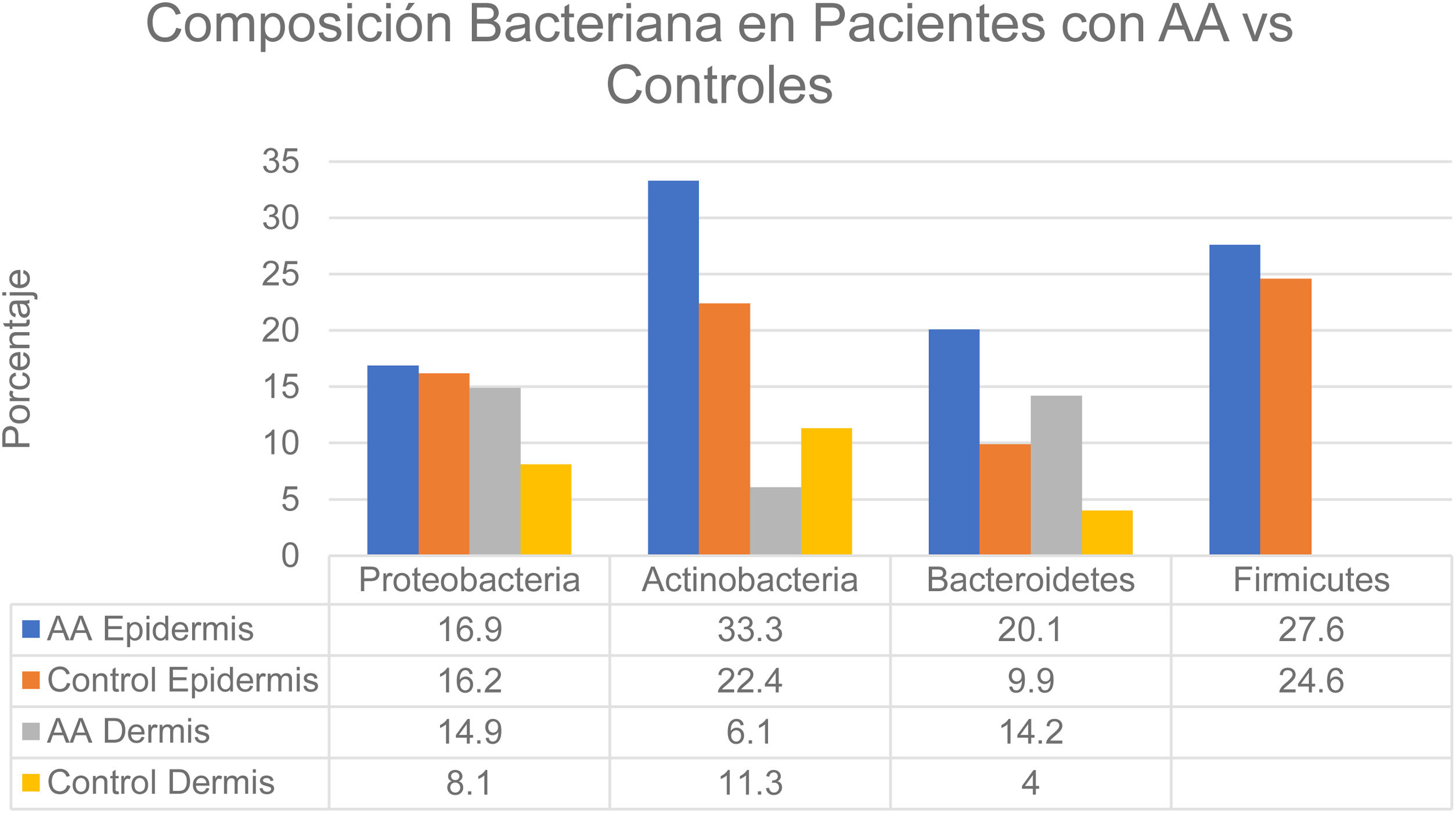
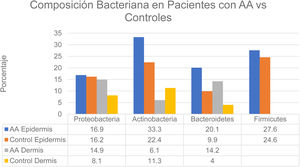
Se han observado cambios en la composición del microbioma en diversos compartimentos cutáneos. En la epidermis las proporciones según un estudio fueron: Actinobacteria (22,4% control vs. 33,3% AA) y Bacteroidetes (9,9% control vs. 20,1% AA). En la dermis los valores fueron: Actinobacteria (11,3% control vs. 6,1% AA), Proteobacteria (8,1% control vs. 14,9% AA) y Bacteroidetes (4,0% control vs. 14,2% AA) (fig. 2). Por otro lado, a nivel de la hipodermis en pacientes con AA se observó un aumento de la proporción de Proteobacteria, Bacteroidetes y Firmicutes en comparación con los sujetos controles. Finalmente, en los pacientes con AA se detectó la presencia de Prevotella copri en todos los compartimentos analizados así como la presencia de Akkermansia muciniphila (<1,5% de la población total) en los subcompartimentos, principalmente en la hipodermis6.
Composición bacteriana en pacientes con AA vs. controles.
Fuente: Pinto et al.6.
Existen controversias respecto a la asociación de infección por Helicobacter pylori y AA, con evidencias de coexistencia de este organismo con diversas condiciones autoinmunes. Adicionalmente se evidenció la cura de AA posterior a tratamiento antibiótico de infección por H. pylori, aunque el mecanismo exacto no ha sido descubierto9.
Se han asociado algunos agentes virales con este subtipo de alopecia, como por ejemplo gripe porcina (durante los brotes en 2009-2010), infección por influenza y EBV (mononucleosis infecciosa). El rol del citomegalovirus es controvertido7,9. Skinner et al. encontraron secuencias de ADN de citomegalovirus en tejido folicular de pacientes con AA. Finalmente existe una posible conexión con la colonización por Alternaria spp. y el desarrollo de AA, siendo positivo en el 20% de los cultivos vs. el 13,3% de los controles7.
No es solo el microbioma cutáneo el asociado con AA, sino también el microbioma intestinal. Se evidencia un aumento de la permeabilidad intestinal por disbiosis y/o inflamación las cuales pueden ser factores estresantes sobre el sistema inmune en individuos genéticamente susceptibles. Este proceso de disbiosis lleva a una menor producción de ácidos grasos de cadena corta resultado de una ingesta inadecuada de fibras en las «dietas occidentales», lo que altera la barrera intestinal y afecta las células T reguladoras colónicas las cuales son importantes reguladores del sistema inmune7. En estos pacientes se encontró una presencia enriquecida de Holdemania filiformis, Erysipelotrichacea, Lachnospiraceae, Parabacteroides johnsonii, Clostridiales vadin grupo BB60, Bacteroides eggerthii y Parabacteroides distasonis; en este mismo estudio también se encontró que estos biomarcadores bacterianos se asociaban con la presencia de AA10. Finalmente, Nair et al. demostraron la necesidad de Lactobacillus spp. a nivel intestinal para la inducción de AA11.
Alopecia androgenética (AGA)Hay evidencia de que existe una microinflamación en el tercio superior del folículo piloso con presencia de múltiples organismos. A este nivel se encuentran bacterias del género Cutibacterium spp. (58% AGA vs. 12% de controles) que secretan porfirinas las cuales estimulan la activación de complemento; además se observa mejoría después de la aplicación de agentes antimicrobianos, sugiriendo un posible rol con la microflora del cuero cabelludo7.
Se ha sugerido población aumentada de P. acnes en unidades foliculares miniaturizadas de pacientes con AGA1. Se demostró que en el cuero cabelludo sin enfermedad las especies del phylum Actinobacteria, Firmicutes y Proteobacteria representaban un 98%, dato que también se presentaba en pacientes con AGA. A nivel de géneros, el Propionibacterium (79%) y Staphylococcus (12%) representaron el 90% de la microflora en voluntarios sanos. En los sujetos con AGA el Propionibacterium (76,5%) y Staphylococcus (14%) también representaron el 90% de la flora microbiana. La especie Stenotrophomonas geniculate se presentaba de forma aumentada en pacientes de AGA, al mismo tiempo que un ratio C. acnes/S. epidermidis mayor en comparación con sujetos control12.
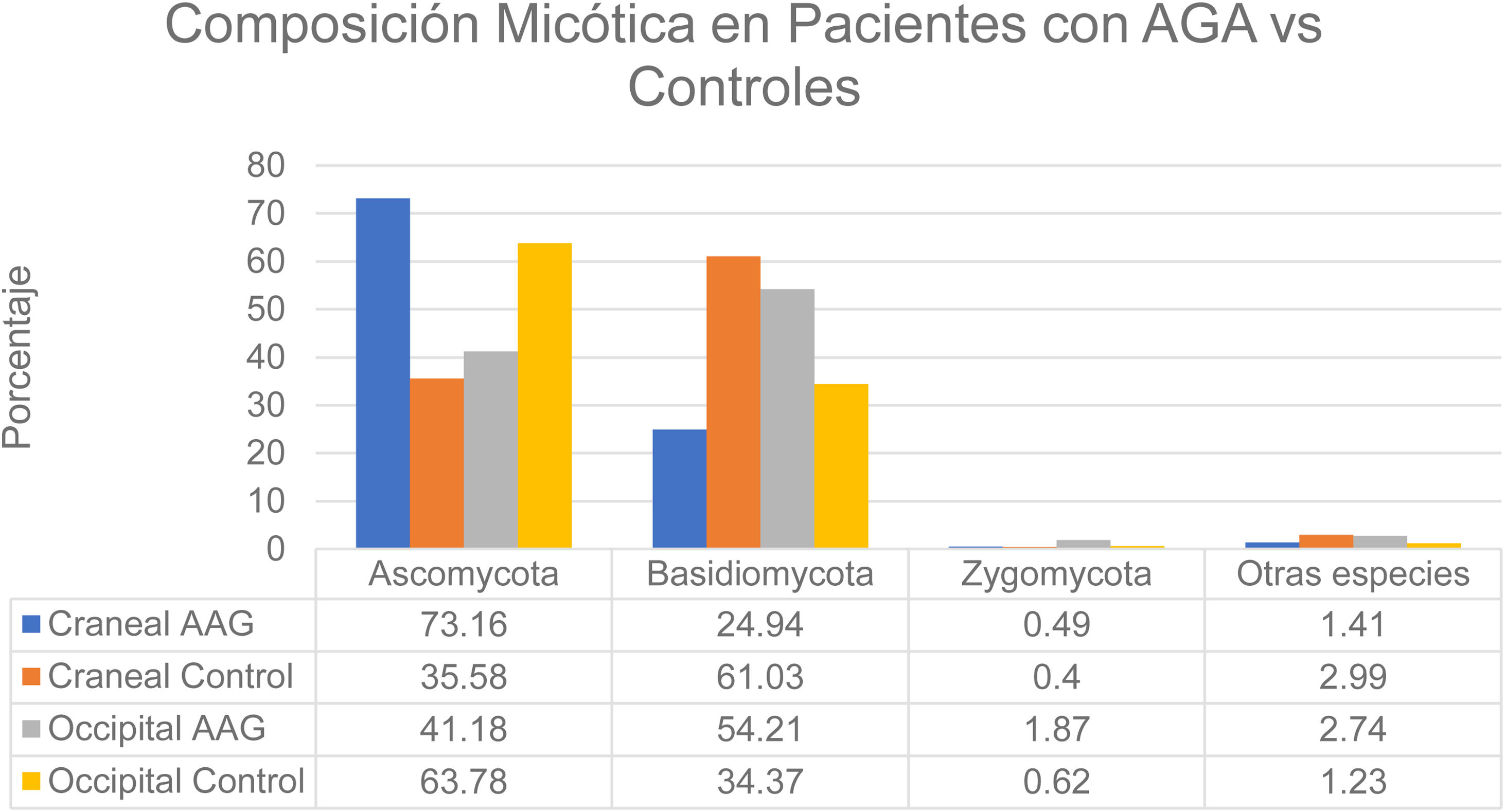
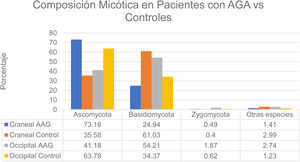
Se realizó un estudio en hombres con alopecia grado III-IV (Escala de Hamilton-Norwood) y mujeres con alopecia grado II (Escala de Ludwig)12. Estos pacientes no se realizaron tratamientos como permanentes o tintes en 2 meses previos al estudio, no utilizaron champú anticaída, no recibieron antifúngicos orales/tópicos en un periodo de un mes previo y no tenían historia de enfermedades del cuero cabelludo como pediculosis, foliculitis o AA. Se establecieron dos grupos: el grupo con alopecia y el grupo control. De manera global se encontró una mayor tasa de colonización en el grupo de AGA (60%) en comparación con el grupo control (40%). Las especies encontradas a nivel del vértice craneal de los pacientes control pertenecían al grupo Ascomycota en un 73,16%, Basidiomycota en un 24,94%, Zygomycota en un 0,49% y otras especies en un 1,41%. En este mismo grupo (control) en la región occipital se encontraron los grupos Ascomycota en un 63,78%, Basidiomycota en un 34,37%, Zygomycota en un 0,62% y otras especies en un 1,23%. Por otro lado, en el grupo con AGA, a nivel del vértice se encontraron especies de Ascomycota en un 35,58%, Basidiomycota en un 61,03%, Zygomycota en un 0,40% y otras especies en un 2,99%. En este mismo grupo (AGA) a nivel occipital se encontró predominio de Ascomycota en un 41,18%, Basidiomycota en un 54,21%, Zygomycota en un 1,87% y otras categorías en un 2,74% (fig. 3). La carga de Malassezia a nivel del vértice en el grupo con alopecia fue significativamente mayor y sin diferencia a nivel occipital en comparación con el grupo control. En el grupo con alopecia la carga fue superior a nivel del vértice en comparación con la región occipital. En el grupo control no se encontró diferencia significativa entre las dos áreas12. Se halló abundancia tanto de las especies M. restricta como M. globosa1. Por otro lado, en un estudio diverso se encontraron resultados contradictorios al evidenciar una menor proporción de M. globosa y M. restricta (56% control vs. 52% AGA)8. Por otro lado, algunos autores han postulado el rol de Demodex en AGA y dermatitis seborreica1.
Composición micótica en pacientes con AGA vs. controles.
Fuente: Huang et al.12.
Existe un debate sobre si la superinfección bacteriana masiva está asociada con algunas alopecias cicatriciales (p. ej., foliculitis decalvante) o está involucrada en un mecanismo patogénico primario o secundario a cambios inflamatorios que causan la disbiosis en los folículos pilosos. El hecho de que la monoterapia con antibióticos es usualmente ineficaz y que existe mejor respuesta hacia los retinoides no descarta que una disbiosis pueda desencadenar una foliculitis neutrofílica (p. ej., queratinocitos que secretan citoquinas y quimiocinas atrayentes de neutrófilos)1. El soporte hacia una etiología infecciosa es la presencia de S. aureus en cultivos de estas lesiones y una respuesta temporal al tratamiento antibiótico7.
En un estudio español en pacientes con patrón típico neutrofílico de foliculitis decalvante (FD) se demostró la presencia de Staphylococcus en el 25,9% de los casos en las biopsias foliculares de zonas afectadas por la enfermedad en comparación con el 6,6% de los folículos sanos. Una observación adicional es que el S. aureus juega un papel oportunista en lugar de un rol patogénico específico en la FD, ya que algunos sujetos sufren de enfermedad activa en ausencia de niveles significativos, sobre todo en formas liquenoides de la enfermedad, y por otro lado se demostró que estas cepas no son más virulentas que las presentes en la población general; es por esto que se plantea la hipótesis de una vulnerabilidad inmunológica o alteración en la estructura folicular que influye en la susceptibilidad a este tipo de alopecia cicatricial. Estos hallazgos han sido un punto contradictorio respecto a las teorías anteriores sobre el desarrollo de la FD13.
Por otro lado, se evidenció que en el 80% de los pacientes había presencia de S. aureus a nivel de piel tanto lesional superficial como no lesional y también se demostró su localización a nivel subepidérmico, siendo la única bacteria que se ha demostrado en más de dos tercios de los pacientes con FD. Esta invasión por esta bacteria oportunista implica una alteración en la integridad de la barrera epidérmica, como se ha mencionado anteriormente. En este mismo estudio se evidenció que el tratamiento con antibióticos en pacientes con FD no restauró por completo la flora, lo que sugiere que existe una persistencia en el defecto de barrera epidérmica14.
Finalmente se evidencia la presencia de estructuras similares a biofilms de C. acnes en muestras de biopsias7,14. Estos biofilms inicialmente pueden ser no patogénicos, luego pueden extenderse y transformarse en variantes patogénicas causando inflamación además de proveer protección y estabilidad7,14,15. El tratamiento antibiótico puede eliminar las bacterias liberadas de los biofilms y aliviar los síntomas, pero al persistir células bacterianas en estas estructuras pueden formar un nido para la infección crónica7.
La FD se ha clasificado como una alopecia cicatricial de predominio neutrofílico en el pasado; sin embargo, se propone un espectro amplio de la enfermedad con posibles hallazgos liquenoides (FDLPPPS)13. Se han observado cambios dinámicos en la tricoscopia de un cambio fenotípico FD hacia liquen plano pilar (LPP) en el tiempo y presencia de lesiones pustulares en esta variante de alopecia liquenoide13,15. Entre los mecanismos propuestos se encuentran el fenómeno de Koebner sobre lesiones de inflamación crónica de FD, lesiones de LPP no identificadas con infección secundaria o puede ser la manifestación fenotípica de una vía común en donde la disbiosis microbiana puede causar daño folicular o señales de estrés que propagan la respuesta inflamatoria con posible exposición de autoantígenos que llevan a respuestas inmunitarias anormales15.
En los resultados del estudio se observó que los pacientes con esta variante (FDLPPPS) mostraron niveles disminuidos de S. aureus en comparación con la variante típica de FD (niveles de S. aureus superiores al 20% del total de la composición bacteriana folicular total en FD versus menos del 20% en pacientes con FDLPPPS), siendo estos sensibles a la oxacilina y con ausencia de los genes mecA y Leucocidina de Panton-Valentine (PLV). Se propone que en la variante típica de FD con predominio de infiltrado neutrofílico la presencia de Staphylococcus fue el mejor marcador microbiológico para su diferenciación con su variante FDLPPS. Esto sugiere un manejo terapéutico con antibióticos en los pacientes con los estadios más agudos y con predominio neutrofílico en comparación con el manejo que se le puede dar a la variante FDLPPPS, en donde los fármacos antiinflamatorios pueden ser la primera opción terapéutica13.
Avances terapéuticosTrasplantes fecalesSe han reportado 3 casos de pacientes masculinos con AA con crecimiento folicular con respuesta mantenida posterior a trasplantes de microbiota intestinal que apoyan la teoría del papel del microbioma intestinal en su inducción7,16,17. De estos casos, 2 de ellos corresponden al patrón de AA universal7,16. El primer paciente es un adulto de 38años con AA refractaria a esteroides intralesionales que reportó un crecimiento a nivel de brazos y cabeza (incluyendo cara) documentado en la cita de seguimiento posterior a 8 semanas, con respuesta persistente posterior a los 3años. El segundo caso es un paciente de 20años con enfermedad de Crohn ileocólica severa e historia adicional de AA de 2años de evolución (resistente a corticosteroides intralesionales/tópicos, ácido esteárico y tratamientos láser) que recibió tratamiento para sus episodios recurrentes de diarrea por Clostridium difficile y en quien se reportó respuesta de mejoría en el score SALT, pasando de un S4b previo al tratamiento (95-99% caída capilar) a un S2 (25-49% caída capilar) postratamiento16. Por último se reportó un tercer caso, el de un paciente de 86años con historia de diarrea no infecciosa asociada a disbiosis intestinal que también reportó crecimiento de cabello en la zona afectada de su cuero cabelludo y cambio de coloración de blanquecinos a color negro de algunos cabellos residuales sin recibir tratamiento para su condición capilar y con una respuesta mantenida17.
Uso de posbióticosEl tratamiento con el plasma rico en plaquetas es un tratamiento utilizado para diversos tipos de alopecia; sin embargo, este tiene sus limitaciones, entre las cuales se encuentra la ausencia de una concentración estandarizada de plaquetas y su variación en la manufactura. Se han creado ciertos péptidos bioactivos a través de técnicas de biotecnología modernas que simulan la actividad de los factores de crecimiento plaquetarios con una efectividad similar y pueden ser usados de forma tópica y en un futuro posiblemente de manera lesional18.
Con las teorías de alteración del microbioma asociadas a trastornos de pérdida capilar, particularmente la AA, se ha sugerido un posible papel terapéutico a los metabolitos microbianos denominados posbióticos. Se realizó un estudio aleatorizado doble ciego con 160 participantes con AA (score SALT S2-S5) y edades de 18 a 60años en el cual se asignó un grupo placebo y otro grupo recibió un preparado con plantaricina A [Pln A], Lactobacillus kunkei y extractos de la flor de la planta Tropaeolum majus. Ambos grupos tenían características demográficas similares e historia de enfermedad resistente a tratamientos tópicos, sistémicos o fototerapia; adicionalmente los sujetos no recibieron tratamientos un año previo a su inclusión en el estudio. Se evidenció una regresión completa de la enfermedad en el 47,50% de los sujetos, regresión parcial en el 13,75% y un 6,25% de los sujetos no presentaron respuesta. En contraste, solo un 5% de los controles presentaron resolución completa18.
Un número grande de péptidos biomiméticos se han desarrollado con el fin de superar las limitaciones del plasma rico en plaquetas. Se ha descrito que las cadenas cortas de 10-15 aminoácidos actúan similarmente a los factores de crecimiento naturales al simular su estructura, su actividad o ambas. Estos péptidos poseen mayor estabilidad, especificidad, son menos costosos que el plasma rico en plaquetas y pueden ser incluidos fácilmente en las formulaciones tópicas18.
En otro estudio se investigó el efecto de los probióticos para generar ácidos grasos de cadena corta, en particular el butirato. El tratamiento de 16 semanas no revirtió la AA crónica pero aumentó el ratio Tregs/CD4+ (15% en grupo tratado vs. 12% en controles) a nivel de los nodos linfáticos cutáneos11.
Otros posibles futuros tratamientosEn modelos murinos se evaluaron los efectos a largo plazo de la descontinuación de la finasterida sobre la microbiota, evaluando una muestra de heces posterior a un mes de su descontinuación. Los resultados no demostraron diferencias entre la diversidad alfa; sin embargo, el phylum Firmicutes mostró una disminución en comparación con los niveles basales a diferencia de los Bacteroidetes, que sufrieron un aumento. En los controles las familias Bacteroidaceae y Prevotellaceae fueron las más abundantes, seguidas de Lactobacillaceae, Lachnospiraceae y Ruminococcacea. A nivel de géneros, Bacteroides, Prevotella, Lactobacillus, Oscillospira, Lachnospira, Ruminococcus y Coprococcus fueron los más representativos. El género Oscillospira y Lachnospira estaban significativamente disminuidos en el grupo con ausencia de tratamiento con finasterida. Como última observación, en el grupo de finasterida se encontró una cantidad aumentada del phylum Bacteroidetes y familia Prevotellaceae sugiriendo que la exposición a finasterida puede afectar la composición de la microbiota intestinal19.
Una posible diana terapéutica es el receptor GPR43/41 en el tratamiento de trastornos inmunes; aunque esto todavía no está claro, se ha observado inflamación exacerbada o persistente en modelos murinos (deficientes de GPR43) de colitis, artritis y asma indicando la influencia de este receptor en agravar la enfermedad inflamatoria. Se ha propuesto que el propionato a nivel intestinal puede llevar a la estimulación de receptores de GPR43/41 o GPR 43/109 que induce más células T reguladoras que pueden ejercer un papel protector a nivel de folículos pilosos de un ataque inmunológico. En un estudio piloto se observó un recrecimiento de cabello en 5/5 ratones después del tratamiento posterior a 11 semanas con propionato versus ningún modelo murino en el grupo control. Finalmente se analizaron las diferencias en los diferenciales celulares después de 4 semanas adicionales con tratamiento y se encontró un importante aumento del ratio Treg/CD4+ en comparación con el grupo control. Por otro lado, los autores intentaron repetir el estudio pero no pudieron reproducir los mismos efectos positivos sobre el crecimiento capilar. Por último, no fue posible prevenir la aparición de las manifestaciones de la enfermedad con el tratamiento profiláctico11.
Se sugiere que los polifenoles y terpenos tienen un efecto positivo sobre las vías celulares del crecimiento folicular, intensifican la proliferación de las células en las papilas dérmicas y aumentan las concentraciones de factor de crecimiento como el IGF-1 y VEGF que reduce el estrés oxidativo y mejora el crecimiento capilar8.
En un estudio con 12 pacientes con AGA de 40-65años con estadio III-IV en la escala de Hamilton-Norwood, estos pacientes no usaron antibióticos en los últimos 30 días previos al estudio, sin historia de probióticos en los últimos 15 días, con 48h desde el último lavado, sin tratamientos antitumorales, inmunosupresores o radioterapia en los últimos 3 meses, sin datos de terapia tópica/hormonal que afecte el crecimiento capilar en los últimos 3 meses, sin uso de minoxidil o finasterida en los 6 meses previos al inicio del estudio y sin historia de otras enfermedades dermatológicas progresivas o inflamatorias a nivel de cuero cabelludo (psoriasis, dermatitis seborreica, eritema severo, excoriación severa, quemaduras solares severas, etc.). En estos pacientes se utilizó el fototricograma para la evaluación en los días 0 y 84 valorando principalmente el estadio III de la escala de Hamilton-Norwood. A estos pacientes se les aplicó el extracto de Lindera strychnifolia al 1% versus placebo con aplicación 2 veces al día durante 84 días dividiendo el cuero cabelludo en 2 zonas (zona con tratamiento y zona placebo). Los resultados demostraron que el extracto no afectó la diversidad alfa pero que sí logró mantener la biodiversidad de bacterias. Además se reportó una disminución significativa de C. acnes (disminución del 15%), aumento de S. epidermidis (33%) y disminución del ratio C. acnes/S. epidermidis en un 37,8%. Los extractos de Lindera strychnifolia lograron restablecer las poblaciones fúngicas a la «normalidad», especialmente los del phylum Basidiomycota y los 3 géneros fúngicos Wallemia, Eurotium y Malassezia. Por otro lado, se evidenció un aumento en la abundancia de Malassezia (incremento del 3%) con la restauración de la proporción de M. restricta a los valores del grupo sano. Además se observó una disminución de Eurotium y Wallemia. Finalmente se demostró un crecimiento significativo en el número capilar que alcanzó un 7%8.
DiscusiónEl microbioma cutáneo es un sistema microbiológico complejo con múltiples interacciones que pueden llevar a alteraciones tanto en la homeostasis local como en sitios distantes. Esto puede conducir a procesos patológicos como la disfunción de las células inmunitarias que además pueden comportar cambios en unidades funcionales como el folículo piloso. Es así como este sistema puede asociarse con procesos de inflamación como la AA o alteraciones en el ciclo folicular como la AGA. Se han descrito múltiples cambios en la composición de especies a nivel superficial o de cuero cabelludo, tanto bacterianas como fúngicas, en estas dos entidades patológicas; sin embargo, todavía no existen asociaciones de certeza absoluta y el poco conocimiento del microbioma folicular complica más este escenario. Es necesario la mejor caracterización del perfil microbiológico para una mejor comprensión de su posible rol en la patogénesis de la enfermedad, por lo que este todavía es un campo de investigación bastante amplio con posibles implicaciones terapéuticas.
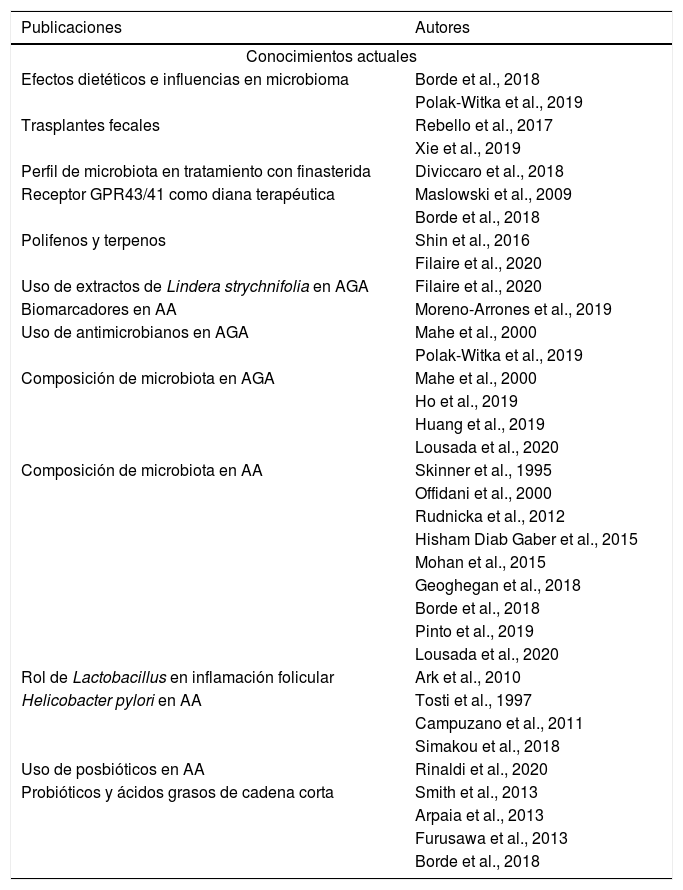
En los perfiles descritos anteriormente se puede mencionar la importancia de los cambios en los géneros de especies bacterianas asociados a AA y los casos que han sufrido regresión posterior al uso de posbióticos o productos bacterianos como forma terapéutica asociada a terapias convencionales como el plasma rico en plaquetas. Adicionalmente se puede pensar que otras terapias usuales como el uso de corticosteroides puede alterar este porcentaje microbiano además de ejercer un papel inmunomodulador creando más interrogantes sobre su papel modificador o incitador de la enfermedad. Por otro lado, se han documentado casos de resolución posterior al uso de trasplantes de materia fecal, lo que abre la posibilidad de una diana terapéutica al modificar la microbiota intestinal; sin embargo, estos hallazgos solo han sido vistos en una poca cantidad de pacientes y se deben realizar mayores estudios para valorar tanto su efectividad como sus posibles efectos adversos. Finalmente, cabe destacar la poca cantidad de estudios en esta nueva rama del microbioma como un papel clave en la patología de algunas enfermedades y que se conocen más detalles sobre su rol en enfermedades inflamatorias como la dermatitis atópica y la psoriasis. Es por lo anterior que los autores instan a valorar esta nueva línea de investigación como una posible vía hacia nuevas dianas terapéuticas relacionadas con la modificación del microbioma intestinal o cutáneo con tratamientos farmacológicos localizados, sistémicos, dietas terapéuticas o uso de organismos vivos como es el caso de los probióticos (tabla 1).
Conocimientos actuales y futuras líneas de investigación
| Publicaciones | Autores |
|---|---|
| Conocimientos actuales | |
| Efectos dietéticos e influencias en microbioma | Borde et al., 2018 |
| Polak-Witka et al., 2019 | |
| Trasplantes fecales | Rebello et al., 2017 |
| Xie et al., 2019 | |
| Perfil de microbiota en tratamiento con finasterida | Diviccaro et al., 2018 |
| Receptor GPR43/41 como diana terapéutica | Maslowski et al., 2009 |
| Borde et al., 2018 | |
| Polifenos y terpenos | Shin et al., 2016 |
| Filaire et al., 2020 | |
| Uso de extractos de Lindera strychnifolia en AGA | Filaire et al., 2020 |
| Biomarcadores en AA | Moreno-Arrones et al., 2019 |
| Uso de antimicrobianos en AGA | Mahe et al., 2000 |
| Polak-Witka et al., 2019 | |
| Composición de microbiota en AGA | Mahe et al., 2000 |
| Ho et al., 2019 | |
| Huang et al., 2019 | |
| Lousada et al., 2020 | |
| Composición de microbiota en AA | Skinner et al., 1995 |
| Offidani et al., 2000 | |
| Rudnicka et al., 2012 | |
| Hisham Diab Gaber et al., 2015 | |
| Mohan et al., 2015 | |
| Geoghegan et al., 2018 | |
| Borde et al., 2018 | |
| Pinto et al., 2019 | |
| Lousada et al., 2020 | |
| Rol de Lactobacillus en inflamación folicular | Ark et al., 2010 |
| Helicobacter pylori en AA | Tosti et al., 1997 |
| Campuzano et al., 2011 | |
| Simakou et al., 2018 | |
| Uso de posbióticos en AA | Rinaldi et al., 2020 |
| Probióticos y ácidos grasos de cadena corta | Smith et al., 2013 |
| Arpaia et al., 2013 | |
| Furusawa et al., 2013 | |
| Borde et al., 2018 | |
| Futuras líneas de investigación |
|---|
| Estudios controlados y aleatorizados de los descubrimientos anteriores |
| Rol de los cambios dietéticos sobre la composición del microbioma y terapéutica |
| Mayor caracterización de los cambios a nivel del microbioma y rol patológico |
| Investigación sobre el uso de probióticos y posbióticos como opción terapéutica |
| Efectos adversos de los tratamientos experimentales |
| Investigación sobre el efecto de tratamientos convencionales y sus cambios en la microbiota |
| Uso de biomarcadores y medicina de precisión |
| Dianas terapéuticas moleculares y celulares |
| Rol del microbioma intestinal y sus implicaciones |
| Uso de trasplantes fecales como alternativa terapéutica |
| Estudios comparativos de costo-efectividad con tratamientos actuales. |
Los autores reportan que no presentan conflictos de interés.